UPLC-MS/MS法测定黄酒中8 种生物胺
2021-08-31王可利于劲松阴凤琴吴秀秀
王可利,叶 泰,徐 斐,曹 慧,袁 敏,于劲松,阴凤琴,吴秀秀
(上海食品快速检测工程技术研究中心,上海理工大学医疗器械与食品学院,上海 200093)
生物胺是具有生物活性的低分子含氮有机化合物的总称,主要由氨基酸脱羧基后产生,也可通过微生物对醛酮的氨基转移作用产生[1]。生物胺广泛存在于各种食品中,如水产品、酒类产品、肉制品、乳制品等[2],一般发酵食品中的生物胺含量明显高于非发酵食品[3]。作为氮源,适量的生物胺在人体的神经系统与心血管系统中能够参与DNA、RNA及蛋白质的合成、稳定生物膜以及调节胃酸分泌等重要生理作用[4]。但过量的生物胺会影响人体健康,引起一系列不良症状,如头痛、呕吐、腹泻、血压变化等,严重可致呼吸困难、休克甚至死亡,有些生物胺可与食品中的亚硝酸盐反应生成致癌的亚硝胺[5-6]。此外,生物胺也常作为评价贮存过程中,食品的新鲜度或腐败变质程度的重要指标[3]。
现有检测食品中生物胺的方法主要有液相色谱法[7-9]、气相色谱法[10-11]、薄层色谱法[12-13]、毛细管电泳法[14-15]等仪器方法,其中最常用的是反相高效液相色谱法,样品经衍生化处理后连接紫外、荧光或二极管阵列检测器进行分析。Henríquez-Aedo等[16]采用高效液相色谱-荧光法在45 min内实现了智利葡萄酒中6 种生物胺的定量分析;曹利瑞等[17]建立了高效液相色谱-紫外法用于黄酒中9 种生物胺的检测,结果表明9 种生物胺可在40 min内分离。但是,这2 种方法均存在分析时间较长的缺点。为了更加快速地检测食品中生物胺,Sagratini等[18]建立了高效液相色谱串联质谱法,可在25 min内检测鱼中的8 种生物胺,其检出限范围为0.02~0.25 mg/kg;Yoon等[19]建立的高效液相色谱-紫外法,可在20 min内实现发酵农产品中8 种生物胺的快速定量分析,这种方法的检出限范围为0.01~0.1 mg/kg。虽然这2 种方法的分析时间较短,但仍然无法满足食品中痕量生物胺的快速分析、检测的需求。
黄酒是我国传统的发酵型酒精类饮料,含有丰富的氨基酸与维生素等营养物质,黄酒在发酵过程中,一些微生物(乳酸菌、酵母菌等)产生氨基酸脱羧酶,使游离的氨基酸脱羧形成相应的生物胺[20]。人体摄入黄酒后,生物胺经胃肠道黏膜上的单胺氧化酶、二胺氧化酶及多胺氧化酶等分解[21-22],然而乙醇会抑制这些酶的活性[23-24]。李彬彬[25]和张来颖[26]等发现,体积分数低于10%的乙醇溶液可增加脱羧酶的活性[25-26],而12%乙醇溶液会抑制91%的胺氧化酶活性[27-28]。我国黄酒中酒精含量一般在8.5%~17.0%之间。因此,黄酒中的生物胺会给人体带来更大的健康风险。本实验通过丹磺酰氯衍生化反应,优化萃取试剂的种类及检测条件,建立基于超高效液相色谱-串联质谱法检测8 种生物胺的方法,并考察其在黄酒样品中生物胺检测的应用。
1 材料与方法
1.1 材料与试剂
黄酒样品 市购。
β-苯乙胺盐酸盐(纯度≥99%)、色胺盐酸盐(纯度≥98%) 上海麦克林生化科技有限公司;腐胺二盐酸盐、尸胺二盐酸盐、酪胺盐酸盐(纯度均不小于98%)、亚精胺三盐酸盐、精胺四盐酸盐(纯度均不小于99.5%)、组胺二盐酸盐、丹磺酰氯(纯度均不小于99%)、1,7-二氨基庚烷(纯度98%) 西格玛奥德里奇(上海)贸易公司;甲酸(质谱纯) 美国赛默飞世尔科技有限公司;乙腈(色谱纯) 德国默克公司;乙酸乙酯(色谱纯)、氨水、碳酸氢钠、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
1290-6490超高效液相色谱-三重四极杆质谱联用仪(配有电喷雾离子源) 美国安捷伦科技公司;Milli-Q超纯水器 美国Millipore公司;氮吹仪 杭州奥盛仪器有限公司;0.22 μm一次性针头滤器 上海阿拉丁生化科技股份有限公司;ACQUITY UPLC BEH C18色谱柱(100.0 mm×2.1 mm,1.7 µm) 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18柱(100.0 mm×2.1 mm,1.7 µm);流动相A:体积分数0.1%甲酸溶液,B:体积分数0.1%甲酸-乙腈溶液;柱温35 ℃;流速0.3 mL/min;进样量2 μL;梯度洗脱:0~2 min,50% A、50% B;2~10 min,50%~25% A、50%~75% B;10~13 min,25%~0% A、75%~100% B;13~16 min,0% A、100% B;16~16.1 min,0%~50% A、100%~50% B;16.1~19 min,50% A、50% B。
1.3.2 质谱条件优化
取1.0 mL 250 ng/mL的生物胺混合标准溶液于15 mL离心管,依次加入250 μL内标溶液、1.0 mL饱和碳酸氢钠溶液、100 μL氢氧化钠溶液、1.0 mL衍生试剂按照1.3.4节样品前处理步骤衍生化处理后,注射泵直接进样,将标准物质注入质谱。8 种生物胺中均含有氨基,为极性碱性化合物,在结构上氮原子具有孤对电子,容易加合质子形成带正电荷的离子,在正离子模式扫描模式下响应值较高[29],因此选择在电喷雾正离子模式下进行一级质谱扫描,确定母离子质量数,优化毛细管电压、喷雾电压、鞘气等参数,使母离子响应值达到最高,然后对母离子进行二级质谱扫描,优化碰撞能量等参数,使子离子响应值达到最高,得到多反应监测模式(multiple reaction monitoring,MRM)下的最佳离子对。
1.3.3 标准溶液与内标溶液的配制
准确称取8 种生物胺标准品适量,用0.1 mol/L盐酸溶液配制成质量浓度为1 000 mg/L的生物胺标准储备溶液,-20 ℃保存,保存期为6 个月。分别吸取1 mL的单组分生物胺标准溶液,用0.1 mol/L盐酸溶液定容至10 mL,配制成质量浓度100 mg/L的生物胺混合标准溶液,-20 ℃保存,保存期为3 个月。准确吸取上述生物胺标准溶液,用0.1 mol/L盐酸溶液稀释成终质量浓度为1、20、50、100、250、500、1 000 ng/mL的生物胺混合标准工作溶液,现用现配。
准确称取内标物质(1,7-二氨基庚烷)适量,用0.1 mol/L的盐酸溶液配制成质量浓度10 mg/mL的内标标准储备溶液,-20 ℃保存,保存期为6 个月。准确吸取上述内标标准储备液,用0.1 mol/L的盐酸溶液稀释,配制成质量浓度250 ng/mL的内标使用液,现用现配。
1.3.4 样品前处理
准确量取1.0 mL黄酒样品、250 μL质量浓度250 ng/mL内标溶液、1.0 mL饱和碳酸氢钠溶液、100 μL 1 mol/L氢氧化钠溶液、1.0 mL衍生试剂(丹磺酰氯溶液质量浓度10 mg/mL)于10 mL塑料连盖离心管中,旋涡混匀1 min,60 ℃恒温水浴15 min后取出加入100 μL氨水,旋涡混匀,60 ℃水浴反应15 min,取出,冷却10 min,加入1.0 mL超纯水,旋涡混匀,氮气吹去丙酮,加入0.5 g氯化钠,振荡至完全溶解,加入5 mL乙酸乙酯,充分混匀后静置分层,吸取上层有机相,下层水相重复萃取1 次,合并2 次制得的有机相,氮吹至干。加入1.0 mL乙腈复溶,用0.22 μm滤膜针头滤器过滤,收集滤液,待测[30]。
1.4 数据处理
图谱的采集采用Agilent Masshunter Qualitative Analysis B.04.00软件,实验数据采用Excel 2019软件进行统计分析,Origin 2019 b软件进行绘图。
2 结果与分析
2.1 质谱条件优化
离子源扫描模式:电喷雾正离子模式;监测模式:MRM;氮气为载气;干燥气温度:250 ℃;干燥气流量:12 L/min;鞘气温度:300 ℃;鞘气流量:11 L/min;雾化气压力:241 kPa;毛细管电压:4 000 V;喷嘴电压:500 V;质谱参数的驻留时间均为75 s、锥孔电压均为25 V、加速电压均为3 V;组胺、酪胺、腐胺、尸胺、色胺、β-苯乙胺、亚精胺、精胺共8 种生物胺的定性、定量离子对中的母离子分别为m/z579、605、556、570、394、355、423、568,子离子均为m/z170。
2.2 色谱条件优化
Waters ACQUITY UPLC BEH C18色谱柱采用桥式亚乙基杂化颗粒技术,对生物胺有良好的保留作用,并具有极高的分离效率,可以获得更快的分析速度与更高的灵敏性。分别选择纯水和甲醇、纯水和乙腈、0.1%甲酸和0.1%甲酸-甲醇、0.1%甲酸和0.1%甲酸-乙腈作为流动相,实验发现乙腈较甲醇的分离效果更好,流动相内加入0.1%甲酸后出现的峰形更好,无严重拖尾现象,因此,选用0.1%甲酸和0.1%甲酸-乙腈作为流动相。8 种生物胺的总离子流图如图1所示。

图1 8 种生物胺的总离子流图Fig. 1 Total ion current chromatograms of eight biogenic amines
2.3 萃取试剂的选择
本实验比较分别用乙醚和乙酸乙酯萃取同一个样品的结果,结果如图2所示。2 种萃取剂均可将生物胺萃取出来,萃取效果无显著差异,但考虑到乙醚的毒性较大,因此,本实验选择乙酸乙酯作为生物胺萃取溶剂。
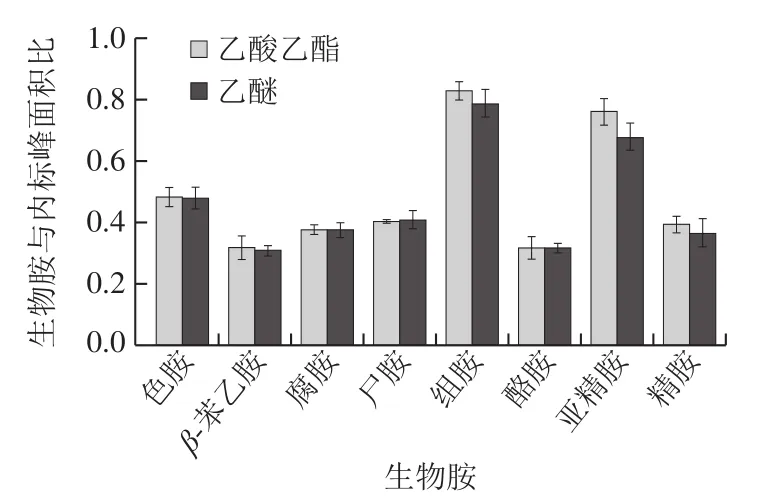
图2 不同萃取剂对生物胺组别萃取效果的影响Fig. 2 Effect of different extraction agents on the extraction efficiency of biogenic amines
2.4 线性范围、检出限与定量限
分别配制终质量浓度为1、2、50、100、250、500、1 000 ng/mL的生物胺混合标准溶液,经衍生化处理后,进行测定,以各生物胺质量浓度为横坐标,以对应生物胺与内标物质峰面积比作为纵坐标,绘制各生物胺的标准曲线,确定线性方程与线性相关系数。以信噪比为3作为检出限,信噪比为10作为定量限,测定结果见表1。结果表明,8 种生物胺的线性方程的线性相关系数r2均大于0.995 1,在各自线性范围内线性良好,检出限在0.25~0.50 ng/mL之间,定量限在1~2 ng/mL之间。均优于GB 5009—2016《食品中生物胺的测定》[30]中的检出限(2~5 mg/L)和定量限(5~10 mg/L)。

表1 8 种生物胺的线性方程、检出限与定量限Table 1 Linear equations, limits of detection and quantitation for eight biogenic amines
2.5 精密度
精密度分为日内精密度和日间精密度,以相对标准偏差(relative standard deviation,RSD)表示。分别选取低、中、高3 个质量浓度(50、300、500 ng/mL)的生物胺混合标准溶液,按样品前处理步骤衍生化处理后,进行分析,3 个质量浓度的样品在24 h内每隔2 h重复进样6 次,计算各生物胺质量浓度RSD,记为日内精密度。连续3 d做重复性实验,计算3 d内各生物胺质量浓度RSD,记为日间精密度,测定结果见表2。8 种生物胺的日内精密度在0.61%~5.68%之间,日间精密度在0.82%~5.00%之间,具有良好的精密度和准确性。

表2 测定8 种生物胺方法的日内和日间精密度Table 2 Intra-day and inter-day precision of the method for the determination of eight biogenic amines
2.6 样品加标回收率
取同种黄酒样品3 份,稀释50 倍分别向其中加入质量浓度分别为30、100、200 ng/mL的生物胺混合标准溶液,按照样品前处理步骤衍生处理后,每个水平平行测定6 次,计算平均加标回收率及RSD,结果见表3。8 种生物胺的平均加标回收率在83.56%~117.45%之间,RSD均小于6.69%。

表3 黄酒中生物胺的平均加标回收率和RSD(n=6)Table 3 Average recoveries and RSDs of eight biogenic amines from spiked Huangjiu (n = 6)
2.7 实际样品的测定
按照上述方法对10 个市售黄酒样品进行检测,10 个样品中均未检出色胺与精胺。10 个样品均检出组胺、腐胺和亚精胺,质量浓度分别为1.42~8.05、0.80~15.69 μg/mL和0.06~0.53 μg/mL,具体见表4。

表4 黄酒样品中生物胺的含量Table 4 Biogenic amine contents in Huangjiu samples determined by the method
3 结 论
本实验建立超高效液相色谱-串联三重四极杆质谱的方法同时检测黄酒中8 种生物胺。该方法采用丹磺酰氯进行柱前衍生,液-液萃取后结合内标法进行质谱检测,可在19 min内实现黄酒中8 种生物胺的定量分析,其具有分析速度快、灵敏度高与重复性好的优点,可用于我国黄酒产品的质量控制和安全评价。
