三七PnAAE41基因的克隆、表达分析及原核表达
2021-08-26闫静向贵生冯垒杨梅郭敏张广辉
闫静 向贵生 冯垒 杨梅 郭敏 张广辉

摘 要:草酰輔酶A合成酶参与了三七主要止血活性成分三七素的生物合成,研究三七草酰辅酶A合成酶基因(PnAAE41)的分子特征及表达特征,从而完善三七素生物合成途径以及成分积累调控机制等方面的研究。以三七为实验材料,在前期转录组研究基础上,设计特异性引物,通过RT-PCR扩增获得1个三七AAE基因的cDNA全长。采用生物信息学方法分析其分子特性,通过qRT-PCR技术分析PnAAE41基因的时空表达特异性。通过异源表达探索进行PnAAE41最佳蛋白最佳的诱导条件的探索,随后以颜色反应作为定性研究的基础。序列分析结果表明,PnAAE41的开放阅读框长度为1572 bp,编码523个氨基酸,登录号为MW242343。系统进化分析显示,PnAAE41蛋白与拟南芥AtAAE蛋白亲缘关系最近。预测PnAAE41蛋白主要定位于细胞质膜上,不含信号肽序列,二级结构中α-螺旋和无规则卷曲占大部分比例。qRT-PCR分析表明,PnAAE41基因主要在根和茎中优势表达。异源表达最佳诱导条件为0.5 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG),16 ℃诱导9 h,该蛋白对草酸具有催化作用。本研究结果为进一步深入研究AAE在三七素生物合成途径中的功能提供理论基础。
关键词:三七;草酰辅酶A合成酶;生物信息学分析;时空表达;原核表达
中图分类号:S567.23+6 文献标识码:A
Clone and Prokaryotic Expression Analysis of Acyl-activating Enzyme Gene from Panax notoginseng
YAN Jing1,2,3, XIANG Guisheng1,2, FENG Lei1,2,3, YANG Mei3, GUO Min3, ZHANG Guanghui1,2*
1. National & Local Joint Engineering Research Center on Germplasms Utilization & Innovation of Chinese Materials in Southwest/ , Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. Yunnan Provincial Key Laboratory of Medicinal Plant Bio?logy, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 3. College of Agriculture and Biotechnology, Yunnan Agricultural University, Kunming, Yunnan 650201, China
Abstract: Acyl-activating enzyme (PnAAE41) of Panax notoginseng is involved in the biosynthesis of dencichine,the main hemostatic active ingredient. The molecular characteristics and expression characteristics of Acyl-activating enzyme was explored to provide a basic theory for further research on the biosynthesis pathway of dencichine and the regulation mechanism of component accumulation. The full length of PnAAE41 gene was obtained by RT-PCR. The molecular properties was analyzed by bioinformatics methods. The spatio-temporal expression specificity of PnAAE41 gene was determined by real-time quantitative PCR. The heterologous expression was used to explore the optimal induction condition. The color reaction was used as the basis for qualitative research. The sequence analysis results showed that PnAAE41 was 1572 bp, encoding 523 amino acids, and the login number was MW242343. Phylogenetic analysis showed that PnAAE41 was most closely related to Arabidopsis AtAAE. PnAAE41 was predicted to be mainly located on the plasma membrane, which did not contain signal peptide sequence, and its secondary structure was mainly composed of alpha helix and random coil. The optimal induction condition was 0.5 mmol/L IPTG and 16 ℃ induction for 9 h. The protein had a catalytic effect on oxalic acid. The study would provide a theoretical basis for the further research on the role of AAE in the biosynthesis of dencichine.
Keywords: Panax notoginseng; acyl-activating enzyme; bioinformatics analysis; spatio-temporal expression; prokaryotic expression
DOI: 10.3969/j.issn.1000-2561.2021.07.008
三七[Panax notoginseng (Burk) F. H. Chen]为五加科人参属多年生草本植物,以根及根茎入药,是我国重要的中药材大品种。三七具有散瘀止血、消肿定痛、防止脑缺血、止血、降脂和保护肝脏等功效,与人参共享“北参南七”的美誉。三七总皂苷广泛用于治疗冠心病、心绞痛、脑血管后遗症和高血压等。云南省一半以上的制药企业需要三七为原料,其加工产品产值占云南医药产值的“半壁江山”,因此三七是云南乃至我国的中药产业最重要的支柱品种。前期对于三七活性成分的研究主要集中于三萜皂苷,其他药用成分则鲜有关注。三七素(dencichine)是一种非蛋白游离氨基酸,化学名称为β-N-草酰-L-α,β-二氨基丙酸(β-N-oxalyl-L-α,β-diaminopropionic acid,β-ODAP),是云南白药、三七止血片等药品的有效成分,具有增加血小板数量、缩短凝血和出血时间的功效[1-2]。除三七外,三七素还存在于人参(Panax. Ginseng C. A. Meyer)、西洋参(Panax. Quinquefolius L.)等其他人参属(Panax)植物以及山黧豆属(Lathyrus)、猪屎豆属(Crotalaria)等豆科植物中[3-6]。尽管三七素是三七的主要活性成分之一,但目前对其在三七中的生物合成机理、积累规律等研究未见相关报道。
Malathi等[7]在对家山黧豆(Lathyrus sativus L.)的研究中发现,草酰辅酶A(Oxalyl coenzyme A)与L-α,β-二氨基丙酸(L-α,β-diaminopropanoic acid, DAP)在ODAP合成酶作用下產生β-ODAP,这是三七素生物合成的最后一步,也是最为关键的一步反应。现已证实,家山黧豆ODAP合成酶属于BAHD酰基转移酶基因家族,能够催化上述反应,但其基因序列并未公布[8]。草酰辅酶A是由草酸和辅酶A在草酰辅酶A合成酶的作用下生成的,因此,草酰辅酶A合成酶也是三七素生物合成的关键酶之一。研究发现草酰辅酶A合成酶属于酰基激活酶(Aacyl-activating enzyme,AAE)超家族,其中还包括长链酰基辅酶A合成酶(Llong-chain acyl-CoA synthetases, LACSs),4-香豆酸辅酶A连接酶(4-coumarate CoA ligases,4CLs)和乙酰辅酶A合成酶(Aacetyl-CoA synthetase)[9-10]。
植物体内合成草酰辅酶A是草酸分解代谢的一部分,能够避免植物受到草酸钙积累的伤害,并且在植物的非生物和生物胁迫反应中都能发挥作用[11-12]。有研究从拟南芥(Arabidopsis thaliana L. Heynh.)[13]、蒺藜苜蓿(Medicago truncula L.)[14]、赤小豆(Vigna umbellate Thunb.)[15]与酵母(Saccharomyces cerevisiae)[16]中均克隆到1条草酰辅酶A合成酶基因,并对其功能进行了验证,但在三七中的研究及其在三七素合成中的功能则未见报道。本研究基于三七转录组数据克隆到的1条草酰辅酶A合成酶基因PnAAE41,对其结构与功能进行了初步探索,为进一步研究三七素的生物合成与积累调控机制等方面奠定基础,为深入了解三七品质形成机理提供了理论依据,也为在其他物种中三七素的生物合成提供数据线索。
1 材料和方法材料与方法
1.1 实验材料与试剂
三七材料采自于云南省文山壮族苗族自治州砚山县文山苗乡三七科技有限公司(23°06′N,103°43′ E)。
二硫苏糖醇(DTT)、磷酸烯醇丙酮酸(PEP)、肌激酶、还原型辅酶I(NADH)、1-甲氧基-5-甲基-吩嗪硫酸甲酯和四唑硝基蓝购自麦克林公司;丙酮酸激酶、乳酸脱氢酶、腺嘌呤核苷三磷酸(ATP)购自索莱宝公司;辅酶A(CoA)为MedChemExpress公司产品;pET-28a载体、BL21(DE3)感受态购自上海唯地。
1.2 PnAAE41基因的鉴定与克隆
以33年生三七不同组织(根、茎、叶)转录组数据为基础,从Pfam 33.1数据库(http://pfam. xfam.org/)下载AAE基因家族种子文件PF00501,利用HMMER v3.0软件从三七转录组数据中提取AAE同源序列,使用NCBI CDD(https://www.ncbi. nlm.nih.gov/Structure/cdd/wrpsb.cgi)工具进行手工校正,应用ORF Finder(https://www.ncbi.nlm. nih. gov/orffinder/)工具获得基因的开放阅读框,随后同Pfam 33.1和SMART[17]数据库进行结构域预测,获得最终候选基因AAE。本研究中其他物种的氨基酸序列均来自于NCBI数据库。
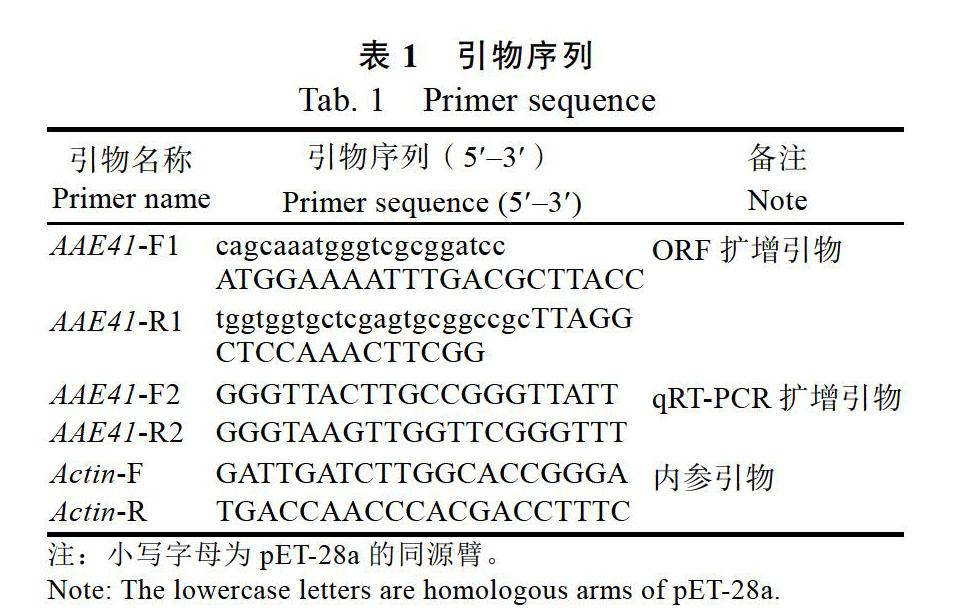
采集33年生三七的不同部位(根、茎、叶),参照难提植物总RNA小提试剂盒(MaGen)的操作说明提取三七总RNA,随后使用逆转录试剂盒(TakaraTaKaRa)进行逆转录反应,将获得的cDNA于–80 ℃备用。设计特异性引物AAE41-F1和AAE41-R1对PnAAE41全长进行扩增(表1),反应体系:cDNA 2.0 μL,上下游引物各1.6 μL,Q5 2×Master Mix 25.0 μL,加ddH2O补至总体积为50.0 μL;反应程序:98 ℃ 30 s;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 50 s(35个循环);72 ℃ 2 min。1.0%的琼脂糖凝胶电泳切胶回收。将PnAAE41基因回收产物与pET-28a线性化载体进行连接,热激转化,挑取阳性克隆菌株测序。
1.3 PnAAE41蛋白的生物信息学与系统进化分析
利用Expasy Protparam(https://web.expasy. org/ protparam)分析蛋白的理化性质;使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白的跨膜结构域;通过PSORT(http://psort1.hgc. jp/form.html)进行亚细胞定位预测;利用SignalP(http://www.cbs.dtu.dk/ services/SignalP0)预测蛋白质有无信号肽;使用GORIV(https://npsa-prabi. ibcp.fr/cgi-bin/ secpred_ gor4.pl)预测蛋白二级结构;利用SWISS-MODEL(https://swissmodel. expasy.org/ interactive/Sbb BSU/ models)预测蛋白的三维结构,并构建三维结构模型。利用MAFFT v7.471软件进行氨基酸序列比对;IQ-TREE v2.1.1软件用于构建ML系统进化树(模型:LG+F+R5),并使用EvolView 3(https://www.evolgenius.info/ evolview/)进行进化树编辑与美化。
1.4 PnAAE41基因的时空表达特异性分析
以Actin为内参基因[18],使用Primer 5.0工具设计qRT-PCR特异性引物AAE-F2和AAE-R2,Actin-F和Actin-R(表1)。按照ChamQ Universal SYBR qPCR Master Mix(Vazyme)试剂盒的反应体系:cDNA 1.0 μL,上下游引物各0.4 μL,SYBR Mix 10.0 μL,加ddH2O补充至总体积为20.0 μL。反应程序:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s(40個循环);72 ℃ 30 s。采用2–△△CT法计算目的基因的相对表达量[19]。
1.5 PnAAE41重组蛋白的诱导及纯化
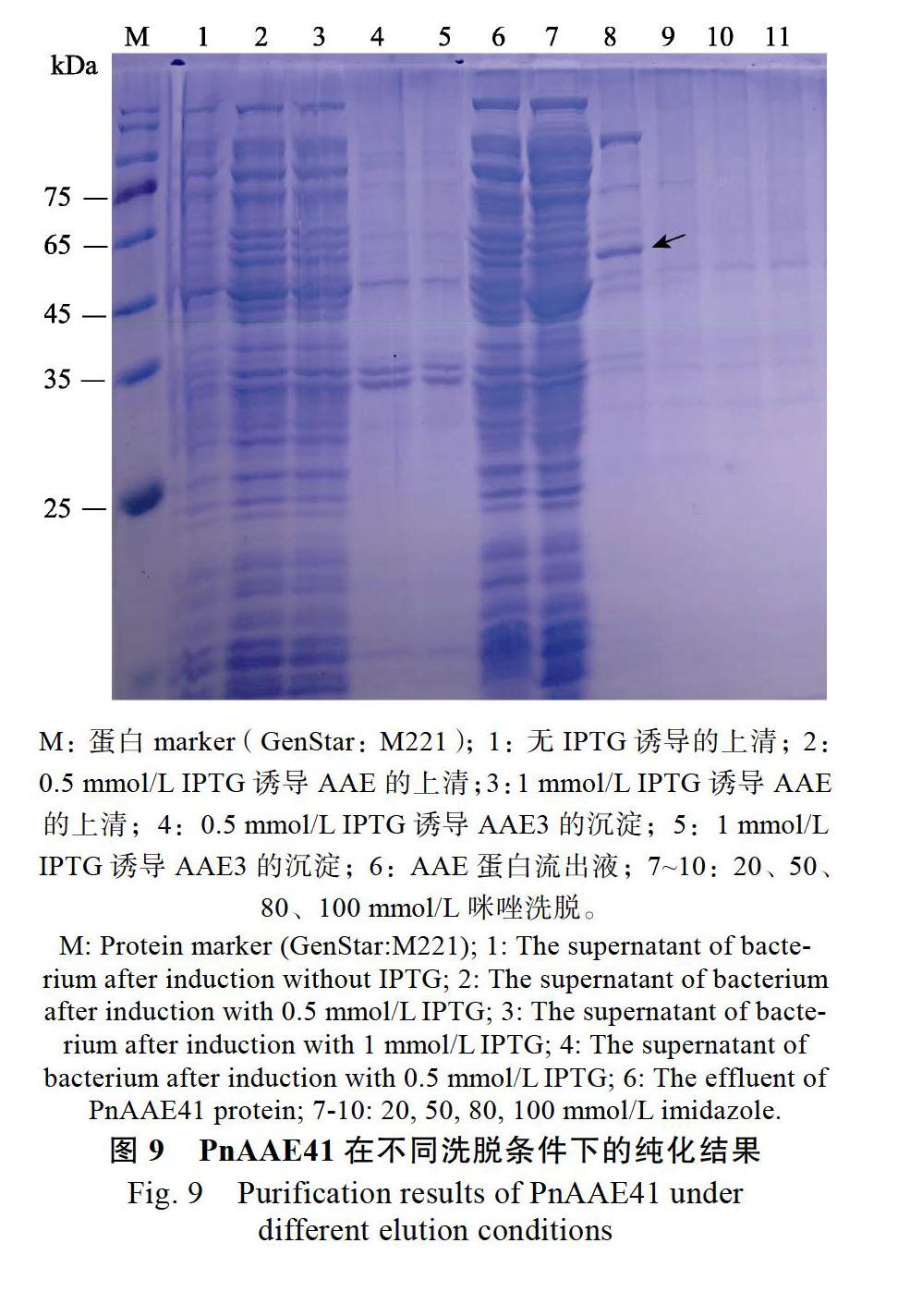
将通过测序验证的阳性菌株接种到含50 mg/L Kan+的LB液体培养基中,并在37 ℃ 200 r/min条件下过夜培养,按1∶100(V/V)的接种量接种后,同条件下培养至A600为0.6~0.8,随后对不同诱导温度(16、37、25 ℃)、不同诱导浓度(0.1、0.5、1.0 mmol/L)异丙基-β-D-硫代半乳糖苷(IPTG)与不同诱导时间(8、12、16 h)条件下蛋白诱导的最佳条件进行了筛选。在最佳的诱导条件下进行扩大培养,4 ℃ 5000 ×g离心20 min收集菌体,用PBS(pH 8.0)重悬菌体;低温高压破碎细胞至菌液澄清透明,离心收集上清与沉淀。上清用0.45 μm滤膜过滤,然后按照天地人和Ni NTA Beads预装柱纯化说明书对其进行纯化;沉淀用PBS(pH 8.0)重悬;随后对其进行SDS-PAGE检测,并分析蛋白表达情况。
1.6 PnAAE41蛋白催化活力检测
反应体系缓冲液中含有0.479 mg重组蛋白、NaPO4(pH 8.0)、DTT、MATP、MgCl2、CoA、NADH、PEP,以及肌激酶、丙酮酸激酶、乳酸脱氢酶各10个单位,使用不同浓度(0.0、0.5、1.0、2.0、5.0、8.0、10.0 μmol/L)的草酸溶液为底物进行催化反应,在室温下孵育10 min后加入显色剂1-甲氧基-5-甲基-吩嗪硫酸甲酯和四唑硝基蓝。二硫化四唑盐被用作NADH的显色指示剂,如果PnAAE41蛋白能以测试的有机酸作为底物,那么随着NADH的消耗其颜色会从紫色变为淡黄色[20],基于此,可以作为定性研究的基础。
2 结果与分析
2.1 PnAAE41基因的鉴定与克隆
根据Pfam和SMART数据库结构域预测共获得49条AAE同源基因,根据植物基因的命名方法将其命名为PnAAE1~PnAAE49,其中39条含有完整的开放阅读框(open reading frame,ORF)。以4条已验证的具有草酰辅酶A合成酶功能的基因为参考序列[13-16],利用IQ-TREE软件将其与49条三七AAE同源基因构建系统发育树,结果显示PnAAE41与已验证有功能的基因聚为一支,其中PnAAE41与AtAAE亲缘关系最近,与OsAAE亲缘关系较远;单子叶和双子叶的AAE蛋白被分成两个不同的分支蛋白被分成2个不同的分支(图1)。为了进一步揭示PnAAE41是否具有AAE型基因的典型结构特征,将其与上述4条参考序列进行了多序列比对,结果显示,它们具有较高的序列相似性;其中PnAAE41具有典型的AMP结合域和乙酰辅酶A合成酶结构域,并且在结构域及其附近具有高度的保守性(图2)。
以33年生叶的cDNA为模板,利用特异性引物AAE41-F1和AAE41-R1经RT-PCR扩增与单克隆测序分析,序列结果显示,其大小与预期结果一致,长1572 bp,编码523个氨基酸。
2.2 PnAAE41的生物信息学分析
理化性质分析结果显示,PnAAE41蛋白相对分子质量56.32 kDa,等电点6.14,不稳定指数33.51,平均亲水性–0.024,属于亲水性蛋白。信号肽预测结果显示,整个氨基酸肽链上没有信号肽的存在,推测该蛋白属于非分泌蛋白(图3)。亚细胞定位预测结果显示,PnAAE41蛋白具有多个亚细胞定位,其主要分布于细胞质膜。跨膜结构预测结果显示,在第50~100个氨基酸之间有2个跨膜螺旋区,推测该蛋白允许存在跨膜结构域及其位点呈现(图4)。
2.3 PnAAE41蛋白的二级与三级结构分析
PnAAE41蛋白的二级结构进行预测结果显示(图5),PnAAE41蛋白主要以无规则卷曲和α螺旋为主,其中无规则卷曲的结构类型所占比例最高,为47.99%;α螺旋的结构类型比例为35.56%;延伸链所占比例最低,为16.44%。
通过SWISS-MODEL在线软件预测PnAAE41蛋白的三维结构并构建其三维结构模型,以草酰辅酶A连接酶[5ie2.1.A]为参考模型,结果显示(图6),与模板蛋白序列的一致性为79.69 %,GMQE值为0.93,QMEAN为0.51。
2.4 PnAAE41基因的时空表达特异性
以Actin为内参基因,对PnAAE41基因在三七不同生长年限、不同组织的相对表达水平进行了分析。结果显示(图7),PnAAE41基因在1年生三七叶中的相对水平最低,在根和茎中的相对表达水平较高,在22年生三七中,根中的表达水平较高,其次为茎,其中叶中表达水平最低。在33年生三七中,PnAAE41在茎中的表达水平高于根和叶。
2.5 重组蛋白表达与催化活力分析
对测序验证的阳性菌株进行了表达条件的筛选,当添加终浓度为0.5 mmol/L IPTG并在16 ℃、200 r/min下诱导9 h后,收集菌体并对其进行破碎、纯化、SDS-PAGE检测,结果发现,在此条件下诱导表达的蛋白量最多,其分子质量约56 kDa,与预期的重组蛋白大小一致(56.32 kDa),其中上清中出现大小一致的蛋白特异条带(图8~图9)。使用BCA蛋白质定量试剂盒对浓缩后重组蛋白的浓度进行了测定(479 μg/mL),并利用颜色可视化法来检测其对草酸的催化性,结果显示,PnAAE41蛋白催化草酸消耗了NADH,颜色从紫色变成淡黄色(图10)。
3 讨论
三七素属于非蛋白质氨基酸,可通过增加体内血小板数量并缩短凝血和出血的时间达到止血效果,被广泛用于治疗外伤出血,是云南白药等
多种传统药方的有效成分。郑邓毅男等[21]对三种人参属对3种人参属(三七、人参、西洋参)植物都进行了三七素含量检测,结果发现三七素的含量以三七最高,人参次之,西洋参最低。三七素可能是人参属植物特征性成分,该化合物容易被检测到,因此可以作为人参属植物化学分类的依据。前人对于三七素的研究仅涉及三七素液相质谱检测与提取方法,并且多集中在豆科植物家山黧豆中[22-26]。
关于草酰辅酶A合成酶在植物中代谢途径的提出可以追溯到1961年[27],但直到2012年这种酶才被发现。Foster等[22]描述了拟南芥酰基激活酶(AAE)基因,该基因编码1种草酰辅酶A合成酶,能够催化草酸分解代谢途径的第一步,接着在蒺藜苜蓿、水稻、赤小豆与酵母中也发现了草酰辅酶A合成酶。在三七素合成途径中,草酰辅酶A在最后一步中作为酰基供体进行酰基转移反应,与L-α,β-二氨基丙酸在BAHD酰基转移酶作用下产生三七素,这是最为关键的一步反应。我们基于三七转录组数据筛选到了1条草酰辅酶A合成酶基因PnAAE41并成功克隆,随后对其理化性质、表达特征进行了分析。与已知的4种草酰辅酶A合成酶进行氨基酸序列比对发现PnAAE41具有AAE型基因典型的AMP结合域和乙酰辅酶A合成酶结构域,与拟南芥AtAAE具有86.05%的一致性。接着为了确定PnAAE41是否编码草酰辅酶A合成酶,构建了该蛋白的His标记载体并在大肠杆菌中进行了异源表达,接着通过亲和层析对获得的蛋白进行纯化并利用颜色反应检测其催化功能。
AAE在草酸降解途径中的作用是一个复杂的多信号互作过程,除了遗传因素,还受到生长阶段,组织部位等因素的影响。通过研究PnAAE41基因的组织时空特异性,发现该基因主要在三七根和茎中表达,与段绍凤等[28]在研究三七素在三七植株的分布规律结果一致。本研究基于课题组前期对三七素的生物合成途径做出的有根据的推测,成功克隆了候选基因PnAAE41,为深入研究三七素的生物合成提供了理论基础。下一步将开展三七素合成途徑中所参与的BAHD酰基转移酶基因的异源表达及功能分析,继续完善三七中三七素的生物合成途径,为三七素生物合成途径的阐明提供参考。
参考文献
[1] Kosuge T, Yokota M, Ochiai A. Studies on antihemorrhagic principles in the crude drugs for hemostatics. II. Onantihemorrhagic principle in Sanchi Ginseng Radix [J]. Yakugaku Zasshi, 1981, 101(7): 629-632.
[2] 赵国强, 王秀训. 三七止血成分dencichine [J]. 中草药, 1986, 17(6): 34-35, 20.
[3] 焦成瑾, 杨玲娟, 赵菲佚, 等. 三七素检测方法研究进展[J]. 氨基酸和生物资源, 2015, 37(3): 15-20.
[4] Koh H L, Lau A J, Chan E C. Hydrophilic interaction liquid chromatography with tandem mass spectrometry for the determination of underivatized dencichine (beta-N-oxalyl- L-alpha, beta-diaminopropionic acid) in Panax medicinal plant species[J]. Rapid Commun Mass Spectrom, 2005, 19(10): 1237-1244.
[5] Kuo Y H, Ikegami F, Lambein F. Neuroactive and other free amino acids in seed and young plants of Panax ginseng[J]. Phytochemistry, 2003, 62(7): 1087-1091.
[6] Qiao C F, Liu X M, Cui X M. High-performance anion-exchange chromatography coupled with diode array detection for the determination of dencichine in Panax notoginseng and related species[J]. Journal of separation Separation scienceScience, 2013, 36(15): 2401-2406.
[7] Malathi K, Padmanaban G, Sarma P S. Biosynthesis of β-N-oxalyl-l-α,β- diaminopropionic acid, the Lathyrus sativus neurotoxin[J]. Phytochemistry, 1970, 9(7): 1603-1610.
[8] Martin P Peter E. Genetic improvement of grass pea (Lathyrus sativus) for low β-L-ODAP content[D]. Norwich: University of East Anglia, 2017.
[9] Staswick P E, Tiryaki I, Rowe M L. Jasmonate response locus JAR1 and several related Arabidopsis genes encode enzymes of the firefly luciferase superfamily that show activity on jasmonic, salicylic, and indole-3-acetic acids in an assay for adenylation[J]. Plant Cell, 2002, 14(6): 1405-1415.
[10] Jay M, Shockey, Martin S, et al. Arabidopsis contains a large superfamily of acyl-activating enzymes. phylogenetic and biochemical analysis reveals a new class of Acyl-Coenzyme A Synthetases [J]. Plant Physiology, 2003, 132(2): 1065-1076.
[11] [11]Nakata P A. Plant calcium oxalate crystal formation, function, and its impact on human health[J]. Front Biology, 2012, 7(3): 254-266.
Foster J, Kim H U, Nakata P A, et al. A previously un-known oxalyl-CoA synthetase is important for oxalate ca-tabolism in Arabidopsis[J]. Plant Cell, 2012, 24(3): 1217-1229.
[12]蔡曉锋, 徐晨曦, 王小丽. 植物中的草酸: 合成、降解及其积累调控[J]. 植物生理学报, 2015, 51(3): 267-272.
[11]
[12] 蔡晓锋, 徐晨曦, 王小丽. 植物中的草酸: 合成、降解及其积累调控[J]. 植物生理学报, 2015, 51(3): 267-272.
Foster J, Kim H U, Nakata P A, et al. A previously unknown oxalyl-CoA synthetase is important for oxalate catabolism in Arabidopsis[J]. Plant Cell, 2012, 24(3): 1217-1229.
[12] 272.
[13] Foster J, Kim H U, Nakata P A, et al. A previously un-known oxalyl-CoA synthetase is important for oxalate ca-tabolism in Arabidopsis[J]. Plant Cell, 2012, 24(3): 1217-1229.
[13] Foster J, Luo B, Nakata P A. An oxalyl-CoA dependent pathway of oxalate catabolism plays a role in regulating calcium oxalate crystal accumulation and defending against oxalate-secreting phytopathogens in Medicago truncatula[J]. PLoS One, 2016, 11(2): e0149850.
[14] Foster J, Luo B, Nakata P A. An oxalyl-CoA dependent pathway of oxalate catabolism plays a role in regulating calcium oxalate crystal accumulation and defending against oxalate-secreting phytopathogens in Medicago truncatula[J]. PLoS One, 2016, 11(2): e0149850.
[14] Lou H Q, Fan W, Xu J M, et al. An oxalyl-CoA synthetase is involved in oxalate degradation and aluminum tolerance[J]. Plant Physiology, 2016, 172(3): 1679-1690.
[15] Lou H Q, Fan W, Xu J M, et al. An oxalyl-CoA synthetase is involved in oxalate degradation and aluminum tol-erance[J]. Plant Physiology, 2016, 172(3): 1679-1690.
[15] Foster J, Nakata P A. An oxalyl-CoA synthetase is im-portant for oxalate metabolism in Saccharomyces cerevisiae [J]. FEBS Letters, 2014, 588(1): 160-166.
[16] Foster J, Nakata P A. An oxalyl-CoA synthetase is im-portant for oxalate metabolism in Saccharomyces cerevisiae [J]. FEBS Letters, 2014, 588(1): 160-166.
[16] Chen H, Kim H U, Weng H, et al. Malonyl-CoA synthetase, encoded by ACYL ACTIVATING ENZYME13, is essential for growth and development of Arabidopsis[J]. Plant Cell, 2011, 23(6): 2247-2262.
[17] Chen C, Chen H, Zhang Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[18] Li X J, Yang J L, Hao B, et al. Comparative transcriptome and metabolome analyses provide new insights into the molecular mechanisms underlying taproot thickening in Panax notoginseng[J]. BMC Plant Biology, 2019, 19(1): 451.
[19] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408.
[20] Ishiyama M, Miyazono Y, Sasamoto K, et al. A highly water-soluble disulfonated tetrazolium salt as a chromogenic indicator for NADH as well as cell viability[J]. Talanta, 1997, 44(7): 1299-1305.
[21] 鄭毅男,李向高. 人参属植物止血成分比较分析[J]. 吉林农业大学学报, 1989, 11(1): 24–-27.
[22] Foster J, Kim H U, Nakata P A, et al. A previously unknown oxalyl-CoA synthetase is important for oxalate catabolism in Arabidopsis[J]. Plant Cell, 2012, 24(3): 1217-1229.
[23] Xie G X, Qiu Y P, Qiu M F, et al. Analysis of dencichine in Panax notoginseng by gas chromatography-mass spectrometry with ethyl chloroformate derivatization[J]. J Pharm Biomed Anal, 2007, 43(3): 920-925.
[24] 李 琳, 王承潇, 曲 媛, 等. 反相离子对色谱法测定三七中的三七素含量[J]. 中国中药杂志, 2015, 40(20): 4026-4030.
[25] 杨玲娟, 焦成瑾, 高二全. 三七中三七素及其异构体的高效液相色谱检测[J]. 中药材, 2015, 38(2): 311-314.
[26] Ji W H, Xie H K, Zhou J, et al. Water-compatible molecularly imprinted polymers for selective solid phase extraction of dencichine from the aqueous extract of Panax notoginseng[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2016, 1008: 225-233.
[27] Giovanelli J, Tobin N F. Adenosine triphosphate-and coenzyme A-dependent decarboxylation of oxalate by extracts of peas[J]. Nature, 1961, 190: 1006-1007.
[28] 段紹凤, 陈 庚, 闫 静, 等. 三七素提取工艺及检测方法的优化研究[J]. 热带作物学报, 2019, 40(11): 2255-2260.
责任编辑:黄东杰
