油棕EgGRF转录因子家族的全基因组鉴定与表达分析
2021-08-26金龙飞尹欣幸曹红星
金龙飞 尹欣幸 曹红星
摘 要:生長调控因子(Growth regulating factor,GRF)是植物中重要的转录因子,参与植物生长、发育和逆境胁迫响应等多种生物学过程。本研究从油棕(Elaeis guineensis)基因组中鉴定出15个EgGRF基因家族成员,并对其理化性质、染色体定位、基因结构、保守功能域、进化关系、启动子顺式作用元件、组织表达模式和果肉不同时期表达模式进行分析。结果表明:EgGRF基因家族成员编码的肽链平均为409个氨基酸,分子量为27.62~65.51 kDa,等电点为6.24~9.38,蛋白不稳定指数为47.24~68.37,脂溶指数为47.52~67.69,总平均亲水性为–0.945~–0.400。EgGRF基因家族成员含有3~5个外显子,均含有特征结构域QLQ(Gln、Leu、Gln)和WRC(Trp、Arg、Cys),基于系统进化关系将EgGRF家族分为5个亚族,油棕EgGRF的亲缘性与拟南芥较近。启动子上鉴定出大量植物激素响应、逆境胁迫响应、光响应和分生组织特异表达顺式作用元件。不同组织的转录组数据分析结果表明,EgGRF基因家族在茎尖和花中表达量较高,8个EgGRF在果肉的不同时期特异表达。本研究为进一步探索EgGRF调控油棕生长发育过程的机制奠定基础。
关键词:EgGRF;油棕;生物信息学;基因表达
中图分类号:S565.9 文献标识码:A
Genome-wide Identification and Expression of EgGRF Gene Family in Oil Palm
JIN Longfei, YIN Xinxing, CAO Hongxing*
Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences / Hainan Key Laboratory of Tropical Oil Crops Biology, Wenchang, Hainan 571339, China
Abstract: Growth regulating factor (GRF) is an important transcriptional factor in plants which is involved in various biological processes, including regulating plant growth, development, and stress response. In this study, 15 EgGRF transcription factor family members were identified from the oil palm genome using bioinformatics methods, and the physicochemical properties, chromosomal location, gene structure, conserved functional domains, evolutionary relationships, promoter cis-acting elements, tissue expression patterns and mesocarp expression patterns at different stages were analyzed. The results showed that the EgGRF family members encoded an average of 409 aa in the peptide. The molecular weight was between 27.62 and 65.51 kDa, the isoelectric point was between 6.24 and 9.38, the instability index was between 47.24 and 68.37, the aliphatic index was between 47.52 and 67.69, and the gravy was between –0.945 and –0.400. Each EgGRF members contained 3-5 exons, and contained QLQ (Gln, Leu, Gln) and WRC (Trp, Arg, Cys) domain. EgGRF family was divided into 5 groups based on phylogenetic relationships, and was closely related to the Arabidopsis. Analysis of transcriptome data from different tissues showed that the EgGRF family was significantly high expressed in the shoot and flower. Eight EgGRFs were specifically expressed in different stages of mesocarp. The results would provide useful information and resource for the further investigation of EgGRF on oil palm growth and development.
Keywords: EgGRF; oil palm; bioinformatics; gene expression
DOI: 10.3969/j.issn.1000-2561.2021.07.002
转录因子是一类重要的调控基因,参与植物生长、发育、代谢、繁殖、分化、逆境響应等多种生物学过程[1-3]。目前在植物中已经发现了60多个转录因子家族,其中生长调控因子(Growth regulating factor,GRF)主要在植物生长发育中起重要的调控作用[4-5]。GRF转录因子的N端有2个保守结构域,分别是QLQ(Gln、Leu、Gln)和WRC(Trp、Arg、Cys)保守结构域[6]。QLQ结构域可通过与GRF互作因子(GRF-interacting factor1,GIF1)结合,形成转录共激活因子,激活下游的靶基因表达;WRC结构域包含一个核定位信号NLS区域和一个与DNA结合的锌指基序,均与GRF转录因子生物学功能密切相关[7]。植物中第一个编码GRF转录因子的基因OsGRF1是在水稻中发现的,该基因通过调控赤霉素代谢诱导茎伸长[8]。OsGRF4通过调控2个细胞分裂素脱氢酶前体基因(OsCKX5和OsCKX1)的表达,增加细胞分裂素的含量,进而促进稻穗的伸长[9]。拟南芥AtGRF5通过调控细胞增殖,刺激叶绿体分裂,增加叶绿素含量,促进叶片生长[10]。AtGRF1、AtGRF4、AtGRF8、AtGRF9通过调控PTL基因控
制体胚发生过程中内源生长素的合成[11]。OsGRF4还能与miR396c、OsGIF1互作调控水稻籽粒大小[12],对提高水稻产量具有重要意义。在油菜中的研究也发现,超表达BnGRF2能够调控细胞分裂、叶绿素含量和光合作用效率,进而增加油菜的产油量[13]。随着越来越多植物基因组测序完成,GRF基因家族在拟南芥[14]、水稻[15]、番茄[16]、藜麦[17]、大豆[18]、茶树[19]、棉花[20]、龙眼[21]等多个物种中被鉴定出来,而在油棕中的研究未见报道。
油棕(Elaeis guineensis)是世界上产油效率最高的油料作物,油量高达4.27 t/hm2,是花生的7~8倍、大豆的9~10倍[22]。油棕果压榨的棕榈油,广泛应用于食品加工、日用化工、机械润滑和生物柴油等领域[23]。近年来市场对棕榈油的需求逐年增加,油棕种植业的快速发展毁坏了大量的热带雨林。因此,提高油棕单产是维持热带雨林保护和食用油短缺平衡的重要途径,而挖掘控制油棕重要农艺性状的关键基因并采用分子育种加快高产油棕品种的选育是油棕育种研究的重要工
作[24]。本研究基于油棕基因组数据库挖掘和鉴定调控油棕生长的转录因子EgGRF,分析其理化性质、染色体定位、基因结构、保守结构域、进化关系、启动子顺式作用元件,同时分析其在不同组织和果肉不同发育时期的表达模式,为进一步探索EgGRF调控油棕生长发育过程的机制奠定基础。
1 材料与方法
1.1 油棕EgGRF基因家族的挖掘与鉴定
油棕全基因组数据从NCBI数据库(https://www.ncbi.nlm.nih.gov/ ID:2669)中下载,拟南芥AtGRF蛋白质序列从TAIR数据库(https://www.arabidopsis.org/)中下载,水稻OsGRF蛋白序列从NCBI数据库中下载。以AtGRF和OsGRF蛋白质序列作为参考序列,通过Blsatp在油棕基因组数据库中进行比对。将获得的蛋白序列提交到NCBI的保守结构域数据库,利用Batch Web CD-search Tool软件[25]进行保守结构域分析。利用在线工具ExPAsy(http://www.expasy.org)分析油棕EgGRF基因家族的蛋白质分子量、等电点、蛋白不稳定指数、脂溶指数和总平均亲水性等理化性质。
1.2 油棕EgGRF基因家族的基因结构、保守结构域、染色体定位及进化分析
油棕EgGRF基因家族的基因结构、保守结构域和染色体定位均采用Tbtool软件[26]进行可视化分析。采用ClustalW软件[27]对油棕、拟南芥和水稻的GRF蛋白质序列进行多重比对,采用MEGA 6.0软件的Neighbor-joining法进行建树,分析进化关系,设置校验值Bootstrap为1000。
1.3 油棕EgGRF基因家族的启动子顺式作用元件分析
从NCBI数据库中下载油棕EgGRF基因CDS上游2000 bp的序列。利用Plant Care软件[28]进行顺式作用元件分析,采用Tbtool软件进行可视化分析[26]。
1. 4 油棕EgGRF基因家族的表达分析
油棕的根(SRR851071)、茎尖(SRR851103)、叶(SRR851096)、花(SRR851108)和花后15周(SRR190698)、17周(SRR190699)、21周(SRR190701)和23周(SRR190702)果肉的转录组数据从NCBI的SRA数据库(https://trace.ncbi.nlm.nih.gov/Traces/sra/sra.cgi?)中下载。利用RPKM值对转录组数据进行归一化处理,利用基迪奥云平台在线工具(https://www.omicshare.com/tools/)绘制热图。
2 结果与分析
2.1 油棕EgGRF基因家族的全基因组鉴定和理化性质分析
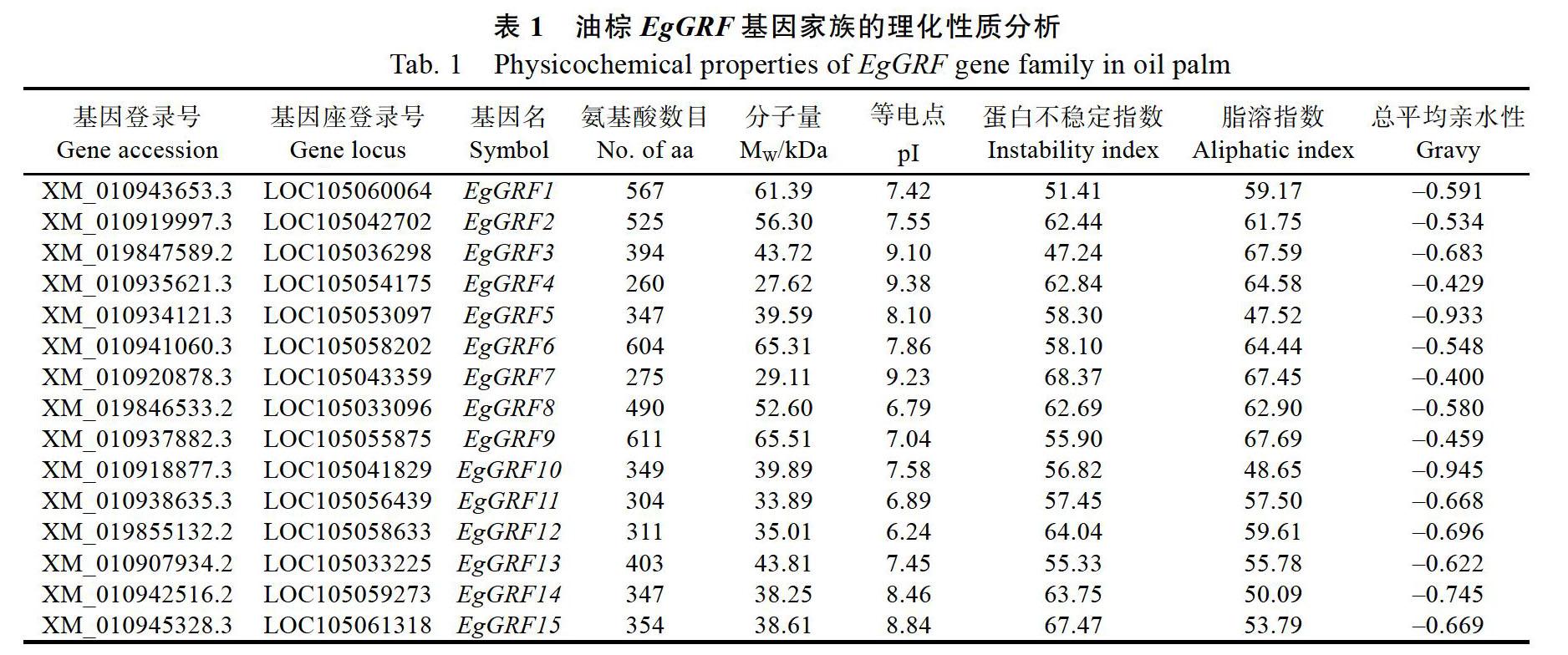
通过Blastp比对分析获得油棕EgGRF的候选蛋白质序列,预测保守结构域,去除不含QLQ和WRC保守结构域的序列,共获得15个EgGRF家族成员。根据其与拟南芥的同源性顺序进行命名,依次命名为EgGRF1~EgGRF15。油棕EgGRF多肽链氨基酸数目为260~611,平均为409;蛋白质分子量为27.62~65.51 kDa,平均为44.71 kDa;等电点为6.24~9.38,平均为7.86;蛋白不稳定指数为47.24~68.37,平均为59.48,表明EgGRF家族成员编码的均为不稳定蛋白;脂溶系数为47.52~67.69,平均为59.23,脂溶性一般;总平均亲水性为–0.945~–0.400,平均为–0.633,都为负值,表明EgGRF均为亲水性蛋白(表1)。
2.2 油棕EgGRF基因家族成员在染色体上的定位
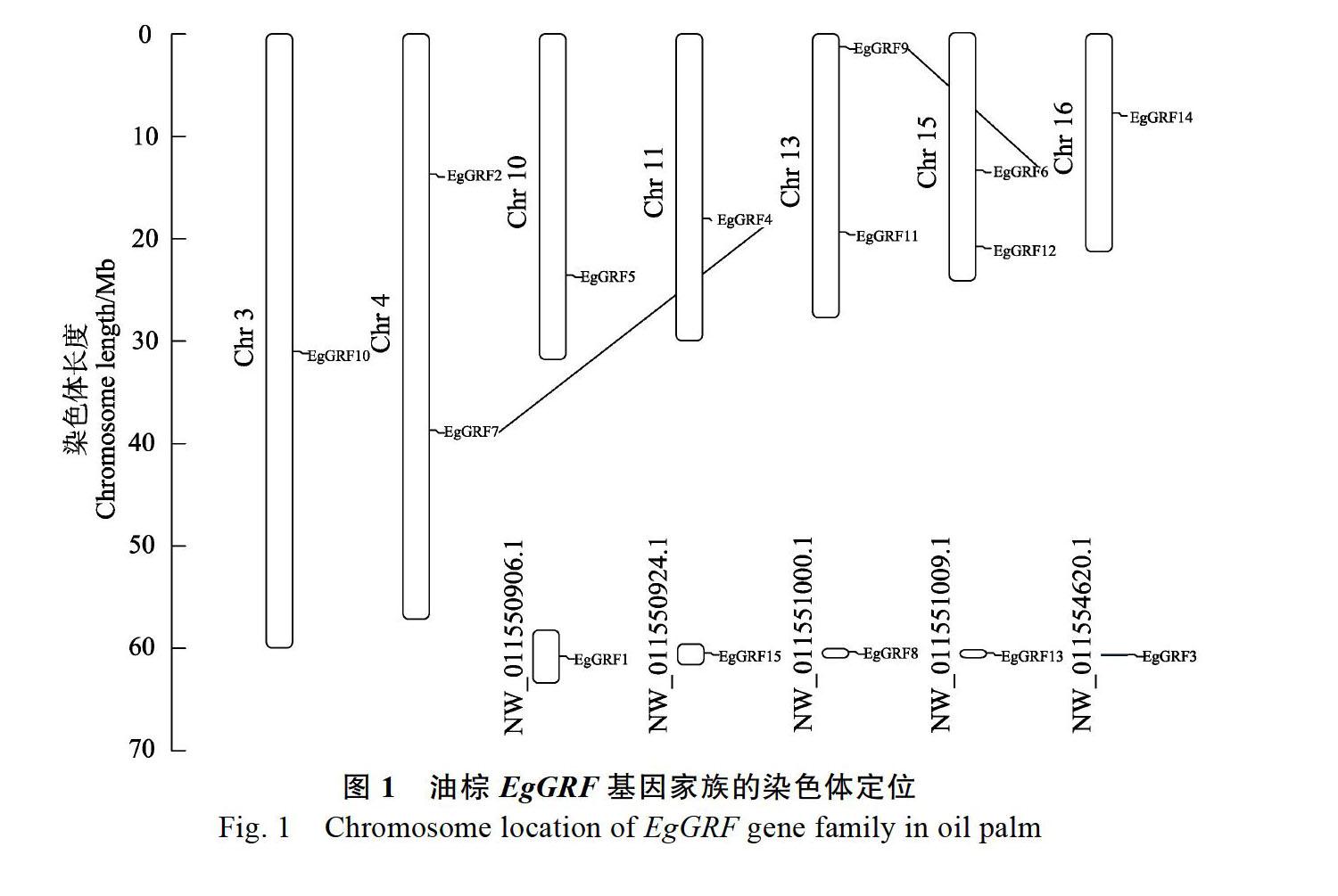
对油棕EgGRF基因家族在染色体上位置进行分析(图1),发现15个EgGRF基因家族成员分布 在7条染色体和5个Scaffolds上。EgGRF10在Chr3上,EgGRF2、EgGRF7在Chr4上,EgGRF5在Chr10上,EgGRF4在Chr11上,EgGRF9、EgGRF11在Chr13上,EgGRF6、EgGRF12在Chr15上,EgGRF14在Chr16,EgGRF1、EgGRF3、EgGRF8、EgGRF13、EgGRF15分別在5个Scaffolds上。EgGRF4和EgGRF7,EgGRF6和EgGRF9存在基因共线性现象。
2.3 油棕EgGRF的基因结构、保守结构域和进化关系
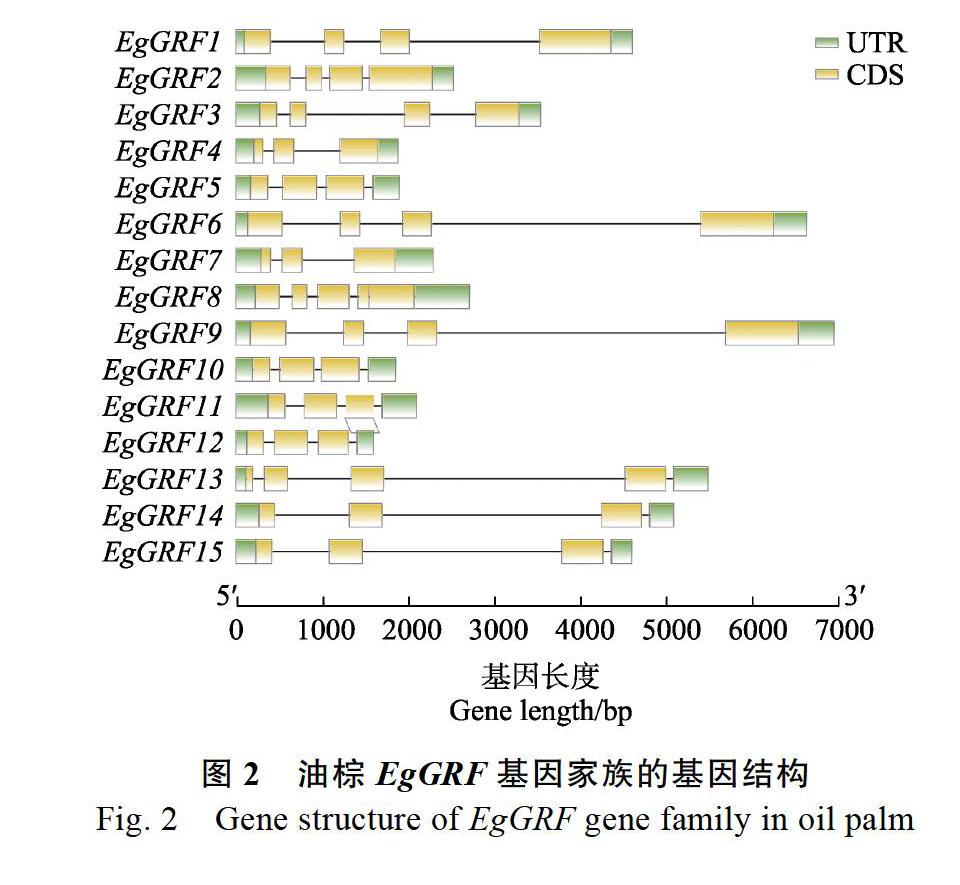
15个油棕EgGRF基因家族具有3~5个外显子,其中EgGRF4、EgGRF7有3个外显子,EgGRF8、EgGRF13有5个外显子,其余EgGRF成员均为4个外显子(图2)。15个EgGRF基因家族成员均含有GRF转录因子特有的WRC和QLQ保守结构域(图3)。为了分析油棕EgGRF基因家族的进化发育关系,将油棕EgGRF和AtGRF、OsGRF蛋白质序列进行多重比对构建进化树。根据进化树分支(图4),可将15个EgGRF分成5个亚族,EgGRF5、EgGRF10、EgGRF11、EgGRF12、EgGRF13、EgGRF14、EgGRF15为Ⅰ亚族,EgGRF4、EgGRF7为Ⅱ亚族,EgGRF3为Ⅲ亚族,EgGRF2、EgGRF8为Ⅳ亚族,EgGRF1、EgGRF6、EgGRF9为V亚族。其中第Ⅲ和第Ⅳ亚族EgGRF仅与AtGRF聚在一起,表明油棕的EgGRF与拟南芥的亲缘关系更近。
2.4 油棕EgGRF基因家族的启动子顺式作用元件的鉴定
在油棕EgGRF基因家族的启动子中鉴定了大量的顺式作用元件(EgGRF8的启动子中有大量的碱基未测序,故顺式作用元件较少)(图5),包括生长素响应(10个)、脱落酸响应(21个)、赤霉素响应(19个)、茉莉酸甲酯响应(21个)、水杨酸响应(10个)、低温响应(3个)、干旱响应(7个)、光响应(53个)、防卫和逆境响应(4个)、分生组织特异表达(12个)等顺式作用元件,表明EgGRF参与植物激素和环境刺激的应答。
2.5 油棕EgGRF基因家族的表达分析
油棕EgGRF基因家族在不同组织中表达量差异较大(图6),其中EgGRF1、EgGRF2、EgGRF3、EgGRF5、EgGRF6、EgGRF7、EgGRF9、EgGRF10、EgGRF12、EgGRF13、EgGRF14在茎尖中高表达,EgGRF4、EgGRF11、EgGRF15在花中高表达;EgGRF基因家族在根和叶中的表达量均较低,仅EgGRF8在叶片中表达量较高,这表明GRF在油棕的茎尖和花发育过程中起重要调控作用。8个EgGRF基因在果肉发育的不同时期中特异表达不同(图7),其中EgGRF2、EgGRF9、EgGRF14在花后15周的果肉中高表达,EgGRF6、EgGRF8在花后17周的果肉中高表达,EgGRF3在花后21周的果肉中高表达,EgGRF11、EgGRF15在花后23周的果肉中高表达,这表明不同的EgGRF分别在油棕发育的不同时期起调控作用。
3 讨论
随着基因组测序技术的发展和生物信息学研
究的不断深入,大量植物完成了全基因组测序,这为植物基因家族的挖掘、鉴定和功能分析提供了有利条件。GRF转录因子是植物中特有的一类转录因子,在叶片生长、子叶生长、茎伸长、花发育、籽粒发育、胚胎发生等生长发育过程中起重要的调控作用[5, 8, 11, 14]。油棕作为世界上产油效率最高的油料作物,其GRF基因家族的研究尚未见报道,而在拟南芥和水稻等模式植物中研究较为深入,这些研究给油棕EgGRF的研究提供参考。
本研究利用生物信息学分析,从油棕基因组中鉴定了15个EgGRF基因家族成员,比拟南芥(9个)和水稻(12个)成员数目更多,EgGRF4和EgGRF7、EgGRF6和EgGRF9存在基因共线性,这可能是油棕在进化过程中发生了基因串联复制而导致EgGRF基因数目增加。基因复制事件能够导致植物基因组中形成大量的重复基因,重复基因的存在能够促进基因新功能的进化,增强植物对环境变化的适应性[29]。油棕EgGRF转录因子的蛋白长度、分子量、等电点、蛋白不稳定指数、脂溶指数和总平均亲水性等基本特性存在较大差异,与拟南芥和水稻中的研究相似。基因的结构分析发现,绝大部分EgGRF基因具有4个外显子,与拟南芥AtGRF家族的基因结构分布相似,其中EgGRF8的第4个和第5个外显子之间有个极短的内含子,植物进化过程中转座子的插入可能导致内含子数目的增加[30],EgGRF8内含子的产生可能是转座子插入导致的。进化分析发现油棕EgGRF优先与AtGRF聚在一起,表明油棕EgGRF与拟南芥的亲缘关系更近。
EgGRF主要在油棕的茎尖、花和果肉中表达,可能是由于EgGRF在这些组织或器官的生长发育中发挥着重要调控作用。研究发现GRF在幼嫩组织中的表达较高,在成熟的组织和器官中表达量低[31-33]。在本研究中EgGRF1、EgGRF2、EgGRF3、EgGRF5、EgGRF6、EgGRF7、EgGRF9、EgGRF10、EgGRF12、EgGRF13、EgGRF14在茎尖中的表达显著高于其他组织。茎尖是油棕的顶端生长点,分生能力极强,EgGRF的高表达可能与油棕茎尖旺盛的分生能力相关,同时EgGRF启动子中也鉴定了大量分生组织特异表达响应元件。在杨树中的研究发现PtGRF在茎尖生长中起着重要的调控作用[34],在玉米中的研究发现ZmGRF与ZmGIF1基因互作调控茎尖的发育[35]。GRF还参与植物根的发育[36],而本研究发现在生长极为旺盛的根尖部分EgGRF整体表达都很低,这表明油棕根发育可能主要受其他转录因子的调控,例如NAC1、TIR1等。EgGRF4、EgGRF11、EgGRF15在花中的表达量显著高于其他组织,表明EgGRF在油棕花发育中起重要的调控作用,在拟南芥和毛果杨中的研究也发现GRF对花的发育起重要的调控作用[37-38]。GRF在果实发育中起重要调控作用,在柑橘中的研究发现CsGRF3和CsGRF4在果实发育前期高表达,且受赤霉素的诱导[39]。花后15周,油棕完成细胞分裂和膨胀,进入成熟阶段;花后17周,油棕果皮开始转色;花后21周,油棕进入内含物的快速积累期,乙烯含量达到峰值;花后23周,油棕进入完熟期,内含物积累达到峰值[40]。为探索EgGRF在油棕果肉发育中的作用,选择4个时期进行基因表达分析,结果发现EgGRF2、EgGRF6、EgGRF8、EgGRF9、EgGRF14在油棕果肉发育前期高表达,EgGRF3、EgGRF5、EgGRF11在油棕果肉发育后期高表达,这表明不同EgGRF在油棕果肉发育的不同时期都起调控作用,同时在EgGRF启动子上也发现大量与果实发育密切相关的植物激素应答元件,如生长素、赤霉素和脱落酸应答元件。油棕果肉发育的不同阶段受不同激素的调控,前期主要受生长素、赤霉素和细胞分裂素的调控,后期主要受乙烯和脱落酸的调控[40],而EgGRF的表达受赤霉素、脱落酸和水杨酸等植物激素的诱导[16],这表明EgGRF在激素控制果肉发育中起着重要的调控作用。果肉是油棕主要的产油器官,因此明确EgGRF在果肉发育中的调控机制对提高油棕的产油量具有重要的意义。在后续的研究中还需要利用转基因技术或基因编辑技术对这些基因的功能和作用机制进一步验证。
參考文献
[1] Amorim L L B, Da Fonseca Dos Santos R, Neto J P B, et al. Transcription factors involved in plant resistance to pathogens[J]. Current Protein and Peptide Science, 2017, 18(4): 335-351.
[2] Ng D W, Abeysinghe J K, Kamali M. Regulating the regulators: the control of transcription factors in plant defense signaling[J]. International Journal of Molecular Sciences, 2018, 19(12): 3737.
[3] Gaudinier A, Rodriguez-Medina J, Zhang L, et al. Transcriptional regulation of nitrogen-associated metabolism and growth[J]. Nature, 2018, 563(7730): 259-264.
[4] Debernardi J M, Mecchia M A, Vercruyssen L, et al. Post-transcriptional control of GRF transcription factors by microRNA miR396 and GIF co-activator affects leaf size and longevity[J]. Plant Journal, 2014, 79(3): 413-426.
[5] Baucher M, Moussawi J, Vandeputte O M, et al. A role for the miR396/GRF network in specification of organ type during flower development, as supported by ectopic expression of Populus trichocarpa miR396c in transgenic tobacco[J]. Plant Biology, 2013, 15(5): 892-898.
[6] Fonini L S, Lazzarotto F, Barros P M, et al. Molecular evolution and diversification of the GRF transcription factor family[J]. Genetics and Molecular Biology, 2020, 43(3): e20200080.
[7] Kim J H. Biological roles and an evolutionary sketch of the GRF-GIF transcriptional complex in plants[J]. BMB Reports, 2019, 52(4): 227-238.
[8] Van Der Knaap E, Kim J H, Kende H. A novel gibberellin-induced gene from rice and its potential regulatory role in stem growth[J]. Plant Physiology, 2000, 122(3): 695-704.
[9] Sun P, Zhang W, Wang Y, et al. OsGRF4 controls grain shape, panicle length and seed shattering in rice[J]. Journal of Integrative Plant Biology, 2016, 58(10): 836-847.
[10] Vercruyssen L, Tognetti V B, Gonzalez N, et al. GROWTH REGULATING FACTOR5 stimulates Arabidopsis chloroplast division, photosynthesis, and leaf longevity[J]. Plant Physiology, 2015, 167(3): 817-832.
[11] Szczygiel-Sommer A, Gaj M D. The miR396-GRF regulatory module controls the embryogenic response in Arabidopsis via an auxin-related pathway[J]. International Journal of Molecular Sciences, 2019, 20(20): 1-18.
[12] Li S, Gao F, Xie K, et al. The OsmiR396c-OsGRF4-OsGIF1 regulatory module determines grain size and yield in rice[J]. Plant Biotechnology Journal, 2016, 14(11): 2134-2146.
[13] Liu J, Hua W, Yang H L, et al. The BnGRF2 gene (GRF2-like gene from Brassica napus) enhances seed oil production through regulating cell number and plant photosynthesis[J]. Journal of Experimental Botany, 2012, 63(10): 3727-3740.
[14] Kim J H, Choi D, Kende H. The AtGRF family of putative transcription factors is involved in leaf and cotyledon growth in Arabidopsis[J]. The Plant Journal, 2003, 36(1): 94-104.
[15] Choi D, Kim J H, Kende H. Whole genome analysis of the OsGRF gene family encoding plant-specific putative transcription activators in rice (Oryza sativa L.)[J]. Plant and Cell Physiology, 2004, 45(7): 897-904.
[16] Khatun K, Robin A H K, Park J, et al. Molecular characterization and expression profiling of tomato GRF transcription factor family genes in response to abiotic stresses and phytohormones[J]. International Journal of Molecular Sciences, 2017, 18(5): 1056.
[17] 時丕彪, 何 冰, 费月跃, 等. 藜麦GRF转录因子家族的鉴定及表达分析[J]. 作物学报, 2019, 45(12): 1841-1850.
[18] Chen F, Yang Y, Luo X, et al. Genome-wide identification of GRF transcription factors in soybean and expression analysis of GmGRF family under shade stress[J]. BMC Plant Biology, 2019, 19(1): 269.
[19] 王鹏杰, 郑玉成, 林 浥, 等. 茶树GRF基因家族的全基因组鉴定及表达分析[J]. 西北植物学报, 2019, 39(3): 413-421.
[20] Cao J F, Huang J Q, Liu X, et al. Genome-wide characterization of the GRF family and their roles in response to salt stress in Gossypium[J]. BMC Genomics, 2020, 21(1): 575.
[21] 刘蒲东, 张舒婷, 陈晓慧, 等. 龙眼GRF家族全基因组鉴定及表达模式[J]. 应用与环境生物学报, 2020, 26(2): 236-245.
[22] 雷新涛, 曹红星, 冯美利, 等. 热带木本生物质能源树种——油棕[J]. 中国农业大学学报, 2012, 17(6): 185-190.
[23] Mahlia T M I, Ismail N, Hossain N, et al. Palm oil and its wastes as bioenergy sources: a comprehensive review[J]. Environmental Science and Pollution Research International, 2019, 26(15): 14849-14866.
[24] Cros D, Tchounke B, Nkague-Nkamba L. Training genomic selection models across several breeding cycles increases genetic gain in oil palm in silico study[J]. Molecular Breeding, 2018, 38(7): 1-12.
[25] Lu S, Wang J, Chitsaz F, et al. CDD/SPARCLE: the conserved domain database in 2020[J]. Nucleic Acids Research, 2020, 48(d1): D265-D268.
[26] Chen C, Chen H, Zhang Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[27] Edgar R C, Batzoglou S. Multiple sequence alignment[J]. Current Opinion in Structural Biology, 2006, 16(3): 368-373.
[28] Lescot M, Déhais P, Thijs G, et al. Plant CARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
[29] Panchy N, Lehti-Shiu M, Shiu S H. Evolution of gene duplication in plants[J]. Plant Physiology, 2016, 171(4): 2294-2316.
[30] Huff J T, Zilberman D, Roy S W. Mechanism for DNA transposons to generate introns on genomic scales[J]. Nature, 2016, 538(7626): 533-536.
[31] Rodriguez R E, Mecchia M A, Debernardi J M, et al. Control of cell proliferation in Arabidopsis thaliana by microRNA miR396[J]. Development, 2010, 137(1): 103-112.
[32] Ercoli M F, Rojas A M, Debernardi J M, et al. Control of cell proliferation and elongation by miR396[J]. Plant Signaling & Behavior, 2016, 11(6): e1184809.
[33] Kim J H, Lee B H. GROWTH-REGULATING FACTOR4 of Arabidopsis thaliana is required for development of leaves, cotyledons, and shoot apical meristem[J]. Journal of Plant Biology, 2006, 49(6): 463-468.
[34] Zhang D, Sun W, Singh R, et al. GRF-interacting factor1 regulates shoot architecture and meristem determinacy in maize[J]. Plant Cell, 2018, 30(2): 360-374.
[35] Chao Q, Gao Z F, Zhang D, et al. The developmental dynamics of the Populus stem transcriptome[J]. Plant Biotechnology Journal, 2019, 17(1): 206-219.
[36] Samad A F A, Sajad M, Nazaruddin N, et al. MicroRNA and transcription factor: key players in plant regulatory network[J]. Front Plant Science, 2017, 8: 565.
[37] Yang F X, Liang G, Liu D M, et al. Arabidopsis MiR396 mediates the development of leaves and flowers in transgenic tobacco[J]. Journal of Plant Biology, 2009, 52(5): 475-481.
[38] Baucher M, Moussawi J, Vandeputte O M, et al. A role for the miR396/GRF network in specification of organ type during flower development, as supported by ectopic expression of Populus trichocarpa miR396c in transgenic tobacco[J]. Plant Biology, 2013, 15(5): 892-898.
[39] Liu X, Guo L X, Jin L F, et al. Identification and transcript profiles of Citrus growth-regulating factor genes involved in the regulation of leaf and fruit development[J]. Molecular Biology Reports, 2016, 43(10): 1059-1067.
[40] Tranbarger T J, Stéphane D, Thierry J, et al. Regulatory mechanisms underlying oil palm fruit mesocarp maturation, ripening, and functional specialization in lipid and carotenoid metabolism[J]. Plant Physiology, 2011, 156(2): 564-584.
責任编辑:黄东杰
