银杏叶提取物含药血清间接抑制肝癌细胞株恶性进展的机制
2021-08-21刘敬莉柳科军
付 江,刘敬莉,柳科军,,段 磊,蒲 俊,卜 阳,4
(1.湖北省孝感市中心医院神经外科,孝感 432000;2.宁夏医科大学临床医学院,银川 750004;3.宁夏医科大学总医院肝胆外科,银川 750004;4.宁夏回族自治区人民医院肝胆外科,银川 750002)
肝细胞癌(hepatocellular carcinoma,HCC)(简称肝癌)目前居于恶性肿瘤发病率第5位,病死率居第3位[1]。肝癌术后易复发,且对转移缺乏有效治疗手段,最终多死于复发转移。临床证实肝癌对分子靶向药物(索拉非尼等)反应不佳,患者生存获益率有限。免疫检查点阻断剂是近年发展最迅速的免疫治疗手段,主要以PD1/PDL1和CTLA4作为治疗靶点,通过恢复受抑制的T细胞功能达到杀伤肿瘤的作用[2],然而研究发现肝癌抗PD-1应答率不到20%[3-4]。因此,从传统中药中寻求综合治疗策略,是精准医学时代背景下提高肝癌生存获益率的重要策略之一[5-6]。银杏叶提取物(ginkgo biloba extract,GBE)是目前临床使用较广泛的中药材之一,其中起主要作用的是黄酮类以及萜内酯类等化合物[7-8]。近年研究证实GBE是血小板活化因子(platelet activating factor,PAF)特异性受体拮抗剂,竞争性抑制PAF与其受体结合发挥作用[9]。然而,GBE与PAF表达水平的关系及其对肝癌细胞增殖、迁移及侵袭能力的影响尚不明确。因此,本研究拟检测GBE含药血清中PAF水平,进而探讨GBE含药血清对肝癌细胞株增殖、迁移、侵袭的影响及相关机制。
1 材料与方法
1.1 主要试剂
GBE制剂(3.5 mg·mL-1)购自悦康药业集团有限公司;兔抗人E-cadherin、Vimentin、Snail和PCNA抗体均购自美国Abcam公司;鼠抗人βactin购于武汉Proteintech公司;HRP标记山羊抗兔/鼠IgG二抗、PAF小鼠酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒、DMEM高糖、TRYPSIN 0.25%EDTA、苏木素-伊红染色剂,吉姆萨染液均购自上海威奥生物科技有限公司;Transwell小室购自于美国Corning公司;CCK8细胞增殖检测试剂盒购自日本同仁。
1.2 GBE含药血清的制备
BALB/c nu裸鼠:雄性,4~6周龄,购自宁夏医科大学实验动物中心,裸鼠适应性饲养7 d,将裸鼠随机分为GBE组[GBE 1 mg·(kg·d)-1,腹腔注射]和对照组(同体积生理盐水,每天腹腔注射1次),连续注射2周后眼球取血并800 r·min-1离心获取血清,0.22 μm针式微孔滤膜过滤除菌并-20℃冻存备用。实验完毕后采用高浓度水合氯醛麻醉裸鼠,经颈椎脱位处死。所有动物实验方案均经宁夏医科大学实验动物伦理委员会审批同意后实施。
1.3 ELISA法检测裸鼠GBE含药血清中PAF含量
设空白孔、GBE含药血清孔、对照血清孔、不同浓度标准品孔。GBE含药血清孔加1∶5稀释裸鼠GBE含药血清50 μL,对照孔加1∶5稀释裸鼠对照组血清50 μL,标准品孔加不同浓度标准品50 μL。实验按PAF的ELISA试剂盒说明书操作。
1.4 GBE含药血清处理人肝癌细胞株
人肝癌细胞株MHCC97H和Hep3B,购自中国科学院上海生命科学研究院细胞资源中心。人肝癌细胞MHCC97H和Hep3B培养于含1%链霉素青霉素、10%胎牛血清的DMEM培养基中,将细胞置于37℃,5% CO2温育箱中培养,取处于对数生长期细胞,细胞达80%~90%密度进行再传代或备用。按照50 μL裸鼠血清加入1 mL培养液比例将上述GBE组含药血清和对照组血清分别加入含5%胎牛血清的DMEM培养基,并分别处理人肝癌细胞株MHCC97H和Hep3B,培养48 h后收集细胞待用。
1.5 CCK8检测人肝癌细胞株MHCC97H和Hep3B的增殖
采用GBE含药血清和对照组血清分别处理人肝癌细胞株,浓度为10 μL含药血清加入200 μL含5%胎牛血清的DMEM培养基,对照组血清同比例稀释,分别处理MHCC97H和Hep3B细胞24 h、48 h、72 h和96 h,加入CCK8,450 nm测定光密度(OD)值。
1.6 细胞划痕实验检测人肝癌细胞株MHCC97H的迁移能力
采用上述GBE含药血清和对照组血清处理的人肝癌细胞株MHCC97H,计数并加入6孔板,约5×105个细胞/孔,37℃培养箱培养24 h后采用枪头进行横线划痕,而后用胎牛血清洗细胞3次,去除划下的细胞,加入无血清培养基,放入37℃,5% CO2培养箱,分别于培养24 h和48 h拍照,并测量各组划痕宽度。
1.7 Transwell法检测肝癌细胞株的侵袭和迁移能力
Matrigel胶(购自美国BD公司),4℃过夜解冻,用无血清预冷的培养液DMEM按1∶8的比例稀释Matrigel;将80 μL稀释过的Matrigel加入Transwell小室(上室),4℃孵育4 h使其成凝胶状;0.25%胰酶-EDTA消化细胞,用不含血清的培养液DMEM重悬上述经GBE含药血清(或对照血清)处理后的肝癌细胞,使其终浓度为6×105/mL;用预温的无血清培养基轻轻洗涤已经凝固的Matrigel并在Matrigel上加入100 μL细胞悬液;下室加入700 μL含有10%胎牛血清的培养液DMEM,将Transwell小室放入37℃,5%CO2细胞培养箱,孵育48 h;吉姆萨染色后40倍镜下观察并计数。
1.8 Western blot检测肝癌细胞株增殖及EMT相关蛋白的表达
收集细胞获得沉淀,加入RIPA裂解液裂解细胞获得蛋白,BCA法检测蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭,4℃一抗(PCNA、E-cadherin、Vimentin、Snail、β-actin)培养过夜,TBST洗膜后二抗孵育,电化学发光法(ECL)曝光,Western blot结果采用Image J软件进行灰度值评估,目标蛋白的半定量数据=目标蛋白灰度值/内参灰度值。
1.9 统计学方法
采用SPSS 17.0统计学软件和Graphpad Prism 7.0绘图软件处理。所有实验进行3次重复操作,数据用均数±标准差(±s)表示,两组比较采用配对t检验,P≤0.05为差异有统计学意义。
2 结果
2.1 GBE含药血清中PAF的含量
ELISA检测GBE含药血清和对照组血清中PAF,发现GBE处理后的裸鼠外周血清中PAF含量为(89.13±18.14)μg·dL-1,对照组为(231.7±26.87)μg·dL-1,GBE组较对照组降低(P<0.001)。
2.2 GBE含药血清能够抑制肝癌细胞株的增殖
CCK8检测提示GBE含药血清处理的肝癌细胞增殖速度明显降低。GBE含药血清处理后96 h,MHCC97H细胞株GBE组OD值为(0.59±0.25),对照组为(0.99±0.42),GBE组低于对照组(P<0.001)。Hep3B细胞株GBE组OD值为(0.56±0.22),对照组为(0.69±0.14),GBE组低于对照组(P<0.001),见图1。

图1 CCK8检测GBE含药血清抑制肝癌细胞株MHCC97H和Hep3B的增殖
2.3 GBE含药血清能够抑制肝癌细胞株的迁移能力
GBE含药血清及对照血清处理肝癌细胞MHCC97H 24 h时,两组划痕间隙宽度相近(P>0.05);48 h时GBE组划痕间隙宽度为(135.80±23.23)μm,对照组为(86.55±14.51)μm,GBE组高于对照组(P=0.0038),见图2。

图2 细胞划痕实验检测GBE含药血清抑制肝癌细胞株MHCC97H的迁移(×40)
2.4 GBE含药血清能够抑制肝癌细胞株的侵袭能力
Transwell检测结果显示,与对照血清组比较,GBE含药血清组穿透Transwell小室基底膜的肝癌细胞数目减少。GBE组的MHCC97H细胞穿膜数为(11.25±2.98)个,对照组为(29.01±7.26)个,GBE组低于对照组(P=0.004);GBE组的Hep3B细胞穿膜数为(14.25±5.56)个,对照组为(42.75±8.53)个,GBE组亦低于对照组(P=0.0014),见图3。
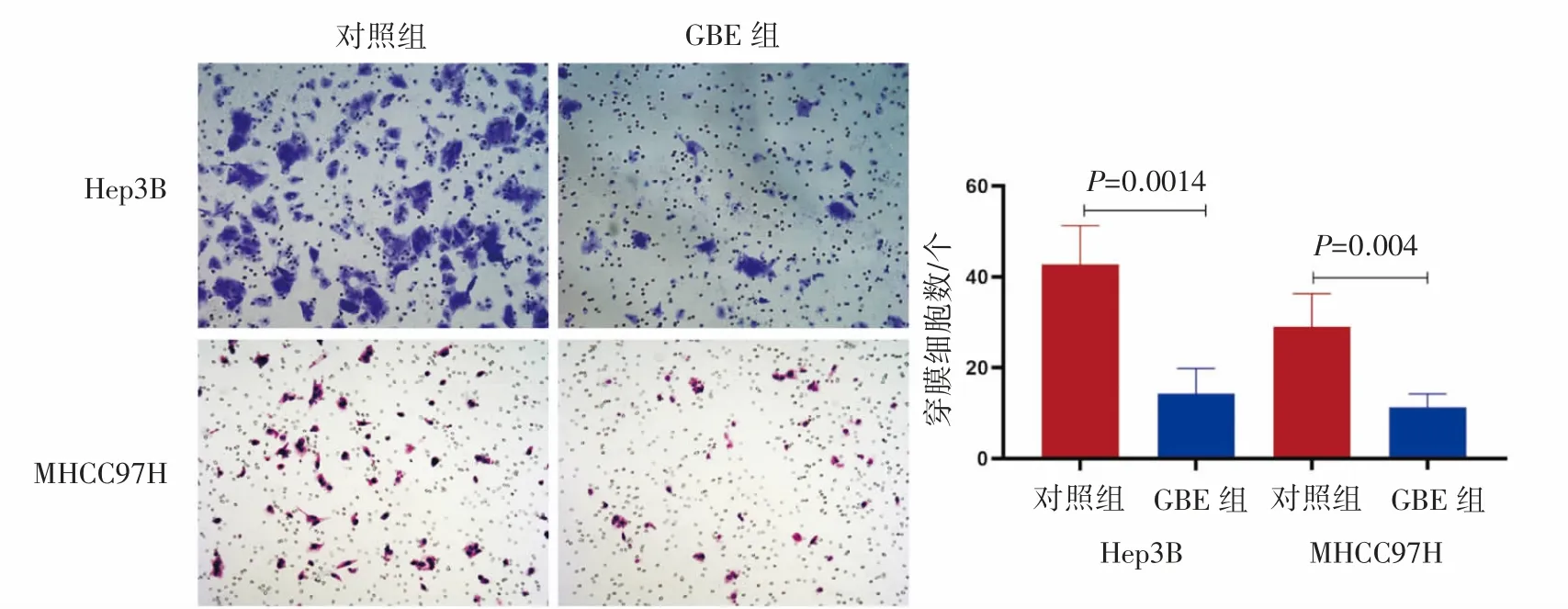
图3 Transwell法检测GBE含药血清对肝癌细胞株侵袭力的影响(×40)
2.5 GBE含药血清改变肝癌细胞株的MET及增殖相关蛋白的表达
Western blot检测GBE组的Hep3B细胞PCNA相对表达量为(0.24±0.06),对照组为(0.48±0.07),GBE组低于对照组(P=0.0105);Hep3B细胞的GBE组Vimentin(0.17±0.04)和Snail(0.42±0.06)的相对表达量低于对照组的Vimentin(0.31±0.04)和Snail(0.71±0.07)(P=0.021,0.006);Hep3B的GBE组的E-cadherin相对表达量为(0.18±0.02),对照组为(0.11±0.04),GBE组高于对照组(P=0.0451)。
Western blot检测GBE组的MHCC97H细胞PCNA相对表达量为(0.09±0.03),对照组为(0.15±0.03),GBE组低于对照组(P=0.0474);MHCC97H细胞的GBE组Vimentin(0.21±0.03)和Snail(0.35±0.13)的相对表达量低于对照组的Vimentin(0.32±0.04)和Snail(0.47±0.10)(P=0.012,0.034);Hep3B的GBE组的E-cadherin相对表达量为(0.23±0.04),对照组为(0.13±0.02),GBE组高于对照组(P=0.0139)。
Western blot检测结果提示:GBE含药血清处理两种肝癌细胞株的细胞增殖能力降低与细胞PCNA表达降低有关,肝癌细胞株的MET改变与E-cadherin表达升高,Vimentin和Snail表达降低有关,见图4。
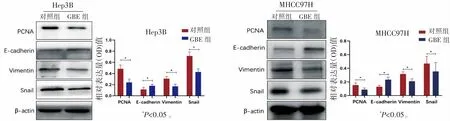
图4 Western blot检测GBE含药血清对肝癌细胞株增殖和EMT相关蛋白表达的影响
3 讨论
肝癌的复发转移是患者病死的重要原因,而肿瘤细胞持续增殖、血管新生及侵袭转移是肿瘤恶性进展的首要条件。虽然近年来在肝癌的发病机制、新辅助化疗及免疫治疗方面的研究取得了不少进展,但仍未找到有效的抑制肝癌恶性进展的治疗方法。因此,传统中药在肿瘤综合治疗中的应用便成为肿瘤治疗的研究热点。近年来研究证实GBE具有抗肿瘤生理活性,在抗氧化应激反应、抑制肿瘤细胞增殖、诱导肿瘤细胞分化凋亡、调控肿瘤细胞信号转导通路和抑制血管生成等方面具有显著的疗效[10]。早期国内外研究者已经明确了GBE在神经胶质瘤、乳腺癌、前列腺癌及肝癌中具有良好的抗肿瘤作用[11-13]。GBE能够通过调控NF-κB信号通路发挥抗肿瘤作用,抑制神经胶质瘤U87细胞的增殖和侵袭转移能力[14]。Pretner等[15]发现GBE可以抑制乳腺癌及前列腺癌中外周型苯二氮卓受体的表达水平,进而抑制肿瘤细胞的增殖能力,诱导肿瘤细胞凋亡。杨涛等[16]研究表明GBE可以明显抑制黄曲霉毒素B1诱发大鼠HCC的作用,主要是抑制肝细胞增生性病变,降低肝癌的发生率。另外,银杏叶注射液可以抑制肝癌H22荷瘤小鼠的肿瘤细胞增殖能力和肿瘤的毛细血管新生,同时增强环磷酰胺的抗肿瘤能力[17]。同既往研究结果一致,本研究应用GBE腹腔注射的裸鼠含药血清处理肝癌细胞株MHCC97H和Hep3B,结果表明GBE含药血清能够明显抑制肝癌细胞的增殖、侵袭和迁移能力。
上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤侵袭和早期转移的重要过程,癌细胞能够通过激活EMT促进肿瘤的侵袭转移,肿瘤中EMT水平升高表现为肿瘤细胞的侵袭转移能力增加,同时肿瘤细胞中E-cadherin的表达降低,Vimentin、Snail1和Twist的表达升高,具备EMT表达特征的肿瘤预后较差;但是肿瘤细胞在侵袭转移的整个过程中,会出现从EMT到MET的逆转,癌细胞通过MET能够获得上皮表型和黏附能力,最终有利于肿瘤归巢,抑制肿瘤细胞迁移和侵袭[18]。另外,细胞增殖异常是肿瘤生物侵袭性的重要指标之一,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达水平升高在一定程度上决定了恶性肿瘤的不良预后[19-20]。在本研究中,Western blot检测发现,与对照血清处理组相比,GBE含药血清处理组肝癌细胞(MHCC97H和Hep3B)后,E-cadherin表达明显升高,而Vimentin和Snail表达明显降低,呈现MET改变。同时,GBE含药血清处理后,PCNA表达显著降低,细胞增殖能力降低。提示GBE含药血清具有抑制肝癌细胞增殖、侵袭和转移的能力,逆转肿瘤细胞EMT改变,抑制肝癌的恶性进展。
已有大量研究发现,银杏内酯B、银杏内酯衍生物等多种银杏叶提取成份均是血小板活化因子受体(platelet activating factor receptor,PAFR)的特异性拮抗剂[21-23]。GBE能够通过抑制PAF/PAFR通路发挥抗血小板作用[24]。Ye等[25]研究发现GBE能够抑制PAF阳性的卵巢癌细胞的增殖和侵袭能力,从而抑制卵巢癌的恶性进展。PAF作为最强的血小板聚集诱导剂,在极低浓度下能够通过与特异性G蛋白受体结合,进而介导炎性反应、肿瘤的发生及其他疾病。同时,肿瘤细胞本身能够产生大量PAF,从而激活循环血中的血小板,促进血小板与肿瘤细胞聚集和黏附[26-27]。Bussolati等[28]发现PAF能够通过增加乳腺肿瘤细胞的侵袭力、增殖力和激活血管生成因子的反应来加快肿瘤的发展。Aponte等[29]发现PAF在PAFR阳性的卵巢细胞中显著诱导细胞增殖和侵袭,而PARF的拮抗剂可以抑制这一作用。也有研究表明GBE可通过作用于靶细胞膜上的受体,竞争性抑制PAF与其受体结合,从而减轻细胞毒性[30]。而我们推测,GBE可能还具备下调PAF的作用,为了进一步探究GBE在抑制肝癌细胞增殖、迁移及侵袭能力的可能机制,本文采用ELISA检测GBE处理BALB/c小鼠血清和对照组血清,结果发现,GBE处理后的小鼠外周血清中PAF含量较对照组显著降低。结合本实验结果,GBE含药血清的作用与其中PAF水平降低有关,其作用机制可能是GBE含药血清中PAF水平下降,从而竞争性抑制PAF对血小板的激活,降低血小板与肿瘤组织细胞的黏附能力,改善了肿瘤细胞的恶性潜质。
综上所述,银杏叶提取物能够较好地抑制肝癌细胞增殖、侵袭和转移,相关蛋白检测提示其可能通过逆转EMT发挥作用,其相关抗肿瘤作用可能与GBE降低外周循环血中的PAF含量有关。因此有理由推测,GBE可能成为肝癌治疗的辅助药物,应进一步深入研究其作用和机制,为肝癌的临床全身化疗联合传统中药治疗提供理论依据。
