金属有机骨架NH2-MIL-101(Fe)对酸性橙 吸附性能的研究
2021-08-21林晓宇崔龙哲吴桂萍
林晓宇,崔龙哲,吴桂萍*
(1. 中南民族大学 资源与环境学院,湖北 武汉 430074;2. Division of Semiconductor and Chemical Engineering, Jeonbuk National University, Jeonju Jeonbuk 561-756, Republic of Korea)
我国每年染料使用量居世界首位,印刷、纺织、印染等行业产生大量的染料废水,其高色度、高CODcr、三致性(致癌、致畸、致突变)的特点,对生态环境造成严重危害[1]。目前,常用的处理方法有吸附法、化学氧化法[2]、催化法[3]和生物法等,其中以吸附法最为简单、安全、高效。目前常用的吸附剂主要有活性炭、硅藻土、农业废弃物等,但其吸附效果较差[4-6]。
金属有机骨架(MOFs),是金属离子通过配位键与有机配体上的配体官能团相互作用形成的一种无限结构的配合物,具有孔隙率较高、品种较多、比表面积较大、结构性能优良等优点[7,8]。近年来,金属有机骨架在药物运输[9]、气体储存[7,10]、载体、催化[11]以及吸附[12,13]等领域都有较为广泛的应用。MIL-101型金属有机骨架是以铁、铝或铬与对苯二甲酸通过配位作用形成一种具有八面体结构的柔性材料。作为一种新型的吸附材料,被广泛的应用于气体分离与富集以及水中污染物的吸附。金属有机骨架NH2-MIL-101 (Fe)结合了MIL-101材料与氨基的优点,使得功能化的金属有机骨架具有更加良好的吸附性能。近年来, NH2-MIL-101 (Fe)作为一种新颖的吸附材料被广泛应用于水中抗生素,酚等有机污染物的去除[14,15]。然而,NH2-MIL-101 (Fe)对水溶液中染料的吸附少有研究。
1 实验部分
1.1 试剂
N,N-二甲基甲酰胺DMF(AR)、六水三氯化铁(AR)、2-氨基对苯二甲酸(AR)、无水乙醇(AR)、酸性橙(AR)、氢氧化钠(AR)、盐酸(AR)。
1.2 材料制备
称取1.0483g 2-氨基对苯二甲酸和3.1534 gFeCl3·6H2O超声溶于70mlDMF中,转移至反应釜中,于383.15K下反应24h。将得到的深褐色固体用DMF和无水乙醇交替洗涤多次至中性,抽滤,将所得固体于333.15K下真空干燥、研磨,得到深褐色产品,即为NH2-MIL-101(Fe)。
1.3 吸附实验
1.3.1 溶液pH对吸附性能的影响
移取50mL浓度为100 mg·L-1的酸性橙溶液至100mL锥形瓶中,用HCl或者NaOH溶液调节酸性橙溶液pH为1-8。随后称取0.01g的NH2-MIL-101(Fe)加入酸性橙溶液中震荡搅拌8h。吸附结束后,抽取部分溶液过膜(0.45um),通过可见分光光度计(721E,上海光谱仪器有限公司)测定溶液中酸性橙浓度。根据式(1)计算NH2-MIL-101(Fe)对酸性橙的吸附量。

式中:q为吸附量,mg·g-1;C0为初始浓度,mg·L-1;Ct为 t时刻溶液浓度,mg·L-1;V为溶液的体积,mL;m 为NH2-MIL-101(Fe)的质量,g。
1.3.2 吸附动力学研究
移取500mL浓度为100 mg·L-1的酸性橙溶液至1000mL烧杯中并调节溶液pH=6。称取0.1g NH2-MIL-101(Fe)加入酸性橙溶液中磁力搅拌。在设定时间下抽取部分溶液过滤后测定溶液中酸性橙的残留浓度。
1.3.3 等温吸附研究
移取50mL浓度分别为50-1000 mg·L-1的酸性橙溶液至100mL锥形瓶中并调节溶液pH=6。称取0.01g NH2-MIL-101(Fe)加入酸性橙溶液中震荡搅拌8h。吸附结束后,抽取部分溶液过膜并测定溶液中酸性橙的浓度。
1.3.4 吸附热力学研究
称取0.01g NH2-MIL-101(Fe)投加入50mL初始浓度为100 mg·L-1,pH=6的酸性橙溶液中。分别将溶液至于 293.15,303.15,313.15,323.15以及333.15 K 条 件 下 吸附 8h后取样过膜,测定溶液中酸性橙浓度。
2 结果与讨论
2.1 NH2-MIL-101(Fe)性能表征
2.1.1 XRD分析
用X-射线衍射仪(D8 ADVANCE,德国Bruker公司)对所制备的NH2-MIL-101(Fe)进行了晶体结构分析,结果如图1所示。分析NH2-MIL-101(Fe)的XRD图谱可知,在2θ=5.103°、8.333°、8.971°、10.205°以及16.377°出现较明显的吸收峰,与文献报道的NH2-MIL-101 (Fe)的特征峰基本一致[16,17],表明成功合成得到金属有机骨架材料NH2-MIL-101 (Fe)。同时NH2-MIL-101(Fe)与MIL-101标准图谱特征峰位置基本一致,表明NH2-MIL-101(Fe)保留了与MIL-101一样的晶型结构。

图1 NH2-MIL-101(Fe)的XRD图谱
2.1.2 SEM分析
用场发射扫描电子显微镜对合成样品进行SEM分析,分析结果如图2所示。由图2(a)可知,合成的样品为正八面体结构,其尺寸约为637nm。图2(b)显示合成的材料形状尺寸基本一致。

图2 NH2-MIL-101(Fe)的SEM图谱:(a)100000倍;(b)50000倍
2.2 溶液pH对吸附的影响
溶液pH是影响吸附过程的重要参数,研究中考察了溶液pH对NH2-MIL-101(Fe)吸附酸性橙的影响,结果如图3(a)所示。在pH值为1-6范围内,随着pH值的增大,吸附量从140.71mg· g-1增加到246.67mg· g-1。从图3(b)中可知,pH<6时,NH2-MIL-101 (Fe)的Zeta电位大于0,表面带正电,可以静电的方式对溶液中带负电的离子产生吸附,而pH较低时,酸性橙(D-SO3Na)在溶液中以(D-SO3H)形式存在,不利于静电吸附。随着溶液pH增大,溶液中磺酸根(D-SO3-)增多,有利于吸附的进行。当pH>6时,NH2-MIL-101(Fe)对酸性橙的吸附量减少,这是因为随着pH升高,NH2-MIL-101(Fe)表面Zeta电位降低,当pH≥7时,NH2-MIL-101(Fe)表面带负电,而酸性橙(D-SO3Na)在溶液中以磺酸根(D-SO3-)形式存在,不利于吸附;且溶液中存在大量的OH-与磺酸根(D-SO3-)形成竞争吸附,所以当pH>6时,随着pH的升高,NH2-MIL-101(Fe)对酸性橙的吸附量呈下降趋势[18]。

图3 溶液pH对吸附效果以及 NH2-MIL-101(Fe) Zeta电位的影响
2.3 吸附动力学研究
在pH=6,酸性橙溶液初始浓度C0=100mg·L-1,投加量为0.2g·L-1的条件下,NH2-MIL-101(Fe)对酸性橙的吸附量随时间变化如图4所示。由图4可知,在吸附初始阶段,吸附速率较快,50min之后吸附速率逐渐变缓,180min左右基本达到吸附平衡。

图4 时间对吸附性能的影响
为了进一步研究NH2-MIL-101(Fe)吸附酸性橙的动力学特征。对图4实验数据进行准一级动力学(式(2))、准二级动力学(式(3))、液膜扩散理论(式(4))以及颗粒内扩散模型(式(5))线性拟合。拟合结果如图5(a-d)所示,相关参数如表1、表2所示。

图5 NH2-MIL-101(Fe)对酸性橙吸附动力学模型

其中qt为t时刻的吸附量,mg·L-1;qe为平衡吸附量,mg·g-1;F为t时刻吸附量与平衡吸附量比值,即qt/qe;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g·mg-1·min-1。
分析表1中的数据可知,准二级动力学模型的相关系数R2大于准一级动力学,说明NH2-MIL-101(Fe)吸附酸性橙的过程更符合准二级动力学特征。且其拟合得到的平衡吸附量更接近于真实实验数据[18,19]。液膜理论线性拟合结果如图5(c)所示,由图可知拟合直线不通过原点,故而表明液膜扩散并非影响吸附速率的控制因素,且拟合参数t1/2=16.558min,表明NH2-MIL-101(Fe)对酸性橙的吸附速率较快[20]。颗粒内扩散模型拟合结果如图5(d)所示,相关参数列于表2。从图5(d)可看到吸附过程大致可以拟合成3段,并且均不通过原点,表明吸附过程的限速因素不止受颗粒内扩散控制,还受膜扩散等其他吸附因素共同控制[21]。表2中,k1>k2>k3,分析原因可能是在吸附初期,速率控制步骤为膜扩散,吸附剂表面活性位点数量较多,酸性橙非常容易被吸附。当吸附剂的外表面逐渐达到饱和后,进入缓慢吸附阶段,其吸附速率以颗粒内扩散过程控制为主,最后达到吸附平衡[22,23]。

表1 NH2-MIL-101(Fe)对酸性橙吸附动力学模型相关参数

表2 NH2-MIL-101(Fe)对酸性橙吸附颗粒内扩散相关参数
2.4 等温吸附研究
不同温度(293.15K、303.15K、313.15K)下,溶液平衡浓度对吸附量的影响如图6所示。不同温度条件下,吸附量均随着平衡浓度的增大而增大,且在平衡浓度相同的条件下,温度升高,吸附量下降。
为了更好地了解NH2-MIL-101(Fe)对酸性橙的等温吸附特性,对图6中的实验数据进行Langmuir(式(6))、Freundlich(式(7))、BET(式(8))、TemKin(式(9))模型拟合,拟合结果如图7(a-d)所示,相关参数如表3所示。
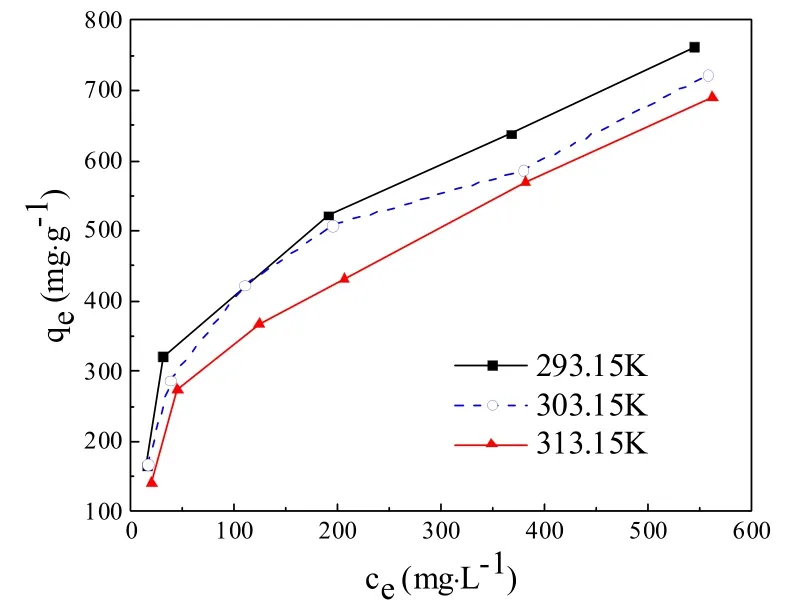
图6 溶液浓度对吸附效果的影响

图7 NH2-MIL-101(Fe)对酸性橙吸附等温模型

其中C0为酸性橙的初始浓度,mg·L-1;Ce为吸附平衡浓度,mg·L-1;qe为吸附达到平衡时的吸附容量,mg·g-1;qm为最大吸附量,mg·g-1;qen为单层铺满时的吸附量,mg·g-1。
由表3可知Langmuir模型拟合相关系数大于Freundlich模型,故而NH2-MIL-101(Fe)对酸性橙的等温吸附模型更加符合Langmuir模型。同时表明NH2-MIL-101(Fe)表面的活性位点的均匀分布,且吸附为单层吸附[23,24]。根据Langmuir模型拟合结果, NH2-MIL-101(Fe)在293.15k、303.15k、313.15k温度下对酸性橙的最大吸附量分别为818.67mg·g-1、787.25 mg·g-1、781.40 mg·g-1。BET模型主要适合于多层吸附,吸附剂与吸附剂之间的作用力主要为范德华力。若吸附符合BET模型,则认为属于物理吸附。TemKin模型适用于吸附热随着覆盖度的增加而减小的吸附模型,若等温吸附符合TemKin模型,则认为吸附以化学吸附为主。 由表3可知,相比较BET模型而言,NH2-MIL-101(Fe)对酸性橙的吸附更加符合TemKin 模型,故而表明吸附主要以化学吸附为主。

表3 NH2-MIL-101(Fe)对酸性橙吸附等温模型相关参数
2.5 吸附热力学研究
温度对NH2-MIL-101(Fe)吸附酸性橙的影响可以从热力学参数,例如吉布斯自由能(ΔG)焓变(ΔH)、熵变(ΔS)反映出来。相关参数可以通过公式(10)、(11)、(12)以及图8(b)拟合计算得到。

式中:Kc代表平衡常数;qe为吸附达到平衡时的吸附容量,mg·g-1;Ce为溶液平衡浓度,mg·L-1;ΔG为吉布斯自由能;ΔH为焓变;ΔS为熵变; R为气体常数,8.314 J·mol-1·K-1。
溶液温度对吸附量的影响如图8(a)所示,由图8(a)可知,NH2-MIL-101(Fe)对酸性橙的吸附量随着温度的升高而减小。热力学相关参数如表4所示。由表4的数据可知:ΔG<0,表明酸性橙被NH2-MIL-101(Fe)吸附是自发进行;ΔS=-59.44 (J·mol-1·K-1),表明在吸附过程中,体系熵值减少,即NH2-MIL-101(Fe)吸附酸性橙的过程中整个水溶液体系的混乱度减少[20];ΔH=-23.19(kJ·mol-1),即吸附过程为放热过程,升高温度使得吸附平衡向解吸方向移动,不利于吸附,与实验结果相符合[25]。其可能是因 为在吸附过程中,NH2-MIL-101(Fe)上的Fe与酸性橙上的氧、氮等元素在吸附过程中形成稳定的化学键或者配位键,使得吸附过程为放热反应。以上结果同时表明,NH2-MIL-101(Fe)对溶液中酸性橙的吸附之所以可以自发进行的推动力为吸附体系能量的降低。

图8 吸附热力学:(a)溶液温度对吸附效果的影响;(b)热力学拟合

表4 NH2-MIL-101(Fe)对酸性橙吸附热力学参数
3 结论
采用水热法合成金属有机骨架材料NH2-MIL-101(Fe),用其吸附溶液中酸性橙得到主要结论如下:
(1)溶液pH对吸附有较明显的影响,pH =6条件下,NH2-MIL-101(Fe)对酸性橙溶液的吸附效果最佳;
(2)NH2-MIL-101(Fe)对酸性橙的吸附速率较快,180min基本达到吸附平衡.吸附过程符合准二级动力学,且吸附过程中,颗粒内核扩散不是控制吸附的唯一控制因素;
(3)NH2-MIL-101(Fe)对酸性橙的等温吸附数据与Langmuir和TemKin模型拟合良好,吸附以单层化学吸附为主,最大吸附量为818.67 mg·g-1;
(4)吸附过程中,体系ΔG、ΔS、ΔH均小于0,此吸附反应为自发放热反应,且体系的混乱度减少。
