甲壳类水产品中氨基脲研究进展
2021-08-19朱盼盼邢丽红李兆新孙海新孙晓杰郑旭颖张梦婷
朱盼盼 邢丽红 李兆新 孙海新 孙晓杰 郑旭颖 张梦婷
摘要: 针对养殖的甲壳类水产品多次被检出未使用呋喃西林但氨基脲质量分数超标的现状,为解决呋喃西林特征性代谢产物氨基脲内源性和外源性无法区分的问题,本文对氨基脲的本底质量分数、氨基脲來源与产生机制、呋喃西林代谢物残留检测技术等方面进行综述。通过对甲壳类产品中氨基脲本底质量分数、甲壳类产品中氨基脲来源及产生机制、呋喃西林代谢物残留检测技术、存在问题及展望进行综述,并对内源性氨基脲干扰导致的假阳性问题,寻找内源性氨基脲形成机制,筛选检测呋喃西林药物的标志物,建立有效的检测方法。该综述为后续研究呋喃西林代谢物的检测方法和解决氨基脲假阳性问题提供参考。
关键词: 甲壳类水产品; 呋喃西林; 氨基脲; 氨基脲来源; 检测方法
中图分类号: S912 文献标识码: A
收稿日期: 20210315; 修回日期: 20210430
基金项目: 国家自然科学基金青年基金资助项目(41806148); 中国水产科学研究院基本科研业务费资助项目(2020TD71)
作者简介: 朱盼盼(1995),女,山东聊城人,硕士研究生,主要研究方向为水产品质量与安全。
通信作者: 李兆新,男,研究员,主要研究方向为水产品质量与安全。 Email: Lizx@ysfri.ac.cn
氨基脲(semicarbazide, SEM)是呋喃西林的特征性代谢产物,呋喃西林药物作为一种人工合成的抗菌药,抗菌谱较广,对多种革兰氏阳性菌和阴性菌都有抗菌作用,疗效好、价格低廉、不易产生耐药性,在畜牧及水产养殖等行业应用广泛。使用呋喃西林药物后,原药在生物体内很快得到降解,产生代谢物氨基脲,在体内和蛋白质结合形成稳定的残留物质存在数周。由于氨基脲对人体具有致癌致畸的副作用[1],欧盟、日本等发达国家及我国先后制定了禁止使用该类药物的规定。2003年,欧盟通过了2003/181/EC委员会决议,建立了用于水产品中呋喃西林代谢物氨基脲的各种检测方法,并规定最小要求性能限值为1 μg/kg。近几年监督检查结果表明,很多甲壳类水产品氨基脲含量严重超标,尤其是沼虾产品最为突出,但在养殖过程中没有使用呋喃西林药物,从而导致该类产品的质量安全问题备受质疑,严重影响养殖业的发展。为解决氨基脲内源性和外源性无法区分的问题,许多研究者在不同虾中进行氨基脲质量分数的检测,研究发现氨基脲作为内源性物质在甲壳类产品中普遍存在,且在不同甲壳类水产品中氨基脲质量分数存在差异,至今还没有方法可以直接检测氨基脲的来源,因此不能将氨基脲作为检测呋喃西林药物的标志物。当前迫切需要解决内源性氨基脲干扰导致的假阳性问题,寻找内源性氨基脲形成机制,筛选检测呋喃西林药物的标志物,建立有效的检测方法,促进养殖业健康有效发展。本文主要从甲壳类产品中氨基脲的本底质量分数、氨基脲来源与产生机制、呋喃西林代谢物残留检测技术等方面进行综述,希望能对后续研究提供参考。
1 甲壳类氨基脲的来源与产生机制
氨基脲又名氨基甲酰肼,化学式为CH5N3O,是一种白色晶体,易潮解,溶于水,不溶于无水乙醇和乙醚,用于医药、农药等有机合成的中间体。氨基脲分子结构如图1所示。氨基脲来源广泛,其来源与产生机制主要包括以下几方面。
1.1 呋喃西林代谢产生
呋喃西林作为广谱抗菌药物,效果好,不易产生抗药性,在水产养殖业中广泛使用。黄宣运等人[2]研究了室外池塘自然养殖环境下呋喃西林在中华绒螯蟹中代谢规律,用浓度为20 mg/L和80 mg/L的呋喃西林溶液浸泡中华绒螯蟹60 min后,移至不含药的池塘中饲养,停药2 h,中华绒螯蟹的肌肉、肝胰腺和鳃中氨基脲质量分数达到高峰,其中20 mg/L实验组的测定值分别为152±21.7,234.0±12.0,3160±169 μg/kg;80 mg/L实验组测定值分别为327±31.2,372±27.2,4623±247 μg/kg,2个实验组氨基脲的残留浓度远高于判定限量;樊新华等人[3]研究呋喃西林在中国绒螯蟹体内的代谢规律,35 d后不同实验组中华绒螯蟹残留氨基脲质量分数分别为95、91、80、11 μg/kg;李东利等人[4]研究了呋喃西林在中国对虾中的代谢规律,发现20 d实验结束时,各组织中氨基脲残留量依次为肌肉(11.09±0.47) μg/kg>鳃(1.77±0.53) μg/kg>甲壳(1.56±0.66) μg/kg>血淋巴(0.69±0.13) μg/kg>肝胰腺(0.55±0.07) μg/kg,肌肉中最高;辛少平等人[5]测定氨基脲在对虾中的代谢规律,发现停药后氨基脲在对虾肌肉内富集质量分数最高为51.5 μg/kg;王明兴等人[6]研究呋喃西林在凡纳滨对虾中的代谢规律,发现30 d实验结束时,各组织氨基脲残留浓度仍然较高,肌肉、鳃、血淋巴、肝胰腺、肠线质量浓度分别为30.36,9.97,6.05,5.49,1.90 μg/kg,其中肌肉组织中的残留量明显高于其它组织。
1.2 加工过程产生
除了使用呋喃西林药物导致氨基脲残留外,J. Johnston等人[7]用鸡肉作为检测样品,鸡肉样品加工处理前未检出氨基脲,加工处理后检出氨基脲,表明样品检出氨基脲并不是呋喃西林药物造成;程波等人[8]分析了非呋喃西林氨基脲的来源,包括外界迁移性污染、生产加工过程产生等外界因素;R. H. Stadler等人[9]收集了多种食品的数据,并检测海鲜(甲壳类动物、鱼粉)、肉类(牛肉、鸡肉粉)、乳制品(如奶粉、酸奶)、蜂蜜和其他种类中氨基脲质量分数,结果表明氨基脲普遍存在,但质量分数有差异,加工过程中使用的原料有产生氨基脲的成分,加工过程中发生化学反应也会产生氨基脲;李红权等人[10]发现水产品在生产加工过程中原料检验合格,加工过程中使用消毒水、保鲜剂等辅料后检出含有氨基脲。
1.2.1 偶氮二甲酰胺产生
偶氮二甲酰胺(Azodicarbonamide,ADC)用作泡沫塑料发泡剂,广泛用于聚乙烯等合成材料,作为高温分解型发泡剂应用在馒头、面包等膨胀有气孔的食品中,同时也是一种具有漂白和氧化作用的面粉改良剂,以增加产品的韧性弹性,还可作为化学发泡剂广泛应用于各种塑料级橡胶产品的生产。赵天祎等人[11]在蜂蜜中检测到氨基脲,可能是由于密封罐内垫圈的原因导致氨基脲外溶;Ye J等人[12]研究了不同面制品中ADC热降解形成氨基脲的原因,在高温和水分条件下,通过联二脲中间体形成氨基脲;陈志锋等人[13]在食品接触材料中发现金属垫圈中加入发泡剂ADC经过加热后分解成氨基脲;蒋志红等人[1415]发现含ADC的面粉经干热、湿热处理均能形成氨基脲,形成的氨基脲质量分数会受到不同条件的影响;姚敬等人[16]检测ADC和产生氨基脲的关系,实验证明湿热条件下可以形成氨基脲。
1.2.2 次氯酸盐
次氯酸盐具有强氧化性和漂白性,广泛用于食品加工、水产、畜牧养殖生产的卫生处理和消毒,与菌体核酸和酶等产生氯化反应,从而杀死病原微生物。袁涛等人[17]在鸡肉中使用次氯酸盐,结果表明次氯酸盐处理的鸡肉中氨基脲检出值高于未经次氯酸盐处理的鸡肉中氨基脲质量分数;杨曦等人[18]通过改变次氯酸盐的质量浓度、浸泡时间、水产品接触消毒水的面积等方面来检测对氨基脲质量分数的影响,结果表明氨基脲质量分数和次氯酸盐浓度、浸泡时间、消毒水的面积成正比;G.A.Abernethy等人[19]在次氯酸盐处理食品中发现通过氨的氯化生成肼,然后任一途径可在吖嗪形成时聚合,随后与脲化合物反应,氨基甲酸根离子可能通过与肼反应生成氨基脲;J.G. Bendall等人[20]通过实验研究认为尿素和次氯酸盐在高酸碱度下发生霍夫曼反应,产生氨基脲。
1.2.3 温度影响
温度对氨基脲的产生具有重要作用。曹爱玲等人[21]在不同温度下检测南美白对虾及中华鳖中的氨基脲,发现温度高低和氨基脲的检出量成正比关系,并且甲壳中氨基脲的质量分数高于其它组织;Yu W L等人[22]检测了不同条件下空白虾样品中氨基脲质量分数,发现在高温下易形成氨基脲。
1.3 从外界环境中摄入
自然界中甲壳类生物摄食的天然食物在体内可能转化为氨基脲,生存环境可能受到氨基脲的污染,通过长时间富集导致生物体内氨基脲质量分数不断累积。徐英江等人[23]调查潮河入海口邻近海域海水、沉积物和生物体内氨基脲质量分数,发现氨基脲在潮河口邻近海域海水、沉积物和生物体内浓度都沿潮河向下呈放射性递减分布;田秀慧等人[24]发现氨基脲作为一种新型的海洋环境污染物,在海水和沉积物中长時间存在并不断地富集,最终在海洋生物体内累积;于召强等人[25]检测了四十里湾海洋贝类氨基脲的富集程度,随着时间推移,海水中氨基脲质量分数不断增加,贝类中的氨基脲质量分数也增加。
1.4 天然来源氨基脲
氨基脲在很多产品中天然存在,如在一些未使用硝基呋喃药物的鸡蛋粉、雄峰蛹粉、红藻提取物中均检出过氨基脲,可能与加工过程或自身生长过程有关系。倪永付等人[26]检测微山湖的小青虾不同部位,结果显示未使用呋喃西林药物仍检测到氨基脲,推测虾本身产生氨基脲;于慧娟等人[27]测定了野生甲壳类水产品的氨基脲质量分数,结果表明氨基脲作为内源性物质在甲壳类产品中普遍存在;M.Robert等人[28]研究罗氏沼虾中氨基脲可能产生的途径,收集了不同地点的样品,包括未使用硝基呋喃药物的罗氏沼虾,结果表明氨基脲在罗氏沼虾中天然存在;C.Van Poucke等人[29]在实验室中养殖罗氏沼虾,经检测沼虾中存在不同质量分数的氨基脲,养殖环境在实验室中,排除使用呋喃西林药物处理之后产生的氨基脲。
1.5 甲壳类水产品氨基脲产生机制研究
曹爱玲等人[30]分析中华鳖粉中氨基脲的质量分数和来源,发现中华鳖骨粉中氨基脲质量分数高于中华鳖肉粉中氨基脲质量分数,进一步蛋白分析表明氨基脲的产生与样品蛋白质的质量分数和氨基酸组成密切相关;彭婕等人[31]分析了中华绒螯蟹甲壳中氨基脲的残留水平、甲壳素质量分数、蛋白质质量分数以及氨基酸组成,结果表明,蟹甲壳中甲壳素质量分数与氨基脲残留水平成正比,蛋白质质量分数及氨基酸组成与氨基脲残留水平成反比,推断甲壳素和蛋白质及其水解氨基酸可能与氨基脲的形成具有相关性,并且前处理过程中可能发生化学反应产生氨基脲;J.V.Samsonova等人[32]分离并鉴定了与呋喃西林体内结合有关的蛋白质,第1个被鉴定为含有质量浓度高的氨基脲蛋白质是白蛋白;谢冬冬等人[33]对鸡肉中不同组织的氨基脲质量分数进行分析,结果显示氨基脲的生成不仅与蛋白质质量分数有关,还和氨基酸组成有关,其中精氨酸质量分数最高;张乐年等人[34]研究不同鸡组织经NaClO处理后产生的氨基脲与样品的蛋白质质量分数及氨基酸质量分数相关,其中精氨酸质量分数的差异是氨基脲生成量差异的主要原因;Yu W等人[35]推测内源性氨基脲的形成可能与精氨酸的胍基、瓜氨酸和尿素的酰胺结构有关。
2 甲壳类产品中氨基脲本底质量分数
氨基脲在不同甲壳类产品中的含量差异较大,同一产品在不同组织中也存在差异,本文对几种主要甲壳类产品中氨基脲本底质量分数进行了分类总结。
2.1 虾中氨基脲本底质量分数
2.1.1 日本沼虾
日本沼虾又名青虾或河虾,隶属十足目长臂虾科沼虾属,是我国主要淡水虾养殖品种之一。于慧娟等人[27]对日本沼虾不同组织中氨基脲质量分数进行研究,发现肌肉组织中氨基脲质量分数范围为4.06~11.87 μg/kg,头部组织中氨基脲质量分数范围为58.6~81.3 μg/kg,甲壳组织中氨基脲质量分数范围为68.4~315.3 μg/kg;王鼎南等人[36]测得日本沼虾甲壳中氨基脲质量分数范围30.0~77.0 μg/kg,肌肉组织中氨基脲质量分数范围1.38~9.82 μg/kg;舒秀君等人[37-38]对日本沼虾中氨基脲存在特征进行研究,一致认为日本沼虾各个组织中均含有结合态和游离态氨基脲,总氨基脲在日本沼虾甲壳组织中质量分数最高,肌肉组织中质量分数最少;舒秀君等人[37]发现氨基脲在甲壳、眼柄、附肢、头胸部组织中主要以结合态形式存在;宋蓓等人[38]认为肌肉、胰腺团和目组织中氨基脲主要以结合态形式存在,比例大于50%,甲壳、足和鳃组织中氨基脲主要以游离态形式存在,结合态氨基脲比例小于20%;舒秀君[39]研究野生日本沼虾的不同组织的氨基脲质量分数,发现野生日本沼虾各组织中均含有氨基脲,肌肉、甲壳、肝胰腺、鳃和眼柄组织中氨基脲质量分数分别为1.62~4.18 μg/kg,93.42~284.19 μg/kg,3.32~23.29 μg/kg,4.05~13.56 μg/kg,33.72~65.17 μg/kg。
2.1.2 罗氏沼虾
罗氏沼虾又称泰国虾。于慧娟等人[27]测定结果表明,罗氏沼虾肌肉组织中氨基脲质量分数为1.23±0.05 μg/kg,头部组织氨基脲质量分数为23.8±2.3 μg/kg,甲壳中氨基脲质量分数为73.2±9.7 μg/kg;王鼎南等人[36]研究发现罗氏沼虾肌肉组织中氨基脲检出值在1.63~4.41 μg/kg;张睿等人[40]对罗氏沼虾中氨基脲质量分数进行研究发现,整虾中氨基脲质量分数范围在2.3~6.1 μg/kg,甲壳中氨基脲的质量分数范围在27.2~29.2 μg/kg;范清涛等人[41]研究结果显示,罗氏沼虾肌肉组织氨基脲质量分数为0.71~2.72 μg/kg,甲壳组织氨基脲质量分数为26.38~64.16 μg/kg。
2.1.3 南美白对虾
曹爱玲等人[21]研究南美白对虾肌肉和甲壳组织中氨基脲质量分数,发现肌肉组织中氨基脲质量分数小于0.5 μg/kg,甲壳组织中氨基脲质量分数范围12.3±1.96 μg/kg;于慧娟等人[27]研究发现,在南美白对虾肌肉组织中未检出氨基脲,头部组织中氨基脲质量分数为0.85±0.06 μg/kg,甲壳组织中氨基脲质量分数为4.4±1.5 μg/kg;C.Van Poucke等人[29]检测不同地区的南美白对虾,甲壳中氨基脲质量分数在1.5~2.6 μg/kg,肌肉中氨基脲质量分数小于0.5 μg/kg;王鼎南等人[36]对南美白对虾肌肉组织中氨基脲进行测定,结果表明氨基脲质量分数在0~6.36 μg/kg;范清涛等人[41]检测南美白对虾肌肉组织氨基脲质量分数为0~0.76 μg/kg,甲壳组织氨基脲质量分数为2.42~10.27 μg/kg。
2.1.4 中国对虾
中国明对虾,又称中国名对虾、东方对虾,属对虾科。李东利等人[4]研究呋喃西林代谢物在中国对虾体内的消除代谢规律时,测得空白中国对虾各组织中氨基脲质量分数低于1 μg/kg。
2.1.5 克氏原螯虾
于慧娟等人[27]检测克氏原螯虾不同组织中的氨基脲质量分数,结果表明肌肉组织中氨基脲质量分数为0.52±0.03 μg/kg,头部组织中氨基脲质量分数为2.06±0.09 μg/kg,甲壳中氨基脲质量分数为3.57±0.09 μg/kg。
2.1.6 斑节虾
于慧娟等人[27]在斑节虾肌肉组织中未检出氨基脲,但头部组织中氨基脲质量分数为0.95±0.07 μg/kg,甲壳组织中氨基脲质量分数为1.46±0.41 μg/kg;范清涛等人[41]发现斑节虾肌肉组织氨基脲质量分数为0~0.76 μg/kg,甲壳组织氨基脲质量分数为3.04~15.36 μg/kg。
2.2 蟹中氨基脲本底質量分数
2.2.1 中华绒螯蟹
黄宣运等人[2]在中华绒螯蟹肌肉、肝胰腺和鳃组织中均未检出氨基脲;于慧娟等人[27]检测中华绒螯蟹甲壳组织氨基脲质量分数为10.55±0.53 μg/kg,肌肉组织氨基脲质量分数为2.05 μg/kg;彭婕等人[31]研究发现,中华绒螯蟹肌肉、肝脏和鳃等组织中均未检出氨基脲,但蟹壳中均有氨基脲检出,质量分数为5.48~24.31 μg/kg,且不同处理方式氨基脲质量分数有很大差别,活体蟹甲壳组织中氨基脲质量分数范围为3.50~10.74 μg/kg死体蟹甲壳组织中氨基脲质量分数范围为3.99~9.81 μg/kg,煮熟蟹甲壳组织中氨基脲质量分数范围为4.22~9.49 μg/kg,新长软壳组织中氨基脲质量分数范围为3.45~3.85 μg/kg;王鼎南等人[36]对中华绒螯蟹进行了氨基脲质量分数调查发现,氨基脲质量分数平均值为0.597 μg/kg,肌肉组织中氨基脲质量分数为0~1.19 μg/kg;张睿等人[40]检测中华绒螯蟹甲壳组织中,氨基脲质量分数为33.4 μg/kg,肌肉组织中零氨基脲。
2.2.2 海蟹
海蟹一般指三疣梭子蟹。于慧娟等[27]检测海蟹甲壳组织中氨基脲质量分数为16.2±1.4 μg/kg,肌肉组织中未检出氨基脲;张睿等人[40]对海蟹组织中的氨基脲质量分数进行检测,发现海蟹甲壳组织中氨基脲质量分数高达26.5 μg/kg,肌肉组织中未检出氨基脲。
2.2.3 锯缘青蟹
于慧娟等人[27]检测锯缘青蟹不同组织的氨基脲质量分数,在肌肉组织中未检出氨基脲,甲壳组织中氨基脲质量分数为81.8±7.0 μg/kg。
2.2.4 珍宝蟹
于慧娟等人[27]检测珍宝蟹不同组织的氨基脲质量分数,头部组织中未检出氨基脲,甲壳组织中氨基脲质量分数为46.3±4.8 μg/kg。
2.3 中华鳖
中华鳖,又名水鱼、甲鱼、团鱼,属龟鳖目鳖科。于慧娟等人[27]检测中华鳖不同组织的氨基脲,结果表明肌肉组织中未检出氨基脲,甲壳组织中氨基脲质量分数为1.36 μg/kg;曹爱玲等人[21]研究中华鳖不同组织的氨基脲质量分数发现鳖肉和鳖壳中氨基脲质量分数均小于0.5 μg/kg。
3 呋喃西林代谢物残留检测技术
3.1 氨基脲检测方法
使用呋喃西林药物后,原药在生物体内很快降解,半衰期只有数小时,但其代谢物氨基脲能与蛋白质结合形成稳定的残留物质长期存在,因此常以氨基脲作为检测食品中非法使用呋喃西林的标志物。氨基脲常用的检测方法有高效液相色谱法、液相色谱串联质谱法,免疫学测定方法等。
3.1.1 高效液相色谱法
早期国内外报道的关于硝基呋喃药物残留检测方法多数是检测原药化合物,常用的检测仪器有紫外检测器和二极管阵列检测器。我国于2004年发布了行业标准SC/T 3022—2004,用于检测水产品中呋喃唑酮的残留量,然而硝基呋喃类原药在体内代谢快速,原型药物很短时间就降至检出限以下,而其代谢产物则以蛋白结合态形式长期稳定存在,因而检测代谢产物更有意义。由于呋喃结构的紫外光谱吸收不明显,直接测定灵敏度低,无法满足硝基呋喃类代谢残留限量的检测要求。为提高灵敏度,需通过衍生化方式生成具有强紫外吸收的化合物。Wang Y等人[42]将高效液相色谱法和荧光检测法相结合,检测限和定量限分别为0.15 μg/kg和0.5 μg/kg,检测限低于欧盟规定的最低要求性能水平。我国于2008年发布了农业部1077号公告22008[43],该方法以二氯苯甲醛作为衍生化试剂,采用高效液相色谱法紫外检测法分析水产品中硝基呋喃代谢物,方法定量限为1.0 μg/kg,能够满足我国现行判定标准。Sheng L Q等人[44]以2羟基1萘甲醛为衍生化试剂,在酸性条件下与硝基呋喃类代谢物衍生化,建立了高效液相色谱荧光检测法分析动物源性产品中硝基呋喃类代谢物,4种代谢物定量限均低于1.0 μg/kg,满足我国现行判定标准。
3.1.2 液相色谱串联质谱法
液相色谱串联质谱法比高效液相色谱法灵敏度高、选择性好、精密度高,提高了目标化合物的定性和定量结果的准确性,可以排除高效液相色谱法和酶联免疫法检测的假阳性结果,能够进行代谢物的确证。氨基脲是一类小分子化合物,分子质量在75 g/mol,在该质荷比范围内质谱背景干扰较大,离子碎片不具备特征性,因此直接测定氨基脲的结果是不理想的。通过衍生化之后,增加了分子质量和特征碎片离子的选择性,提高了质谱响应。现有方法多以2硝基苯甲醛为衍生化试剂,衍生化氨基以增加代谢物的离子化效率,生成硝基苯衍生物,再经提取净化后,液相色谱串联质谱仪测定。氨基脲在水生动物体内有两种存在形式结合态和游离态。李金强等人[45]建立了偶氮二甲酰胺分解产生氨基脲的检测方法;丁磊等人[4549]建立了水产品中氨基脲总量的测定方法。Du N N等人[5052]建立了甲壳类水产中氨基脲总量的测定方法;李虞明[53]建立了贝类中氨基脲总量的测定方法;Tang T等人[54]建立了鱼类中氨基脲总量的测定方法;C.Van Poucke等人[29,5559]建立了结合态氨基脲的测定方法;刘正才等人[60]开展不同方法对氨基脲测定结果的对比研究,结果表明由于样品制备中洗涤和不洗涤的差异,各检测方法中检测结果差异显著。
3.1.3 免疫分析法
免疫分析法操作簡单,灵敏度高,不需要昂贵的仪器操作,检测成本低,同时可以满足现场大批量样品快速检测,节省时间和资源。
3.1.3.1 酶联免疫法
酶联免疫法利用特异性抗体,可以在短时间内筛查大量的水产样本。李泳宁等人[61]采用间接竞争酶联免疫技术建立呋喃西林检测方法,在0.1~10.0 ng/mL具有良好的线性关系,相关系数为0.998 7,IC50为1.43 ng/mL;Fang Z等人[62]建立直接酶免疫吸附检测方法,检测限低至0.07 μg/L,该方法比竞争酶免疫吸附方法更快速;闫叶娜[63]以人工合成的氨基脲单克隆抗体检测氨基脲,最低检测限为0.03 ng/mL,IC50为2.19 ng/mL;任海涛等人[64]设计合成半抗原与牛血清白蛋白偶联制备免疫原并免疫新西兰大白兔,IC50为12.37 ng/mL,定量检测限范围(IC20~IC80)为0.439~110.78 ng/mL,检测限IC10达到0.07 ng/mL,黄登宇等人[65]用衍生化后的氨基脲半抗原与卵清蛋白偶联成为包被原,线性范围为0.123~2.398 ng/mL,IC50为0.544 ng/mL;Wang Q等人[66]以山羊抗小鼠免疫球蛋白为对照,得出氨基脲最低检测线为0.75 μg/kg;李军[67]以5硝基糠醛为分子模板合成了硝基呋喃类药物的共有半抗原,制备相应的免疫抗原并免疫新西兰白兔,交叉反应率为95%,IC50为95 ng/mL,最低检测限为8.3 ng/mL。
3.1.3.2 胶体金免疫法
免疫胶体快速检测法具有操作简便、携带方便、准确率高等优点,可以在现场对样品进行快速检测。王佳[68]通过胶体金定量免疫层析方法检测氨基脲,虾肉中氨基脲检测限为0.15 μg/kg;谢世红等人[69]检测南美白对虾肌肉组织中氨基脲质量分数,最低检出限为1.0 μg/kg,假阳性率小于5%,假阴性率为0;赵正苗等人[70]用胶体金免疫层析法检测氨基脲,检测限为1.0 μg/kg,和谢世红等人[69]假阳性率和假阴性率结果一致,对其他药物无交叉反应;柳爱春等人[71]在对水产品中氨基脲快速衍生化之后建立免疫胶体金检测方法,最低检出限为1.0 μg/kg,与液相色谱串联质谱法的检测结果相比,符合率为98%。
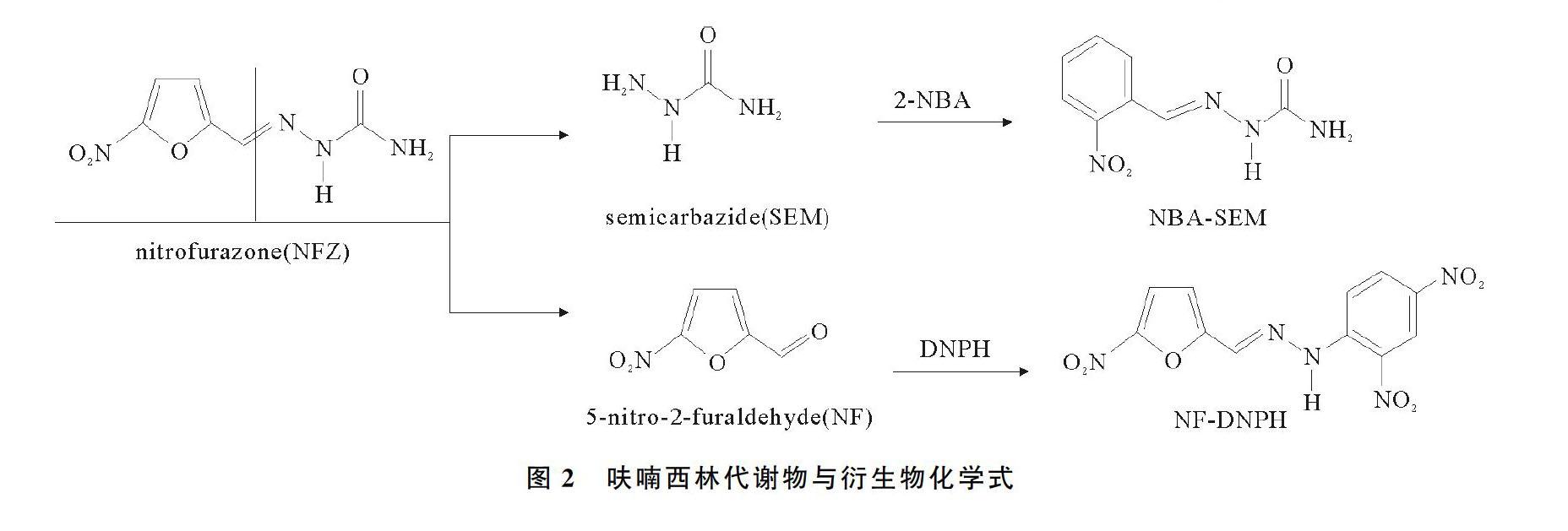
3.2 新型生物标志物5硝基2糠醛
5硝基2糠醛(5nitro22furaldehyde,5NF)是呋喃西林药物代谢的另一种产物,微溶于水,性质不稳定,对光敏感,代谢较快。呋喃西林代谢物与衍生物化学式如图2所示。J.G.Bendall等人[20,7276]研究了5硝基2糠醛作为标志物检测呋喃西林,并用2,4二硝基苯肼进行柱前衍生,将5硝基2糠醛转化为稳定的腙类化合物,再进行分离提取纯化并检测;Zhang S等人[77]以2,4二硝基苯肼作为衍生剂、对二甲基氨基苯甲醛为内标物进行柱前衍生化,并成功地用于5硝基2糠醛的测定,定量限和检测限分别为0.2,0.1 ng/g;Wang Y等人[78]提出了呋喃西林一种新的标志物氰基代谢物,经过使用呋喃西林药物喂养鲶鱼检测氰基代谢物,发现氰基代谢物可以在体内存在长达2周,消除半衰期为81 h。不管是5硝基2糠醛还是氰基代谢物,其在生物体内半衰期短,代谢快速,均不宜作呋喃西林的代谢标志物。
4 结束语
甲壳类水产品中氨基脲质量分数超标的原因不仅仅是呋喃西林药物产生的代谢物,而且其他途径也会产生氨基脲,具体机理仍在研究中。氨基脲的产生原因包括内源性和外源性,目前内源性氨基脲的形成机制尚不明确,高效液相色谱串联质谱法是目前测定氨基脲最通用的确证技术,但现有检测技术无法区分呋喃西林源氨基脲和非呋喃西林源氨基脲。氨基脲在甲壳类不同生物和同种生物不同组织中的质量分数存在差异,其来源和具体的产生机理还有待进一步研究。随着多组学技术的发展和成熟,借助蛋白组学和代谢组学技术建立新型呋喃西林代谢标志物的方法成为可能。优化检测技术,并且提高残留风险评估方法的应用,利用各种方法学研究氨基脲形成机制。开展内源性氨基脲鉴别技术研究对解决氨基脲假阳性问题、探究内源性氨基脲形成机理有重要意义。研究氨基脲控制技术可以减少并控制氨基脲的污染源,提高质量安全,减少食品安全问题。
参考文献:
[1] 高素, 汝少国. 氨基脲的毒性效应研究进展[J]. 环境科学研究, 2013, 26(6): 637644.
[2] 黄宣运, 沈晓盛, 黄冬梅, 等. 室外池塘自然养殖条件下呋喃西林代谢物在中华绒螯蟹体内残留和消除规律[J]. 海洋渔业, 2017, 39(6): 674681.
[3] 樊新华, 郑浩, 钱伟, 等. 呋喃西林代谢物氨基脲在中华绒螯蟹体内的衰减研究[J]. 江苏农业科学, 2010(6): 368370.
[4] 李东利, 李健, 常志强, 等. 呋喃西林代谢产物在中国对虾(Fenneropenaeus Chinensis)体内的消除规律及其对代谢酶活性的影响[J]. 渔业科学进展, 2015, 36(5): 8794.
[5] 辛少平, 邓建朝, 杨贤庆, 等. 高效液相色谱法测定硝基呋喃类药物代谢物及其在对虾体内的代谢[J]. 食品科学, 2014, 35(24): 151157.
[6] 王明兴, 吴晓萍, 廖艳, 等. 呋喃西林代谢物在凡纳滨对虾体内代谢及残留[J]. 食品与机械, 2013, 29(1): 7680.
[7] Johnston J, Duverna R, Williams M, et al. Investigating the suitability of semicarbazide as an indicator of ppreharvest nitrofurazone use in raw chicken[J]. J Food Prot, 2020, 83(8): 13681373.
[8] 程波, 舒秀君, 宋蓓, 等. 甲殼类水产品氨基脲残留来源研究进展[J]. 广东海洋大学学报, 2018, 38(5): 9398.
[9] Stadler R H, Verzegnassi L, Seefelder W, et al. Why semicarbazide (SEM) is not an appropriate marker for the usage of nitrofurazone on agricultural animals[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2015, 32(11): 18421850.
[10] 李红权, 孙良娟, 杨劲, 等. 水产品加工辅料中呋喃西林代谢物含量的测定[J]. 广州化工, 2013, 41(15): 148150.
[11] 赵天祎, 马占峰, 张莹. 蜂蜜中氨基脲本底来源研究[J]. 食品安全质量检测学报, 2019, 10(11): 34013404.
[12] Ye J, Wang X H, Sang Y X, et al. Assessment of the determination of azodicarbonamide and its decomposition product semicarbazide: investigation of variation in flour and flour products[J]. Agric Food Chem, 2011, 59(17): 93139318.
[13] 陈志锋, 李成, 孙利, 等. 食品接触材料中的氨基脲问题[J]. 食品与机械, 2009, 25(2): 57.
[14] 蒋志红, 吴晓萍, 王明兴, 等. 偶氮甲酰胺与氨基脲在面粉及面包虾中的形成关系[J]. 食品科学, 2014, 35(19): 9195.
[15] 黄晓姗, 关铭鑫, 杭义萍. 面制品添加剂偶氮甲酰胺热处理下转化为氨基脲的研究[J]. 分析测试学报, 2018, 37(8): 977980.
[16] 姚敬, 黄伟雄, 李少霞, 等. 小麦粉制品中氨基脲的检测及与偶氮甲酰胺的转化规律研究[J]. 中国卫生检验杂志, 2016, 26(18): 26002602, 2606.
[17] 袁涛, 田国华, 吴伟, 等. 次氯酸钠、酒精及穿串用竹签对鸡肉产品中呋喃西林代谢物检测结果的影响研究[J]. 中国家禽, 2011, 33(20): 1820, 23.
[18] 杨曦, 李红光. 水产品在消毒水作用下产生呋喃西林代谢物的研究[J]. 食品工业科技, 2011, 32(4): 158159.
[19] Abernethy G A. Generation of semicarbazide from natural azine development in foods, followed by reaction with urea compounds[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2015, 32(9): 14161430.
[20] Bendall J G. Semicarbazide is nonspecific as a marker metabolite to reveal nitrofurazone abuse as it can form under hofmann conditions[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2009, 26(1): 4756.
[21] 曹爱玲, 陈怡琳, 蔡路昀, 等. 不同烘干温度对甲壳类水产品中氨基脲检出量的影响[J]. 中国动物检疫, 2020, 37(1): 9499.
[22] Yu W L, Liu W H, Tian W R. Semicarbazide universality study and its speculated formation pathway[J]. Food Safety, 2019, 39(1): 18.
[23] 徐英江, 孙玉增, 宋秀凯, 等. 潮河口邻近海域氨基脲污染现状调查研究[J]. 海洋与湖沼, 2010, 41(4): 538542.
[24] 田秀慧, 于召强, 徐英江. 氨基脲在藻体内生物富集规律的研究[J]. 齐鲁渔业, 2012, 29(12): 13.
[25] 于召强, 徐英江, 田秀慧, 等. 四十里湾海洋贝类对氨基脲的生物富集特性[J]. 海洋环境科学, 2013, 32(1): 3942.
[26] 倪永付, 朱莉萍, 王勇, 等. 微山湖小青虾各部分呋喃西林代谢物含量测定[J]. 食品与发酵科技, 2012, 48(1): 8688.
[27] 于慧娟, 李冰, 蔡友琼, 等. 液相色谱串联质谱法测定甲壳类水产品中氨基脲的含量[J]. 分析化学, 2012, 40(10): 15301535.
[28] Robert M, Bob H, David E, et al. The occurrence of semicarbazide in the meat and shell of bangladeshi freshwater shrimp[J]. Food Chemistry, 2013, 136(34): 15621567.
[29] Van Poucke C, Detavernier C, Wille M, et al. Investigation into the possible natural occurence of semicarbazide in macrobrachium rosenbergii prawns[J]. Agric Food Chem, 2011, 59(5): 21072112.
[30] 曹爱玲, 沈立, 蔡路昀, 等. 中华鳖粉中氨基脲来源及相关性分析[J]. 食品研究与开发, 2015, 36(19): 13, 51.
[31] 彭婕, 吕磊, 喻亚丽, 等. 中华绒螯蟹中内源性氨基脲的产生途径研究[J]. 淡水渔业, 2019, 49(3): 108112.
[32] Samsonova J V, Douglas A J, Cooper K M, et al. The identification of potential alternative biomarkers of nitrofurazone abuse in animal derived food products[J]. Food Chem Toxicol, 2008, 46(5): 15481554.
[33] 谢冬冬, 万志刚, 沈金灿, 等. 不同鸡组织经次氯酸钠处理后氨基脲生成量差异研究[J]. 食品安全质量检测学报, 2014, 5(11): 33943399.
[34] 张乐年, 徐子华, 张文波. 鸡不同组织经NaClO处理后氨基脲生成量差异研究[J]. 中兽医医药杂志, 2016, 35(3): 2629.
[35] Yu W, Liu W, Sang Y, et al. Analysis of endogenous semicarbazide during the whole growth cycle of litopenaeus vannamei and its possible biosynthetic pathway[J]. J Agric Food Chem, 2019, 67(29): 82358242.
[36] 王鼎南, 周凡, 李诗言, 等. 甲殼类水产品中呋喃西林代谢物氨基脲的本底调查及来源分析[J]. 中国渔业质量与标准, 2016, 6(6): 611.
[37] 舒秀君, 程波, 徐娟娟, 等. 日本沼虾养殖过程中氨基脲存在特征研究[J]. 淡水渔业, 2020, 50(3): 1116.
[38] 宋蓓, 程波, 宋怿, 等. 日本沼虾中氨基脲含量检测方法的优化[J]. 食品安全质量检测学报, 2018, 9(8): 17821788.
[39] 舒秀君. 日本沼虾中氨基脲的存在特征研究[D]. 上海: 上海海洋大学, 2020.
[40] 张睿, 张晓燕, 吴斌, 等. 甲壳类水产品中氨基脲的测定和来源分析[J]. 环境化学, 2012, 31(6): 915916.
[41] 范清涛, 邓建朝, 张宾, 等. 养殖虾类中呋喃西林代谢物检测方法的优化[J/OL]. 食品与发酵工业, 2021: 19. https:∥doi.org/10.13995/j.cnki.111802/ts.027396.
[42] Wang Y, Chan W. Automated ininjector derivatization combined with highperformance liquid chromatographyfluorescence detection for the determination of semicarbazide in fish and bread samples[J]. Agric Food Chem, 2016, 64(13): 28022808.
[43] 中华人民共和国农业部. 农业部1077号公告22008, 水产品中硝基呋喃类代谢物残留量的测定高效液相色谱法[S]. 北京: 中国标准出版社, 2008.
[44] Sheng L Q, Chen M M, Chen S S, et al. Highperformance liquid chromatography with fluorescence detection for the determination of nitrofuran metabolites in pork muscle[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2013, 30(12): 21142122.
[45] 李金强, 郭海霞, 曹鹏, 等. 偶氮甲酰胺分解产生呋喃西林代谢物的相关性研究[J]. 化学分析计量, 2009, 18(6): 3436.
[46] 丁磊, 蒋俊树, 顾亮, 等. 高效液相色谱串联质谱法快速测定水产品中硝基呋喃类代谢物研究[J]. 现代农业科技, 2010(11): 336337, 345.
[47] 李剑, 陈泽暖, 蔡楠. 超高效液相色谱串联质谱法快速检测水产品中硝基呋喃类代谢物残留研究[J]. 江苏调味副食品, 2019(1): 3437.
[48] ValeraTarifa N M, PlazzBolaos P, RomeroGonzález R, et al. Determination of nitrofuran metabolites in seafood by ultra high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry[J]. Journal of Food Composition and Analysis, 2013, 30(2): 8693.
[49] 王跃, 尹燕杰, 赵丹, 等. 超高效液相色谱串联质谱法测定水产品中的硝基呋喃代谢物[J]. 化学分析计量, 2018, 27(5): 4347.
[50] Du N N, Chen M M, Sheng L Q, et al. Determination of nitrofuran metabolites in shrimp by high performance liquid chromatography with fluorescence detection and liquid chromatographytandem mass spectrometry using a new derivatization reagent[J]. Chromatogr A, 2014, 1327: 9096.
[51] ElDemerdash A, Song F, Reel R K, et al. Simultaneous determination of nitrofuran metabolites and chloramphenicol in shrimp with a single extraction and LCMS/MS analysis[J]. Journal of AOAC International, 2015, 98(3): 595601.
[52] 彭婕, 甘金华, 陈建武, 等. 中华绒螯蟹中氨基脲的分布及产生机理分析[J]. 淡水渔业, 2015, 45(4): 108112.
[53] 李虞明. 超高效液相色谱质谱联用仪检测贝类产品中硝基呋喃代谢物[J]. 食品安全导刊, 2019(9): 7879.
[54] Tang T, Wei F, Wang X, et al. Determination of semicarbazide in fish by molecularly imprinted stir bar sorptive extraction coupled with high performance liquid chromatography[J]. Journal of Chromatography B, 2018, 1076: 814.
[55] 宋蓓, 程波, 宋懌, 等. 日本沼虾中氨基脲含量检测方法的优化[J]. 食品安全质量检测学报, 2018, 9(8): 17821788.
[56] 丁春燕. 青虾中硝基呋喃代谢物残留的检测研究[D]. 杭州: 浙江工业大学, 2019.
[57] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 213112007动物源性食品中硝基呋喃类药物代谢物残留量检测方法高效液相色谱串联质谱法[S]. 北京: 中国标准出版社, 2008.
[58] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 207522006猪肉、牛肉、鸡肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定液相色谱串联质谱法[S]. 北京: 中国标准出版社, 2007.
[59] 中华人民共和国农业部. 农业部公告781号公告42006动物源食品中硝基呋喃类代谢物残留量的测定高效液相色谱串联质谱法[S]. 北京: 中国标准出版社, 2006.
[60] 刘正才, 杨方, 余孔捷, 等. 硝基呋喃类代谢物残留量检测标准的比较[J]. 分析试验室, 2011, 30(11): 4347.
[61] 李泳宁, 彭臻菲, 黄慧, 等. 一种呋喃西林酶联免疫检测方法的建立[J]. 安徽农业科学, 2020, 48(4): 193195.
[62] Fang Z Y, Jiang B S, Wu W, et al. ELISA detection of semicarbazide based on a fast sample pretreatment method[J]. Chemical Communications, 2013, 49(55): 61646166.
[63] 闫叶娜. 呋喃西林代谢物单克隆抗体的制备及其免疫分析方法的建立[D]. 南京: 南京农业大学, 2010.
[64] 任海涛, 沈玉栋, 徐振林, 等. 呋喃西林代谢物多克隆抗体制备及酶联免疫吸附分析方法[J]. 食品工业科技, 2012, 33(5): 330333, 379.
[65] 黄登宇, 高丽霞, 李亚楠, 等. 间接竞争化学发光酶免疫法检测动物源食品中的呋喃西林代谢物[J]. 食品安全质量检测学报, 2017, 8(2): 402410.
[66] Wang Q, Liu Y, Wang M, et al. A multiplex immunochromatographic test using gold nanoparticles for the rapid and simultaneous detection of four nitrofuran metabolites in fish samples[J]. Anal Bioanal Chem, 2018, 410(1): 223233.
[67] 李军. 畜禽饲料中硝基呋喃类药物快速检测技术研究[D]. 保定: 河北农业大学, 2011.
[68] 王佳. 动物性食品中硝基呋喃类代谢物残留的定量免疫层析技术研究[D]. 重庆: 西南大学, 2019.
[69] 谢世红, 谢世涛, 欧阳敏. 水产品中4种硝基呋喃类代谢物残留快检方法的研究[J]. 江西农业学报, 2014, 26(8): 6164.
[70] 赵正苗, 罗晓琴, 汪善良, 等. 应用胶体金免疫层析法检测动物组织中呋喃西林代谢物的残留[J]. 上海畜牧兽医通讯, 2012(5): 45.
[71] 柳爱春, 刘超, 赵芸, 等. 免疫胶体金法快速检测水产品中硝基呋喃类代谢物的研究[J]. 浙江农业学报, 2013, 25(1): 95102.
[72] Zhang S, Li P, Yan Z, et al. Identification and quantification of nitrofurazone metabolites by ultraperformance liquid chromatographyquadrupole timeofflight highresolution mass spectrometry with precolumn derivatization[J]. Anal Bioanal Chem, 2017, 409(9): 22552260.
[73] Wang Q, Wang X F, Jiang Y Y, et al. Determination of 5nitro2furaldehyde as marker residue for nitrofurazone treatment in farmed shrimps and with addressing the use of a novel internal standard[J]. Scientific Reports, 2019, 9(1): 1924319251.
[74] Zhang X, Chen S, Xu H, et al. Identification and occurrence of endogenous semicarbazide in prawns and crabs from Zhejiang Province, China[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2016, 33(2): 252258.
[75] 王建. 甲殼类水产中呋喃西林及氨基脲的研究[D]. 杭州: 浙江工商大学, 2015.
[76] 胡梦玲, 张小军, 严忠雍, 等. UPLCMS/MS法测定凡纳滨对虾中呋喃西林新型生物标志物[J]. 浙江海洋大学学报: 自然科学版, 2019, 38(6): 546553.
[77] Zhang S, Guo Y, Yan Z, et al. A selective biomarker for confirming nitrofurazone residues in crab and shrimp using ultraperformance liquid chromatographytandem mass spectrometry[J]. Anal Bioanal Chem, 2015, 407(30): 89718977.
[78] Wang Y S, Jester E L E, El Said K R, et al. Cyano metabolite as a biomarker of nitrofurazone in channel catfish[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 313316.
Research Progress of Semicarbazide in Crustacean Products
ZHU Panpan1,2,3, XING Lihong1,3, LI Zhaoxin1,3, SUN Haixin2, SUN Xiaojie1,3, ZHENG Xuying1,3, ZHANG Mengting1,3
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266100, China;
2. College of Life Sciences, Qingdao University, Qingdao 266071, China;
3. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China)
Abstract: For breeding of shellfish aquatic products in which many times unused nitrofurazone was detected but semicarbazide excessive levels of the status qua, in order to solve the problem that nitrofurazone semicarbazide endogenous and exogenous characteristic metabolites can′t distinguish, in this paper, the background content of semicarbazide, semicarbazide sources and generation mechanism, nitrofurazone metabolite residues detecting technology, etc., were summarized. Semicarbazide has been identified as a characteristic metabolite of nitrofurazone drugs and as a marker to monitor illicit use of nitrofurazone in food. After the use of nitrofurazone, the active drug degrades quickly in living organisms, and its metabolite, semicarbazide, combines with protein to form stable residues, which are referred to human through the food chain and harm human health. Semicarbazide from natural sources is found in crustacean products without using nitrofurazone, which seriously affects the effective implementation of aquatic product quality and safety supervision and law enforcement. Of shellfish products, crustaceans semicarbazide background content in the product source and generation mechanism, semicarbazide nitrofurazone metabolite residues detection technology, problems and prospects were reviewed. For the false positive problem caused by endogenous semicarbazide interference, it looks for endogenous semicarbazide formation mechanism, screening to detect markers of nitrofurazone drugs, and establishes an effective detection method. This review provides a reference for further research on the detection methods of nitrofurazone metabolites and solving the problem of false positive semicarbazide.
Key words: crustacean aquatic products; nitrofurazone; semicarbazide; semicarbazide sources; detection technology
