黄精多糖提取工艺优化及体外抗氧化研究
2021-08-06周东月关敬付博孙群宙赵美雅刘露张国斌姜爽
周东月 关敬 付博 孙群宙 赵美雅 刘露 张国斌 姜爽


摘要 [目的]考察黄精多糖的制备工艺及体外抗氧化作用。[方法]采用水提醇沉法提取黄精多糖,以多糖提取率为评价指标,在单因素试验的基础上采用正交试验优化最佳提取工艺。测定黄精多糖对DPPH、超氧阴离子、羟基自由基的清除能力,以及黄精多糖对三价铁的还原能力。[结果]最佳提取工艺条件为黄精药材粒度80目、料液比1∶25、pH 9、提取时间3.0 h。黄精多糖对DPPH、超氧阴离子、羟基自由基均有较强的清除能力,且清除能力随多糖浓度的升高而增大;黄精多糖对三价铁的还原能力与浓度成正相关。[结论]確定了水提醇沉法的最佳工艺参数,证明了黄精多糖具有较强的体外抗氧化活性。
关键词 黄精多糖;提取工艺;正交试验;体外抗氧化
中图分类号 R-284 文献标识码 A 文章编号 0517-6611(2021)13-0180-04
doi:10.3969/j.issn.0517-6611.2021.13.045
开放科学(资源服务)标识码(OSID):
Study on Extraction Technology and Antioxidant Activity in vitro of Polygonatum Polysaccharide
ZHOU Dong yue, GUAN Jing, FU Bo et al
(Changchun University of Chinese Medicine,Changchun, Jilin 130117)
Abstract [Objective] To investigate the preparation technology of Polygonatum polysaccharide and its anti oxidant effect in vitro. [Method]Using water extraction and alcohol precipitation method to extract polysaccharides from Polygonatum odoratum, using Polygonatum odoratum polysaccharide extraction rate as an evaluation index, and using orthogonal experiment to optimize process conditions based on single factor experiment to determine the best process. The scavenging ability of Polygonatum polysaccharide on DPPH, superoxide anion and hydroxyl radical, and the reducing ability of Polygonatum polysaccharide on trivalent iron were determined. [Result] The optimal process conditions were that the particle size of Polygonatum medicinal material was 80 mesh, the ratio of material to liquid was 1∶25, pH 9, and the extraction time was 3.0 h. Polygonatum polysaccharides had strong scavenging ability for DPPH, superoxide anion and hydroxyl radical, and the scavenging ability varied with the concentration of polysaccharides. The reduction ability of Polygonatum polysaccharides to trivalent iron was also positively related to the concentration. [Conclusion] The optimal process parameters of the water extraction and alcohol precipitation method were determined, and Polygonatum polysaccharide had strong antioxidant activity in vitro.
Key words Polygonatum polysaccharide;Extraction process;Orthogonal test;In vitro antioxidant
黄精(Rhizom polyonati)为百合科植物滇黄精(Polyonatum kingianum Coil et Hemsl)、黄精(Polyonatum sibiricum Redoute)、多花黄精(Polyonatum cyrtonem Hua)的干燥根茎,味甘、性平,归脾肺肾经,在我国南方分布广泛[1]。黄精草药同源,在我国当前的大流行紧急情况下作为治疗COVID-19的替代药物成分,但其机制尚不清楚[2]。随着黄精在药理学、药物化学和临床研究方面的应用,其活性部位和有效成分成为新药研究和开发的热点。黄精含有多种化学成分,包括多糖、生物碱、甾体皂苷、三萜、木脂素、类黄酮、植物甾醇等[3-6]。其中,黄精多糖是黄精主要生物学活性成分之一,应用广泛,具有增强免疫力、抗炎、抗病毒、调节血脂和改善内皮功能等作用[7-9]。该研究采用水提、醇沉法提取黄精多糖,优化提取工艺,探讨其体外抗氧化作用,旨在为黄精多糖的深入研究提供科学依据。
1 材料与方法
1.1 药材和试剂
黄精药材、葡萄糖标准品,购自上海源叶生物科技有限公司;苯酚、三氯化铁,购自西陇科学股份有限公司;浓硫酸、盐酸、氢氧化钠、无水乙醇,购自北京化工厂;pH试纸,购自郑州市津北化工有限公司;DPPH、硫酸亚铁,购自上海麦克林生化科技有限公司;VC,购自天津天泰精细化学品有限公司;过氧化氢,购自天津市福晨化学试剂厂;水杨酸,购自天津百伦斯生物技术有限公司;Tris,购自上海科雅生物科技有限公司;邻苯三酚,购自西安天茂化工有限公司;铁氰化钾,购自天津市兴复科技发展有限公司;三氯乙酸,购自国药集团化学试剂有限公司;磷酸盐缓冲液,购自上海力辰仪器科技有限公司。
1.2 主要仪器
药筛,购自安平县拓通丝网制品有限公司;粉碎机,购自浙江红景天工贸有限公司;恒温水浴锅,购自常州市国旺仪器制造有限公司;紫外分光光度计,购自北京普析通用仪器有限责任公司;电子天平,购自德国赛多利斯公司;烘箱,购自上海精宏实验设备有限公司;离心机,购自长沙湘智离心机仪器有限公司;冻干机,购自东京理化器械株式会社。
1.3 葡萄糖标准曲线制备
精密称取干燥至恒重的葡萄糖标品100 mg,定容至100 mL。取出1 mL定容于10 mL容量瓶中,分别取0、0.2、0.4、0.6、0.8、1.0 mL至具塞试管中,分别加蒸馏水至2 mL,每管加入5%苯酚1 mL、浓硫酸5 mL,振荡混匀后置于沸水浴中加热15 min,取出后在流动自来水中冷却至室温,于紫外可见光分光光度计490 nm处测吸光度,得到标准曲线Y=6.700 0X-0.004 2,R2=0.999 2(图1)。
1.4 黄精多糖的提取工艺
黄精药材55 ℃干燥→粉碎→过筛→精密称取药材粉末→加水浸提→抽滤→滤液调整醇沉浓度为80%→4 000 r/min离心10 min→冻干→配制待测溶液→苯酚-浓硫酸法测定吸光度→计算粗多糖提取率。
1.5 单因素试验
精密称取黄精药材粉末5 g于100 ℃水浴回流提取,趁热抽滤,将滤液调整至醇浓度为80%,混匀,4 000 r/min离心10 min,沉淀冻干,得黄精粗多糖。适当稀释样品,代入标准曲线,计算粗多糖浓度,从而算出多糖提取率。分别考察不同粒度(10、14、50、80、100目)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、pH(3、5、7、9、11)、提取时间(1.0、1.5、2.0、2.5、3.0 h)对黄精多糖提取率的影响。
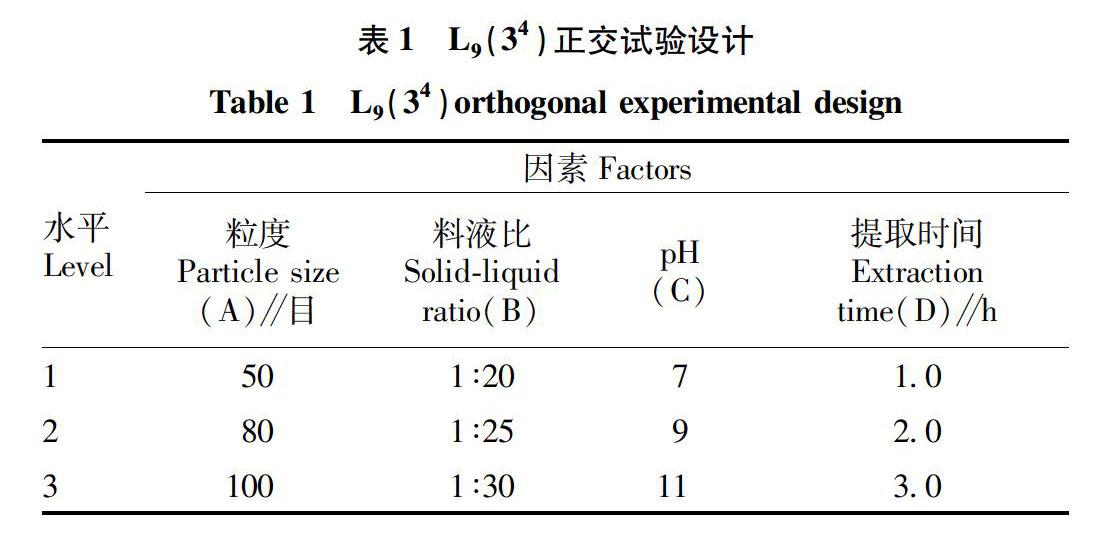
1.6 正交试验设计
根据单因素试验结果进行L9(34)正交试验,因素水平设计见表1。
1.7 体外抗氧化试验
1.7.1 DPPH自由基清除能力测定。
取2.0 mL不同浓度(0.5、1.0、2.0、4.0、6.0、8.0、10.0 mg/mL)的黄精多糖溶液于试管中,分别加入0.1 mmol/L DPPH溶液2.0 mL,充分混匀后避光反应20 min,在517 nm处测定吸光度Ai。VC作阳性对照;对照组以无水乙醇代替DPPH,测定吸光度Aj;以蒸馏水代替多糖溶液作为空白组,测定吸光度为Ao。
DPPH自由基清除率=(Ao-Ai+Aj)/Ao×100%
1.7.2 羟基自由基清除能力测定。
取2.0 mL不同浓度(0.5、1.0、2.0、4.0、6.0、8.0、10.0 mg/mL)的黄精多糖溶液于试管中,依次加入6 mmol/L硫酸亚铁2.0 mL、6 mmol/L双氧水2.0 mL,混匀后静置10 min,各加入6 mmol/L水杨酸-无水乙醇2.0 mL,混匀后再静置30 min,于510 nm处测吸光度Ai;以无水乙醇代替水杨酸测吸光度Aj;VC作阳性对照;以蒸馏水代替黄精多糖溶液作为空白组,测定吸光度Ao。
羟基自由基清除率=(Ao-Ai+Aj)/Ao×100%
1.7.3 超氧阴离子清除能力测定。
取4.5 mL Tris-HCl(pH 8.2)缓冲液,25 ℃水浴20 min后,分别加入1.0 mL不同浓度(0.5、1.0、2.0、4.0、6.0、8.0、10.0 mg/mL)的黄精多糖溶液,再加入25 mmol/L邻苯三酚溶液0.4 mL,充分混匀后,于25 ℃水浴中反应5 min,然后加入1 mL 8 mol/L盐酸终止反应,最后在299 nm处測定吸光度Ai;空白组以蒸馏水代替多糖溶液,测定吸光度Ao;样品对照组用蒸馏水代替邻苯三酚、盐酸,测定吸光度Aj;VC作阳性对照;用蒸馏水做空白调零。
超氧阴离子自由基清除率=(Ao-Ai+Aj)/Ao×100%
1.7.4 还原能力测定。
分别取2.5 mL不同浓度(0.5、1.0、2.0、4.0、6.0、8.0、10.0 mg/mL)的黄精多糖溶液于试管中,依次加入pH 6.6磷酸盐缓冲液2.5 mL、1%铁氰化钾溶液2.5 mL,混匀,50 ℃恒温20 min后加入10%三氯乙酸溶液2.5 mL,然后以3 000 r/min离心10 min,取上层清液5 mL,再依次加入蒸馏水5 mL、0.1%三氯化铁溶液1 mL,于700 nm处测定吸光度;VC作阳性对照。
1.8 数据处理
试验数据以平均值±方差(±s)表示,采用Sigma Plot 13软件作图,SPSS Statistics 24软件进行方差分析。
2 结果与分析
2.1 单因素试验结果
由图2a可知,当黄精药材粒度为80目时,黄精多糖提取率最高,因此选择50、80、100目3个水平。由图2b可知,当料液比为1∶25时,黄精多糖提取率最高,因此选择料液比1∶20、1∶25、1∶30 3个水平。由图2c可知,当pH为9时,黄精多糖提取率最高,因此选择pH为7、9、11。根据图2d可知,当提取时间为2.5 h时,黄精多糖提取率最高,因此提取时间选择1.0、2.0、3.0 h。
2.2 正交试验结果
由表2可知,影响水提醇沉法提取黄精多糖提取率的主次因素依次为提取时间(D)、粒度(A)、料液比(B)、pH(C),其中因素D具有极显著影响,因素A、B对提取过程有显著影响,因素C对试验影响较小,最终确定最佳工艺条件为A2B2C2D3,即黄精药材粒度80目、料液比1∶25、pH 9、提取时间3.0 h。
2.3 体外抗氧化试验结果
2.3.1 对自由基的清除能力。
从图3可见,黄精多糖对DPPH、羟基自由基、超氧阴离子的清除率具有浓度依赖性,清除率随浓度的升高而增加。当黄精多糖浓度为6.0 mg/mL时,对DPPH的清除能力为(38.24±0.14)%,且随着浓度的升高,清除率无明显变化;当黄精多糖浓度为4.0 mg/mL时,对超氧阴离子的清除能力为(16.93±0.11)%,且随着黄精多糖浓度的升高,清除率无明显变化;当黄精多糖浓度为6.0 mg/mL时,对羟基自由基的清除能力为(37.98±0.12)%,且随着剂量增加,清除率无明显变化;但与VC相比,黄精多糖对氧化自由基的清除能力仍有较大差距。
2.3.2 对三价铁的还原能力。由图4可知,黄精多糖对三价铁具有一定的还原能力,且随着黄精多糖浓度的升高,对三价铁的还原能力逐渐增大,但其还原能力明显弱于Vc。
3 讨论
(1)相关研究表明,细胞[10]和组织的氧化损伤[11]在人类病理生理中广泛涉及,其中,癌症[12-13]、衰老[14-15]等疾病大多与产生过量自由基有关。人类饮食中含有重要的微量营养素,例如VC[16]、VE[17]和类胡萝卜素[18],对维持人类健康至关重要。其中,VC广泛分布于水果和蔬菜中,它们是饮食摄入的主要来源,因此,饮食途径是调节内源性抗氧化剂保护的有效手段。然而,在全球食品工业中,目前使用的抗氧化剂主要是人工合成。合成抗氧化剂都有一定的毒性,这使得天然抗氧化剂越来越受欢迎。天然抗氧化剂来源于天然中草药,不仅能保护身体组织免受氧化损伤,还能延缓衰老,预防与衰老有关的疾病。多糖类化合物是人类饮食中的重要成分和体外清除自由基的有效物质,其体内抗氧化活性不同于其体外自由基清除能力[19-27]。
(2)笔者研究了黄精多糖的提取工艺及体外抗氧化活性,为黄精多糖开发利用研究提供理论依据。鉴于黄精多糖较广泛的药用价值,研究合理的纯化工艺并应用批量生产,使黄精多糖更广泛地发挥作用具有重要意义。
参考文献
[1] 国家药典委员会.中华人民共和国药典:2020年版 一部[S].北京:中国医药科技出版社,202.
[2] MU C L,SHENG Y F,WANG Q,et al.Potential compound from herbal food of Rhizoma Polygonati for treatment of COVID 19 analyzed by network pharmacology:Viral and cancer signaling mechanisms[J/OL].Journal of functional foods,2021,77[2020-06-20].https:doi.org/10.1016/j.jff.2020.104149.
[3] 朱新焰,孙信梅,杜春华,等.滇黄精与轮叶黄精多糖的组织化学及含量测定研究[J].中华中医药学刊,2020,38(1):61-64.
[4] 孙隆儒,王素贤,李铣.中药黄精中的新生物碱[J].中国药物化学杂志,1997,7(2):129.
[5] 廖荣俊,杨阳,叶碧欢,等.多花黄精根茎的转录组分析与甾体皂苷生物合成相关基因发掘[J].中国中药杂志,2020,45(7):1648-1656.
[6] 姜程曦,张铁军,陈常青,等.黄精的研究进展及其质量标志物的预测分析[J].中草药,2017,48(1):1-16.
[7] 秦宇雯,袁玮,陆兔林,等.九华黄精的炮制工艺沿革及现代研究[J].中草药,2018,49(18):4432-4438.
[8] 孔瑕,刘娇娇,李慧,等.黄精多糖对高脂血症小鼠脂代谢相关基因mRNA及蛋白表达的影响[J].中国中药杂志,2018,43(18):3740-3747.
[9] 楊婧娟,张希,马雅鸽,等.发酵对黄精主要活性成分及其抗氧化活性和刺激性的影响[J].食品工业科技,2020,41(2):52-58.
[10] 宋志明,余舒杰,焦洁,等.人参皂苷Rb1减轻人脐静脉内皮细胞氧化损伤[J].基础医学与临床,2020,40(8):1064-1067.
[11] 李雅琢,徐甄,兰天野,等.七叶皂苷钠抑制大鼠晶状体组织氧化损伤的实验研究[J].中国中医眼科杂志,2020,30(5):308-312.
[12] EBRAHIMI S,SOLTANI A,HASHEMY S I.Oxidative stress in cervical
cancer pathogenesis and resistance to therapy[J].Journal of cellular biochemistry,2019,120(5):6868-6877.
[13] SHEN S,ZHU C L,HUO D,et al.A hybrid nanomaterial for the controlled generation of free radicals and oxidative destruction of hypoxic cancer cells[J].Angewandte chemie international edition,2017,56(30):8801-8804.
[14] DEEPASHREE S,NIVEDITHA S,SHIVANANDAPPA T,et al.Oxidative stress resistance as a factor in aging:Evidence from an extended longevity phenotype of Drosophila melanogaster[J].Biogerontology,2019,20(4):497-513.
[15] KOLTOVER V K.Free radical timer of aging:From chemistry of free radicals to systems theory of reliability[J].Current aging science,2017,10(1):12-17.
[16] OBI EZEANI C N,DIOKA C E,MELUDU S C,et al.The effect of vitamin C on toxic metals,antioxidant minerals,oxidative stress,and lipid profile of automobile workers[J].Journal of integrated health science,2020,8(1):9.
[17] MAZUR KUS'NIREK M,ANTOSZKIEWICZ Z,LIPIN'SKI K,et al.The effect of polyphenols and vitamin E on the antioxidant status and meat quality of broiler chickens fed diets naturally contaminated with ochratoxin A[J].Archives of animal nutrition,2019,73(6):431-444.
[18] SONG X D,MUJUMDAR A S,LAW C L,et al.Effect of drying air temperature on drying kinetics,color,carotenoid content,antioxidant capacity and oxidation of fat for lotus pollen[J].Drying technology,2020,38(9):1151-1164.
[19] MATKOWSKI A.Antioxidant activity of extracts and different solvent fractions of Glechoma hederacea L.and Orthosiphon stamineus(Benth.)Kudo[J].Advances in clinical and experimental medicine,2008,17(6):615-624.
[20] 欧丽兰,税丕先,朱烨,等.慈姑多糖的提取工艺及抗氧化活性研究[J].农业科学与技术:英文版,2017,18(4):724-728,732.
[21] 殳叶婷,高洁,彭文潇,等.灵芝多糖的抗氧化作用研究[J].南京中医药大学学报,2020,36(4):504-508.
[22] 孟菲,宗雯雯,王纯,等.日本虫草子实体多糖抗氧化及免疫调节作用[J].菌物学报,2020,39(7):1391-1399.
[23] 王莹,邢晓玲,李屿君,等.香菇多糖脱蛋白工艺及其抗氧化活性研究[J].食品研究与开发,2020,41(14):98-103.
[24] 刘兆倩,张颖颖,栾皓,等.月见草根多糖提取工艺优化及其抗氧化活性研究[J].植物学研究,2020,9(2):83-95.
[25] 崔艳秋,罗鼎真,王晓民.褐藻多糖硫酸酯的抗炎与抗氧化活性研究进展[J].藥学学报,2008,43(12):1186-1189.
[26] 黄先菊,郭莲军,曲玲,等.仙人掌多糖组分对大鼠脑片氧化应激损伤的保护作用[J].中国药理学与毒理学杂志,2007,21(1):1-6.
[27] 景年华,史俊友,田照秀,等.黑牛肝菌多糖超声提取工艺优化及抗氧化研究[J].安徽农业科学,2021,49(8):170-174.
