土鳖虫活性肽LL8在大鼠体内的药动学及药效学研究
2021-08-05董萍萍张加余魏永利李华健王少平
董萍萍,张加余,魏永利,兀 琦,徐 静,李华健,代 龙*,王少平*
1.滨州医学院药学院,山东 烟台 264003
2.山东中医药大学药学院,山东 济南 250300
3.山东中医药大学附属医院,山东 济南 250300
土鳖虫,又称土元,为鳖蠊科昆虫地鳖Eupolyphaga sinensisWalker 或冀地鳖Steleophaga plancyi(Boleny)的雌虫干燥体,主要用于治疗跌打骨折、血瘀密闭等症,中医临床定义其为破血逐瘀、续筋接骨之要药[1]。现代药理学研究表明,土鳖虫具有抗血栓、调血脂、抗肿瘤、免疫调节、抗氧化等作用[2-5]。鉴于土鳖虫传统的口服给药特点及人体消化道对蛋白质药物的消化吸收原理,本课题组前期采用胃蛋白酶和胰蛋白酶复合酶系对土鳖虫进行仿生酶解,经过除盐、超滤、纳滤、DA201-C 型大孔吸附树脂、葡聚糖凝胶G-25 色谱、反相高效液相色谱以及半制备液相色谱等技术分离纯化后,获得纤溶活力最强的土鳖虫活性肽组分F2,且F2 具有改善急性血瘀模型大鼠血液流变学指标、调节血脂和血液因子水平的作用[2,6]。
药动学是反映药物在机体内吸收、分布、代谢、排泄全过程,并运用数理知识和方法论阐述血药浓度变化的综合知识体系[7]。随着现代分析设备的普及与测试方法的更新,蛋白或活性肽类药物在机体内的变化也能够被反映出来,如人体信使因子谷胱甘肽在体内的分布和衰老的研究,可以借助123I、2H、13C 等放射性同位素标记示踪其活动规律[8-11];藻酸双酯钠等多糖类药物的多羟基酚酸类结构体征,可以采用罗丹明、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和溴酚蓝等有色极性溶剂进行络合标记[12],进而基于络合物发色光转移的原理运用紫外分光光度法、荧光分析方法进行分析,得出其药动学变化规律。因此,采用标记示踪技术可以实现蛋白或活性肽类药物的体内分析[13]。
本课题组前期研究表明,土鳖虫活性肽F2 组分具有调血脂活性,但其所含单体活性肽序列以及体内药理作用尚未明确。本研究采用基质辅助激光解析电离串联飞行时间质谱(MADIL-TOF/TOF- MS)对前期纯化得到的土鳖虫单体活性肽进行肽序鉴定,对其中含量最高的活性肽LL8 用FITC 标记后进行药动学研究,并进行LL8的调血脂作用研究。
1 材料
1.1 动物
SPF 级雄性SD 大鼠,6 周龄,体质量(200±10)g,购自山东省朋悦实验动物繁育中心,动物许可证号SCXK(鲁)20190003。动物饲养于SPF 级实验动物中心,温度22~26 ℃、相对湿度(50±2)%。动物实验经山东中医药大学伦理委员会批准(批准号SDUTCM20190515001)。
1.2 药材
土鳖虫(批号20190107)购自山东省长清土元养殖场,经山东中医药大学代龙教授鉴定为鳖蠊科冀地鳖S.plancyi(Boleny)的雌虫干燥体。
1.3 药品与试剂
去离子水购自浙江娃哈哈纯净水公司;辛伐他汀(批号J20180007)购自德国Merck 公司;乙醚(批号10009318)、无水乙醇(批号20181111)购自国药集团化学试剂有限公司;水合氯醛(批号2018103001)购自成都市科隆化学品有限公司;总胆固醇(total cholesterol,TC)测定试剂盒(批号20190811)、三酰甘油(triglycerides,TG)测定试剂盒(批号20190709)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒(批号20190529)购自南京建成生物工程研究所有限公司。
1.4 仪器
BPH-9082 型精密恒温培养箱(上海一恒科学仪器有限公司);HH-601 型超级恒温水浴锅(镇江瑞祥仪器有限公司);MS104 型十万分一天平、MS105 型万分之一天平(梅特勒-托利多国际贸易上海有限公司);EnSpire 多模式微孔板检测系统(珀金埃尔默企业管理上海有限公司,由山东省科学院分析测试中心提供);TG20W 型台式高速冷冻式离心机(博科精密仪器有限公司);KQ2200DV 型超声振荡仪(杭州法兰特超声波科技有限公司);Aμtoflex II 型MADIL-TOF/TOF-MS(德国布鲁克工公司);电子显微镜(日本尼康公司)。
2 方法与结果
2.1 LL8 氨基酸序列分析与结构预测
采用MADIL-TOF/TOF-MS 对本课题组前期经分离纯化得到的土鳖虫活性肽组分F2[9]进行氨基酸序列分析。LL8 二级质谱图见图1,经解析,其肽序为LAPAPGTL,即亮氨酸-丙氨酸-脯氨酸-丙氨酸-脯氨酸-甘氨酸-苏氨酸-亮氨酸,命名为LL8。

图1 LL8 二级质谱图Fig.1 Secondary mass spectrum of LL8
采用pepdraw(http://pepdraw.com/)、PEP- FOLD3 ( https://bioserv.rpbs.univ-paris-diderot.fr/ services/PEP-FOLD3/)在线对LL8 进行分子结构和构型预测(图2),等电点为5.58,亲水指数为33.806 72 kJ/moL,水溶性较好;空间结构存在5个α 折叠。
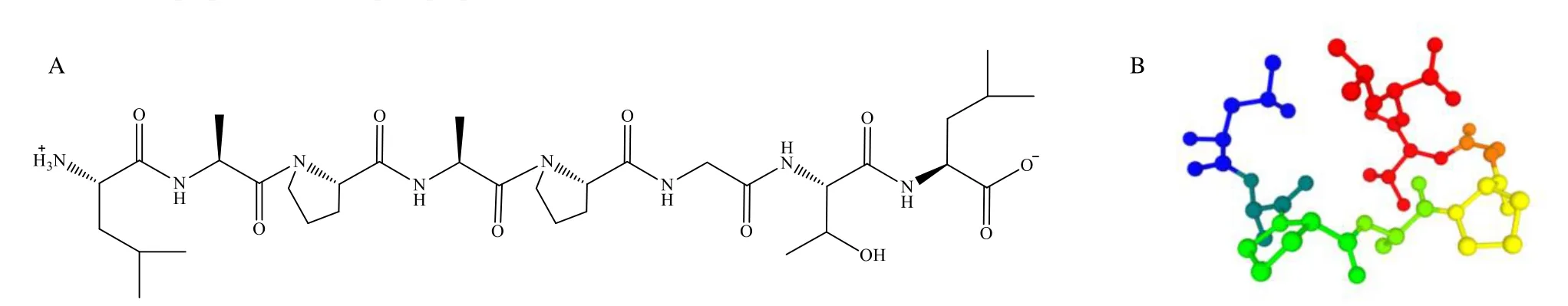
图2 LL8 氨基酸序列 (A) 及空间结构预测 (B)Fig.2 Prediction of amino acid sequence (A) and spatial structure (B) of LL8
2.2 固相合成与荧光标记
将分析出的肽段序列委托上海吉尔生物科技有限公司进行固相合成,其质量分数为99.5%。将合成的LL8活性肽委托上海摩尔生物科技有限公司采用FITC 对LL8 活性肽进行N段修饰,修饰后多肽序列为 FITC-{acp}-Leu-Ala-Pro-Ala-Pro-Gly-Thr- Leu,质量分数>95%,其色谱图见图3。

图3 FITC-LL8 纯度检测Fig.3 Purity test of FITC-LL8
2.3 LL8 在正常大鼠体内的药动学研究
2.3.1 血浆样品的制备 SD 大鼠乙醚麻醉后,眼眶取血置肝素钠抗凝管中,2 次/d,每次2 mL,10 000 r/min 离心10 min,取上层血浆并合并,加入等体积十二烷基硫酸钠溶液(0.1 mol/L)增敏,作为空白血浆溶液备用。
2.3.2 方法学考察
(1)线性考察:精密称取FITC-LL8 10 mg,采用空白血浆溶解,制备成一系列不同质量浓度的FITC-LL8 血浆溶液,以490 nm 为激发波长,525 nm为发射波长,采用酶标仪测定吸光度(A)值。以空白血浆溶液A值作为空白,以质量浓度为横坐标(X),A为纵坐标(Y),绘制标准曲线,得到回归方程为Y=2 760.9X+464.63,R2=0.999 1。FITC-LL8 在0.195 3~50.000 0 μg/mL 具有良好的线性关系,定量限为0.195 3 μg/mL。
(2)日间、日内精密度考察:精密称取FITC-LL8 适量,用空白血浆溶解,分别配制成质量浓度为50.0、25.0、12.5 μg/mL 的溶液,标记为LL8高、中、低3 个质量浓度。采用酶标仪测定A值,各质量浓度样本平行测定6 次并连续测定5 d,计算3 个质量浓度的日内精密度及日间精密度。结果显示,LL8 3 个质量浓度的日内精密度RSD 值分别为0.28%、0.74%、1.08%,日间精密度RSD 值为1.99%、1.21%、1.87%。
(3)准确度考察:精密称取FITC-LL8 适量,以空白血浆溶解,分别配制成质量浓度为50.0、25.0、12.5 μg/mL 的溶液,标记为LL8 高、中、低3 个质量浓度。采用酶标仪测定A值,平行测定3次,计算各溶液的回收率。结果显示,LL8 3 个质量浓度的回收率分别为100.23%、99.03%、101.23%,RSD 值分别为1.03%、0.34%、0.57%。
(4)稳定性试验:精密称取FITC-LL8,加入空白血浆配制成质量浓度为50 μg/mL 的溶液。采用酶标仪在0、60、180、240、600、720 min 对溶液进行测定,记录各时间点下样品的A值,计算RSD值为0.199%,表明血浆稳定性良好。
(5)加样回收率试验:取FITC-LL8,加入1 mL大鼠新鲜血液,配制6 份质量浓度为50 μg/mL 的溶液。充分混匀后,按“2.3.1”项下方法处理,采用酶标仪测定A值。结果显示,加样回收率为97.63%~100.15%,平均加样回收率为99.29%,RSD值为0.88%。
(6)反复冻融条件下的含量变化:取FITC-LL8,溶于5 mL 空白血浆,配制成质量浓度为25 μg/mL 的溶液,测定A值;于 −80 ℃超低温冰箱存放15 d 后,测定A值;再于 −80 ℃超低温冰箱放置15 d 后,测定A值。结果显示,经过2 次冻融后,第15 天和第30 天3 次测定结果的RSD 值分别为0.08%、0.21%,表明FITC-LL8 不会在反复冻融下发生荧光减弱现象。
2.3.3 药动学研究 12 只SD 大鼠适应性饲养7 d,实验前禁食 12 h,自由饮水。大鼠随机分成FITC-LL8 高、低剂量(10、5 mg/kg)组,每组6只;各给药组im 相应药物,于不同时间点采集血液,按“2.3.1”项方法处理,采用酶标仪测定A值。以时间为横坐标(X),血药浓度为纵坐标(Y),绘制血药浓度-时间曲线。采用DAS 2.0 软件结合最小偏二乘法计算药动学参数,以非房室模型分析法进行数据分析;采用SPSS 26.0 软件对药动学结果进行统计学分析;Graphpad Prism 8.0.2 软件绘制曲线图。FITC-LL8 血药浓度-时间曲线见图4,主要药动学参数见表1。
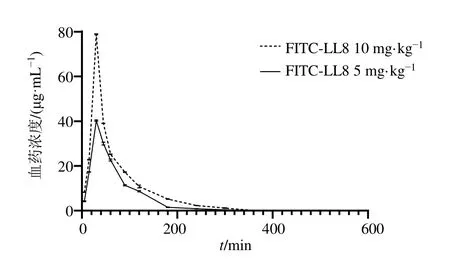
图4 正常大鼠im FITC-LL8 的药-时曲线 ( ± s , n=6)Fig.4 Drug-time curve of im FITC-LL8 in normal rats ( ± s , n=6)
表 1 FITC-LL8 在正常大鼠体内的主要药动学参数 ( ± s , n=6)Table 1 Main pharmacokinetic parameters of FITC-LL8 in normal rats ( ± s , n=6)
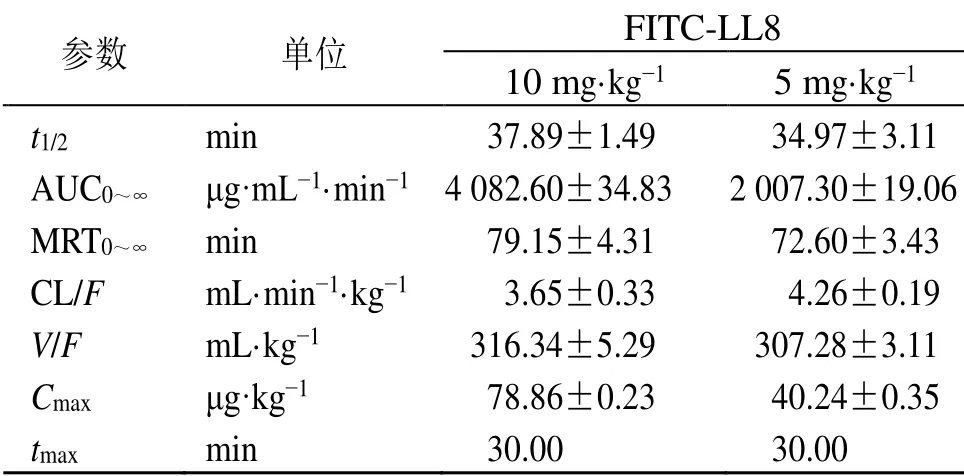
表 1 FITC-LL8 在正常大鼠体内的主要药动学参数 ( ± s , n=6)Table 1 Main pharmacokinetic parameters of FITC-LL8 in normal rats ( ± s , n=6)
参数 单位 FITC-LL8 10 mg·kg−1 5 mg·kg−1 37.89±1.49 34.97±3.11 t1/2 min AUC0~∞ μg·mL−1·min−1 4 082.60±34.83 2 007.30±19.06 MRT0~∞ min 79.15±4.31 72.60±3.43 CL/F mL·min−1·kg−1 3.65±0.33 4.26±0.19 V/F mL·kg−1 316.34±5.29 307.28±3.11 Cmax μg·kg−1 78.86±0.23 40.24±0.35 tmax min 30.00 30.00
2.4 LL8 对高脂血症大鼠的调脂作用研究
2.4.1 高脂血症模型的制备 48 只SD 大鼠适应性饲养7 d,随机分为对照组、模型组、辛伐他汀(200 mg/kg)组、土鳖虫(3 g/kg)组和LL8 高、低剂量(50、25 mg/kg)组,每组8 只。对照组大鼠给予普通饲料,其余各组给予高脂饲料。第45 天于20: 00时禁食,第46 天8: 00 时各组大鼠眼眶取血1 mL,测定血浆中TC 和TG 水平,若模型组与对照组之间 有显著性差异,则确定高血脂症大鼠模型制备成功。
2.4.2 给药 辛伐他汀溶于0.9%氯化钠溶液,配制成质量浓度为4 mg/mL 的溶液;土鳖虫溶于0.9%氯化钠溶液,配制成质量浓度为0.6 g/mL 的溶液;LL8 溶于0.9%氯化钠溶液,分别配制成质量浓度为10、5 mg/mL 的溶液。造模成功后,各给药组ig 2 mL相应药物,对照组和模型组ig 等体积0.9%氯化钠溶液,1 次/d,连续3 周。
2.4.3 LL8 对高脂血症大鼠血浆中TC、TG 和LDL-C 水平的影响 给药结束后,大鼠禁食12 h,不禁水,ip 10%水合氯醛麻醉,腹主动脉取血,置肝素钠抗凝试管中,3500 r/min 离心10 min,取上层血浆,按试剂盒说明书检测大鼠血浆中TC、TG和LDL-C 水平。如图5 所示,与对照组比较,模型组大鼠血浆中TC、TG 和LDL-C 水平均显著升高(P<0.05、0.01);与模型组比较,各给药组大鼠血浆中TC 和TG 水平均显著降低(P<0.05),LL8各剂量组大鼠血浆中LDL-C 水平显著降低(P<0.05)。
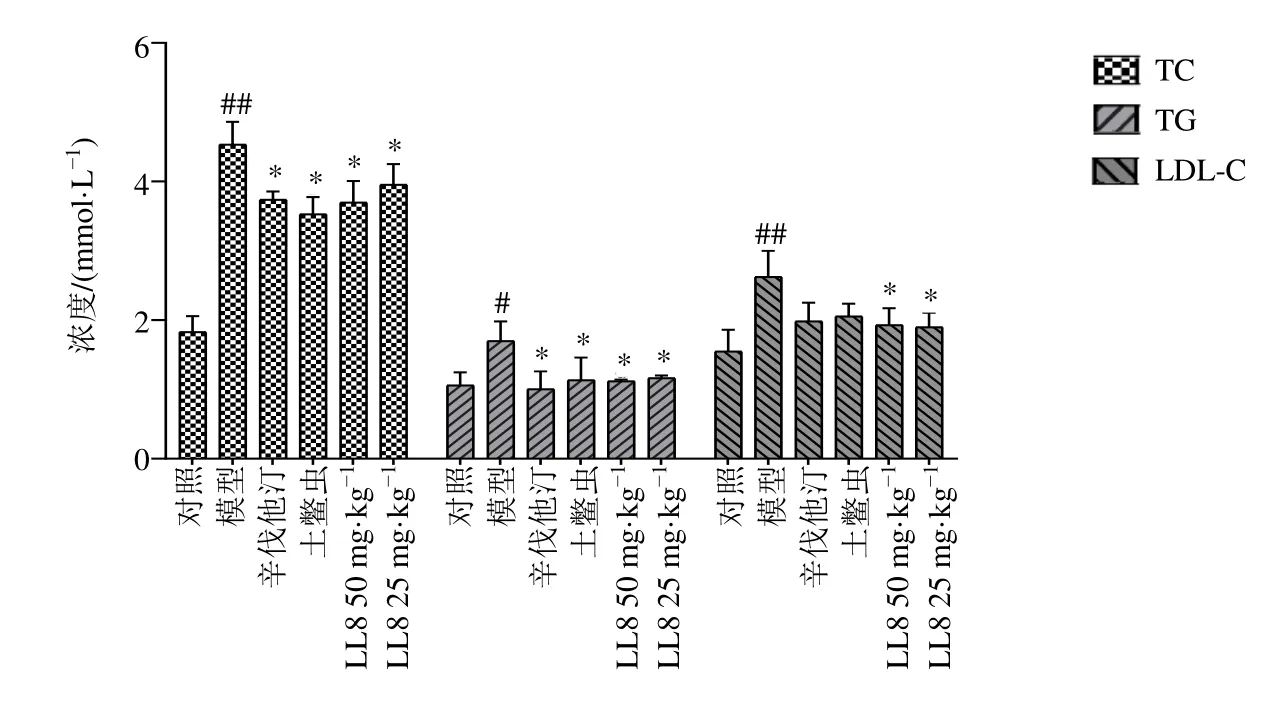
图5 LL8 对高脂血症大鼠血浆中TC、TG 和LDL-C 水平的影响 ( ± s , n=8)Fig.5 Effect of LL8 on levels of TC, TG and LDL-C in plasma of hyperlipidemia rats ( ± s , n=8)
2.4.4 LL8 对高脂血症大鼠肝脏组织中TC 和TG水平的影响 大鼠脱颈椎处死,取肝脏组织,加入甲醇-氯仿(2∶1)混合溶剂制成5%的匀浆液,按试剂盒说明书检测大鼠肝脏组织中TC 和TG 水平。如图6 所示,与对照组比较,模型组大鼠肝脏TC和TG 水平明显升高(P<0.05、0.01);与模型组比较,各给药组大鼠肝脏TC 和TG 水平均显著降低(P<0.05、0.01)。

图6 LL8 对高脂血症大鼠肝脏TC 和TG 含量的影响 ( ± s , n=8)Fig.6 Effect of LL8 on levels of TC and TG in liver of hyperlipidemia rats ( ± s , n=8)
2.4.5 LL8 对高脂血症大鼠肝脏组织病理变化的影响 取各组大鼠肝脏组织,于4%多聚甲醛溶液中固定,梯度乙醇脱水后包埋并切片,进行苏木素-伊红(HE)染色,于显微镜下观察肝脏组织中脂肪变性情况[14-16]。如图7 所示,对照组大鼠肝脏组织结构正常,染色均匀分布,细胞排列整齐清晰,质 核均匀,肝窦清晰,偶有极细微脂肪颗粒;模型组大鼠肝脏组织发生脂肪变性,细胞排列紊乱,细胞核被挤压于细胞一侧,细胞间隙与细胞质之间具有较多脂肪滴,出现了脂质沉积,且有大小不等的脂肪空泡;与模型组大鼠相比,辛伐他汀组与LL8 高剂量大鼠肝细胞排列明显改善,肝窦结构清晰,无明显脂滴,肝细胞受损情况显著改善;LL8 低剂量组肝细胞的结构中脂滴数量显著减少,细胞排列明显改善,但仍见脂质空泡;土鳖虫组大鼠肝细胞肿胀程度较模型组轻,仍见脂质空泡,脂滴多分布于细胞间隙,细胞质中脂滴显著减少。

图7 LL8 对高脂血症大鼠肝脏病理变化的影响 (HE, ×100)Fig.7 Effect of LL8 on pathological changes of liver in hyperlipidemia rats (HE, × 100)
3 讨论
目前阿加曲班[17]、利拉鲁肽[18]等活性肽类药物的主要给药方式为iv,活性肽类药物在胃肠道内易被消化酶酶解再次形成小分子肽,导致活性肽结构破坏而失去药效。因此,本研究通过im 土鳖虫活性肽LL8,从而减少肠道未知因素带来的实验误差。高脂饮食是诱发高脂血症的主要因素,本研究采用喂食高脂饲料成功诱导了高脂血模型大鼠,结果显示,与对照组比较,模型组大鼠血浆中TC、TG 和LDL-C 水平明显升高,同时高脂饲料的长期摄入导致进入大鼠肝脏的脂质物质过多,超过肝脏代谢能力,导致肝脏脂类代谢失衡,造成肝脏内TC 和TG水平升高;LL8 能够降低高血脂症大鼠血浆中TC、TG 和LDL-C 水平以及肝脏中TC 和TG 水平;LL8能够显著改善肝组织脂肪变性与肝脏病变,减少肝脏脂滴与脂质空泡,表明LL8 可以改善高脂血症大鼠血脂紊乱情况,且具有较强的肝脏保护作用。
本研究采用荧光素标记示踪方法对LL8进行药动学研究,结果显示,高、低剂量LL8 在正常大鼠体内的半衰期相近,属于快速代谢型药物。活性肽药物iv 时半衰期短的原因主要为:①体内多组合蛋白酶对活性肽药物进行急速水解,导致血药浓度骤降;②基于“相似相容”原理,活性肽类药物因与机体成分相似,较其他植物性成分代谢速度快,引起半衰期短[19-20]。目前主要通过末端修饰、形成环肽及螺旋结构修饰、物理包裹等[21-22]方法,从而解决活性肽类药物不能长期留存体内的问题。
与植物活性成分药动学研究方法不同,活性肽类药物没有特定的结构母核,在目前的常规检测手段下很难被正常计算出来,借助于发色荧光物质的标记,并采用先进仪器分析是主流方法[23-24]。但随着蛋白质组学的普及,借助于纳流液相色谱仪Easy LC II 串联高分辨质谱(Nano Easy LC Ⅱ-HRMS)对血液中全肽段进行痕量分析,可以明确iv 时活性肽药物的吸收、分布、代谢等情况。
与尿激酶等大分子蛋白类药物相比,LL8 的药物平均滞留时间短[25],通过药动学实验结果,结合药物相对分子质量大小,后期需对LL8 进行结构修饰,在保证药效与安全的用药基础上增加药物在体内保留时间和药物半衰期。为阐明LL8 在大鼠体内的代谢、排泄与组织分布情况,课题组后期将对LL8在正常SD 大鼠体内的排泄、代谢及其分布进行系统研究。
利益冲突所有作者均声明不存在利益冲突
