黄芪-当归配伍对家兔血管内膜增生、平滑肌细胞表型转化和增殖的影响
2021-08-05刘彩霞邓常清
李 霞,曹 旺,刘彩霞,邓常清,*
1.湖南中医药大学 中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410028
2.湖南中医药大学 血管生物学实验室,湖南 长沙 410028
血管内膜增生(intimal hyperplasia,IH)是多种心血管疾病的基本病理机制[1-2]。IH 是一种独特的血管重塑状态,涉及内皮细胞损伤、成纤维细胞激活、细胞外基质重建以及血管平滑肌细胞(vascular smooth muscle cells,VSMC)迁移、增殖和分化等血管的所有组成部分。VSMC 迁移至血管内膜并不断增殖,血管管腔逐渐缩小,为造成动脉粥样硬化、冠状动脉搭桥术、冠状动脉支架置入术等血管狭窄的主要原因[3]。
黄芪和当归药对为临床常用的气血双补药对,也是常用的益气活血药对。黄芪味甘而薄,具补气之功;当归味甘而重,故专能补血,其气轻而辛,故又能行血。黄芪-当归配伍具有保护心血管[4]、抗动脉粥样硬化、抗脑缺血、抗脏器纤维化等作用,可以干预血管内膜增生多个相关的病理机制[5-7]。本课题组前期研究表明,黄芪-当归配伍能够抑制大鼠血管内皮损伤诱导的血管内膜增生,其作用机制与抑制VSMC 增殖、炎性反应和细胞外基质沉积等有关[8]。目前对于黄芪-当归配伍抗血管内膜增生的配伍形式、药效物质基础和作用机制尚不明确。由于中药治疗疾病具有多成分、多靶点、多通路的作用特点,本课题组前期采用网络药理学方法,探讨了黄芪-当归配伍改善血管内膜增生的药效物质基础和可能的作用靶点,发现黄芪-当归配伍可能通过20 个活性成分,作用于193 个潜在靶点,调控磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitrogen-acitivated protein kinase,MAPK)、Ras等信号通路,从而发挥抗血管内膜增生的作用[9]。本研究以黄芪和当归配伍益气活血功效为基础,以VSMC 功能为切入点,探讨黄芪-当归配伍抗血管内膜增生的作用,并从VSMC 表型转化和增殖研究其作用机制,旨在揭示其抗血管内膜增生的有效配伍,为临床合理应用提供科学依据。
1 材料
1.1 动物
清洁级新西兰兔,雌雄各半,3~4月龄,体质量2.0~2.5 kg,购自湖南中医药大学实验动物中心,动物许可证号SCXX(湘)2020-0005。动物于清洁级动物实验室适应性饲养1 周,温度25 ℃、湿度45%~65%,自由进食饮水。动物实验经湖南中医药大学医学动物实验伦理委员会批准(批准号LL219102002)。
1.2 药材
黄芪、当归由湖南中医药大学第一附属医院药剂科提供,经湖南中医药大学第一附属医院药剂科左亚杰教授鉴定分别为豆科植物膜荚黄芪Astragalus membranaceus(Fisch.) Bge.的干燥根、伞形科植物当归Angelica sinensis(Oliv.) Diels 的干燥根,符合《中国药典》2020年版规定。
1.3 药品与试剂
阿托伐他汀钙片(批号20190411B,10 mg/片)购自浙江乐普药业有限公司;Masson 改良三色染色试剂盒(批号20190613)购自北京索莱宝科技有限公司;二步法免疫组化法试剂盒(批号2015G0115)、DAB 显色试剂盒(批号K196721D)购自北京中杉金桥生物技术有限公司;PI3K 抗体(批号LS-C312573)购自美国LSBio 公司;Akt 抗体(批号bs69512)、磷酸化PI3K(p-PI3K)抗体购自北京博奥森生物技术有限公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号GR3257713-3)、p-Akt 抗体购自英国Abcam 公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(批号10003678)、β-actin 抗体、HRP标记的山羊抗小鼠IgG 抗体、HRP 标记的山羊抗兔IgG 抗体购自美国Proteintech 公司;骨桥蛋白(osteopontin,OPN)抗体(批号NB110-89062)购自美国Novus 公司;总胆固醇(total cholesterol,TC)检测试剂盒(批号 20201028)、三酰甘油(triglycerides,TG)检测试剂盒(批号20101034)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒(批号20200820)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)检测试剂盒(批号20201024)购自南京建成生物科技有限公司;BCA 蛋白定量试剂盒(批号PQ0012)购自上海碧云天生物技术有限公司;PVDF 膜(批号IPV00010)、ECL 化学发光试剂盒(批号WBKLS0100)购自美国Millipore 公司。
1.4 仪器
石蜡切片机(英国Shado 公司);光学显微镜(日本Olympus 公司);水平电泳仪、凝胶成像分析系统、蛋白电泳及转膜设备(美国Bio-Rad 公司);高速离心机(美国Beckman 公司);低温台式高速离心机(赫西仪器装备有限公司);台式高速冷冻离心机(德国Eppendorf 公司);脱色摇床(上海新波公司);超纯水仪(美国Millipore 公司)。
2 方法
2.1 黄芪-当归配伍和制备
本课题组前期研究表明,黄芪-当归(1∶1)配伍时具有较好的抗血管内膜增生的作用[8],而传统的黄芪-当归配伍(当归补血汤)多为5∶1 配伍,因此本研究设置黄芪-当归(1∶1)、黄芪-当归(1∶5)、黄芪-当归(5∶1)3 个比例的配伍。按以上比例分别取药材,加入8 倍量水,回流提取1 h,滤过;再加入6 倍量水,回流提取1 h,滤过;再加入6倍量水,回流提取1 h,滤过;合并3 次滤液,真空减压浓缩至1 g/mL(以生药量计)。
2.2 造模、分组与给药
新西兰兔随机分为对照组、模型组、黄芪(1 g/kg)组、当归(1 g/kg)组、黄芪-当归(1∶1,2 g/kg)组、黄芪-当归(1∶5,6 g/kg)组、黄芪-当归(5∶1,6 g/kg)组和阿托伐他汀(5 mg/kg)组,每组10 只。按颈总动脉套管法改良制备颈总动脉血管内膜增生模型[10],新西兰兔术前12 h 禁食不禁水,耳缘iv 2.5%戊巴比妥钠(1 mL/kg)麻醉,仰卧固定,颈部正中切口,分离两侧颈总动脉;将1个无活性的柔软的硅橡胶管(长20 mm、内径1.0 mm)沿长轴剪开后,套在分离的两侧颈总动脉外面,用丝线结扎固定;术后im 青霉素,1 次/d,连续7 d。对照组只分离颈总动脉,不进行血管套管。自术后第1 天起喂养高脂饲料(2%胆固醇+3%橄榄油+95%普通饲料),对照组喂养普通饲料。自术后第1 天起,各给药组ig 相应药物,对照组和模型组ig 等体积蒸馏水(15 mL/kg),1 次/d,连续28 d。
2.3 黄芪-当归配伍对家兔血管内膜增生模型血清中TC、TG、LDL-C 和HDL-C 水平的影响
给药结束后,新西兰兔腹主动脉采血,3000 r/min 离心15 min,取上层血清,按试剂盒说明书测定血清中TC、TG、LDL-C 和HDL-C 水平。
2.4 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉病理变化的影响
新西兰兔腹主动脉采血后,取损伤段颈总动脉,在PBS 中将血管剥离干净,于4%多聚甲醛中固定7 d,梯度乙醇脱水,石蜡包埋,每段血管间断均匀切取8 片(厚4~6 μm);按试剂盒说明书进行Masson 染色,于显微镜下观察并拍照,采用Image-Pro Plus 6.0 软件测定中膜面积(media area,MA)、内膜面积(intimal area,IA)、内膜中线周长、中膜中线周长,计算中膜厚度(media thickness,MT)、内膜厚度(intimal thickness,IT)、内膜面积增生率(hyperplasia ratio of intimal area,HRIA)、内膜厚度增生率(hyperplasia ratio of intimal thickness,HRIT),评价血管内膜增生程度。
MA=外弹力膜内面积-内弹力膜内面积
IA=内弹力膜内面积-管腔面积
MT=(外弹力膜内面积/π)1/2-(内弹力膜内面积/π)1/2
IT=(外弹力膜内面积/π)1/2-(管腔面积/π)1/2
HRIA=内膜面积/(内膜面积+中膜面积)
HRIT=内膜厚度/(内膜厚度+中膜厚度)
2.5 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉α-SMA、OPN 和PCNA 表达的影响
免疫组化法测定损伤段颈总动脉增生内膜中VSMC 收缩表型标志物α-SMA、合成表型标志物OPN 和增殖标志物PCNA 表达。取各组损伤段颈总动脉,于4%多聚甲醛中固定7 d,梯度乙醇脱水,石蜡包埋,切片(厚4 μm);60 ℃烤片过夜,脱蜡水化,微波抗原修复,冷却至室温,分别滴加50 μL α-SMA 抗体(1∶2000)、PCNA 抗体(1∶300)、OPN 抗体(1∶300),4 ℃孵育过夜;滴加HRP 标记的山羊抗小鼠/兔IgG 抗体,37 ℃孵育30 min;DAB 显色,苏木素复染,脱水、透明后封片,于显微镜下观察并拍照,阳性表达呈棕黄色点状或纤维状染色,采用Image-Pro Plus 6.0 软件测定吸光度(A)值并计算阳性染色面积。
2.6 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉PI3K/Akt 通路相关蛋白表达的影响
取各组损伤段颈总动脉,加入RIPA 裂解液,4 ℃、12 000 r/min 离心15 min,取上清,采用BCA蛋白定量试剂盒测定蛋白质量浓度,100 ℃加热变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5%脱脂牛奶,室温封闭90 min;分别加入PI3K 抗体(1∶1000)、p-PI3K抗体(1∶500)、Akt 抗体(1∶1000)、p-Akt 抗体(1∶1000)和β-actin 抗体(1∶5000),4 ℃孵育过夜;加入HRP 标记的山羊抗小鼠/兔IgG 抗体(1∶1000),室温孵育90 min;加入ECL 化学发光液显影,采用Image J 软件分析条带。
2.7 统计学方法
数据以±s表示,采用SPSS 23.0 软件进行统计分析。先将各组数据进行正态性、方差齐性检验,多组间比较采用单因素方差分析,方差齐者用LSD检验;方差不齐者用Dunnett’sT3 检验。
3 结果
3.1 黄芪-当归配伍对家兔血管内膜增生模型血清中TC、TG、LDL-C 和HDL-C 水平的影响
如表1 所示,与对照组比较,模型组家兔血清中TC、TG 和LDL-C 水平显著升高(P<0.01),HDL-C 水平显著降低(P<0.01);与模型组比较,黄芪-当归(1∶1、5∶1)组及阿托伐他汀组血清中TC、TG 和LDL-C 水平显著降低(P<0.05、0.01),HDL-C 水平显著升高(P<0.01);当归组血清中TG 和LDL-C 水平显著降低(P<0.05、0.01)。
表1 黄芪-当归配伍对家兔血管内膜增生模型血清中TC、TG、LDL-C 和HDL-C 水平的影响 ( ± s , n=5)Table 1 Effect of Astragali Radix-Angelicae Sinensis Radix on levels of TC, TG, LDL-C and HDL-C in serum of vascular intimal hyperplasia rabbit model ( ± s , n=5)
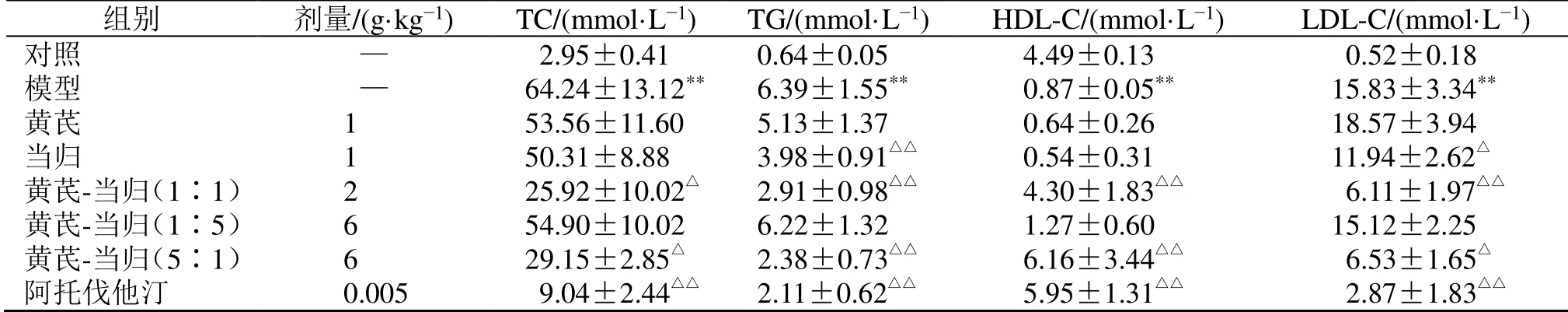
表1 黄芪-当归配伍对家兔血管内膜增生模型血清中TC、TG、LDL-C 和HDL-C 水平的影响 ( ± s , n=5)Table 1 Effect of Astragali Radix-Angelicae Sinensis Radix on levels of TC, TG, LDL-C and HDL-C in serum of vascular intimal hyperplasia rabbit model ( ± s , n=5)
与对照组比较:*P<0.05 **P<0.01;与模型组比较:△P<0.05 △△P<0.01,下表同*P < 0.05 **P < 0.01 vs control group; △P < 0.05 △△P < 0.01 vs model group, same as below tables
组别 剂量/(g·kg−1) TC/(mmol·L−1) TG/(mmol·L−1) HDL-C/(mmol·L−1) LDL-C/(mmol·L−1) 对照 — 2.95±0.41 0.64±0.05 4.49±0.13 0.52±0.18 模型 — 64.24±13.12** 6.39±1.55** 0.87±0.05** 15.83±3.34** 黄芪 1 53.56±11.60 5.13±1.37 0.64±0.26 18.57±3.94 当归 1 50.31±8.88 3.98±0.91△△ 0.54±0.31 11.94±2.62△ 黄芪-当归(1∶1) 2 25.92±10.02△ 2.91±0.98△△ 4.30±1.83△△ 6.11±1.97△△ 黄芪-当归(1∶5) 6 54.90±10.02 6.22±1.32 1.27±0.60 15.12±2.25 黄芪-当归(5∶1) 6 29.15±2.85△ 2.38±0.73△△ 6.16±3.44△△ 6.53±1.65△ 阿托伐他汀 0.005 9.04±2.44△△ 2.11±0.62△△ 5.95±1.31△△ 2.87±1.83△△
3.2 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉病理变化的影响
如图1 所示,对照组家兔血管内弹力膜完整,呈单层,未见明显增生;模型组血管内膜呈均一或不均一增厚,并有大量增生的VSMC 存在,排列紊乱,内膜增生明显;各给药组血管内膜呈增生性改变,但增生程度较模型组减轻。
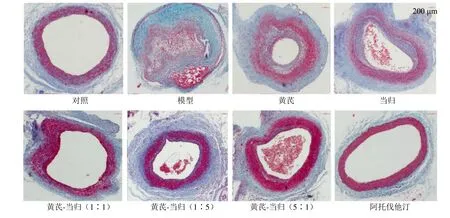
图1 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉病理变化的影响 (Masson, ×100)Fig.1 Effect of Astragali Radix-Angelicae Sinensis Radix on pathological changes of common carotid artery in vascular intimal hyperplasia rabbit model (Masson, × 100)
如表2 所示,与对照组比较,模型组IA、IT、HRIA、HRIT 均显著升高(P<0.01),表明兔颈总动脉不完全性狭窄后出现明显的内膜增生;与模型组比较,黄芪-当归(1∶1、5∶1)组及阿托伐他汀组IA、IT、HRIA、HRIT 均显著降低(P<0.01)。
表2 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉IA、IT、HRIA 和HRIT 的影响 ( ± s , n=5)Table 2 Effect of Astragali Radix-Angelicae Sinensis Radix on IA, IT, HRIA and HRIT of common carotid artery in vascular intimal hyperplasia rabbit model ( ± s , n=5)
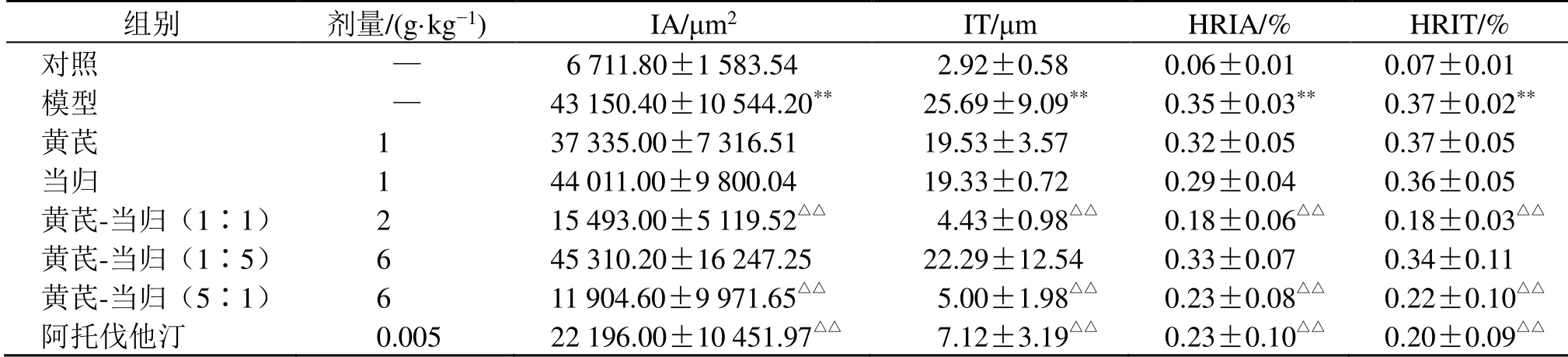
表2 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉IA、IT、HRIA 和HRIT 的影响 ( ± s , n=5)Table 2 Effect of Astragali Radix-Angelicae Sinensis Radix on IA, IT, HRIA and HRIT of common carotid artery in vascular intimal hyperplasia rabbit model ( ± s , n=5)
组别 剂量/(g·kg−1) IA/μm2 IT/μm HRIA/% HRIT/% 对照 — 6 711.80±1 583.54 2.92±0.58 0.06±0.01 0.07±0.01 模型 — 43 150.40±10 544.20** 25.69±9.09** 0.35±0.03** 0.37±0.02** 黄芪 1 37 335.00±7 316.51 19.53±3.57 0.32±0.05 0.37±0.05 当归 1 44 011.00±9 800.04 19.33±0.72 0.29±0.04 0.36±0.05 黄芪-当归(1∶1) 2 15 493.00±5 119.52△△ 4.43±0.98△△ 0.18±0.06△△ 0.18±0.03△△ 黄芪-当归(1∶5) 6 45 310.20±16 247.25 22.29±12.54 0.33±0.07 0.34±0.11 黄芪-当归(5∶1) 6 11 904.60±9 971.65△△ 5.00±1.98△△ 0.23±0.08△△ 0.22±0.10△△ 阿托伐他汀 0.005 22 196.00±10 451.97△△ 7.12±3.19△△ 0.23±0.10△△ 0.20±0.09△△
3.3 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉α-SMA、OPN 和PCNA 表达的影响
α-SMA 是VSMC 的收缩表型标志物,能够反映VSMC 的收缩状态;OPN 是VSMC 合成表型标志物,能够反映VSMC 的合成和分泌状态;PCNA能够反映VSMC 的增殖活性。如图2~4 和表3 所示,与对照组比较,模型组颈总动脉α-SMA 表达显著降低(P<0.05),OPN 和PCNA 表达显著升高(P<0.01);与模型组比较,黄芪-当归(1∶1、5∶1)组及阿托伐他汀组颈总动脉α-SMA 表达显著升高(P<0.05、0.01),OPN 和PCNA 表达显著降低(P<0.01);黄芪-当归(1∶5)组颈总动脉PCNA 表达显著降低(P<0.01)。

图2 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉α-SMA 表达的影响 (×200)Fig.2 Effect of Astragali Radix-Angelicae Sinensis Radix on α-SMA expression in common carotid artery of vascular intimal hyperplasia rabbit model (× 200)

图3 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉OPN 表达的影响 (×200)Fig.3 Effect of Astragali Radix-Angelicae Sinensis Radix on OPN expression in common carotid artery of vascular intimal hyperplasia rabbit model (× 200)
3.4 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉PI3K/Akt 通路相关蛋白表达的影响
如图5 所示,与对照组比较,模型组颈总动脉p-PI3K和p-AKT蛋白表达水平显著升高(P<0.01);与模型组比较,黄芪-当归(1∶1、1∶5、5∶1)组及阿托伐他汀组颈总动脉p-PI3K 和p-Akt 蛋白表达水平显著降低(P<0.05、0.01)。
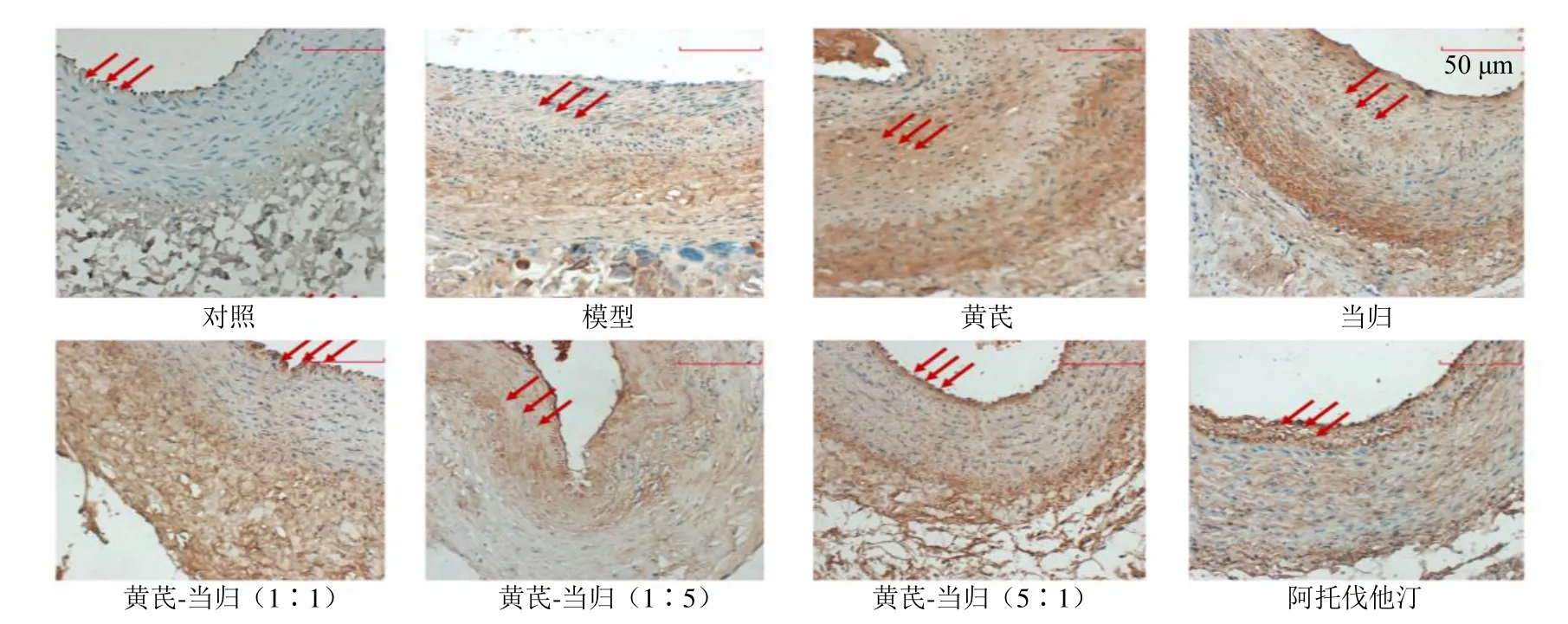
图4 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉PCNA 表达的影响 (×200)Fig.4 Effect of Astragali Radix-Angelicae Sinensis Radix on PCNA expression in common carotid artery of vascular intimal hyperplasia rabbit model (× 200)

图5 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉PI3K/Akt 通路相关蛋白表达的影响 ( ± s , n=6)Fig.5 Effect of Astragali Radix-Angelicae Sinensis Radix on PI3K/Akt pathway related protein expressions in common carotid artery of vascular intimal hyperplasia rabbit model ( ± s , n=6)
表3 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉α-SMA、OPN 和PCNA 表达的影响 ( ± s , n=5)Table 3 Effect of Astragali Radix-Angelicae Sinensis Radix on expression of α-SMA, OPN and PCNA in common carotid artery of vascular intimal hyperplasia rabbit model ( ± s , n=5)

表3 黄芪-当归配伍对家兔血管内膜增生模型颈总动脉α-SMA、OPN 和PCNA 表达的影响 ( ± s , n=5)Table 3 Effect of Astragali Radix-Angelicae Sinensis Radix on expression of α-SMA, OPN and PCNA in common carotid artery of vascular intimal hyperplasia rabbit model ( ± s , n=5)
组别 剂量/(g·kg−1) α-SMA/μm2 OPN/μm2 PCNA/μm2 对照 — 0.40±0.05 0.22±0.02 0.24±0.03 模型 — 0.23±0.01* 0.33±0.02** 0.33±0.03** 黄芪 1 0.26±0.02 0.32±0.06 0.31±0.02 当归 1 0.26±0.03 0.29±0 0.31±0.02 黄芪-当归(1∶1) 2 0.39±0.03△△ 0.24±0.02△△ 0.23±0.01△△ 黄芪-当归(1∶5) 6 0.25±0.03 0.30±0.03 0.29±0.03△△ 黄芪-当归(5∶1) 6 0.38±0.05△ 0.21±0.01△△ 0.23±0.01△△ 阿托伐他汀 0.005 0.34±0.02△ 0.22±0.01△△ 0.24±0.03△△
4 讨论
血管成形术后的6 个月内,55%患者会发生血管再狭窄[11]。血管成形术和支架植入后再狭窄主要由IH 引起,VSMC 活化在IH 的发生发展中具有重要的作用。当血管成形术和支架植入后,血管内皮受损,导致VSMC 由收缩表型向合成表型转化,具有增殖、分化和合成的能力;VSMCs 由血管中膜向内膜迁移并增殖,并合成大量细胞外基质,导致血管内膜增生,管腔逐渐缩小[12-13]。中药具有多环节、多靶点的调控作用,可以通过多成分调节血管内膜增生的病理机制,从而抑制或延缓血管内膜增生的发生发展。由于VSMC 迁移和增殖是血管内膜增生的主要病理机制,因此基于VSMC 功能来研究中药防治血管内膜增生具有重要的意义。
本研究通过建立家兔颈总动脉血管内膜增生模型,考察黄芪和当归不同比例配伍对血管内膜增生的作用,结果显示,单用黄芪或当归对血管内膜增生无显著抑制作用,黄芪-当归配伍能够抑制兔血管内膜增生,黄芪和当归不同配伍显著降低IA、IT、HRIA、HRIT,其中黄芪-当归(1∶1、5∶1)配伍的疗效最佳,提示黄芪-当归配伍具有抑制血管内膜增生的作用,以黄芪-当归(1∶1、5∶1)配伍为宜。
血脂是诱发血管内膜增生的重要因素,高脂水平易引起机体代谢与功能紊乱,导致血管内皮受损、发生炎性反应及氧化损伤,从而直接或间接参与IH的病理过程[14]。血清炎性因子水平与血脂水平密切相关,调节血脂有助于改变机体的炎性反应[15]。研究表明,黄芪当归合剂具有调脂作用,疗效与他汀类药物相似且更持久[16]。本研究结果显示,单用黄芪对血脂水平无显著影响,单用当归仅降低TG 水平,黄芪-当归(1∶1、5∶1)配伍能够降低血清中TC、TG、LDL-C 水平,升高HDL-C 水平,表明黄芪-当归配伍可能通过调节血脂水平,抑制脂质向血管壁沉积,从而抑制血管内膜增生。
VSMC 向血管内膜迁移和增殖在血管增生性疾病的发生发展中具有重要作用[17]。VSMC 是一种高度分化的细胞,可以形成血管壁的中层,通过收缩和舒张血管从而控制血压。与其他终末分化的肌细胞不同,VSMC 保留了分化(或收缩)和去分化(或合成)表型之间相互转换的独特能力,能够响应血管损伤、机械拉伸或生长因子刺激等生理和病理信号[18-20]。收缩型VSMC 呈细长的纺锤形形态,表现为极低的增殖活性,表达α-SMA、平滑肌22α(smooth muscle 22α,SM22α)等VSMC 特异性收缩基因。合成型VSMC 形态与成纤维细胞类似,体积较收缩型VSMC 大,其迁移、增殖活性增加,合成胶原、基质金属蛋白酶等细胞外基质蛋白的能力增强,收缩基因的表达减少[19],表达OPN、表皮生长因子(epidermal growth factor,EGF)等合成型标志物[21]。PCNA 是一种核蛋白,参与细胞增殖相关的DNA 合成,只在增殖细胞中合成和表达[22]。本研究结果显示,模型组颈总动脉中VSMC 收缩表型的标志物α-SMA 表达降低,合成表型标志物OPN和细胞增殖标志物PCNA 表达升高,表明在血管狭窄模型中,VSMC 活化,由收缩表型向合成表型转化增多,细胞向内膜迁移并增殖,促进新生内膜的形成;与模型组比较,单用黄芪或当归对α-SMA、OPN 和PCNA 表达无明显作用,黄芪-当归(1∶1、5∶1)配伍能够上调α-SMA 表达水平,下调OPN和PCNA 表达水平,提示黄芪-当归配伍可以抑制VSMC 活化,抑制VSMC 由收缩型向合成型转换和细胞增殖。
PI3K-Akt 信号通路是EGFR 下游信号通路的重要组成部分,在调节细胞周期、细胞生长、增殖和凋亡中发挥关键作用。PI3K/Akt 磷酸化激活是刺激VSMC 增殖和迁移的主要信号通路[23-25]。在血管内膜增生性疾病中,PI3K/Akt被激活,从而抑制VSMC收缩表型标记基因的表达[26-28]。本研究结果显示,模型组颈总动脉中p-PI3K 和p-Akt 蛋白表达水平显著升高,表明PI3K/Akt 信号被激活;与模型组比较,黄芪-当归(1∶1、5∶1)组p-PI3K 和p-Akt 蛋白表达水平显著降低,表明黄芪-当归(1∶1、5∶1)配伍能够抑制PI3K/Akt 信号通路,从而抑制VSMC增殖及表型转化,发挥抗血管内膜增生的作用。
综上所述,血管成形术后再狭窄的发生涉及血管重构、血管内膜增生、炎性反应、氧化应激、血管平滑肌细胞迁移和过度增殖等病理过程。黄芪-当归配伍能够调节血脂、抑制血管内膜增生、缓解管腔狭窄,其机制可能与抑制PI3K/Akt 信号通路、抑制VSMC 表型转化和增殖有关。
利益冲突所有作者均声明不存在利益冲突
