龙鳖胶囊含药血清通过调控Hippo-YAP信号通路促进骨髓间充质干细胞迁移研究
2021-08-05梁桂洪黄和涛曾令烽赵金龙潘建科杨伟毅陈红云罗明辉韩燕鸿
梁桂洪,黄和涛,曾令烽,杨 园,赵金龙,潘建科,杨伟毅,陈红云,罗明辉,韩燕鸿,刘 军*
1.广州中医药大学第二附属医院(广东省中医院)骨科,广东 广州 510120
2.广东省中医药科学院 骨与关节退变及损伤研究团队,广东 广州 510120
关节软骨因缺乏血管、神经和淋巴液的营养供应,导致其自我修复能力受到限制,损伤后难以再生,从而引起骨关节炎(osteoarthritis,OA)等退行性疾病,严重影响中老年人的关节活动[1]。目前关于关节软骨修复的方法主要有自体软骨移植、骨软骨移植、干细胞治疗和基因治疗等[2]。然而,提取自体软骨细胞会对供体部位造成一定的损伤,移植的外源性软骨细胞迁移能力弱,不能有效地聚集到损伤部位,且移植后分泌细胞外基质的功能明显减弱,不能与软骨下板很好地融合,从而降低自体软骨细胞移植治疗效果[3]。骨髓间充质干细胞(bone marrow stromal cells,BMSCs)是最常用的间充质干细胞(marrow stromal cells,MSCs),由于其具有易获得、多向分化和定向迁移的特性,在骨和软骨修复中得到广泛的研究和应用[4-5]。当机体组织出现损伤后,BMSCs 因具有较强的迁移能力,可以迁移至损伤处并对损伤组织进行修复[6],因此增强BMSCs 的迁移能力有助于促进损伤后的软骨修复。
Hippo-Yes 相关蛋白(Yes-associated protein,YAP)信号通路是调控MSCs 增殖和分化的重要通路[7]。BMSCs 的增殖、分化、迁移等生物学功能均受Hippo-YAP 信号通路的影响[8]。抑制Hippo 信号通路能够提高BMSCs 在体外的增殖和迁移能力[9]。YAP 作为Hippo-YAP 信号通路中的效应基因,具有调节BMSCs 向成骨和成脂方向分化的作用[10]。本课题组前期研究表明,龙鳖胶囊具有保护和修复OA 关节软骨组织的作用[11],且龙鳖胶囊联合BMSCs 治疗OA 的效果更为显著[12];龙鳖胶囊能够促进BMSCs 增殖[13]。本研究通过考察龙鳖胶囊对BMSCs 中Hippo-YAP 信号通路和迁移功能的影响,为后续探究龙鳖胶囊通过促进BMSCs 归巢和成软骨分化修复关节软骨的作用机制奠定基础。
1 材料
1.1 动物
SPF 级SD 大鼠10 只,雌雄各半,1.5月龄,体质量(200±10)g,购自南方医科大学实验动物中心,动物许可证号SYXK(粤)-2018-0094。动物饲养于广东省中医药科学院实验动物中心SPF 级环境中。动物实验经广东省中医院动物伦理委员会批准(批准号2020050)。
1.2 药品与试剂
龙鳖胶囊(批号200701,0.5 g/粒)主要由蕲蛇、全蝎、丹参、巴戟天、仙茅、土鳖虫等补肾活血的药物组成,由广东省中医院药剂科生产[11];SD大鼠骨髓间充质干细胞完全培养基(批号RASMX-90011)、SD 大鼠骨髓间充质干细胞成骨诱导分化培养基(批号RASMX-90021)、SD 大鼠骨髓间充质干细胞成脂诱导分化培养基(批号RASMX-90031)、含0.04%乙二胺四乙酸(EDTA)的0.25%胰酶(批号TEDTA-10001)购自赛业(苏州)生物科技有限公司;青-链霉素双抗(批号15140-122)、不含 EDTA 的 0.25%胰酶(批号15050065)、澳洲胎牛血清(批号10099141)、DMEM低糖培养基(批号C11885500BT)、PBS 缓冲液(批号C10010500BT)购自美国Gbico 公司;二甲基亚砜(DMSO,批号D2650)购自美国Sigma 公司;YAP 抑制剂维替泊芬(Verteporfin,批号S1786)购自美国Selleck 公司;Transwell 小室(8 μm,批号353097)购自美国BD 公司;BCA 蛋白定量试剂盒(批号K300)购自上海博彩生物科技有限公司;SDS-PAGE 凝胶配制试剂盒(批号P0012A)、结晶紫染色液(批号C0121)购自上海碧云天生物技术有限公司;ECL 化学发光液(批号WBKLS0100)购自美国Millipore 公司;大型肿瘤抑制因子2(large tumor suppressor homolog 2,LATS2)抗体(批号13646)、YAP 抗体(批号14074)、β-actin 抗体(批号3700)、山羊抗兔抗体、山羊抗小鼠抗体购自美国CST 公司;结缔组织生长因子(connective tissue growth factor,CTGF)抗体(批号ab6992)购自英国Abcam 公司;干细胞表面标记物FITC 抗兔CD45抗体(批号202205)和同型阴性对照(批号400107)、PerCP/Cyanine5.5 抗兔CD90/抗小鼠CD90.1 抗体(批号202515)和同型阴性对照(批号400149)、Alexa Fluor 647 抗兔CD44H 抗体(批号203908)和同型阴性对照(批号400234)、PE 抗小鼠/兔CD29抗体(批号102207)和同型阴性对照(批号400907)购自美国BioLegend 公司。
1.3 仪器
311 型CO2细胞培养箱(美国Thermo Fisher Scientific 公司);HR40-IIA2 型生物安全柜(海尔生物医疗股份有限公司);IC-1000 型Count Star 自动细胞计数仪(上海睿钰生物科技有限公司);5424R型高速冷冻离心机(德国 Eppendorf 公司);Advantage A10 型超纯水仪(美国Millipore 公司);TI2-E 型倒置荧光显微镜(日本Nikon 公司);ChemiDoc Touch 型高灵敏度化学发光成像仪(美国Bio-Rad 公司);Novo Quanteon 型流式细胞仪(安捷伦生物);M1000 Pro 型多功能酶标仪(瑞士Tecan公司)。
2 方法
2.1 龙鳖胶囊含药血清的制备
将龙鳖胶囊内的药粉溶于纯水,配制成质量浓度为0.125 g/mL 的溶液。每日于9: 00、15: 00 时,SD 大鼠ig 龙鳖胶囊(0.625 g/kg),连续7 d。最后1 次给药1 h 后,大鼠ip 10%水合氯醛(3.5 mL/kg)麻醉,腹主动脉采血,3000 r/min 离心10 min,收集含药血清,于56 ℃水浴中孵育30 min,经0.22 μm过滤器滤过后分装,于 −80 ℃冰箱中保存备用。
2.2 大鼠原代BMSCs 的提取和培养
采用全骨髓细胞培养法提取和培养大鼠BMSCs。大鼠ip 10%水合氯醛(7 mL/kg)处死,于75%乙醇中浸泡10 min,无菌条件下取出股骨、胫骨和肱骨,剔除肌肉组织,于含1%双抗的PBS缓冲液中浸泡10 min;将长骨转移至超净工作台,用含1%双抗的PBS 缓冲液冲洗2 次,置于10 cm培养皿中,剪断长骨的干骺端,加入10 mL 含1%双抗的DMEM 低糖培养基,用10 mL 注射器抽吸培养基冲洗骨髓,收集骨髓悬液,1500 r/min 离心8 min,弃上清;加入7 mL SD 大鼠骨髓间充质干细胞完全培养基,混匀后将细胞悬液接种至25 cm2培养瓶中,于培养箱中培养48 h 后半量换液,再培养48 h 后全量换液,当细胞融合度达到90%以上,进行传代培养。
2.3 BMSCs 表面抗原的鉴定
取第3 代BMSCs,胰酶消化后制成单细胞悬液,离心后弃上清,用预冷的PBS 洗涤2 次,调整细胞密度为1×107/mL。各取100 μL 细胞悬液,分别加入CD29、CD44、CD45、CD90 标记物抗体,同时每份样品设立同型阴性对照,混匀后于冰上避光孵育30 min,采用流式细胞仪检测细胞表面抗原的表达。
2.4 BMSCs 成骨诱导分化实验
BMSCs 胰酶消化后计数,将1×105个细胞接种至包被0.1%明胶的6 孔板中,每孔加入2 mL 完全培养基,于培养箱中培养。当细胞融合度达到60%~70%,将培养基小心地吸走,按成骨诱导分化培养基试剂盒说明书,每孔中加入2 mL OriCell大鼠骨髓间充质干细胞成骨诱导分化完全培养基,每3 天更换1 次新鲜的成骨诱导液,诱导4 周后吸去诱导液,PBS 冲洗2 次;每孔加入2 mL 4%多聚甲醛固定30 min,PBS 冲洗2 次;每孔加入1 mL茜素红染液染3 min,吸去染液,PBS 冲洗2~3 次,将培养板置于倒置显微镜镜下,观察并拍照染色的效果。
2.5 BMSCs 成脂诱导分化实验
BMSCs 胰酶消化后计数,将2×105个细胞接种至6 孔板中,按成脂诱导分化培养基试剂盒说明书对BMSCs 进行诱导处理,将完全培养基吸走后,每孔加入2 mL OriCell 大鼠骨髓间质干细胞成脂诱导分化培养基A 液(由基础培养基175 mL、胎牛血清20 mL、双抗2 mL、谷氨酰胺2 mL、胰岛素400 μL、3-异丁基-1-甲基黄嘌呤200 μL、罗格列酮200 μL、地塞米松200 μL 组成),诱导3 d 后,吸走A 液,加入2 mL B 液(由基础培养基175 mL、胎牛血清20 mL、双抗2 mL、谷氨酰胺2 mL、胰岛素400 μL 组成);24 h 后,吸走B 液,换回A液进行诱导;A 液和B 液交替作用6 次后,继续用B 液维持培养5 d 直到脂滴变得大和圆;多聚甲醛固定,进行油红O 染色,于显微镜下观察成脂染色效果。
2.6 Verteporfin 和龙鳖胶囊含药血清对BMCSs 水平迁移能力的影响
将BMSCs 以1×105/孔接种至6 孔板中,培养至细胞铺满孔后,在铺满细胞的六孔板底部中间采用1 mL 无菌枪头划1 条直线,用PBS 洗去划痕中间漂浮的细胞,保证划痕区域无细胞存在。设置对照组,Verteporfin(2、5 μmol/L)组,5%含药血清组,5%含药血清+Verteporfin(2 μmol/L)组和5%含药血清+Verteporfin(5 μmol/L)组。各给药组分别加入相应药物,对照组加入DMSO,随即在倒置显微镜下观察并拍照划痕的情况,培养24 h 后在显微镜下观察并拍照划痕愈合的情况。
2.7 Verteporfin 和龙鳖胶囊含药血清对BMCSs 垂直迁移能力的影响
按“2.6”项下方法进行分组,Transwell 小室中加入100 μL 基础培养基湿润小室,24 孔板的下层分别加入 600 μL 含有相应药物的培养基。BMSCs 消化离心,弃上清,用无血清培养基重悬,以2×105/mL 接种于小室上层,培养24 h 后,取出小室,PBS 清洗2 次;用甲醇固定30 min,PBS 清洗2 次;结晶紫染色5 min,PBS 清洗,用棉签擦去小室上层未能穿过薄膜的细胞,于显微镜下观察并拍照迁移后的细胞。
2.8 Verteporfin 和龙鳖胶囊含药血清对BMCSs 中LATS2、YAP 和CTGF 蛋白表达的影响
BMSCs 胰酶消化后计数,将2×105个细胞接种至6 孔板中,培养12 h。设置对照组和含药血清(2.5%、5.0%)组,各给药组加入相应药物,对照组加入不含药物的培养基,培养24 h,收集细胞,加入细胞裂解液,离心取上清液,采用BCA 蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶室温封闭1 h,分别加入LATS2抗体(1∶1000)、YAP 抗体(1∶1000)、CTGF 抗体(1∶1000)和β-actin 抗体(1∶2000),4 ℃孵育过夜;TBST 洗涤3 次,分别加入山羊抗兔抗体(1∶1000)、山羊抗小鼠抗体(1∶2000),室温孵育1 h,TBST 洗涤3 次,加入ECL 化学发光液显影。
2.9 统计学方法
采用SPSS 21.0 软件分析数据,计量资料以x s± 表示,采用t检验或单因素方差分析。
3 结果
3.1 大鼠原代BMSCs 的鉴定
如图1-A 所示,BMSCs 分离后正常贴壁生长,镜下可见细胞呈长梭形。如图1-B 所示,经成骨诱导茜素红染色后,可见大量被染成红色的矿化结节。如图1-C 所示,经成脂诱导油红-O 染色后,可见大量被染成橘红色的脂滴。如图1-D~G 所示,表达CD29 的阳性率为99.68%,表达CD44 的阳性率为99.03%,表达CD45 的阳性率为0.14%,CD90 的阳性率为95.38%,符合BMSCs 的特征。以上结果表明提取的细胞为BMSCs,可以确保后续研究中细胞来源的准确性。

图1 大鼠原代BMSCs 的形态 (A)、矿化结节形成 (B)、脂滴形成 (C) 以及CD29 (D)、CD44 (E)、CD45 (F) 和CD90 (G) 表面标记物表达情况Fig.1 Morphology (A) of primary rat BMSCs, mineralized nodule formation (B), lipid droplet formation (C) and expressions of surface markers of CD29 (D), CD44 (E), CD45 (F) and CD90 (G)
3.2 Verteporfin 和龙鳖胶囊含药血清对BMCSs 水平迁移能力的影响
低表达LATS1 抑制Hippo 信号通路可以促进间充质干细胞的迁移[8],YAP 作为Hippo-YAP 信号通路中的效应基因,可能是调控BMSCs 迁移的重要蛋白。如图2 所示,与对照组比较,YAP 抑制剂Verteporfin 显著抑制BMSCs 迁移(P<0.01、0.001),5%含药血清显著促进BMSCs 迁移(P<0.05);与等剂量的Verteporfin 组比较,5%含药血清+Verteporfin组BMSCs 迁移率显著升高(P<0.01、0.001)。

图2 Verteporfin 和龙鳖胶囊含药血清对BMCSs 水平迁移能力的影响Fig.2 Effect of Verteporfin and Longbie Capsules containing serum on horizontal migration of BMCSs
3.3 Verteporfin 和龙鳖胶囊含药血清对BMCSs 垂直迁移能力的影响
如图3 所示,与对照组比较,Verteporfin 显著 抑制BMSCs 迁移(P<0.05),5%含药血清显著促进BMSCs 迁移(P<0.05);与等剂量的Verteporfin组比较,5%含药血清+Verteporfin 组BMSCs 迁移数显著升高(P<0.01)。

图3 Verteporfin 和龙鳖胶囊含药血清对BMCSs 垂直迁移能力的影响Fig.3 Effect of Verteporfin and Longbie Capsules containing serum on vertical migration of BMCSs
3.4 Verteporfin 和龙鳖胶囊含药血清对BMCSs 中LATS2、YAP 和CTGF 蛋白表达的影响
如图4 所示,与对照组比较,含药血清(2.5%、5.0%)组细胞LATS2 蛋白表达水平显著降低(P< 0.05),YAP、CTGF 蛋白表达水平均显著升高(P<0.01),表明龙鳖胶囊具有调节Hippo-YAP 信号通路的作用。
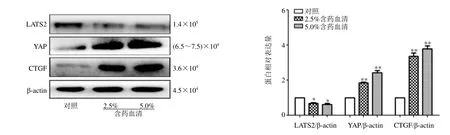
图4 Verteporfin 和龙鳖胶囊含药血清对BMCSs 中LATS2、YAP 和CTGF 蛋白表达的影响Fig.4 Effect of Verteporfin and Longbie Capsules containing serum on expressions of LATS2, YAP and CTGF in BMCSs
4 讨论
关节软骨损伤是发生OA 等关节退行性慢性疾病的主要病理因素,因关节软骨自愈能力较差,受损后无法完成自行修复,最终引起关节功能性障碍,严重影响患者的生活质量[14]。传统的关节软骨修复方法不能形成类似于天然透明软骨组织的结构和生物力学性能,自体软骨细胞移植技术虽然可以生成生物力学性能良好的透明软骨样组织,改善患者症状和恢复运动功能[15],但存在供体部位损伤、分离的软骨去分化等问题[16]。BMSCs 移植在关节软骨修复治疗中备受关注,其在特定条件下可以分化为软骨细胞,且移植后能够与软骨下骨板融合,是修复关节软骨的理想细胞[17]。BMSCs 同样具有较强的迁移和归巢能力,当机体组织出现损伤后,MSCs被损伤部位所召唤后复苏,定向迁移至损伤处并进行多向分化,从而对损伤细胞和组织进行修补[6]。迁移及归巢能力有助于BMSCs 成功定植于损伤部位,因此促进BMSCs 向受损的组织定向迁移是其发挥软骨修复作用的关键环节。本研究通过全骨髓贴壁培养法培养大鼠BMSCs,利用成骨、成脂分化和细胞表面标记物等方法鉴定细胞,结果表明提取的细胞分别被成功诱导出矿化结节和脂肪滴,且细胞表面标记物CD29、CD44 和CD90 为阳性表达,CD45 为阴性表达,符合BMSCs 的表型。
Hippo-YAP 信号通路主要由核心分子LATS1/2和哺乳动物不育系20 样激酶1/2(mammalian sterile 20-like kinase1/2,MST1/2)、效应分子YAP 以及转录共刺激因子(transcriptional co-activator with PDZ-binding motif,TAZ)组成,是调控组织、细胞分化和增殖的重要通路,其多种配体、受体、转录调控因子、激酶以及转录因子在MSCs 中均有表达[8]。通过调控Hippo-YAP 信号通路可能会影响BMSCs 的增殖、分化、迁移等生物学功能[9],从而调控成软骨分化的功能。通过敲低LATS1 可以抑制Hippo 信号通路,降低YAP 磷酸活性,增强YAP转录活性,进而提高小鼠BMSCs 在体外的增殖和迁移能力[10]。YAP 作为Hippo-YAP 信号通路中的效应基因,其活性对BMSCs 分化作用尤为重要。在YAP 缺陷的 BMSCs 中,细胞核 β-连环蛋白(β-catenin)表达水平明显降低,Wnt/β-catenin 信号通路活性减弱,BMSCs 成骨分化功能受限[18];YAP也是人脐带MSCs 成脂、成骨分化的关键调控因子,通过上调YAP,可以诱导脐带MSCs 向成骨细胞的分化[19],表明YAP 是BMSCs 成骨分化重要的调节基因。但YAP 对BMSCs 迁移的作用尚不明确,因此,本研究考察了YAP 抑制剂Verteporfin 对BMSCs迁移的影响,结果表明Verteporfin 能够抑制BMSCs迁移。
补肾活血中药能够有效缓解OA 患者疼痛和改善关节功能[20-21]。龙鳖胶囊以补肾活血为治疗原则,对OA 具有较好的疗效[22];龙鳖胶囊能够修复OA大鼠的关节软骨[23],促进BMSCs 增殖[13],且与BMSCs 联用对OA 的治疗效果更为显著[12]。因此,龙鳖胶囊可能通过调控BMSCs 迁移从而发挥促进关节软骨修复的作用。本研究结果显示,龙鳖胶囊含药血清具有促进BMSCs 迁移的作用,与等剂量的Verteporfin 比较,龙鳖胶囊含药血清+Verteporfin显著促进细胞迁移,表明龙鳖胶囊含药血清能够阻断Verteporfin 抑制的BMSCs 迁移;与对照组比较,龙鳖胶囊含药血清显著抑制LATS2 蛋白表达水平,上调YAP 和CTGF 蛋白表达水平。
综上,YAP 抑制剂Verteporfin 具有抑制BMSCs迁移的功能,龙鳖胶囊含药血清能够阻断这一过程,从而起到增强BMSCs 迁移能力的作用,其作用机制可能与调控Hippo-YAP 信号通路相关。细胞迁移功能与BMSCs 归巢、分化及其组织修复能力密切相关,本课题组后续将研究龙鳖胶囊调控BMSCs成软骨分化的作用及机制,为探索补肾活血中药修复关节软骨提供新的研究方向和思路。
利益冲突所有作者均声明不存在利益冲突
