溪黄草甲素对脂多糖诱导的炎性反应的作用及机制研究
2021-08-05孙礼芹李光霞李医明
孙礼芹,李光霞,王 瑞,李医明,钱 菲,贾 琦*
1.上海中医药大学中药学院,上海 201203
2.上海中医药大学交叉科学研究院,上海 201203
炎性反应是机体应对病原体、感染或组织损伤的保护性反应,但失控的炎性反应会对机体造成损伤[1],因此控制体内炎性反应的动态平衡至关重要。巨噬细胞及其释放的炎性介质在炎性反应的发生发展过程中扮演着重要的角色[2]。除具有吞噬功能外,巨噬细胞还可以在脂多糖(lipopolysaccharides,LPS)等刺激物的诱导下被激活,从而诱导合成并释放大量肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、一氧化氮(nitric oxide,NO)等炎性介质,进而引起炎性反应[3-5]。因此,抑制巨噬细胞的过度活化对抑制炎性反应具有重要意义。溪黄草Rabdosia serra(Maxim.) Hara 为唇形科香茶菜属植物,别名熊胆草、风血草、黄汁草等,具有清热利湿、退黄、凉血散瘀的功效[6-7]。现代药理学研究表明,溪黄草具有抗炎、抗肿瘤、抑菌、增强免疫及保肝利胆等作用。溪黄草甲素是溪黄草中重要的二萜类成分之一,目前仅发现其对人宫颈癌细胞HeLa 的增殖具有显著的抑制作用[8],但对其抗炎作用方面的研究鲜有报道。本研究采用LPS 诱导小鼠建立急性炎性反应模型,并诱导小鼠单核巨噬细胞RAW264.7 细胞建立体外炎性细胞模型,探究溪黄草甲素的抗炎作用及机制,为临床抗炎药物的开发提供依据。
1 材料
1.1 动物
SPF 级雄性BALB/c 小鼠45 只,6 周龄,体质量20~22 g,购自浙江维通利华实验动物技术有限公司,动物许可证号SCXK(浙)2020-0002。动物饲养于上海中医药大学动物实验楼,温度20~26 ℃、相对湿度40%~60%,光照明暗交替各12 h,自由进食饮水。动物实验经上海中医药大学实验动物伦理委员会批准(批准号PZSHUTCM200904008)。
1.2 细胞
RAW264.7 细胞为本课题组保存。
1.3 药品与试剂
溪黄草甲素(质量分数≥98%)为本课题组自制;DMEM 高糖培养基(批号8120449)购自美国Gibco 公司;胎牛血清(批号17M483)、LPS(批号 078M4039V)、二甲基亚砜(DMSO,批号RNBH5492)购自美国Sigma 公司;XTT 试剂盒(批号32141000)购自德国Roche 公司;TNF-α ELISA试剂盒(批号227846-005)、IL-6 ELISA 试剂盒(批号234277-003)购自美国Thermo Fisher Scientific公司;蛋白酶抑制剂(批号410064)、磷酸酶抑制剂(批号510033)购自美国Selleck 公司;RIPA 裂解液、蛋白酶抑制剂PMSF、细胞核蛋白与细胞质蛋白抽提试剂(批号020617170522)、BCA 蛋白定量试剂盒(批号080919190917)购自上海碧云天生物技术有限公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体、c-Jun 氨基端激酶(c-JunN-terminal kinase,JNK)抗体、磷酸化JNK(p-JNK)抗体、细胞外调节蛋白激酶 1/2(extracellular regulated protein kinase 1/2,ERK1/2)抗体、p-ERK1/2 抗体、p38 抗体、p-p38 抗体、p65抗体、Janus 酪氨酸蛋白激酶2(Janus kinase 2,JAK2)抗体、p-JAK2 抗体、信号转导子与转录激活子蛋白 3(signal transducer and activator of transcription 3,STAT3)抗体、p-STAT3 抗体、核因子-κB 抑制蛋白α(inhibitor nuclear factor-κB α,IκBα)抗体、p-IκBα 抗体购自美国CST 公司;小鼠源重组IL-6 、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号DJ18)、Histone H3 抗体(批号A25J)、HRP 标记的山羊抗兔IgE 抗体(批号AS007)、HRP标记的山羊抗小鼠IgE 抗体(批号AS006)购自爱必信生物科技有限公司;ECL 发光液(批号1916102)购自美国Millpore 公司。
1.4 仪器
2 方法
2.1 造模、分组与给药
BALB/c 小鼠随机分为对照组、模型组及溪黄草甲素低、高剂量(50、100 mg/kg)[9-10]组和地塞米松(5 mg/kg)组,每组9 只。以0.5%羧甲基纤维素钠(CMC-Na)作为助溶剂并进行研磨,将溪黄草甲素配制成质量浓度为2.5、5.0 mg/mL 的混悬液,将地塞米松配制成质量浓度为0.25 mg/mL 的混悬液。各给药组ig 相应药物(20 mL/kg),对照组和模型组ig 0.5% CMC-Na,1 次/d,连续2 d。LPS溶于0.9%氯化钠溶液配制成质量浓度为1 mg/mL的溶液,末次给药1 h 后,模型组和各给药组ip LPS(10 mL/kg)刺激6 h 建立急性炎性小鼠模型,对照组ip 等体积0.9%氯化钠溶液。
2.2 溪黄草甲素对LPS 诱导的急性炎性小鼠模型血清中TNF-α 和IL-6 水平的影响
各组小鼠眼眶取血后,ip 戊巴比妥钠处死,分离并得到血清,按ELISA 试剂盒说明书测定血清中TNF-α 和IL-6 水平。
2.3 细胞培养
RAW264.7细胞用含10%胎牛血清的DMEM高糖培养基,于37 ℃、5% CO2培养箱中培养,当细胞融合度达到50%时,采用一次性细胞刮刀进行脱壁并传代,待细胞透明、边界清晰后进行实验。
2.4 溪黄草甲素对RAW264.7 细胞存活率的影响
RAW264.7 细胞以2.5×105/mL 接种于96 孔板中,于培养箱中培养。设置对照组、溪黄草甲素(0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 μmol/L)组,溪黄草甲素溶于DMSO,配制成25 mmol/L 的母液,使用时以培养基稀释至相应浓度。各给药组加入相应药物,对照组加入不含药物的培养基,培养24 h;每孔加入50 μL XTT,培养4 h,振荡30 s,采用酶标仪测定492、690 nm 处的吸光度(A)值,计算细胞存活率。
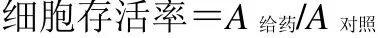
2.5 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中NO 水平的影响
RAW264.7 细胞以5×105/mL 接种于96 孔板中,于培养箱中培养。设置对照组、模型组、溪黄草甲素(0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 μmol/L)组。各给药组加入溪黄草甲素预处理30 min,模型组和各给药组再加入LPS(0.5 μg/mL)刺激24 h,对照组加入不含药物的培养基。采用Griess 法检测细胞上清液中NO 水平。
2.6 溪黄草甲素对LPS 诱导的RAW264.7 细胞iNOS 蛋白表达的影响
RAW264.7 细胞以5×105/mL 接种于100 mm细胞培养皿中,于培养箱中培养。设置对照组、模型组、溪黄草甲素(1.25、2.50、5.00 μmol/L)组。按“2.5”项下方法进行处理,收集细胞,加入RIPA裂解液提取细胞总蛋白,采用BCA 蛋白定量试剂盒测定蛋白质量浓度,于95 ℃水浴加热10 min 使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5%脱脂牛奶室温封闭1 h,分别加入iNOS、GAPDH 抗体,4 ℃孵育过夜;TBST 洗涤5 次,5 min/次,加入HRP 标记的山羊抗兔IgE 抗体,室温孵育1 h,TBST 洗涤后,加入ECL 发光液显影,采用Image J 分析条带灰度值。
2.7 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中TNF-α 和IL-6 水平的影响
RAW264.7 细胞以5×105/mL 接种于96 孔板中,于培养箱中培养。按“2.6”项下方法进行分组和处理,收集细胞上清液,按试剂盒说明书测定细胞上清液中TNF-α 和IL-6 水平。
2.8 溪黄草甲素对LPS诱导的RAW264.7细胞JAK2、p-JAK2、STAT3 和p-STAT3 蛋白表达的影响
RAW264.7 细胞以5×105/mL 接种于100 mm细胞培养皿中,于培养箱中培养。按“2.6”项下方法进行分组,各给药组加入溪黄草甲素预处理30 min,模型组和各给药组再加入LPS(0.5 μg/mL)刺激4 h,对照组加入不含药物的培养基。收集细胞,按“2.6”项下方法检测细胞JAK2、p-JAK2、STAT3和p-STAT3 蛋白表达情况。
做好基建工程项目档案资料管理工作,可以为工程的各环节提供真实可靠数据,使工程项目顺利完成。在开展基建工程项目中,对档案资料进行科学化管理和监控,做好基建档案管理是一项必不可少的工作。
2.9 溪黄草甲素对IL-6 诱导的RAW264.7 细胞STAT3 和p-STAT3 蛋白表达的影响
RAW264.7 细胞以5×105/mL 接种于100 mm细胞培养皿中,于培养箱中培养。按“2.6”项下方法进行分组,各给药组加入溪黄草甲素预处理30 min,模型组和各给药组再加入IL-6(3 ng/mL)刺激30 min,对照组加入不含药物的培养基。收集细胞,按“2.6”项下方法检测细胞STAT3 和p-STAT3蛋白表达情况。
2.10 溪黄草甲素对LPS 诱导RAW264.7 细胞不同时间后的上清液中IL-6 水平的影响
RAW264.7 细胞以5×105/mL 接种于96 孔板中,于培养箱中培养。设置模型组和溪黄草甲素(5 μmol/L)组,给药组加入溪黄草甲素预处理30 min,模型组和给药组再加入LPS(0.5 μg/mL)分别刺激1、2、3、4、6、8、12、16、24 h,收集细胞上清液,按ELISA 试剂盒说明书测定各时间点细胞上清液中IL-6 水平。
2.11 溪黄草甲素对LPS 诱导的RAW264.7 细胞NF-κB 与MAPK 信号通路相关蛋白表达的影响
RAW264.7 细胞以5×105/mL 接种于100 mm细胞培养皿中,于培养箱中培养。按“2.6”项下方法进行分组,各给药组加入溪黄草甲素预处理30 min,模型组和各给药组再加入LPS(0.5 μg/mL)刺激30 min,对照组加入不含药物的培养基。收集细胞,加入RIPA 裂解液提取细胞总蛋白,或采用细胞核蛋白与细胞质蛋白抽提试剂提取细胞核与胞质蛋白,按“2.6”项下方法检测细胞p-IκBα、p65、p-JNK、p-ERK1/2、p-p38 蛋白表达情况。
2.12 统计学分析
数据以±s表示,使用GraphPad Prism 6.0 软件进行统计,采用单因素方差分析和t检验进行差异比较。
3 结果
3.1 溪黄草甲素对LPS 诱导的急性炎性小鼠模型血清中TNF-α 和IL-6 水平的影响
如图1 所示,与对照组比较,模型组小鼠血清中TNF-α 和IL-6 水平显著升高(P<0.001);与模型组比较,各给药组血清中TNF-α 水平显著降低(P<0.05、0.001),溪黄草甲素(100 mg/kg)组和地塞米松组血清中IL-6 水平显著降低(P<0.01、0.001),表明溪黄草甲素对LPS 诱导的小鼠急性炎性反应具有抑制作用。

图1 溪黄草甲素对LPS 诱导的急性炎性小鼠模型血清中TNF-α 和IL-6 水平的影响 ( ± s, n = 9)Fig.1 Effect of rabdoserrin A on TNF-α and IL-6 levels in serum of acute inflammation mice model induced by LPS ( ± s, n = 9)
3.2 溪黄草甲素对RAW264.7 细胞存活率的影响
如图2 所示,与对照组比较,各剂量溪黄草甲素对RAW264.7 细胞存活率均无显著影响。
3.3 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中NO 水平的影响
如图3 所示,与对照组比较,模型组细胞上清液中NO 水平显著升高(P<0.001);与模型组比较,溪黄草甲素(0.625 0、1.250 0、2.500 0、5.000 0 μmol/L)组细胞上清液中NO 水平显著降低(P<0.05、0.001),呈剂量相关性,其半数抑制浓度(50% concentration of inhibition,IC50)值为2.68 μmol/L。 因此,选取1.25、2.50、5.00 μmol/L 3 个浓度展开后续实验。
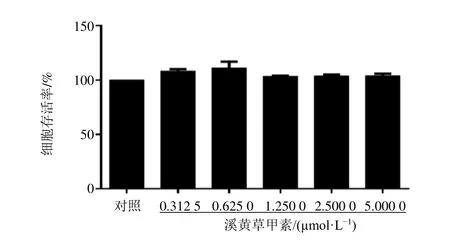
图 2 溪黄草甲素对 RAW264.7 细胞存活率的影响 ( ± s , n=3)Fig.2 Effect of rabdoserrin A on survival rate of RAW264.7 cells ( ± s , n=3)
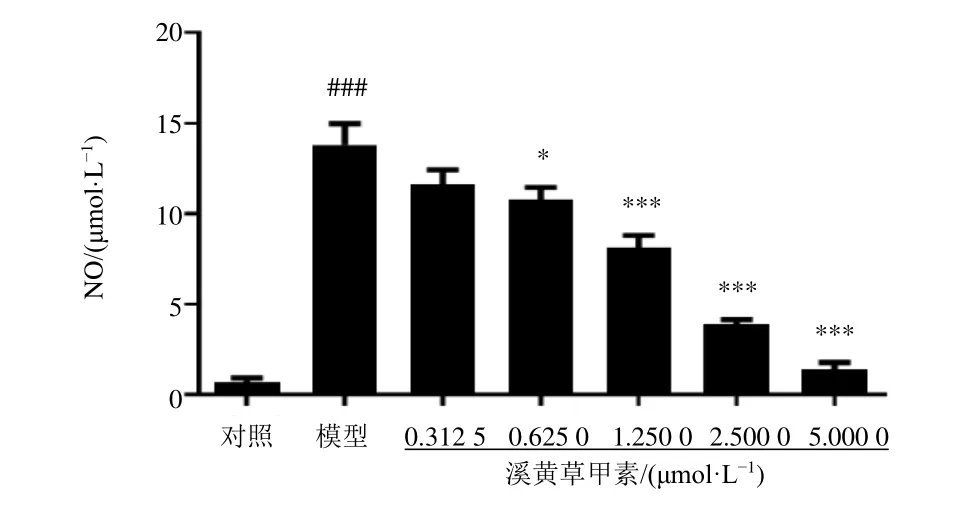
图3 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中NO 水平的影响 ( ± s , n=3)Fig.3 Effect of rabdoserrin A on NO level in supernatant of RAW264.7 cells induced by LPS ( ± s , n=3)
3.4 溪黄草甲素对LPS 诱导的RAW264.7 细胞iNOS 蛋白表达的影响
如图4 所示,与对照组比较,模型组细胞iNOS蛋白表达水平显著升高(P<0.001);与模型组比较,溪黄草甲素(2.50、5.00 μmol/L)组细胞iNOS 蛋白表达水平显著降低(P<0.05、0.01)。

图4 溪黄草甲素对LPS 诱导的RAW264.7 细胞iNOS 蛋白表达的影响 ( ± s , n=3)Fig.4 Effect of rabdoserrin A on iNOS expression of RAW264.7 cells induced by LPS ( ± s , n=3)
3.5 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中TNF-α 和IL-6 水平的影响
如图5 所示,与对照组比较,模型组细胞上清液中TNF-α 和IL-6 水平显著升高(P<0.001);与模型组比较,各剂量溪黄草甲素组上清液中IL-6 水平显著降低(P<0.001),溪黄草甲素(2.50、5.00 μmol/L)组上清液中TNF-α 水平显著降低(P<0.05、 0.01),且呈剂量相关性,表明溪黄草甲素能够抑制LPS 诱导的RAW264.7 细胞的炎性反应。
图5 溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中TNF-α 和IL-6 水平的影响 ( ± s , n=3)Fig.5 Effect of rabdoserrin A on TNF-α and IL-6 levels of RAW264.7 cells induced by LPS ( ± s , n=3)
3.6 溪黄草甲素对LPS诱导的RAW264.7细胞JAK2、p-JAK2、STAT3 和p-STAT3 蛋白表达的影响
如图6 所示,与对照组比较,模型组p-JAK2、p-STAT3 蛋白表达水平均显著升高(P<0.01、0.001);与模型组比较,各剂量溪黄草甲素组p-STAT3 蛋白表达水平显著降低(P<0.05、0.01、0.001),溪黄草甲素(2.50、5.00 μmol/L)组p-JAK2蛋白表达水平显著降低(P<0.05、0.01),且呈剂量相关性。

图6 溪黄草甲素对LPS 诱导的RAW264.7 细胞JAK2、p-JAK2、STAT3 和p-STAT3 蛋白表达的影响 ( ± s , n=3)Fig.6 Effect of rabdoserrin A on expressions of JAK2, p-JAK2, STAT3 and p-STAT3 of RAW264.7 cells induced by LPS ( ± s , n=3)
3.7 溪黄草甲素对IL-6 诱导的RAW264.7 细胞STAT3 和p-STAT3 蛋白表达的影响
JAK2/STAT3 的激活可以促进IL-6 的产生,IL-6能够与胞膜上的受体结合,进一步激活JAK2/ STAT3 信号通路。如图7 所示,与对照组比较,模型组p-STAT3 蛋白表达水平显著升高(P<0.001);与模型组比较,溪黄草甲素(2.50、5.00 μmol/L)组p-STAT3 蛋白表达水平显著降低(P<0.001),且呈剂量相关性。

图7 溪黄草甲素对IL-6 诱导的RAW264.7 细胞STAT3 和p-STAT3 蛋白表达的影响 ( ± s , n=3)Fig.7 Effect of rabdoserrin A on expressions of STAT3 and p-STAT3 of RAW264.7 cells induced by IL-6 ( ± s , n=3)
3.8 溪黄草甲素对LPS 诱导RAW264.7 细胞不同时间后的上清液中IL-6 水平的影响
如图8 所示,LPS 诱导RAW264.7 细胞4 h 时,IL-6 未显著释放,而溪黄草甲素已经能够显著抑制p-JAK2、p-STAT3 蛋白表达水平,表明LPS 诱导RAW264.7 细胞4 h,溪黄草甲素对JAK2/STAT3 的下调与IL-6 分泌无关。
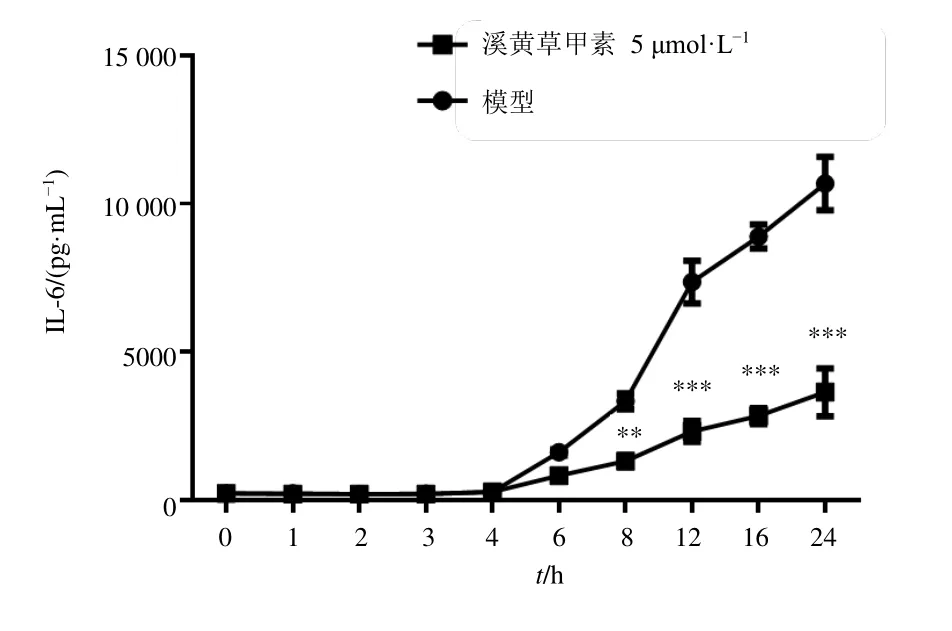
图8 溪黄草甲素对LPS 诱导RAW264.7 细胞不同时间后的上清液中IL-6 水平的影响 ( ± s , n=3)Fig.8 Effect of rabdoserrin A on IL-6 level of RAW264.7 cells induced by LPS for different time ( ± s , n=3)
3.9 溪黄草甲素对LPS 诱导的RAW264.7 细胞NF-κB 与MAPK 信号通路相关蛋白表达的影响
如图9、10 所示,LPS 诱导RAW264.7 细胞30 min 时,与对照组比较,模型组p-IκBα、胞核p65、p-JNK、p-ERK1/2、p-p38 蛋白表达水平均显著升高(P<0.001);与模型组比较,各给药组对NF-κB 与MAPK 信号通路相关蛋白表达水平无明显影响。
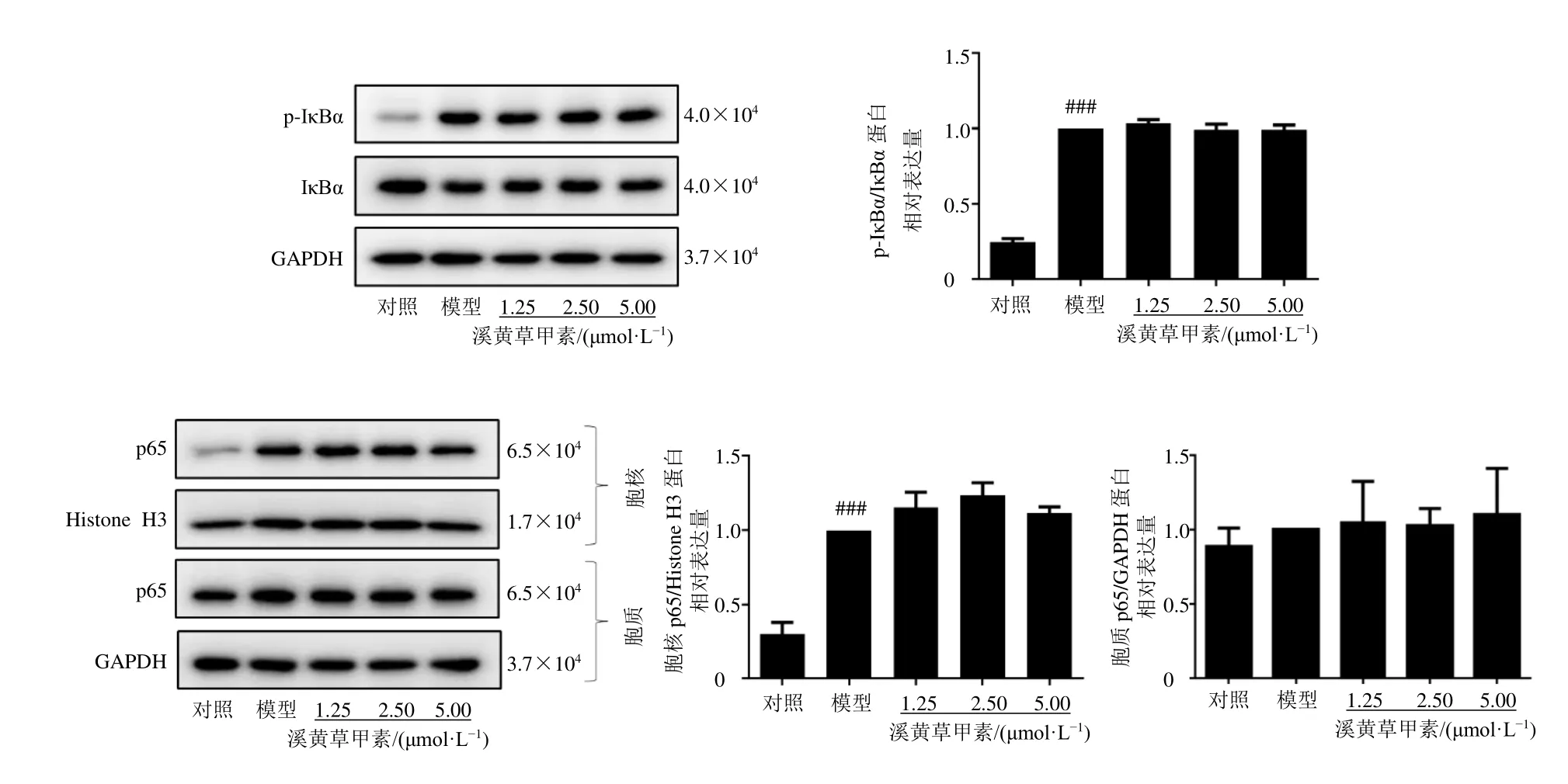
图9 溪黄草甲素对LPS 诱导的RAW264.7 细胞NF-κB 信号通路相关蛋白表达的影响 ( ± s , n=3)Fig.9 Effect of rabdoserrin A on NF-κB signaling pathway related protein expressions of RAW264.7 cells induced by LPS( ± s , n=3)
4 讨论
巨噬细胞在炎性反应的发展中发挥着重要的作用[11]。LPS 可以促使巨噬细胞分泌NO、TNF-α、IL-6等多种促炎介质,引起炎性反应的发生与发展[12]。本研究结果显示,0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 μmol/L 溪黄草甲素对RAW264.7 细胞的活力无明显抑制作用,溪黄草甲素对LPS 诱导的RAW264.7 细胞上清液中NO 水平的IC50值为2.68 μmol/L。因此,后续选择1.25、2.50、5.00 μmol/L进行研究。溪黄草甲素显著抑制 LPS 诱导的RAW264.7 细胞中NO 合成关键酶(iNOS)[13]蛋白表达水平。TNF-α 和IL-6 是2 种重要的促炎细胞因子,LPS 可以诱导其大量分泌,而溪黄草甲素可以显著抑制二者的产生,在LPS 诱导的急性炎性小鼠 体内,溪黄草甲素也具有同样的抑制作用。以上结果表明溪黄草甲素具有良好的抗炎作用,提示溪黄草甲素是溪黄草发挥抗炎作用的物质基础之一。
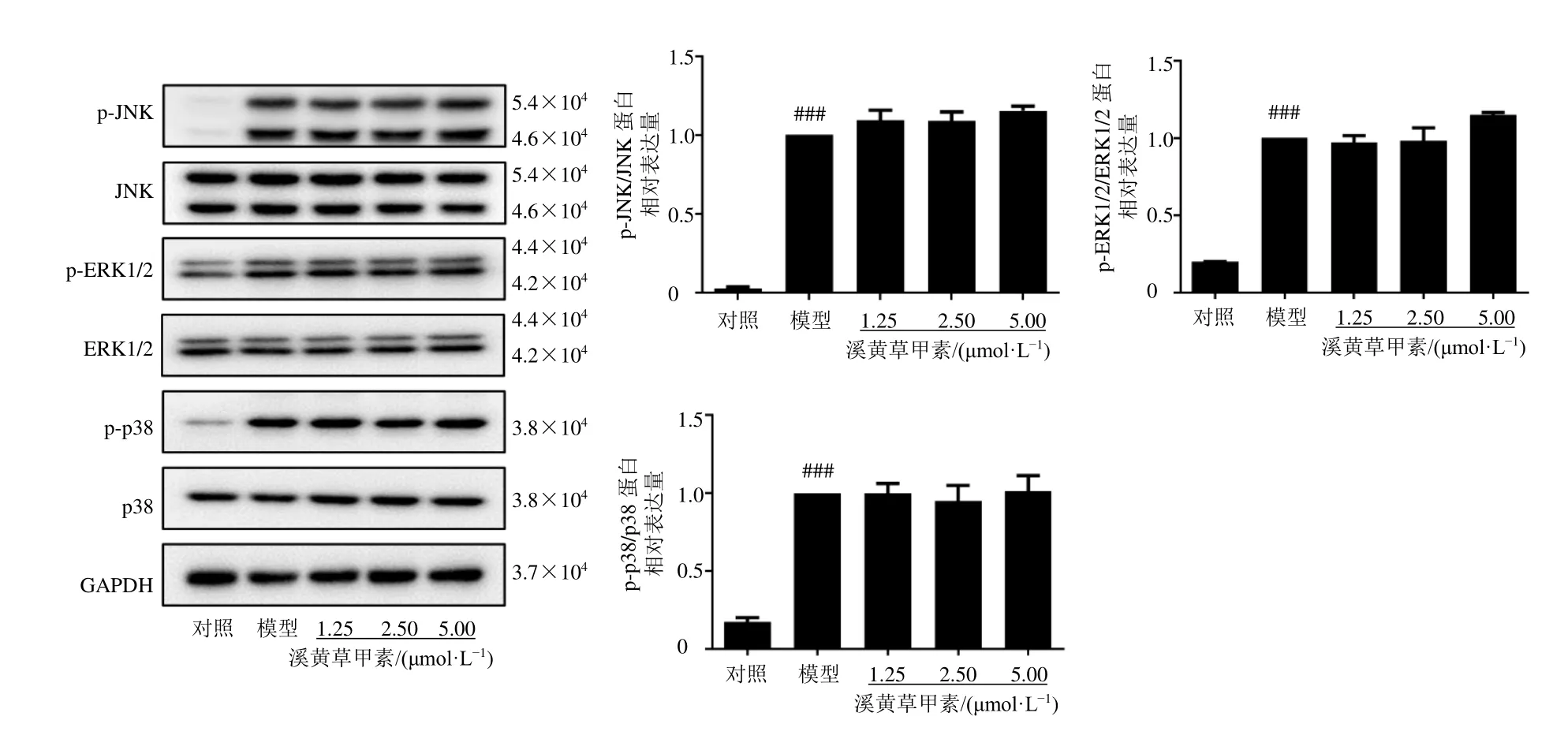
图10 溪黄草甲素对LPS 诱导的RAW264.7 细胞MAPK 信号通路相关蛋白表达的影响 ( ± s , n=3)Fig.10 Effect of rabdoserrin A on MAPK signaling pathway related protein expressions of RAW264.7 cells induced by LPS ( ± s , n=3)
STAT3 是一种关键调节因子,在炎性反应中发挥着重要的作用[14]。JAK2/STAT3 信号的激活由IL-6 识别细胞膜表面受体并与之结合,诱导gp130形成同源二聚体,进一步激活JAK,激活后的JAK会使gp130 胞内结构域上的酪氨酸残基磷酸化,从而招募STAT3,这种激酶级联使STAT3 磷酸化后形成二聚体并转移到细胞核,进而调控炎性细胞因子的表达,促进IL-6 等炎性因子分泌至胞外[15]。溪黄草甲素显著抑制RAW264.7 细胞p-JAK2、p-STAT3蛋白表达水平,表明溪黄草甲素可能通过JAK2/ STAT3 途径发挥抗炎作用。IL-6 可以介导JAK2/ STAT3 的激活[16-17],本研究采用IL-6 作为刺激剂对RAW264.7 细胞进行诱导,发现溪黄草甲素显著抑制IL-6 诱导的RAW264.7 细胞中p-STAT3 蛋白表达水平。STAT3 的磷酸化可以调控LPS 诱导的巨噬细胞中IL-6 的产生[18],而IL-6 又可以通过gp130/JAK/ STAT 途径调节p-STAT3 蛋白表达[17]。为了确定溪黄草甲素对p-STAT3蛋白表达与IL-6分泌抑制作用的先后关系,本研究通过检测LPS 刺激RAW264.7细胞不同时间的 IL-6 分泌,发现 LPS 刺激RAW264.7 细胞4 h 时,IL-6 还未显著释放,但此时溪黄草甲素已经显著抑制p-STAT3 蛋白表达水平,表明溪黄草甲素通过抑制JAK2/STAT3/IL-6 信号通路,从而发挥抗炎作用。
综上所述,本研究发现溪黄草甲素能够抑制LPS 诱导的体内外炎性反应,其作用机制与抑制JAK2/STAT3 信号通路有关。
利益冲突所有作者均声明不存在利益冲突
