pH响应三氧化二砷聚乳酸-羟基乙酸共聚物纳米粒的制备及体外评价
2021-08-05吴仁杰余红芳颜星星诸佳珍谢晓伟姚文栋
吴仁杰,余红芳,颜星星,范 婷,诸佳珍,谢晓伟,施 政*,姚文栋*
1.浙江中医药大学附属第一医院 药剂科,浙江 杭州 310018
2.浙江中医药大学药学院,浙江 杭州 311400
砒霜在我国拥有悠久的应用历史,其主要成分为三氧化二砷(arsenic trioxide,ATO)。20 世纪70年代,黑龙江中医药大学将ATO 用于急性早幼粒细胞白血病的治疗,并取得了显著的疗效[1]。随着ATO的使用,经研究发现其对于肝癌、乳腺癌等多种实体瘤也存在抑制生长和诱导凋亡的作用[2-3]。ATO能够影响细胞周期,抑制肿瘤细胞增殖与转移,还能够通过影响线粒体功能诱导肿瘤细胞凋亡[3]。但ATO 进入人体后,血浆结合率高,代谢消除快,无特异性分布等缺陷导致的诸多不良反应限制了其对于实体瘤的临床应用[4]。因此,通过相关生物学及制剂技术提高ATO 在体内的稳定性,延长作用时间,使其具有靶向性、肿瘤环境响应给药特性[5],这对ATO 应用于肿瘤的治疗具有重要意义。
乳酸-羟基乙酸共聚物(polylactic-co-glyconlic acid,PLGA)由乳酸和羟基乙酸缩合而成,被人体吸收后可正常代谢,对生物体无毒副作用,是美国食品药品监督管理局( Food and Drug Administration,FDA)批准的可安全使用的药用高分子材料[6]。PLGA 具有良好的生物相容性和可降解性,形成纳米粒或微球后可应用于药物的包埋荷载,提高包载药物体内稳定性[7]。PLGA 纳米粒具备靶向性及缓控释特性,使包载药物特异性分布且延长其作用时间[8-9]。并且,PLGA 可经修饰或添加针对肿瘤微环境刺激性响应因子,如NaHCO3,而制备成pH 响应PLGA 纳米粒(pH-PLGA)[10]。
PLGA 纳米粒的上述特性使之成为ATO的理想载体。因此,本研究以NaHCO3为pH 响应因子制备了pH 响应的载三氧化二砷PLGA 纳米粒(pH- ATO-PLGA@NPs),并对其粒径、多分散系数(PDI)、稳定性、体外释放及对人源性肝癌HepG2细胞的毒性进行考察。
1 仪器与材料
Nano-ZS 90 激光粒度分析仪,英国Malvern 仪器有限公司;HT7700 透射电子显微镜(TEM),日本日立公司;Optima Max 超速低温离心机,美国Beckman Coulter 有限公司;JY92-IIN 超声波粉粹仪,宁波新芝生物科技股份有限公司;细胞培养箱,美国Thermo 公司;SpectraMax M2 酶标仪,美国Molecular Devices 公司;ICAP 6300 电感耦合等离子发射光谱仪,美国Thermo 公司;R205D 旋转蒸发仪,上海申胜生物技术有限公司;ZD-85 恒温水浴震荡器,力辰科技有限公司。
PLGA,批号93671849,相对分子质量20 000,6∶4,济南岱罡生物工程有限公司;1,3-双硬脂酸甘油酯,玛雅试剂有限公司,批号MAYA-CR-784;二氯甲烷,麦克林试剂,批号C10167809;ATO,苏州诺德派森公司,批号20151005,质量分数97%;NaHCO3,Aladdin 公司,批号J1916092;砷标准溶液(1 mg/mL,国家有色金属及电子材料分析测试中心,货号GSB04-1714-2004);胎牛血清,杭州四季青公司,批号18110504;司盘-80,Aladdin 公司,批号38771;聚乙烯醇,美国Sigma Aldrich 公司,批号1002287571,其余试剂均为分析纯。HepG2细胞由浙江中医药大学动物实验中心提供。
2 方法与结果
2.1 pH-PLGA 纳米粒(pH-PLGA@NPs)的制备及处方工艺优化
2.1.1 pH-PLGA@NPs 的制备方法 本研究采用复乳溶剂蒸发法[11]制备纳米粒。称取适量PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg及1.0 mL 司盘-80 溶解作为油相;取NaHCO3水溶液作为内水相于离心管,加入油相后于超声波粉粹仪下超声15 min。在超声后所得初乳中加入表面活性剂聚乙烯醇(PVA)的水溶液,再超声得到复乳。复乳至圆底烧瓶40 ℃水浴旋悬蒸10 min 后,于40 ℃水浴搅拌4 h,挥干有机溶剂,即得pH- PLGA@NPs。
以pH-PLGA@NPs 的粒径及多分散系数(PDI)为指标,考察PLGA 用量、超声功率、表面活性剂浓度、NaHCO3质量浓度对纳米粒的影响。
2.1.2 PLGA 用量 根据“2.1.1”项下所述方法,分别称取50、100、150、200、250 mg PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg及1.0 mL 司盘-80 溶解作为油相,采用180 W 超声功率,0.2% PVA 溶液,2.5 mg/mL NaHCO3溶液进行后续操作,制备pH-PLGA@NPs,并分别对所得纳米粒的粒径及PDI 进行检测,结果见表1。为方便后续载药及生物学研究[7],综合纳米粒粒径及PDI 结果,选取200 mg PLGA 投料量进行纳米粒的制备。
表1 不同PLGA 投料量对pH-PLGA@NPs 粒径及PDI 的影响 ( ± s, n = 3)Table 1 Effects of PLGA with different dosages on size and PDI of pH-PLGA@NPs ( ± s, n = 3)

表1 不同PLGA 投料量对pH-PLGA@NPs 粒径及PDI 的影响 ( ± s, n = 3)Table 1 Effects of PLGA with different dosages on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
PLGA/mg 粒径/nm PDI 50 272.38±8.34 0.42±0.07 100 253.76±4.54 0.36±0.07 150 238.26±3.42 0.27±0.05 200 226.61±2.14 0.22±0.02 250 232.54±4.43 0.24±0.02
2.1.3 超声功率 根据“2.1.1”项下所述方法,称取200 mg PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg 及1.0 mL 司盘-80 溶解作为油相。选取0、90、180、270、360 W 超声功率进行超声,采用0.2% PVA 溶液,2.5 mg/mL NaHCO3溶液并进行后续操作,制备pH-PLGA@NPs,并分别对所得纳米粒的粒径及PDI 进行检测,结果见表2。综合粒径与PDI 结果,选取180 W 超声制备pH-PLGA@NPs。
表2 不同超声功率对pH-PLGA@NPs 粒径及PDI 的影响( ± s, n = 3)Table 2 Effect of different ultrasonic power on size and PDI of pH-PLGA@NPs ( ± s, n = 3)

表2 不同超声功率对pH-PLGA@NPs 粒径及PDI 的影响( ± s, n = 3)Table 2 Effect of different ultrasonic power on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
功率/W 粒径/nm PDI 0 896.55±28.52 0.76±0.08 90 428.82±6.38 0.34±0.04 180 224.39±2.52 0.22±0.02 270 234.38±3.65 0.28±0.02 360 239.43±3.26 0.29±0.03
2.1.4 表面活性剂浓度 分别称取0.20、0.40、0.60、0.80、1.00 g PVA 水浴加热溶于100 mL 纯水中得0.2%、0.4%、0.6%、0.8%、1.0% PVA 溶液。根据“2.1.1”项下所述方法,称取200 mg PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg及1.0 mL 司盘-80 溶解作为油相,在180 W 下超声。分别加入0.2%、0.4%、0.6%、0.8%、1.0% PVA 溶液,采用2.5 mg/mL NaHCO3溶液并进行后续操作,制备pH-PLGA@NPs,并分别对所得纳米粒的粒径及PDI 进行检测,结果见表3。0.2%、0.4%浓度的PVA 溶液所制备的pH-PLGA@NPs 粒径无显著性差异(P>0.05),但0.4%浓度下的PDI 更小,故而选取0.4%浓度的PVA 溶液作为表面活性剂制备pH-PLGA@NPs。
表3 不同表面活性剂浓度对pH-PLGA@NPs 粒径及PDI的影响 ( ± s, n = 3)Table 3 Effects of different surfactant concentrations on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
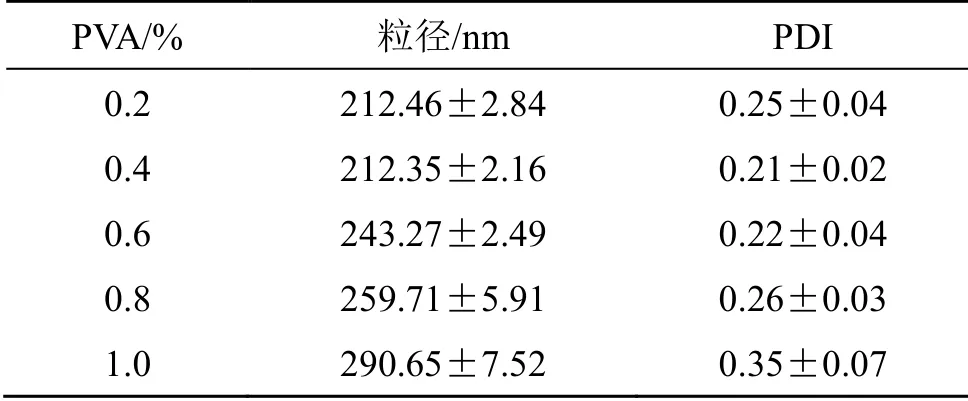
表3 不同表面活性剂浓度对pH-PLGA@NPs 粒径及PDI的影响 ( ± s, n = 3)Table 3 Effects of different surfactant concentrations on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
PVA/% 粒径/nm PDI 0.2 212.46±2.84 0.25±0.04 0.4 212.35±2.16 0.21±0.02 0.6 243.27±2.49 0.22±0.04 0.8 259.71±5.91 0.26±0.03 1.0 290.65±7.52 0.35±0.07
2.1.5 NaHCO3质量浓度 根据“2.1.1”项下所述方法,称取200 mg PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg 及1.0 mL 司盘-80溶解作为油相,在180 W 下超声,加入0.4% PVA溶液。内水相分别为1.0(pH 8.39)、2.5(pH 8.39)、5.0(pH 8.40)、7.5(pH 8.42)、10.0(pH 8.44)mg/mL NaHCO3溶液,并进行后续操作,制备pH-PLGA@ NPs,并分别对所得pH-PLGA@NPs 的粒径及PDI进行检测,结果如表4 所示。综合粒径与PDI 结果,选取2.5 mg/mL NaHCO3溶液为内水相制备pH- PLGA@NPs。
表4 不同NaHCO3 质量浓度对pH-PLGA@NPs 粒径及PDI 的影响 ( ± s, n = 3)Table 4 Effects of different NaHCO3 concentrations on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
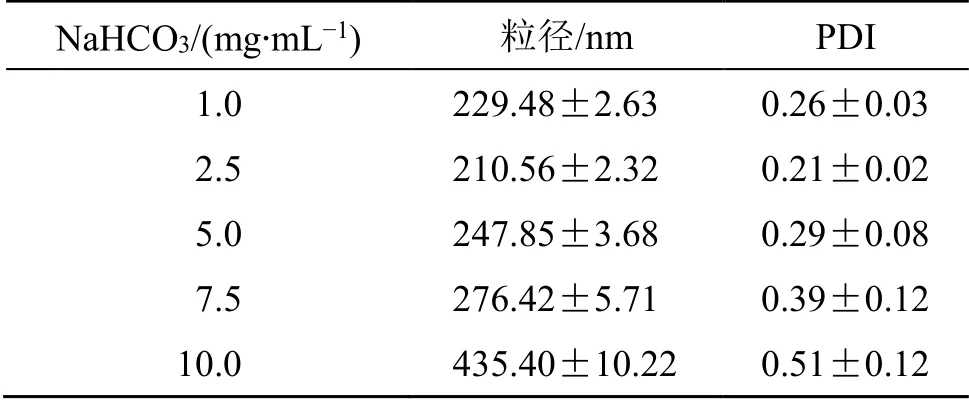
表4 不同NaHCO3 质量浓度对pH-PLGA@NPs 粒径及PDI 的影响 ( ± s, n = 3)Table 4 Effects of different NaHCO3 concentrations on size and PDI of pH-PLGA@NPs ( ± s, n = 3)
NaHCO3/(mg·mL−1) 粒径/nm PDI 1.0 229.48±2.63 0.26±0.03 2.5 210.56±2.32 0.21±0.02 5.0 247.85±3.68 0.29±0.08 7.5 276.42±5.71 0.39±0.12 10.0 435.40±10.22 0.51±0.12
2.1.6 pH-PLGA@NPs 制备方法优化结果 综合PLGA 用量、超声功率、表面活性剂浓度及NaHCO3质量浓度考察结果,得到pH-PLGA@NPs 最终制备方案:称取200 mg PLGA 溶于10 mL 二氯甲烷,加入1,3-双硬脂酸甘油酯60 mg 及1.0 mL 司盘-80溶解作为油相;取2.5 mg/mL NaHCO3溶液0.5 mL作为水相于离心管,加入2.5 mL 油相后于超声波粉碎仪下以180 W 功率超声10 min,形成初乳。所得初乳中加入0.4%聚乙烯醇PVA 水溶液8 mL 后,180 W 功率超声波粉粹仪下超声10 min,得到复乳。取复乳至圆底烧瓶悬旋蒸10 min 后,于40 ℃水浴搅拌4 h,挥干有机溶剂。将成品于10 000 r/min 高速离心10 min,去上清,减压干燥得pH-PLGA@NPs。
2.2 pH-ATO-PLGA、PLGA、ATO-PLGA 纳米粒( pH-ATO-PLGA@NPs 、 PLGA@NPs 、 ATO- PLGA@NPs)的制备
内水相加入0.5 mL 10 mg/mL ATO 溶液,油相按“2.1.6”项下所述方法制备,后续步骤相同。挥干有机溶剂后,将pH-ATO-PLGA@NPs 的溶液移至透析袋中,在500 mL 外液环境中透析6 h(100 r/min)除去未包载的游离ATO,得到pH-ATO- PLGA@NPs。制备过程中不加入NaHCO3溶液重复“2.1.6”项后续步骤,得到普通的PLGA@NPs。无pH 响应的普通PLGA@NPs,重复“2.1.6”项后续步骤负载ATO,得到ATO-PLGA@NPs。
2.3 pH-ATO-PLGA@NPs 的表征
2.3.1 粒径、Zeta 电位及形态 通过Nano-ZS 90激光粒度分析仪测定PLGA@NPs、pH-PLGA@ NPs、ATO-PLGA@NPs、pH-ATO-PLGA@NPs 的粒径、PDI 及Zeta 电位;采用HT7700 透射电子显微镜观察pH-ATO-PLGA@NPs 的形态。
复乳溶剂蒸发法制备所得PLGA@NPs、pH- PLGA@NPs、ATO-PLGA@NPs 及pH-ATO-PLGA@ NPs 的粒径见表5,PLGA@NPs 的粒径、PDI 及Zeta电位分别为(206.18±1.83)nm、0.20±0.02、 (−22.26±1.43)mV。载药后,纳米粒的粒径和PDI均有所增大,变为(212.54±2.04)nm 及0.24±0.03,Zeta 电位下降至(−23.46±1.96)mV。pH 响应因子加入后,pH-PLGA@NPs 粒径较PLGA@NPs 略有增加,Zeta 电位却显著下降至(−32.75±1.81)mV。pH-ATO-PLGA@NPs 兼具载药及pH 响应功能,粒径增大至(214.35±1.86)nm,Zeta 电位下降至(−35.49±1.88)mV。
表5 PLGA@NPs、pH-PLGA@NPs、ATO-PLGA@NPs与pH-ATO-PLGA@NPs 的粒径、PDI、电位 ( ± s, n = 3)Table 5 Particle size, PDI, Zeta potential of PLGA@NPs, pH-PLGA@NPs, ATO-PLGA@NPs and pH-ATO-PLGA@ NPs ( ± s, n = 3)

表5 PLGA@NPs、pH-PLGA@NPs、ATO-PLGA@NPs与pH-ATO-PLGA@NPs 的粒径、PDI、电位 ( ± s, n = 3)Table 5 Particle size, PDI, Zeta potential of PLGA@NPs, pH-PLGA@NPs, ATO-PLGA@NPs and pH-ATO-PLGA@ NPs ( ± s, n = 3)
样品 粒径/nm PDI Zeta 电位/mV PLGA@NPs 206.18±1.53 0.20±0.02 −22.26±1.43 pH-PLGA@NPs 210.43±1.68 0.21±0.02 −32.75±1.81 ATO-PLGA@NPs 212.54±2.04 0.24±0.03 −23.46±1.96 pH-ATO-PLGA@NPs 214.35±1.86 0.24±0.02 −35.49±1.88
TEM 结果(图1)显示,pH-ATO-PLGA@NPs形态规整,呈圆整球形或类球形,分散性良好,无团聚现象,但TEM 下粒径比粒径仪测得的小20 nm左右。

图1 pH-ATO-PLGA@NPs 的TEM 图Fig.1 TEM of pH-ATO-PLGA@NPs
2.3.2 包封率和载药量 取ATO-PLGA@NPs 与pH-ATO-PLGA@NPs 制备过程中透析6 h 后的透析外液,用已建立的电感耦合等离子发射光谱仪测定其砷质量浓度[12],通过质量浓度及质量分数换算得到游离ATO 的质量,记作W1;将收集得到的纳米粒质量,记作Wt;按以下公式分别计算ATO 的包封率和载药量。

W0为ATO 总投药量,W1为ATO-PLGA@NPs 或pH-ATO- PLGA@NPs 中的游离药物量,Wt为ATO-PLGA@NPs 或pH-ATO-PLGA@NPs 的总质量
通过对透析外液测定结果,计算得到ATO- PLGA@NPs 的包封率为(68.76±2.92)%,载药量为(1.84±0.42)%;而pH-ATO-PLGA@NPs 的包封率为(62.32±2.61)%,载药量为(1.59±0.34)%,ATO-PLGA@NPs 的包封率与载药量均略高于pH-ATO-PLGA@NPs。
2.3.3 稳定性 将制备好的 PLGA@NPs、pH- PLGA@NPs、ATO-PLGA@NPs 及pH-ATO-PLGA@ NPs 分散于超纯水中,于4 ℃环境放置,分别测定其0、1、3、5、7 d 粒径及Zeta 电位的变化。
粒径变化结果见图2-A,纳米粒粒径均随着放置时间延长而逐渐减小。到第7 天,PLGA@NPs下降至(195.31±2.94)nm,粒径下降了约11 nm;pH-PLGA@NPs 下降至(192.68±3.02)nm,粒径下降了约17 nm;ATO-PLGA@NPs 下降至(197.62±2.64)nm,较初始粒径下降了约15 nm;pH-ATO- PLGA@NPs 下降至(187.74±3.14)nm,较初始粒径下降幅度最大,约为27 nm。
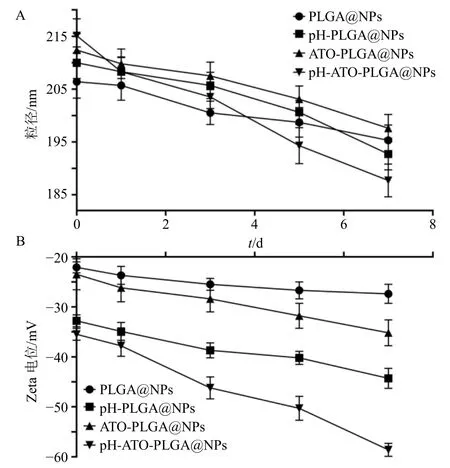
图2 PLGA@NPs、pH-PLGA@NPs、ATO-PLGA@NPs与pH-ATO-PLGA@NPs 在4 ℃环境冷藏的稳定性粒径 (A) 及Zeta 电位 (B) 变化 ( ± s, n = 3)Fig 2 Stability changes in particle size (A) and Zeta potential (B) of PLGA@NPs, pH-PLGA@NPs, ATO- PLGA@NPs and pH-ATO-PLGA@NPs in cold storage at 4 ℃ ( ± s, n = 3)
电位变化结果见图2-B,纳米粒电位均随着放置时间延长而逐渐减小。到第7 天,PLGA@NPs电位下降至(−27.41±1.89)mV,下降幅度最小;pH-PLGA@NPs 电位下降至(−44.92±1.98)mV,较初始电位下降了约12 mV;ATO-PLGA@NPs 电位下降至(−35.22±2.63)mV,较初始电位下降了约 10 mV;pH-ATO-PLGA@NPs 电位下降至 (−59.58±1.39)mV,较初始电位下降了约23 mV,下降幅度最大。
结果表明,加入pH 响应因子及载药后,纳米粒的稳定性较PLGA@NPs 略有下降。
2.4 体外释放
采用透析袋法测定ATO、ATO-PLGA@NPs 与pH-ATO-PLGA@NPs 的体外释药特性。精密称取ATO、ATO-PLGA@NPs 和pH-ATO-PLGA@NPs 并适量分散溶解后,分别取2 mL(含ATO 2 mg)置于透析袋中,密封后分别放入pH 值分别为7.4、6.5、5.5 的500 mL 磷酸盐缓冲溶液(PBS)为释放介质的烧杯中,然后置于37 ℃、100 r/min 恒温水浴震荡器中,避光,平行操作3 份。于0、0.25、0.5、1、2、4、6、8、12、24 h 时间点吸取1.0 mL 的透析液,并补充同温等量释放介质。样品用0.22 μm 微孔滤膜滤过后,续滤液测定砷质量浓度,换算并计算累积释放率,结果见图3。

图3 ATO、ATO-PLGA@NPs 及pH-ATO-PLGA@NPs 在pH 7.4 (A)、6.5 (B)、5.5 (C) 环境中的体外释放曲线 ( ± s, n = 3)Fig.3 In vitro release curves of ATO, ATO-PLGA@NPs and pH-ATO-PLGA@NPs in pH 7.4 (A), 6.5 (B), 5.5 (C) ( ± s, n = 3)
ATO 为水溶性药物,尽管有透析袋减缓其释放速率,2 h 时在3 种不同pH 值的PBS 中均释放超过90%,且在之后基本释放完全,释放曲线趋于平缓。经ATO-PLGA@NPs 包埋后,ATO 的释放速率明显降低,24 h 在pH 7.4、6.5、5.5 环境中累积释放了(62.81±3.11)%、(60.78±2.96)%、(60.78±2.87)%,具有明显的缓释特性,不具备pH 响应特性。pH-ATO-PLGA@NPs 则具备pH 响应特性。24 h时,pH-ATO-PLGA@NPs 中ATO 在pH 7.4 PBS 中积累积释放量接近ATO-PLGA@NPs,为(67.36±3.24)%;在pH 6.5 PBS 中,累积释放量已高于ATO- PLGA@NPs,为(72.42±4.51)%;在pH 5.5 PBS中,pH-ATO-PLGA@NPs 中ATO 积累积释放量进一步升高至(89.06±3.92)%,具备pH 响应特性。
2.5 细胞学评价
2.5.1 空白载体细胞毒性 取处于对数生长期的HepG2 细胞,以8×103个/孔接种于96 孔板,37 ℃培养12 h。取上述培养细胞后的96 孔板,移弃培养液,分别加入质量浓度10、25、50、100、250、500、 1000 μg/mL 的PLGA@NPs 及pH-PLGA@NPs 的无血清培养基继续培养24 h 后,吸去含药培养液,每孔加入0.2 mL 含0.5 mg/mL MTT 的PBS,于37 ℃继续孵育4 h,吸去含有MTT 的培养液,用PBS 清洗3 次后,每孔加入0.15 mL DMSO,振摇15 min,溶解均匀后使用酶标检测仪于波长540 nm 处测定吸收度(A)值。
不同质量浓度的PLGA@NPs 及pH-PLGA@ NPs 对HepG2 细胞存活率的影响结果如图4 所示。在质量浓度10~250 μg/mL 时,PLGA@NPs 表现出良好的生物相容性,存活率均未受影响;当质量浓度达到500 μg/mL 时,HepG2 细胞虽然受到影响,pH-PLGA@ NPs 组HepG2 细胞的存活率小于90%,但仍高于85%,而PLGA@NPs 组的存活率仍大于90%;当质量浓度增大至1000 μg/mL 时,PLGA@ NPs 与pH-PLGA@NPs 组HepG2 细胞的存活率均下降至小于80%。上述结果表明,PLGA@NPs 与pH-PLGA@NPs 均对HepG2 细胞的细胞毒性作用均较弱,pH-PLGA@NPs 的细胞毒性作用略高于PLGA@NPs。
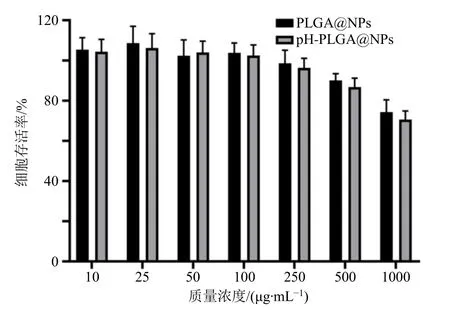
图 4 不同质量浓度PLGA@NPs、pH-PLGA@NPs 对HepG2 细胞存活率的影响 ( ± s, n = 3)Fig.4 Effects of PLGA@NPs, pH-PLGA@NPs with different concentrations on survival rate of HepG2 cells ( ± s, n = 3)
2.5.2 载药纳米粒的细胞毒性 为了测定纳米粒pH 响应性及对ATO 包载后对肿瘤细胞活性的影响,采用MTT 考察纳米粒在pH 7.4、6.5 对HepG2细胞的细胞毒性。取处于对数生长期的HepG2 细胞,以8×103个/孔接种于96 孔板,37 ℃培养12 h。取上述培养细胞后的96 孔板,移弃培养液,分别加入含ATO 浓度为1、5、10、25、50、100 μmol/L的ATO、ATO-PLGA@NPs 及pH-ATO-PLGA@NPs的普通无血清培养基(pH 7.4)与酸化后的无血清培养基(pH 6.5)继续培养24 h。后续操作同“2.5.1”项,测定A值,计算半数抑制浓度(IC50)值。结果见图5-A、B,在pH 7.4 时,ATO 溶液的细胞毒性大于ATO-PLGA@NPs 及pH-ATO-PLGA @NPs,并计算得到其 IC50为(21.99±1.30)μmol/L;ATO-PLGA@NPs 的IC50为(26.64±1.06)μmol/L,细胞毒性低于pH-ATO-PLGA@NPs 的(23.71±0.70)μmol/L(P<0.05)。而在pH 6.5 时,ATO 溶液的IC50为(21.17±1.72)μmol/L,与pH 7.4 时无显著性差异(P>0.05);而pH-ATO-PLGA@NPs的IC50与pH 7.4 时相比显著减小(P<0.01),为(16.40±0.62)μmol/L,ATO-PLGA@NPs 的IC50为(24.36±0.71)μmol/L。

图 5 不同浓度 ATO、ATO-PLGA@NPs 及 pH-ATO- PLGA@NPs 在pH 7.4 (A) 与pH 6.5 (B) 时对HepG2 细胞的毒性 ( ± s, n = 3)Fig.5 Toxicity of ATO, ATO-PLGA@NPs and pH-ATO- PLGA@NPs of different concentrations on HepG2 cells at pH 7.4 (A), pH 6.5 (B) ( ± s, n = 3)

图 6 不同浓度 ATO、ATO-PLGA@NPs 及 pH-ATO- PLGA@NPs 在pH 7.4 时对L02 细胞的毒性 ( ± s, n = 3)Fig.6 Toxicity of ATO, ATO-PLGA@NPs and pH-ATO- PLGA@NPs of different concentrations on L02 cell at pH 7.4 ( ± s, n = 3)
为了测定pH 响应纳米粒包载后对正常细胞活性的影响,采用MTT 考察纳米粒在pH 7.4 的L02细胞中的细胞毒性。L02 细胞(pH 7.4)的培养及给药同HepG2 细胞。结果见图6,在pH 7.4 的L02细胞中,ATO 溶液的细胞毒性大于ATO-PLGA@ NPs 及pH-ATO-PLGA@NPs,其IC50为(28.25±1.33)μmol/L;ATO-PLGA@NPs 的IC50为(40.83±1.76)μmol/L,细胞毒性显著低于ATO(P<0.01);pH-ATO-PLGA@NPs 的 IC50为(39.72±1.84)μmol/L,细胞毒性显著低于ATO(P<0.01),且与ATO-PLGA@NPs 无显著性差异(P>0.05)。
3 讨论
ATO 作为砒霜的活性成分,在我国拥有悠久的用药史。现代医学研究发现其不仅对于包括急性早幼粒细胞白血病的血液癌疗效极佳,对于肝癌等实体瘤也展现出优越的治疗潜力[3,13]。但是ATO 进入人体后,血浆蛋白结合率高[14],肾清除快,无特异性分布等缺陷影响了对实体瘤治疗的效果,且极易对正常组织产生毒副作用[3-4]。纳米技术在医学的应用使药物具备靶向及缓释特性,改善了药物的体内药动学[15-16]。因此,本实验采用生物相容性良好的PLGA 为材料制备了纳米粒并加入NaHCO3赋予纳米粒pH 响应特性[10,17],改善ATO 的上述缺陷:(1)通过对ATO 的包埋,提高ATO 的稳定性;(2)通过缓释及对肿瘤环境低pH 的响应减少对正常组织的毒副作用。
本实验制备的pH-ATO-PLGA@NPs 在马尔文粒径仪中测得粒径为(214.35±1.86)nm,TEM 下观察到的粒径在150~180 nm(电镜图中较小)。其原因为粒径仪测得为纳米粒的水合粒径,大于电镜下直接观察的粒径[18]。pH-ATO-PLGA@NPs 因其存在pH 响应因子的NaHCO3,再负载ATO 时离子强度增加,故而使其载药量、包封率及稳定性均略低于 ATO-PLGA@NPs[17]。因 pH-ATO-PLGA@NPs在纯水中稳定性较ATO-PLGA@NPs 低,更适合以减压干燥或冻干粉末形式保存,在pH-ATO-PLGA@ NPs 在配置后需尽快使用。
ATO-PLGA@NPs 与pH-ATO-PLGA@NPs 包载药物后具备缓释特性,但在释药最初阶段仍然存在轻微突释现象,这可能是由于:(1)原本黏附在纳米粒表面的ATO 经干燥复溶过程而呈游离状态;(2)干燥复溶过程使纳米粒表面存在裂隙,使较为浅表的药物迅速释放[19-20]。pH-ATO-PLGA@NPs 则具备明显的pH 响应特性,随pH 值的下降,24 h累积释放率逐步上升。pH-ATO-PLGA@NPs 的此特性可以使其到达肿瘤后,响应肿瘤微环境的低pH值,加速释放ATO。
细胞学评价表明,作为载体的PLGA@NPs 及pH-PLGA@NPs 在低浓度及正常给药的纳米粒浓度时,生物相容性良好,极高浓度时才会产生细胞毒性。pH-PLGA@NPs 的细胞毒性略高于普通的PLGA@NPs,因pH-PLGA@NPs 中含有作为pH 响应因子的NaHCO3,NaHCO3浓度随pH-PLGA@NPs浓度增加而升高,增强了pH-PLGA@NPs 的细胞毒性。在pH 7.4 时,ATO-PLGA@NPs 及pH-ATO- PLGA@NPs 对HepG2 的细胞毒性均小于ATO 溶液,这是由于:(1)ATO 本身可通过自由扩散进入细胞,PLGA@NPs 及pH-PLGA@NPs 包埋后需要细胞内吞进入细胞,入胞方式的改变使细胞摄入ATO 量减少[21-22];(2)PLGA@NPs 及pH-PLGA@ NPs 包埋后ATO 呈缓释状态,使得在起初阶段大部分ATO 未释放完全[23]。
pH-ATO-PLGA@NPs 的细胞毒性高于ATO- PLGA@NPs,主要原因为细胞摄取进入溶酶体后,因pH-ATO-PLGA@NPs 的pH 响应较ATO-PLGA@ NPs 释放相对较快、较完全[24]。虽然pH 值为7.4时,ATO-PLGA@NPs 及pH-ATO-PLGA@NPs 对肝癌细胞的毒性小于ATO(P<0.05),但pH 值为6.5时(肿瘤微环境pH)[25],pH-ATO-PLGA@NPs 的细胞毒性大于ATO(P<0.05)。这是因为:(1)pH- ATO-PLGA@NPs 的pH 响应性使其未入胞部分也释放了ATO,可以入胞;(2)pH-ATO-PLGA@NPs释放ATO 的同时,也释放了NaHCO3,溶酶体内的渗透压上升快,使溶酶体加速破裂;(3)pH-ATO- PLGA@NPs 及已释放的ATO 释放到细胞质中,接触作用靶点,与上升的渗透压共同作用加速细胞凋亡[26-28]。pH-ATO-PLGA@NPs 不仅具备pH 响应特性,并通过pH 响应特性实现了对ATO 释放的调控从而改变了ATO 在肿瘤细胞中的细胞毒性。
而在人正常肝细胞L02 中,ATO-PLGA@NPs及pH-ATO-PLGA@NPs 的细胞毒性均显著低于ATO 溶液(P<0.01)。这表明制备成纳米制剂后,由于纳米粒的缓释及正常细胞对纳米粒的胞吞作用小于代谢较快的肿瘤细胞,pH-ATO-PLGA@NPs 对正常细胞的毒性降低[29]。并且,进入人体后,纳米粒可改善ATO 原有缺陷并通过靶向性,增加ATO在瘤分布,从而提高疗效。pH-ATO-PLGA@NPs 的pH 响应特性使得其可以在肿瘤微环境加速释放,较ATO-PLGA@NPs 进一步提高疗效。在后继的研究中此外,研究者后续将对其在体内药动学参数及是否可以有效增加荷瘤动物的体内抗肿瘤作用加以探究。
综上所述,pH-ATO-PLGA@NPs 可有效改善ATO 在治疗实体瘤方面代谢消除快,无特异性分布等缺陷,使ATO 具备靶向、缓释及pH 响应特性,为ATO 有效应用于实体瘤的治疗奠定基础。本实验的设计及展开为诸如ATO 的半衰期短、治疗窗窄、无特异性分布的有毒类中药新型纳米制剂的构建研究提供参考。
利益冲突所有作者均声明不存在利益冲突
