WRKY 转录因子家族在植物响应逆境胁迫中的功能及应用
2021-08-03杜超
杜超
(内蒙古师范大学生命科学与技术学院,内蒙古呼和浩特 010022)
在植物基因组中,转录因子基因占据了很大比例,例如,在拟南芥(Arabidopsis thaliana)中有2100多个转录因子基因,在水稻(Oryza sativa)中有2 300多个转录因子基因[1]。这些转录因子根据分子结构特征的不同,被分成不同的基因家族,如WRKY、Basic region-leucine zipper (bZIP)、APETALA2/ethylene response factors(AP2/ERF)、GRAS、Myeloblastosis(MYB)、Basic helix-loop-helix(bHLH)、NAM/ATAF/CUC(NAC)等转录因子家族。这些转录因子能够调控植物特定基因的表达,在植物生长发育和适应环境过程中起到重要作用,其中WRKY转录因子家族是最大的转录因子超家族之一[2-6]。
1994年,在甘薯(Ipomoea batatas)中发现了第1个WRKY 转录因子,并被命名为Sweet Potato Factor1(SPF1),随后在其他植物中同样发现了大量的WRKY转录因子,到目前为止,在拟南芥和水稻中已经分别发现了72和102个WRKY蛋白[7-10]。WRKY转录因子的生物学功能非常复杂,能够调控植物的多种生理过程,包括植物生长、发育、衰老、次生代谢、植物激素信号转导、环境胁迫响应等,在植物适应环境、种群分布以及促进农牧业发展等方面发挥了重要作用[11-13]。因此,深入研究WRKY 转录因子的功能及调控机理,有助于理解植物适应环境的生理过程,为改善生态环境和发展农牧业奠定理论基础。
1 WRKY 转录因子的结构特征与分类
WRKY转录因子属于WRKY-GCM1锌指蛋白超家族,由转座酶突变基因进化而成[14-15]。WRKY蛋白家族因具有高度保守的WRKY 结构域而得名,该结构域由大约60个氨基酸残基组成,在N端具有一段氨基酸序列结构WRKYGQK,而在C端存在一个锌指结构[16]。在少数植物中,WRKY结构域也被替换为WRRY、WSKY、WKRY、WVKY 或WKKY等氨基酸序列[17]。WRKY 结构域的锌指结构有两种类型,分别为Cx4-5Cx22-23HxH (C2H2型)或者Cx7Cx23HxC(C2HC 型) (图1)[18]。2005年,Yamasaki 等[19]首次报道了WRKY 结构域的溶液结构,证明了WRKY结构域主要由4条β 折叠组成,并伴有由半胱氨酸或组氨酸(Cys/His)残基组成的锌指结构。除WRKY 结构域以外,部分WRKY 转录因子也具有核定位序列(NLS)、亮氨酸拉链、脯氨酸富集结构等结构特征。
根据WRKY 结构域的个数以及锌指结构的特征,WRKY 转录因子被分为3类(图1)。Ⅰ类WRKY转录因子含有2个WRKY 结构域和C2H2型锌指结构,例如SPF1、FtWRKY10、CkWRKY33、MdWRKY100、PcWRKY1、AtZAP1和CsSE71等[7,20-23]。Ⅰ类WRKY转录因子不仅存在于高等植物中,也存在于其他真核生物中,包括蓝氏贾第鞭毛虫(Giardia lamblia)、盘基网柄菌(Dictyostelium discoideum)和莱茵衣藻(Chlamydomonas reinhardtii),说明WRKY 蛋白可能起源于一些古老的真核生物[24]。Ⅱ类WRKY 转录因子含有1个WRKY 结构域和C2H2型锌指结构,例 如CsWRKY7、SbWRKY50、MdWRKY30和CiWRKY12等[25-28]。还有一些WRKY 转录因子被称为Ⅲ类WRKY 转录因子,包括TaWRKY42-B、JcWRKY2、PlWRKY70和 NtWRKY5等,Ⅲ类WRKY 转录因子含有1个WRKY 结构域和C2HC型锌指结构[16,29-31]。目前只在高等植物中发现了Ⅲ类WRKY转录因子,均与植物抵抗生物胁迫有关,表明这类转录因子可能是植物在生物胁迫条件下进化产生的[32-33]。另外,对水稻中的WRKY转录因子基因家族进行进化分析,结果显示水稻中的Ⅲ类WRKY转录因子基因数量急剧增加,表明Ⅲ类WRKY 转录因子在生物进化方面比Ⅰ和Ⅱ类WRKY 转录因子更加活跃,并且可能在单子叶植物中发挥了重要功能[34]。

图1 WRKY 结构域序列特征及WRKY 转录因子的分类Figure 1 Sequence characterization of the WRKY domain and classification of WRKY transcription factors
2 WRKY 转录因子的作用机制
WRKY转录因子能够识别并结合DNA 序列中的W-box 顺式作用元件,从而调控目标基因的表达。WRKY转录因子通过C-末端的锌指结构特异性结合在W-box 序列上,该结合过程需要锌离子参与,而WRKY 结构域的N-末端则提高了WRKY 蛋白与W-box 序列的结合能力和特异性[7,35-37]。W-box顺式作用元件的DNA 序列为TTGACT/C,大量研究证明W-box 序列是WRKY 蛋白能够识别并结合的最小DNA 序列[16]。例如,凝胶迁移分析表明TcWRKY1可以结合在DBAT基因启动子的W-box区域[38]。酵母单杂交试验证明ThWRKY2、ThWRKY4和ThWRKY7蛋白能够结合在W-box 序列上,激活下游基因的表达[39]。染色质免疫共沉淀显示AtWRKY46能够结合在ABI4、IAGLU、UGT84B2、GH3.1、LEA、LEA18、TRX5和Peroxidase54等目的基因的启动子区域的W-box 上,并调控这些靶基因的表达[40-41]。
当W-box 顺式作用元件中的碱基发生突变时,WRKY 蛋白与目的DNA 片段的结合会受到不同程度的影响。例如,当W-box 序列“TTGACC”突变为“TTGATC”或者“TCGACC”,ThWRKY4转录因子与这两个突变序列的结合力急剧下降,而当W-box序列“TTGACC”突变为“TTGGCC”时,ThWRKY4转录因子与这个突变序列的结合力仍然很高,这表明了在W-box 顺式作用元件中,“T”和“C”碱基在WRKY 转录因子与W-box 的结合中起到了关键作用,然而“A”碱基的作用较弱[39]。另外,在拟南芥中发现,WRKY6、WRKY11、WRKY26、WRKY38和WRKY43蛋白与单独的W-box 序列结合能力非常低,但是当W-box 序列的两端带有3~4 bp其他碱基时,WRKY6、WRKY11、WRKY26、WRKY38和WRKY43蛋白与W-box 序列的结合能力显著提高[42],表明与W-box 区域相邻的DNA 序列也对WRKY 转录因子结合能力有影响。
3 WRKY转录因子对植物响应非生物胁迫的调控功能
植物在生长过程中会在不同发育时期受到多种非生物胁迫的影响,例如,干旱、盐害、高温、低温、营养元素缺乏、光照不足等,这些非生物胁迫会限制植物的生长和发育,甚至影响植物在不同类型环境中的分布。WRKY转录因子基因在植物响应非生物胁迫过程中起重要作用,可以被不同非生物胁迫诱导表达。对13个OsWRKY转录因子基因进行Northern 杂交分析发现,10个OsWRKY基因能够不同程度地响应盐害、干旱、高温和低温胁迫[43]。在甘蔗(Saccharum officinarum)中,ScWRKY5基因能够被盐胁迫和干旱胁迫诱导表达[44]。在小麦(Triticum aestivum)中,8个WRKY转录因子基因在盐害、干旱、高温和低温胁迫下被诱导表达[45]。值得注意的是,非生物胁迫对WRKY转录因子基因表达的诱导作用通常是非常快速的,这种表达模式确保了WRKY 转录因子介导的细胞信号能够快速传递,激活下游非生物胁迫相关基因的表达,最终导致植物对非生胁迫做出响应。
WRKY转录因子可以通过调控胁迫相关基因的表达以及修改特定胁迫相关基因的时空表达模式来参与植物响应非生物胁迫过程,一个WRKY 转录因子通常可以同时调控多种非生物胁迫响应过程,如OsWRK45和OsWRK72基因通过激活下游胁迫相关基因的表达,提高了转基因拟南芥对盐胁迫和干旱胁迫的耐受性[46-47]。在拟南芥中过表达TaWRKY19基因提高了DREB2A、RD29A、RD29B和Cor6.6的表达量,增强了转基因植株对盐、干旱和冷胁迫的耐受性[48]。WRKY转录因子可以通过多种途径来调控植物响应非生物胁迫,而脱落酸(abscisic acid,ABA)信号通路、抗氧化系统和渗透调节系统是其中最重要的途径,在WRKY转录因子调控植物响应盐、干旱、高温和紫外胁迫等过程中均发挥重要的作用。
3.1 WRKY 转录因子在非生物胁迫条件下对ABA 信号通路的调控作用
ABA 是一种与胁迫相关的植物激素,在植物响应非生物胁迫过程中起到了重要作用,与WRKY 转录因子的调控功能密切相关,例如,2个等位基因OsWRKY45-1和OsWRKY45-2在盐胁迫响应和ABA信号通路中发挥了不同的功能,在水稻中过表达OsWRKY45-1基因降低了转基因植株对ABA 的敏感性,但是对转基因植株的盐胁迫耐受性没有明显影响,而过表达OsWRKY45-2则增加了转基因植株的ABA 敏感性,同时降低了盐胁迫耐受性[49]。WRKY 转录因子家族能够通过调控ABA 信号通路中多个关键基因的表达水平参与植物响应非生物胁迫过程,包括ABA 合成基因、ABA 受体基因以及其他ABA 信号通路相关基因。例如,对盐胁迫处理前后的ZmWRKY114转基因水稻和野生型水稻进行转录组测序发现,NCED3基因、NCED5基因、PYL3基因和PYL9基因的表达水平在ZmWRKY114转基因水稻中具有更高的上调幅度,NCED3、NCED5基因是ABA 合成基因,PYL3、PYL9基因是ABA 受体基因,结合ZmWRKY114转基因水稻具有较低的ABA 含量、ABA 敏感性以及盐胁迫耐受性,推断ZmWRKY114 转录因子通过调控ABA 合成基因和受体基因的表达提高了植物体内的ABA 水平,从而在植物响应盐胁迫过程中起到了负调控作用[50]。小麦的TaWRKY1蛋白也可以通过调控ABA 受体基因NtPYL8的表达来控制植物气孔开度,从而增强了TaWRKY1转基因烟草(Nicotiana tabacum)的干旱耐受性[51]。ABA 响应元件基因ABRE和ABA 响应元件结合因子基因ABF3是ABA信号通路转导过程中的关键基因,在拟南芥中过表达TaWRKY46基因,提高了ABRE基因和ABF3基因的表达水平,增强了TaWRKY46转基因拟南芥对渗透胁迫的耐受性,表明TaWRKY46转录因子可以通过调控ABA信号通路的转导来增强植物的渗透胁迫耐受性[52]。在棉花(Gossypiumspp.)中分别沉默GhWRKY21基因和ABA 信号通路负调控因子基因GhHAB均有效提高了棉花的干旱胁迫耐受性,深入研究发现GhWRKY21蛋白可以结合在GhHAB基因的启动子,因此推测GhWRKY21转录因子通过上调GhHAB基因的表达在植物响应干旱胁迫过程中发挥了负调控作用,表明ABA 信号通路在WRKY 转录因子家族调控植物响应干旱胁迫过程中发挥了关键作用[53]。
WRKY转录因子家族对植物响应非生物胁迫过程中ABA 信号通路的调控机制较为复杂,其不仅可以直接调控ABA 信号通路相关基因的表达,还可以依赖于茉莉酸(jasmonic acid,JA)信号通路与ABA 信号通路之间的协同作用调控ABA 信号通路。例如在拟南芥中过表达GbWRKY1基因,显著降低了转基因拟南芥对盐胁迫和干旱胁迫的耐受性以及对ABA 处理的敏感性。进一步研究发现,GbWRKY1转录因子是ABA 信号通路中的一个负调控因子,它不仅可以调控ABA 响应相关基因RAB18和RD29A的表达,而且还可以依赖于JA 信号通路相关蛋白JAZ1 来调控ABA 信号通路关键负调控因子ABI1的功能,从而降低植物对非生物胁迫的耐受性[54]。
3.2 WRKY 转录因子在非生物胁迫条件下对植物内稳态的调节作用
植物在遭受非生物胁迫时体内的活性氧平衡、离子平衡以及渗透平衡会被破坏,使得植物的内稳态紊乱,从而影响植物的生长发育。环境中的非生物胁迫可以导致植物体中积累过量的过氧化氢(H2O2)、羟自由基(·OH)、单线态氧(1O2)等活性氧,破坏植物内氧化平衡,并对植物细胞膜系统造成损伤,限制了植物的生长发育。WRKY 转录因子可以通过调控植物体内多种抗氧化酶的含量来清除过量积累的活性氧,保持植物在非生物胁迫条件下的活性氧平衡,提高植物的非生物胁迫耐受性,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、谷胱甘肽转移酶(glutathione S-transferase,GST)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等。例如,在非生物胁迫条件下,小黑杨(Populus simonii×P.nigra)中的WRKY56转录因子和沙棘(Hippophae rhamnoides)中的HrWRKY 21转录因子均可以通过提高植物中POD和SOD的活性来降低植物的氧化损伤程度,从而提高植物对盐胁迫的耐受性[55,56]。DgWRKY1、DgWRKY3、DgWRKY4和DgWRKY5的转基因植物在盐胁迫条件下的H2O2含量、丙二醛和超氧阴离子含量显著低于野生型植株(P<0.05),而POD、CAT 和SOD活性显著高于野生型植株,同时还发现抗氧化酶基因CAT、SOD和APX在转基因植株中具有更高的表达量,这些结果表明这3个DgWRKY转录因子可以促进抗氧化酶基因的表达,提高抗氧化酶活性,降低植物在盐胁迫条件下受到的氧化损伤[57-60]。在拟南芥中过表达GhWRKY6基因也提高了转基因植株的SOD和POD活性,降低了丙二醛和H2O2的含量,从而提高了转基因植株的盐胁迫耐受性和渗透胁迫耐受性[61]。
WRKY转录因子家族对植物体内抗氧化酶水平的调控机制较为简单,其可以直接结合在CAT、POD、SOD等抗氧化酶合成途径相关基因启动子上,对其表达水平进行调控。例如在氧化胁迫条件下,FcWRKY40转录因子能够提高FcWRKY40转基因烟草中CAT基因和POD基因的表达水平,从而降低了转基因烟草中丙二醛和H2O2的含量,提高了FcWRKY40转基因烟草对氧化胁迫的耐受性[62]。在盐胁迫条件下,RtWRKY23转录因子可以结合在转基因拟南芥POD、POD22和POD23基因的启动子上并诱导其表达,提高转基因拟南芥体内的过氧化物酶水平,增强转基因拟南芥的盐胁迫耐受性[63]。JcWRKY2 转录因子可以诱导JcWRKY2转基因烟草中NtCAT和NtSOD基因的表达,提高CAT和SOD的酶活,使得JcWRKY2转基因烟草可以在盐胁迫条件下保持体内的活性氧平衡,增强了JcWRKY2转基因烟草的耐盐性[64]。然而,部分WRKY 转录因子结合到抗氧化酶合成途径相关基因启动子上之后,也能够抑制靶基因的表达,在植物响应非生物胁迫过程中起到负调控作用。CaWRKY27基因能够被盐胁迫、渗透胁迫和ABA 处理诱导表达,但在烟草中过表达的CaWRKY27基因却降低了转基因烟草中抗氧化酶合成途径相关基因NtAPX1、NtSOD、NtPOX1和NtPOX2的表达水平,并增加了转基因烟草对盐胁迫和渗透胁迫的敏感性,证明CaWRKY27转录因子通过抑制抗氧化酶合成途径相关基因的表达在植物响应盐胁迫和干旱胁迫过程中发挥了负调控作用[65]。
另外,非生物胁迫,例如干旱胁迫、盐胁迫等,还能够引起植物体内失水以及累积过量的金属离子,破坏植物体内的离子平衡,影响植物的生长发育。WRKY转录因子能够调控植物体内的Na+和K+含量,帮助植物在非生物胁迫条件下保持离子平衡。拟南芥中的WRKY33转录因子可以通过诱导钾离子转运蛋白基因AtKUP2的表达,降低拟南芥在盐胁迫条件下的Na+/K+比率,保持拟南芥体内的离子平衡,增强了拟南芥的耐盐性[66]。GhWRKY34基因在拟南芥中异源表达,提高了拟南芥中与离子转运相关的SOS基因家族的表达量,降低了转基因植株在盐胁迫条件下的Na+/K+比率,使得植株在盐胁迫条件下保持了离子平衡,并具有更好的生长状况[67]。沉默拟南芥中WRKY8基因,提高了盐胁迫条件下的Na+/K+比率,增强了对盐胁迫的敏感性,这表明WRKY8 蛋白在拟南芥抵抗盐胁迫和保持离子平衡过程中起到了重要的作用[68]。在非生物胁迫条件下,植物体内的过度失水及离子平衡紊乱也会导致植物的渗透平衡被破坏,使得植物遭受次级渗透胁迫。脯氨酸(proline)是植物体内重要的渗透调节物质,WRKY 转录因子可以通过调控脯氨酸的代谢保持植物在非生物胁迫条件下的渗透平衡。在干旱胁迫条件下,GmWRKY12转基因大豆(Glycine soja)具有比野生型大豆更好的生长状况及更高的脯氨酸含量,表明GmWRKY12转录因子可以通过提高植物体内脯氨酸含量帮助植物响应干旱胁迫[69]。P5CS基因是脯氨酸合成途径中的关键基因,在菊花(Dendranthema grandiflorum)中过表达DgWRKY2基因显著提高了转基因植株的脯氨酸含量和DgP5CS基因的表达水平(P<0.05),增强了转基因植株对盐胁迫的耐受性,证明WRKY转录因子可以通过诱导脯氨酸合成途径关键基因来促进脯氨酸的累积,增强植物对非生物胁迫的耐受性[70]。WRKY转录因子同样可以通过抑制脯氨酸降解途径关键基因的表达来提高植物体内的脯氨酸水平,维持植物在非生物条件下的渗透平衡。例如,RtWRKY23转录因子结合在脯氨酸降解途径关键基因PRODH2的启动子上抑制其表达,阻止植物体内脯氨酸的降解,提高了植物体内脯氨酸的水平,从而保持了植物在盐胁迫条件下的渗透平衡,增强了植物的盐胁迫耐受性[63]。
一些WRKY 转录因子也能同时调控植物体内的ROS平衡、离子平衡和渗透平衡,帮助植物适应非生物胁迫环境。例如,在番茄(Lycopersicon esculentum)中过表达SlWRKY3基因,提高了大量与抗氧化酶、离子转运、水分转运、防御信号相关基因的表达量,使得转基因植物在盐胁迫条件下具有更高的生物量和光合作用[71]。过表达和基因沉默试验证明,GmWRKY27蛋白能够通过降低植物体内的ROS水平和提高脯氨酸含量来增强植物对盐胁迫和干旱胁迫的耐受性[72]。JcWRKY 蛋白通过参与水杨酸(salicylic acid,SA)信号通路,提高了转基因烟草的脯氨酸、可溶性糖以及K+的含量,抑制了ROS和Na+的累积,使得转基因烟草在盐胁迫条件下具有更好的种子萌发率、光合作用和生长状况[73]。总而言之,在植物响应非生物胁迫过程中,WRKY 转录因子可以结合在下游靶基因的启动子上,包括CAT、SOD、AtKUP2和P5CS等非生物胁迫相关基因,调控这些靶基因的表达,引起植物体内抗氧化酶活性升高、渗透调节物质累积、Na+/K+比率降低等生理变化,维持植物的内稳态,最终帮助植物适应恶劣生境(图2)。
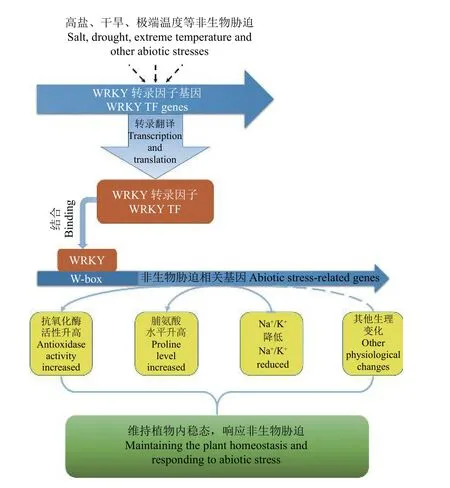
图2 非生物胁迫条件下WRKY 转录因子对植物内稳态的调控机制Figure2 The regulatory mechanism of WRKY TF in plant homeostasisunder abiotic stresses
4 WRKY转录因子对植物响应生物胁迫的调控功能
除了非生物胁迫,植物在自然界中还会受到多种生物胁迫,例如,植物病原菌的侵染、昆虫的侵食、植物之间的寄生等[74]。植物在长久的进化过程中形成了复杂的防御信号网络来响应各种生物的侵害,而且越来越多的研究表明WRKY转录因子在这些防御信号途径中起到了非常复杂的调控作用。植物激素介导的信号通路在植物响应生物胁迫过程中发挥着重要的作用,例如,茉莉酸JA 和乙烯(ethylene,Eth)介导的信号通路可以帮助植物抵抗死体营养型病原菌,而水杨酸SA 介导的信号通路则参与了植物抵抗活体营养型病原菌的过程[75]。WRKY 转录因子可以通过调控植物激素的合成代谢或者作为植物激素介导的信号通路的下游靶基因参与到植物激素介导的信号通路中,从而调控植物响应生物胁迫的过程。例如,PlWRKY13转录因子通过调控芍药(Paeonia lactiflora)体内JA 和SA 水平,提高了芍药对细极链格孢菌(Alternaria tenuissima)的抵抗性[76]。水稻中的两个等位基因OsWRKY45-1和OsWRKY45-2在其抵抗水稻白叶枯菌(Xanthomonas oryzae)侵染的过程中发挥了不同的作用,OsWRKY45-1基因提高了水稻对白叶枯菌的敏感性,而OsWRKY45-2基因则增强了水稻对白叶枯菌的抵抗能力。进一步研究发现,OsWRKY45-1蛋白和OsWRKY45-2蛋白对SA 合成途径相关基因ICS1和PAD4、SA 依赖途径的关键基因PR1a以及SA 依赖途径和JA 依赖途径的共同关键基因PR1b的表达具有不同的调控作用,导致OsWRKY45-1蛋白在水稻抵抗白叶枯菌过程中同时引起了SA 和JA 的累积,而OsWRKY45-2蛋白在该过程中仅引起了JA 的累积,证明了OsWRKY45-1和OsWRKY45-2基因主要是通过调控SA 水平和JA 的水平,从而在水稻抵抗白叶枯菌过程中发挥了不同功能[77]。美洲葡萄(Vitis labrusca)中的VlWRKY3基因可以被茉莉酸甲酯和Eth 处理诱导表达,在拟南芥中异源表达VlWRKY3基因发现,VlWRKY3蛋白可以通过调控PR1、PDF1.2、NPR1和LOX3基因的表达水平来增强植物对灰霉菌(Botrytis cinerea)的敏感性以及对白粉菌(Golovinomyces cichoracearum)的抵抗性,表明VlWRKY3基因作为JA 和Eth 介导的信号通路的下游靶基因参与调控了植物响应生物胁迫的过程[78]。PtrWRKY18和PtrWRKY35基 因 能 被 丁 香 假单胞菌(Pseudomonas syringae)、灰霉菌(Botrytis cinerea)、SA 和JA 处理诱导表达,在拟南芥中过表达PtrWRKY18和PtrWRKY35基因发现,PtrWRKY18和PtrWRKY35转录因子通过诱导JA 信号通路关键基因PR3和PDF1.2的表达来增强转基因拟南芥对灰霉菌的抵抗性,以及抑制SA 信号通路关键基因PR1、PR2和NPR1的表达来提高转基因拟南芥对丁香假单胞菌的敏感性,表明PtrWRKY18和PtrWRKY35转录因子对SA 信号通路和JA 信号通路具有不同的调控机制,并导致了这两个转录因子在JA 介导的植物响应灰霉菌过程和SA 介导的植物响应丁香假单胞菌过程中发挥了不同的调控作用[79]。
近年来研究发现,除了通过调控SA、JA 等植物激素的合成代谢及其介导的信号通路,来影响植物对各种生物胁迫的耐受性以外,WRKY 转录因子还能通过调控植物的次级代谢来影响植物对生物胁迫的耐受性。在南非醉茄(Withania somnifera)中沉默WsWRKY1基因,增强了南非醉茄对丁香假单胞杆菌、灰霉菌以及斜纹夜蛾幼虫(Spodoptera litura)取食的敏感性。进一步研究发现,WsWRKY1基因的沉默导致了内源芸苔素内酯和内源醉茄内脂的浓度降低,引起了依赖于芸苔素内酯的SA 依赖病原相关蛋白编码基因PR1、PR3和PR5的表达水平下调,同时醉茄内脂具有抗细菌、抗真菌以及拒食草动物取食的作用,因此,WsWRKY1转录因子可能通过调控芸苔素内酯和醉茄内脂的合成代谢途径帮助南非醉茄抵抗丁香假单胞杆菌、灰霉菌以及斜纹夜蛾幼虫取食[80]。目前关于WRKY 转录因子调控植物响应生物胁迫过程的研究主要集中于植物激素介导的信号通路方面,诸如VpWRKY3、AtWRKY18、AtWRKY40和AtWRKY60等蛋白[81-84],然而关于WRKY 转录因子通过调控植物次级代谢过程来参与到植物响应生物胁迫过程中的研究较少,仍需要进行更深入的研究。
5 WRKY 转录因子在牧草中的研究及应用
随着WRKY 转录因子家族的生物学功能及调控机理逐渐被挖掘、认识和研究,展现出了其在牧草资源保护及利用、牧草遗传育种、草地生态恢复等牧草相关领域的研究必要性及重要应用价值,目前已有大量牧草WRKY 转录因子被挖掘和利用(表1)。WRKY转录因子家族在牧草生长发育、适应环境及抵抗虫害和病害的过程中具有重要作用,大量WRKY转录因子家族成员被证明参与了牧草生长发育、响应生物和非生物胁迫过程。例如,二穗短柄草(Brachypodium distachyon)中的BdWRKY38转录因子通过调控SA 信号通路,提高了植物对立枯丝核菌(Rhizoctonia solani)的抗性[84]。玉米(Zea mays)是一种重要的农作物及青贮饲料,研究表明大量WRKY 转录因子参与了玉米响应非生物胁迫过程,包 括ZmWRKY106、ZmWRKY40、ZmWRKY114、ZmWRKY53等转录因子[50,85-87]。在紫花苜蓿(Medicago sativa)中共发现了107个WRKY转录因子基因,其中27个WRKY转录因子基因可以被低温、盐、干旱等非生物胁迫诱导表达,表明WRKY转录因子家族在紫花苜蓿适应恶劣生境过程中发挥了重要作用[88]。同样在木豆(Cajanus cajan)中发现了94个CcWRKY基因,其中CcWRKY13、CcWRKY27、CcWRKY31、CcWRKY32、CcWRKY67、CcWRKY77和CcWRKY80的表达水平在盐胁迫和干旱胁迫条件下有显著变化(P<0.05),表明WRKY转录因子家族参与了木豆响应非生物胁迫的过程[89]。中间锦鸡儿(Caragana intermedia)的CiWRKY75-1蛋白可以降低植物的干旱胁迫耐受性,而CiWRKY40-4蛋白可以延迟植物叶片衰老,这两个WRKY转录因子为深入研究中间锦鸡儿响应干旱胁迫及其叶片衰老机制提供了切入点,有助于深入探索中间锦鸡儿的生长发育过程和抗逆机理[90]。

表1 WRKY 转录因子在牧草中的生物学功能Table 1 Functionsof WRKY TFsin pasture plants
目前一些珍稀濒危荒漠牧草的WRKY 转录因子同样被进行了深入研究及利用,这些研究既保护了珍稀濒危荒漠牧草物种,维持了荒漠植被多样性,又为培育优良抗逆牧草品种提供了优异的抗逆基因资源。例如,从荒漠中的重要牧草长叶红砂(Reaumuria trigyna)中克隆获得的RtWRKY1和RtWRKY23基因可以被多种非生物胁迫诱导表达,而RtWRKY1和RtWRKY23蛋白可以结合在CAT1、SOD1、POD、PRODH2下游非生物胁迫相关基因的启动子上,维持植物在盐胁迫条件下的内稳态,帮助植物抵抗盐胁迫,这些研究结果有助于理解长叶红砂响应恶劣生境的分子机理,为长叶红砂的保护工作奠定了基础,并为牧草遗传育种提供了优异抗逆基因资源[63,100]。
另外,一些其他植物的WRKY转录因子基因也可以应用于牧草遗传育种,通过转基因生物技术手段提高牧草品质。例如,小麦TaWRKY2基因在二穗短柄草中进行过表达,通过调控病理相关蛋白基因的表达,提高了二穗短柄草对赤霉病的抵抗力[105]。在紫花苜蓿中异源表达野生大豆的GsWRKY20基因,通过降低转基因苜蓿的Na+/K+和气孔密度,提高了转基因苜蓿对盐胁迫和干旱胁迫的耐受性,获得了紫花苜蓿抗旱新品种[103]。WRKY转录因子家族在牧草中的研究,有助于我们深入理解牧草抵抗恶劣生境及其他生物侵扰的分子机制,为保护珍稀野生牧草品种、培育优良牧草品种及恢复草地生态环境奠定了基础。
6 小结
WRKY转录因子家族广泛存在于多种植物中,例如拟南芥、水稻、小麦、番茄、玉米、棉花、菊花等。有关WRKY 转录因子家族的研究已有很多,大量研究表明WRKY 转录因子在植物的生长发育、响应生物和非生物胁迫过程中起到了重要的调控作用,可以从多种途径来提高或者降低植物对生物和非生物胁迫的耐受性,深入研究WRKY 转录因子的调控机制有助于了解植物生长发育以及响应多种胁迫过程的分子机理。然而,目前关于WRKY 转录因子的研究多集中在模式植物和园艺植物中,而关于野生珍稀荒漠植物体内WRKY 转录因子的相关研究较少。相对于模式植物和园艺植物,自然界中许多野生珍稀荒漠植物对各种生物和非生物胁迫具有更高的耐受性,因此深入研究野生植物体内WRKY 转录因子的调控机理,可能会为我们探索WRKY 转录因子调控功能提供新的视角,对深入理解植物响应生物胁迫及非生物胁迫的调控机制具有重要意义。
