适宜内生真菌Epichloë sinensis生长的碳氮源筛选
2021-08-03王兴迪
王兴迪,田 沛
(草地农业生态系统国家重点实验室/ 兰州大学农业农村部草牧业创新重点实验室/兰州大学草地农业教育部工程研究中心 / 兰州大学草地农业科技学院,甘肃兰州 730020)
禾草内生真菌(Grassendophyte)指在禾草体内渡过全部或大部分生活周期,而禾草本身不显示任何外部症状的一大类真菌[1]。目前国内外对禾草内生真菌的研究主要集中在子囊菌门(Ascomycota)麦角科(Clavicipitaceae)的Epichloë属[2]。禾草内生真菌与禾草形成互惠共生体,即禾草为内生真菌提供生存空间以及糖类、氨基酸等营养物质以维持其生长,内生真菌通过合成生物碱等次生代谢物来抵御害虫、家畜等生物对宿主的侵害以及改善禾草对干旱、盐碱、重金属等非生物胁迫的抵抗能力[3-5]。内生真菌菌丝体主要集中分布于禾草地上部分[6-8]。且主要依靠种子进行垂直传播[9-11],其形态特征以及生长特性具有丰富的多样性[12]。
中华羊茅(Festuca sinensis)是青藏高原草地植被群落中的主要伴生种,在青藏高原有丰富的野生资源分布,具有抗逆性强、适应性广、适口性好、营养价值高等优良特性,是天然草地改良、退化草地恢复和生态建设中最适宜的优良草种之一[13]。中华羊茅对不良环境如干旱、寒冷及盐碱胁迫等有较强的抵抗力,已在气候恶劣的高海拔三江源区引种栽培成功[13]。目前已知中华羊茅多被Epichloë属内生真菌侵染,二者形成互惠共生体[14]。大量研究表明,Epichloë内生真菌可提高宿主中华羊茅在逆境胁迫下的耐受能力[14-17]。干旱胁迫条件下,内生真菌促使中华羊茅地上生物量以及地下生物量增加,促进中华羊茅种子的萌发,提高可溶性糖等渗透调节物质的含量[14]。寒冷胁迫下,内生真菌可提高带菌中华羊茅种子萌发率,缩短带菌中华羊茅种子萌发时间[15]。盐胁迫条件下,内生真菌能够促进种子萌发与幼苗生长[16]。且带菌的中华羊茅与其他禾草混播时,内生真菌能增加中华羊茅的竞争力,促进伴生植物的生长,提高草地群落的稳定性[17]。以上研究结果均说明内生真菌的存在对中华羊茅生长过程中的重要性。
目前此内生真菌已被鉴定为Epichloësinensis。前人研究已确定E. sinensis有丰富的生物多样性[18]。杨洋[19]发现分离自同一地区中华羊茅种子中不同的内生真菌菌株,其生长速度、菌落特征和孢子形态存在差异。金文进等[20]研究也发现不同培养基、温度、pH 以及营养成分均对分布于甘肃的E.sinensis菌株的生长有影响。王美宁[21]发现不同维生素、植物生长调节剂及金属离子均对分布于5个不同地理区域的中华羊茅内生真菌菌株的生长有影响,且5 个不同地理区域的E. sinensis菌株存在显著差异。
植物在受到非生物胁迫时,会产生大量的活性氧(reactive oxygen species,ROS)自由基,自由基会损伤蛋白质、DNA 等生物大分子并引起膜脂过氧化,植物可以通过提高自身抗氧化能力来保护细胞免受氧化胁迫的伤害,这也是植物抗非生物胁迫的主要机理之一[22]。研究发现,植物内生真菌是一种具有较大潜力的天然抗氧化剂。高媛等[23]研究发现,疏花水柏枝(Myricaria laxiflora)淹水前根部分离得到的内生真菌SG17具有强抗氧化活性。Tianpanich 等[24]从一株内生真菌(Colletotrichum)分离出的5种化合物均具有良好的抗氧化能力。
综上所述,目前离体条件下对中华羊茅内生真菌不同菌株生长影响的研究主要集中在不同温度、pH、维生素、植物生长调节剂及重金属元素等方面,而不同碳氮源对中华羊茅内生真菌生长及总抗氧化能力的影响鲜见报道。基于此,为进一步筛选出适宜于不同E.sinensis菌株的碳氮源,本研究拟检测不同碳氮源培养基上从不同生态型中华羊茅宿主中分离的内生真菌的生长情况。
1 材料和方法
1.1 供试材料
1.1.1供试菌株
菌株1分离自甘肃省夏河县野生中华羊茅种子,菌株41C分离自青海省平安县野生中华羊茅种子,菌株111C分离自四川省红原县野生中华羊茅种子,均由兰州大学草地农业科技学院草地保护研究所提供,已明确其均为Epichloë sinensis[25]。各菌株均在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上低温保存,试验前接种于新鲜的PDA 培养基上,于(25±1)℃黑暗培养条件下培养28 d 备用。
1.1.2固体培养基制备
基础成分:去皮马铃薯(Solanum tuberosum)200 g 煮汁、磷酸二氢钾3 g、硫酸镁1.5 g、琼脂18 g、水1 000 mL。在基础培养基中分别添加碳、氮含量等量的碳氮源,即葡萄糖20 g、淀粉29.96 g、麦芽糖33.32 g、甘露醇19.96 g、山梨醇19.96 g 及氯化铵19.10 g、蛋白胨34.48 g、胰蛋白胨36.69 g、酵母浸粉38.12 g、尿素10.72 g(下同),制成不同的碳、氮源培养基[24],分装入90 mm 直径的培养皿中,每皿约30 mL,每个菌株每种处理均为5个重复。待培养皿冷却后,放入一层透气膜(赛璐玢)。
1.1.3液体培养基的制备
基础成分:去皮马铃薯200 g 煮汁、磷酸二氢钾3 g、硫酸镁1.5 g、水1 000 mL。在基础培养基中分别添加碳、氮含量等量的葡萄糖、淀粉、麦芽糖、甘露醇、山梨醇以及氯化铵、蛋白胨、胰蛋白胨、酵母浸粉、尿素,制成不同的碳、氮源培养基,分装入250 mL的锥形瓶中,每瓶100 mL,每个菌株每种处理均为5个重复[26]。
1.2 指标测定
1.2.1菌落直径
将已活化的3株内生真菌菌株用6 mm 打孔器打孔,接于不同碳、氮源固体培养基上,在(25±1)℃黑暗培养条件下培养4周,每周(7 d)用十字法测量菌株直径。
1.2.2菌落生长速率
菌落生长速率=(菌落菌丝直径−初始接菌落菌丝直径)/菌落培养时间[27]。
1.2.3菌丝直径
在收获菌丝之前,用胶带粘贴法获取菌丝后用荧光显微镜(OLYMPUS,BX51)直接测量菌丝直径。
1.2.4菌丝生物量
揭开透气膜,用解剖刀将菌丝轻轻刮取,放入Eppendorf 管中,称量鲜重。
1.2.5总抗氧化能力测定
将已活化的3株内生真菌菌株用6 mm 打孔器打孔,接于不同碳、氮源液体培养基中,在(25±1)℃、148 r·min−1摇床上培养3 周,使用总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒测定(南京建成生物工程有限公司),发酵菌悬液过滤菌体,滤液10 000 r·min−1离心10 min,将所获得的上清液按照试剂盒内置的方法反应,在波长520 nm 处测定吸光 值。计算公式 如 下:T−AOC(U·mL−1) =(ODU–ODC)/N×0.3;式中:ODU(optical density unit)为测定样品吸光度值,ODC(optical density contrast)为对照吸光度值,N为反应液总体积/取样量[21]。
1.3 统计分析
采用SPSS 25.0软件对所测数据进行统计分析,用平均值± 标准误表示测定结果,分别对同一菌株不同碳氮源处理、同一碳氮源处理不同菌株处理进行单因素方差分析;采用Excel 2010制图。
2 结果与分析
2.1 不同碳源对Epichloë sinensis 生长的影响
2.1.1不同碳源对Epichloë sinensis菌落直径的影响
3株Epichloë sinensis在不同碳源条件下的菌落直径存在不同差异,其中6种碳源处理条件下,菌株111C 的菌落直径均显著高于菌株41C和菌株1(P<0.05)(表1)。以葡萄糖为碳源时,3株菌株的菌落直径间均有显著差异(P<0.05),且菌落直径表现为111C>1 >41C;在以山梨醇为碳源时,3株菌株的菌落直径间也均有显著差异(P<0.05),且菌落直径表现为111C>41C>1;以麦芽糖、淀粉、甘露醇为碳源的处理条件下,111C的菌落直径显著大于菌落41C和1(P<0.05),但菌落41C和菌落1之间差异不显著(P>0.05)。

表1 不同碳源条件下Epichloë sinensis 生长4周的菌落直径、菌丝直径和菌丝鲜重Table 1 Colony diameters,hypha diametersand mycelium biomass of Epichloë sinensis grown using different carbon sourcesfor 4 weeks
不同碳源对3株内生真菌菌株的菌落直径均有明显影响(表1)。菌株1在有葡萄糖、麦芽糖的培养基上的菌落直径显著高于其他成分培养基(P<0.05),而有淀粉、甘露醇的培养基上的菌落直径显著高于山梨醇培养基(P< 0.05)。菌株41C在有麦芽糖的培养基上的菌落直径显著高于甘露醇、葡萄糖培养基(P<0.05),而这3种碳源培养基上的菌落直径与淀粉、山梨醇培养基之间差异不显著(P>0.05)。菌株111C在有淀粉的培养基上的菌落直径显著高于山梨醇培养基(P<0.05),而这两种碳源培养基上的菌落直径与甘露醇、麦芽糖、葡萄糖培养基之间差异不显著(P> 0.05)。
2.1.2不同碳源对Epichloë sinensis菌丝直径的影响
3株Epichloë sinensis菌株在不同碳源条件下的菌丝直径存在明显差异(表1)。3株菌株的菌丝直径在以淀粉、麦芽糖、甘露醇、山梨醇为处理的条件下,菌株1、41C的菌丝直径显著高于111C(P<0.05);以葡萄糖为处理的条件下,菌株41C 的菌丝直径显著高于菌株1、111C(P<0.05)。
不同碳源对3株内生真菌菌株的菌丝直径均有明显影响(表1)。菌株1的菌丝直径在不同碳源培养基上有显著差异(P<0.05),而有甘露醇的培养基上的菌丝直径显著高于其他4种培养基(P<0.05),而有淀粉、山梨醇的培养基上的菌丝直径显著高于麦芽糖、葡萄糖培养基(P< 0.05)。菌株41C的菌丝直径在不同碳源培养基上有显著差异(P<0.05),有葡萄糖、甘露醇培养基上的菌丝直径显著高于淀粉、山梨醇、麦芽糖培养基(P<0.05)。菌株111C的菌丝直径在不同碳源培养基上有显著差异(P<0.05),在有甘露醇、山梨醇、葡萄糖的培养基上的菌丝直径显著高于麦芽糖、淀粉培养基(P<0.05),而有淀粉的培养基上的菌丝直径显著低于麦芽糖培养基(P< 0.05)。
2.1.3不同碳源对Epichloë sinensis菌丝鲜重的影响
3株Epichloë sinensis菌株在不同碳源条件下的菌丝鲜重存在明显差异(表1)。3株菌株的菌丝鲜重在以淀粉、甘露醇、山梨醇为处理的条件下均有显著差异(P< 0.05),且菌丝鲜重表现为111C > 41C >1;以葡萄糖、麦芽糖为处理的条件下,111C 的菌丝鲜重显著大于菌株41C和1(P< 0.05)。
不同碳源对3株内生真菌菌株的菌丝鲜重均有明显影响(表1)。菌株1的菌丝鲜重在不同固体培养基上有显著差异(P<0.05),在有葡萄糖的培养基上的菌丝鲜重显著高于其他4种培养基(P<0.05),而有山梨醇、麦芽糖的培养基上的菌丝鲜重显著高于淀粉培养基(P< 0.05)。菌株41C的菌丝鲜重在不同固体培养基上有显著差异(P<0.05),在有葡萄糖培养基上的菌丝鲜重显著高于其他4种培养基(P<0.05),而有甘露醇、山梨醇的培养基上的菌丝鲜重显著高于麦芽糖、淀粉培养基(P<0.05),且在有麦芽糖培养基上的菌丝鲜重显著高于淀粉培养基(P<0.05)。菌株111C的菌丝鲜重在不同碳源培养基上有显著差异(P<0.05),在有麦芽糖的培养基上的菌丝鲜重显著高于其他4种培养基(P<0.05),而有甘露醇、葡萄糖的培养基上的菌丝鲜重显著高于淀粉、山梨醇培养基(P< 0.05)。
2.1.4不同碳源对中华羊茅内生真菌总抗氧化能力的影响
3株Epichloë sinensis菌株在不同碳源条件下的总抗氧化能力存在明显差异(P<0.05)(图1)。在以葡萄糖、淀粉为碳源的条件下,3株菌株的总抗氧化能力均有显著差异(P<0.05),且总抗氧化能力表现为111C>1 >41C;以麦芽糖、甘露醇、山梨醇为碳源的条件下,菌株111C的总抗氧化能力显著高于菌株1和41C(P< 0.05)。
不同碳源对3株内生真菌菌株的总抗氧化能力均有不同影响(图1)。菌株1的总抗氧化能力在不同碳源发酵液中均无显著差异(P<0.05)。菌株41C在麦芽糖发酵液中的总抗氧化能力显著高于葡萄糖、淀粉发酵液(P<0.05)。菌株111C在葡萄糖、麦芽糖发酵液中总抗氧化能力显著高于淀粉、山梨醇发酵液(P<0.05),在甘露醇发酵液中总抗氧化能力则与上述4种发酵液间无显著差异(P>0.05)。
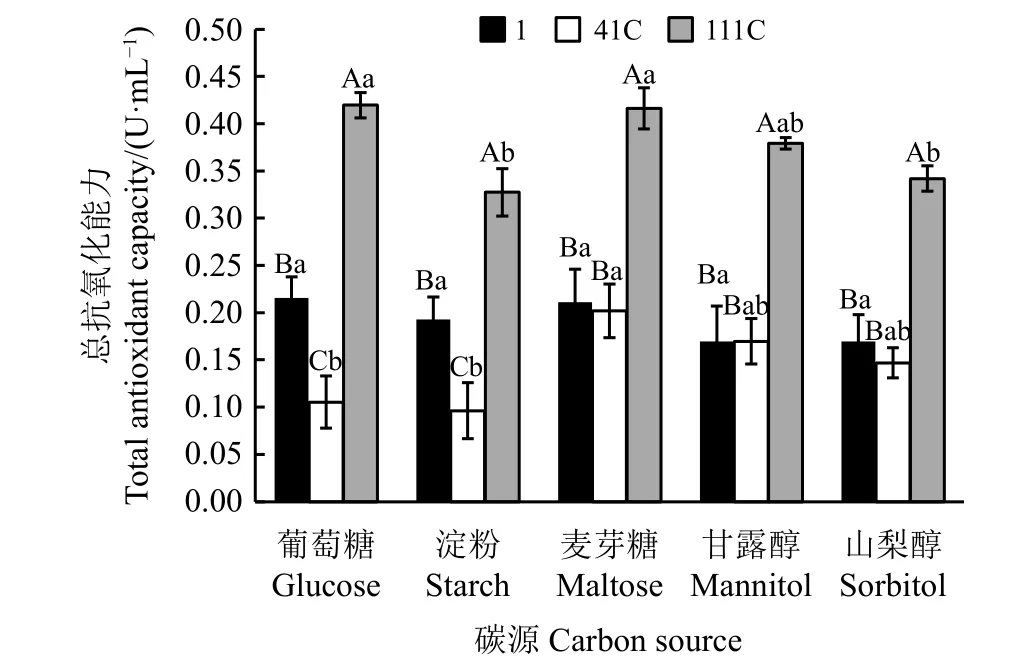
图1 不同碳源条件下Epichloë sinensis菌株的发酵液的总抗氧化能力Figure1 Total antioxidant capacitiesof fermented extractsof Epichloë sinensis grown using different carbon sources
2.2 不同氮源对Epichloë sinensis 生长的影响
2.2.1不同氮源对Epichloë sinensis菌落直径的影响
3株Epichloë sinensis菌株在不同氮源条件下的菌落直径存在明显差异(P<0.05),其中3株中华羊茅菌株在以尿素为氮源时均不生长,且菌株111C的菌落直径在除尿素外的不同氮源条件下均显著高于菌株41C和1(P<0.05)(表2)。在以胰蛋白胨、氯化铵和酵母浸粉为处理的条件下,3株菌株的菌落直径均有显著差异(P<0.05),且菌落直径表现为111C>41C>1;以蛋白胨为处理的条件下,111C的菌落直径显著大于菌落41C和1(P< 0.05)。
氮源对3株内生真菌菌株的菌落直径均有明显影响(P< 0.05),3株菌株均不能吸收利用尿素(表2)。菌株1和41C的菌落直径在除尿素外的不同氮源培养基上有显著差异(P<0.05),在有胰蛋白胨的培养基上的菌落直径均显著高于其余4种培养基(P<0.05),其余4种有蛋白胨、氯化铵、酵母浸粉和尿素的培养基上菌落直径均有显著差异(P<0.05),菌株1 和41C的菌落直径表现为胰蛋白胨>蛋白胨> 氯化铵>酵母浸粉> 尿素。菌株111C的菌落直径则表现为胰蛋白胨>蛋白胨>酵母浸粉>氯化铵>尿素。
2.2.2不同氮源对Epichloë sinensis菌丝直径的影响
3株Epichloë sinensis菌株在除尿素外的不同氮源条件下的菌丝直径存在明显差异(表2)。3株菌株的菌丝直径在以氯化铵、胰蛋白胨、蛋白胨为氮源的条件下均无显著差异(P>0.05),且以氯化铵为氮源时菌丝直径表现为41C> 1>111C、以蛋白胨为氮源时菌丝直径表现为41C > 111C>1、以胰蛋白胨为氮源时菌丝直径表现为111C> 1>41C,以酵母浸粉为氮源的条件下,菌株1和41C的菌丝直径显著高于菌株111C(P< 0.05)。

表2 不同氮源条件下Epichloë sinensis 生长4周的菌落直径Table 2 Colony diameters,hypha diametersand mycelium biomass of Epichloë sinensis grown using different nitrogen sourcesfor 4 weeks
不同氮源对3株内生真菌菌株的菌丝直径均有明显影响(表2)。菌株1的菌丝直径在不同氮源培养基上有显著差异(P<0.05),在有酵母浸粉的培养基上的菌丝直径显著高于其他成分培养基(P<0.05),而有氯化铵的培养基上的菌丝直径显著高于蛋白胨、胰蛋白胨培养基(P<0.05)。菌株41C的菌丝直径在不同氮源培养基上有显著差异(P<0.05),有酵母浸粉、氯化铵的培养基上的菌丝直径显著高于其他2种培养基(P<0.05),而在有蛋白胨的培养基上的菌丝直径显著高于胰蛋白胨培养基(P<0.05)。菌株111C的菌丝直径在不同氮源培养基上有显著差异(P<0.05),有酵母浸粉、氯化铵的培养基上的菌丝直径显著高于蛋白胨、胰蛋白胨培养基(P< 0.05)。
2.2.3不同氮源对Epichloë sinensis菌丝鲜重的影响
3株Epichloë sinensis菌株在不同氮源条件下的菌丝鲜重存在明显差异(表2)。3株菌株的菌丝鲜重在以胰蛋白胨、氯化铵为处理的条件下,3株菌株的菌丝鲜重均有显著差异(P<0.05),且菌丝鲜重表现为111C >1>41C;以酵母浸粉为处理的条件下,3 株菌株的菌丝鲜重均有显著差异(P<0.05),且菌丝鲜重表现为111C>41C>1;以蛋白胨为处理的条件下,菌株111C的菌丝鲜重显著大于菌株1和41C(P< 0.05)。
不同氮源对3株内生真菌菌株的菌丝鲜重均有明显影响(表2)。菌株1的菌丝鲜重在不同氮源培养基上有显著差异(P<0.05),在有胰蛋白胨的培养基上的菌丝鲜重显著高于其他3种培养基(P<0.05),而有蛋白胨的培养基上的菌丝鲜重显著高于酵母浸粉、氯化铵培养基(P<0.05)。菌株41C的菌丝鲜重在不同固体培养基上有显著差异(P<0.05),在有酵母浸粉、胰蛋白胨、蛋白胨的培养基上的菌丝鲜重显著高于氯化铵培养基(P<0.05)。菌株111C 的菌丝鲜重在不同固体培养基上有显著差异(P<0.05),在有胰蛋白胨的培养基上的菌丝鲜重显著高于其他3种培养基(P<0.05),而有蛋白胨的培养基上的菌丝鲜重显著高于酵母浸粉和氯化铵培养基上的(P<0.05)。
2.2.4不同氮源对Epichloë sinensis总抗氧化能力的影响
3株Epichloë sinensis菌株在不同氮源条件下的总抗氧化能力存在明显差异(图2)。在以尿素、氯化铵、酵母浸粉为氮源的条件下,3株菌株的总抗氧化能力均有显著差异(P<0.05),且总抗氧化能力均表现为111C>1>41C。在以蛋白胨为氮源的条件下,菌株1的总抗氧化能力显著高于菌株111C和41C(P<0.05)。在以胰蛋白胨为氮源的条件下,菌株1、111C 的总抗氧化能力显著高于菌株41C(P<0.05)。
不同氮源对3株内生真菌菌株的总抗氧化能力均有明显影响(P<0.05) (图2)。菌株1的总抗氧化能力在不同氮源发酵液中有显著差异(P<0.05),在有酵母浸粉的发酵液中的总抗氧化能力显著高于其他成分发酵液(P<0.05),而在有尿素的发酵液中的总抗氧化能力显著高于胰蛋白胨、氯化铵发酵液(P<0.05)。菌株41C的总抗氧化能力在不同氮源发酵液中有显著差异(P<0.05),在有酵母浸粉的发酵液中的总抗氧化能力显著高于其他成分发酵液(P<0.05),在有尿素、蛋白胨的发酵液中的总抗氧化能力显著高于胰蛋白胨、氯化铵发酵液(P<0.05),且在有胰蛋白胨、氯化铵的发酵液中的总抗氧化能力均差异显著(P<0.05)。菌株111C的总抗氧化能力在不同氮源发酵液中均有显著差异(P<0.05),总抗氧化能力表现为酵母浸粉> 尿素> 胰蛋白胨 > 蛋白胨> 氯化铵。

图2 不同氮源条件下Epichloë sinensis菌株的发酵液的总抗氧化能力Figure 2 Total antioxidant capacities of fermented extracts of Epichloë sinensis grown using different nitrogen sources
3 讨论与结论
Epichloë内生真菌通过促进宿主中华羊茅地上、地下生物量增加以及提高可溶性渗透调节物质含量、植物激素含量等来增强中华羊茅逆境胁迫的抗性[14-17]。因此内生真菌的生长和代谢在中华羊茅生长发育中发挥着重要作用。碳氮源是内生真菌生长所需的最基本营养因子,对其研究具有重要意义。Kulkarni 和Nielsen[28]研究发现在不同碳源及氮源条件下,高羊茅(Festuca arundinacea)内生真菌的菌落直径存在差异,该内生真菌在以甘露醇为碳源、胰蛋白胨为氮源的条件下生长的最好。Li 等[29]亦发现醉马草(Achnatherum inebrians)内生真菌对10种碳源和11种氮源的利用能力各不相同,其中蔗糖是最容易利用的碳源,酵母浸膏是最容易利用的氮源。本研究发现,碳源中菌株1和41C对葡萄糖的利用能力最强,111C对麦芽糖的利用能力最强;氮源中,3株E. sinensis菌株均对胰蛋白胨的利用能力最强。3株E. sinensis菌株在以尿素为氮源的发酵液上均不能正常生长,说明E. sinensis基本上不能以尿素作为氮源。
内生真菌有严格的寄主特异性,即同一种宿主植物中分离出的内生真菌为同一种,但是从不同生态型宿主分离出的内生真菌的形态特征以及生长特性具有丰富的多样性[12]。杨洋[19]从采自甘肃甘南的中华羊茅种子中分离出48株内生真菌,在菌株培养的过程中发现48株内生真菌的生长速度、菌落特征和孢子形态存在差异。王美宁[21]对不同地理区域采集的中华羊茅种子中分离出的5株内生真菌在添加维生素、植物生长调节剂及金属离子的条件下进行培养,发现从不同地理区域中华羊茅种子中分离出的内生真菌菌株在每个处理条件下存在显著差异。本研究选取从3个不同生态型中华羊茅种子中分离出的内生真菌,以进一步明确宿主生态型对E. sinensis最适碳氮源选择的影响。结果发现,3 株E. sinensis在最适碳氮源的选择上仅菌株111C 的最适碳源与其他菌株不同,说明宿主生态型对E. sinensis最适碳氮源的选择影响不大。
此外,内生真菌是一种具有较大潜力的天然抗氧化剂。王梦亮等[30]研究2株红景天(Sedum rosea)内生真菌的抗氧化活性,发现2株内生真菌发酵物的1,1-二苯基-2-三硝基苯肼(DPPH,1,1-Diphenyl-2-Picrylhydrazyl)自由基清除能力、羟基自由基清除能力、超氧阴离子清除能力较强。刘雅莉等[31]研究21株蒺藜(Tribulus terrestris)内生真菌的抗氧化与自由基清除能力,发现21株内生真菌的发酵物均具有一定的抗氧化作用。本研究结果表明,3株E.sinensis菌株均有一定的抗氧化能力,菌株111C的总抗氧化能力最强。在不同碳源条件下,不同菌株的总抗氧化能力差异不显著,说明碳源对E.sinensis的总抗氧化能力影响不大。在不同氮源条件下,不同菌株的总抗氧化能力亦有差异,3株内生真菌均在以酵母浸粉为氮源的条件下,总抗氧化能力最强。而E. sinensis产生抗氧化能力的原因尚未明确,下一步应致力于研究E. sinensis内生真菌的发酵产物,探究其产生抗氧化能力的原因。
