北极新奥尔松地区藻类可培养附生细菌多样性研究
2021-07-23孙晓梦樊守金
孙晓梦 樊守金
(1山东师范大学生命科学学院, 山东 济南 250014;2山东大学微生物技术国家重点实验室, 山东 青岛 266237)
提要 为研究北极地区海洋藻类可培养附生细菌的多样性, 利用稀释平板法自2019年7月采集的北极新奥尔松地区的海洋红藻多管藻(Polysiphonia sp.)样品中分离纯化得到60株可培养的藻类附生细菌。16S rRNA基因序列测定分析表明所分离的藻类附生细菌主要隶属于γ-变形菌纲(39株, 65%), 其次隶属于放线菌纲(10株, 17%)和黄杆菌纲(8株, 13%), 仅有少量隶属于α-变形菌纲(2株, 3%)和芽孢杆菌纲(1株, 2%), 其中的优势细菌属为Psychrobacter属(22株, 37%)和Pseudoalteromonas属(12株, 20%)。此次获得了较多极地藻类多管藻的附生细菌菌株, 初步揭示了多管藻可培养附生细菌的多样性, 为多管藻自身以及其附生细菌生态功能及应用开发研究奠定了基础。
0 引言
藻类是海洋环境中极为重要的资源, 它们种类繁多, 作为生产者在海洋生态系统中起着重要作用。藻类在生长过程中向环境释放糖类、氨基酸、脂类、酶和毒素等成分, 使藻体周围形成独特“藻际微环境”, 简称“藻际”(phycosphere)[1-2]。“藻际”间存在相同的或特异性的藻类附生和浮游细菌群落[3-4]。浮游细菌被认为是藻类附生细菌的主要来源, 对藻类附生细菌群落组成有重要影响[5-6], 附生细菌也可能扩散到浮游细菌中[7-8];而藻类自身特性、不同生长阶段的分泌物及藻类生长的环境条件(如pH值、水流、光照、温度和养分)也影响附生细菌群落的组成[9-10]。这些藻类附生菌与藻类间存在着复杂的相互作用关系, 主要表现为互利共生、拮抗和竞争等作用, 研究藻类附生细菌多样性可以促进对藻菌藻际相互作用关系及其机制的了解。Lachnit等[11]利用DGGE与16S rRNA文库构建相结合的技术分别于2007—2008年连续两年的春季和秋季, 对基尔峡湾的褐藻(Fucus vesiculosus)、红藻(Gracilaria vermiculophylla)、绿藻(Ulva intestinalis)的附生菌群落结构进行了分析。结果发现海洋大型藻类藻体表面具有物种特异性和时间适应性的附生细菌生物膜, 其中寄主特异性细菌组合要么避免了真核生物幼虫的定殖, 要么表现出强大的抗菌活性,在藻类生存中发挥重要作用。近年来, 海洋大藻类已成为微生物多样性和生物活性次生代谢物的丰富来源[12], 多管藻(Polysiphoniasp.)隶属于红藻门(Rhodophyta)、红藻纲(Rhodophyceae)、仙菜目(Ceramiales)、松节藻科(Rhodomelaceae)、多管藻属(Polysiphonia), 有丰富的生物活性物质, 而且具有一定的抗菌、抗氧化、抗肿瘤等多种生理活性。以往的研究多针对于温带地区多管藻附生细菌的应用研究, 对于极地多管藻的附生细菌的应用研究较少: Romanenko等[13]从日本海滨红藻样品(PolysiphoniaGreville, 1823, family Rhodomelaceae)中分离出隶属于3个细菌门(变形菌门、放线菌门和厚壁菌门)12个细菌属的80株附生细菌, 其中变形菌门占优势。北极地区由于其独特的地理环境与气候特征, 蕴含丰富独特的极地藻类和微生物资源, 藻类附生细菌群落组成具有特殊性。本文采集了北极新奥尔松地区的多管藻样品, 进一步研究了这类极地藻类样品中可培养附生细菌的多样性, 为北极藻类附生微生物的生态作用及应用开发研究奠定了基础。
1 实验方法
1.1 材料
1.1.1 样品的采集
于2019年7月利用无菌剪刀和容器采集北极王湾新奥尔松附近的潮间带多管藻(Polysiphoniasp.)样品(11°42′3.24″, 78°57′36.72″)。所采集藻类样品经适当分装后置于无菌容器中于4℃保存,空运(24小时)至实验室进一步处理。
1.1.2 2216E培养基(g·L-1)
蛋白胨5.0, 酵母粉1.0, 柠檬酸铁0.1, 氯化钠19.45, 氯化镁5.98, 硫酸钠3.24, 氯化钙1.8,氯化钾0.55, 碳酸钠0.16, 溴化钾0.08, 氯化锶0.034, 硼酸0.022, 硅酸钠0.004, 氟化钠0.0024,硝酸钠0.0016, 磷酸氢二钠0.008, pH值7.4~7.8。2216E固体培养基配制时添加15.0琼脂。
1.1.3 琼胶唯一碳源培养基(g·L-1)
氯化铵0.5, 氯化钠30.0, 六水氯化镁3.0, 硫酸钾2.0, 磷酸氢二钾0.2, 氯化钙0.01, 六水氯化铁0.006, 七水钼酸钠0.005, 二水氯化铜0.004,Tris 6.0, 琼胶10.0, pH值7.5~8.0。
1.2 方法
1.2.1 菌株分离和保藏
取多管藻样品少许, 用灭菌的天然海水对其进行三次冲洗, 去除表面杂物后将样品悬浮在20~30 mL无菌海水中, 剧烈震荡1 min, 取震荡后的溶液与无菌海水以1∶9的比例混合, 梯度稀释至浓度为10-1、10-2、10-3、10-4、10-5和10-6的菌液, 每个稀释度的菌液100μL菌液涂布在含2216E固体培养基的平板上, 每个梯度做三个重复。将涂布后的平板置于在15℃下培养, 培养3周后挑取平板上不同形态的菌落在含新鲜培养基的平板上进行多次划线分离纯化。获得纯培养的菌株接种于含5 mL 2216E液体培养基试管内,15℃振荡培养3~5 d, 获得的培养液添加20%甘油(v·v-1)后于-80 ℃低温保存。
1.2.2 基因组DNA的提取
菌株接种于含5 ml 2216E液体培养基试管内,15℃振荡培养3~5 d, 培养液10000 rpm离心获得菌体, 利用BioTeKe的细菌基因组提取试剂盒(BioTeKe Corporation公司, 北京)按照操作说明提取。
1.2.3 PCR扩增及产物测序
扩增分离菌株16S rRNA基因所用引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-GGTTACCTTGTTACGACTTC-3′)[14]。
PCR 反应体系: Nuclease-free Water 9.4 µL,2×TransTaq® HiFi PCR SuperMix 10µL, 27F 0.2 µL,1492R 0.2 µL, 细菌基因组DNA(模板)0.5 µL。
PCR反应条件: 94℃, 5 min; 94℃, 30 s, 55℃,30 s, 72℃, 90 s, 30个循环; 72℃, 10 min。
PCR产物直接送至青岛擎科测序公司经纯化后利用ABI 3730XL DNA测序仪进行两端测序,去除不确定碱基后, 利用ChromasPro软件进行序列拼接, 获得不同附生细菌的16S rRNA基因序列。
1.2.4 系统发育树的构建
所有可培养附生菌的16S rRNA基因序列利用Blastn程序在GenBank数据库进行序列相似性搜索, 获取序列相似性较高的菌株信息, 若两种细菌的16S rDNA序列同源性低于98%, 可以认为属于不同种[15]。采用软件MEGA 7.0[16]利用Neighbor-Joining法和Kimura 2-parameter model构建系统进化树。系统树各分支的自举检验值(bootstrap values)由1000次重复检验获得。
2 结果与分析
2.1 多管藻附生细菌分类结果
从多管藻的表面分离可培养附生细菌60株。基于16S rRNA基因序列相似性对比, 发现它们隶属于4个细菌门 [变形菌门(Proteobacteria), 放线菌门(Actinobacteria), 拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)]中的12个属。这些菌株大部分(65%)属于变形菌门, 隶属于γ-变形菌纲(γ-Proteobacteria)中的Pseudoalteromonas(12株)、Halomonas(1株)、Psychrobacter(22株)、Cobetia(2株)、Shewanella(1株)和Marinomonas(1株)6个属以及α-变形菌纲(α-Proteobacteria)中的Paracoccus(1株)和Yoonia(1株)2个属; 少部分菌株(30%)属于放线菌门和拟杆菌门, 隶属于放线菌纲(Actinobacteria)的Salinibacterium属(10株)和黄杆菌纲(Flavobacteriia)的Winogradskyella(4株)、Brumimicrobium(4株)2个属。仅有1株菌株属于厚壁菌门杆菌纲(Bacilli)的Planomicrobium属。将所有菌株的16S rRNA基因序列在NCBI的BLAST中进行两两比对, 序列相似度高于98.5%的菌株视为同种菌株, 各菌株分类隶属关系见表1。

表1 多管藻各可培养附生细菌分类隶属关系Table 1.Taxonomic affiliation of epiphytic bacterial strains isolated from the Polysiphonia sp.
有56.6%的分离菌株隶属于γ-变形菌纲(γ-Proteobacteria)的Psychrobacter(22株)和Pseudoalteromonas(12株)两个细菌属, 这两属的成员在海洋低温环境中分布广泛; 有16.6%(10株)的分离菌株隶属于放线菌纲(Actinobacteria)的Salinibacterium属, 这些分离菌株均与该属来自海水细菌种Salinibacterium amurskyense亲缘关系接近。隶属于其他9属的分离菌株均少于5株,说明其相对丰度较低。
将多管藻的各稀释梯度分离出的附生细菌种属分布相对比, 结果如图1所示, 从各稀释梯度分离得到的附生细菌存在较大差异性: γ-变形菌纲(γ-Proteobacteria)中Psychrobacter属在7个梯度中均存在, 且在大部分梯度中占比较大,Pseu-doalteromonas属在100~10-3梯度中存在, 且占比较大; 放线菌纲(Actinobacteria)的Salinibacterium属和黄杆菌纲(Flavobacteriia)的Winogradskyella属在较低的稀释梯度存在, 但占比较小; 其他8个属均仅在某一梯度存在, 不占优势。进一步证明了γ-变形菌纲(γ-Proteobacteria)在所分离细菌中的优势地位。

图1 多管藻的可培养附生细菌菌群属水平上比较Fig.1.Comparison of community compositions of the cultivable epiphytic bacteria of the Polysiphonia sp.on the genus level
2.2 16S rRNA基因序列分析
基于16S rRNA基因序列构建的分离菌株的系统进化树见图2。其中分离菌株H-3-4-2、H-3-5-1、H-3-5-5、H-3-5-8、H-3-5-10和H-3-5-11与数据库中已知细菌种模式菌株的16S rRNA 基因序列的相似性均小于98.0%, 可能代表细菌新的种(属)。其中H-3-4-2与Marinomonas属的Marinomonas ushuaiensis模式菌株16S rRNA 基因序列的相似性为97.46%, H-3-5-1、H-3-5-8、H-3-5-10和H-3-5-11与Brumimicrobium属的Brumimicrobium mesophilum模式菌株16S rRNA基因序列的相似性分别为97.84%、97.75%、97.34%和97.70%, 而菌株H-3-5-5与Yoonia属的Yoonia sediminilitoris模式菌株16S rRNA 基因序列的相似性为95.46%, 并且在进化树中均形成独立分支。这些说明北极多管藻中蕴含新型菌株资源。
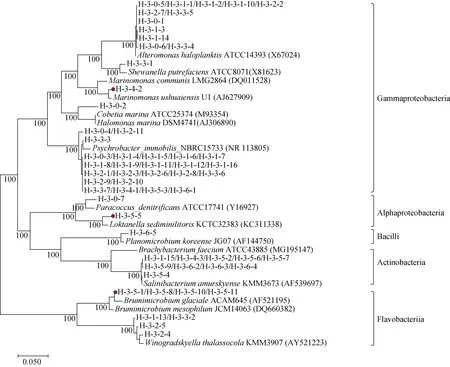
图2 利用NJ法基于16S rRNA基因序列构建的北极多管藻附生细菌的系统进化树Fig.2.A neighbor-joining phylogenetic tree based on the 16S rRNA gene sequences of 60 Epiphytic bacteria from the Arctic Polysiphonia algae (accession numbers are given in parentheses)
2.3 降解琼胶的附生细菌筛选
由于多管藻的多糖组分与琼胶较为相似[17],并且琼胶酶在分子生物学、水产养殖以及原生质体的制备中有较大的应用前景[18], 因此对筛选出的附生菌株进行琼胶酶的初步筛选, 挑取纯化的单菌落涂布在琼胶的唯一碳源培养基上, 培养一段时间后观察生长状况, 初步判断菌株的琼胶降解能力, 结果如表2所示:Cobetia crustatorum、Marinomonas ushuaiensis、Paracoccus sediminilitoris、Pseudoalteromonas distincta、Pseudoalteromonas fuliginea、Pseudoalteromonas nigrifaciens、Pseudoalteromonas translucida、Psychrobacter fozii、Psychrobacter nivimaris、Psychrobacter okhotskensis和Winogradskyella undariae11种菌株可以在琼胶的唯一碳源培养基上生长, 其中Pseudoalteromonas和Psychrobacter两个细菌属占比较大, 可以初步判定它们有琼胶降解能力。

表2 多管藻各可培养附生细菌琼胶降解能力Table 2.Agar-degrading ability of epiphytic bacterial strains isolated from the Polysiphonia sp.
3 讨论
利用培养的方法研究微生物多样性具有一定局限性[19-20], 但目前依然是调查藻类附生细菌常用手段。本文利用稀释平板法从北极潮间带采集的1种海洋红藻多管藻中获得60株附生细菌菌株,它们隶属于放线菌纲、α-变形菌纲、芽孢杆菌纲、黄杆菌纲和γ-变形菌纲等五纲中12个细菌属, 所获得细菌菌株主要集中分布在 γ-变形菌纲Pseudoalteromonas属和Psychrobacter属及放线菌纲Salinibacterium属中。苗祯等[21]对5株北极微藻的不同生长时期的附生细菌和游离细菌的16S rRNA基因进行PCR以及DGGE 分析, 研究发现5株微藻具有不同的藻际微生物群落结构组成, 每个藻株的主要附生微生物群落组成差异显著, 说明藻类附生细菌群落组成与藻类的种类密切相关。Bidle等[22]通过对海洋环境中的硅藻的附生细菌分析也发现它们主要由γ-变形菌纲组成,仅有极少数α-变形菌纲, 同时发现γ-变形菌纲的菌株在藻类生长的延滞期、指数期和稳定期都作为优势定殖者持续存在于硅藻表面, 这与本文多管藻附生细菌群落中γ-变形菌纲成员为优势类群的结论一致, 说明了γ-变形菌纲的成员可能具有较强的藻类表面定殖和生存能力。并且有研究表明γ-变形菌纲不仅在藻类附生菌中占优势地位, 在北极其他海洋环境中也广泛存在且占优势地位, γ-变形菌纲可以在多种不同浓度的碳源上快速生长的[23], 进一步说明了γ-变形菌纲具有较强生存能力。
王子峰等[24]利用TCBS培养基从多管藻(Polysiphonia urceolata)表面分离得到6株细菌。生理生化试验和gyrB基因序列分析结果表明6株细菌都属于变形菌门Vibrio属。Lyudmila等[25]从日本海滨红藻样品(PolysiphoniaGreville, 1823,family Rhodomelaceae)中分离到5株革兰氏阴性需氧嗜盐菌, 并进行了分类研究。根据16S rRNA基因序列分析, 5株分离株隶属于放线菌门Labrenzia属。Romanenko等[13]从日本海滨红藻样品(PolysiphoniaGreville, 1823, family Rhodomelaceae)中分离到的细菌隶属于Pseudovibrio、Labrenzia、Sphingomonas(α-变形菌纲);Cobetia、Shewanella、Vibrio(γ-变形菌纲);Microbacterium、Dietzia、Agrococcus、Streptomyces(放线菌门);Bacillus、Paenibacillus(拟杆菌门)。Goecke等[26]认为在大型藻类的附生细菌中通常存在变形菌门和拟杆菌门的细菌。Bakunina等[27]从鄂霍次克海的红藻样品Polysiphoniasp.分离研究拟杆菌门菌株的糖苷酶活性, 发现Winogradskyella细菌属在数量上占重要地位, 但缺少糖苷酶活性, 可能对藻类生长起其他重要作用。将本文结果与以往研究对比发现, 多管藻的附生细菌多集中在4个细菌门 (变形菌门、放线菌门、拟杆菌门和厚壁菌门)中, 但是在细菌种属分类甚至是细菌科的分类上差异较大。研究表明革兰氏阴性菌在海洋中占据主要地位, 与藻类相关的革兰氏阳性异养菌的占比较少[28], 例如在红藻Delesseria sanguineawere和囊藻Fucus vesiculosus中分离的166株附生细菌中仅有1株细菌属于Salinibacterium属[29], 在以往的关于多管藻的研究中也少有革兰氏阳性菌的报道, 但是本次采集的多管藻附生细菌中Salinibacterium属占比较大(16.7%),这可能与北极地区多管藻自身的性质有关。
藻类附生细菌常产生多种生物活性物质[30-34],包括酶类及小分子的抗菌物质等, 以助其在藻类表面定殖及生存[33]。交替单胞菌属、芽孢杆菌属、假交替单胞菌属、假单胞菌属、链霉菌属和弧菌属细菌是常见的可产生抗菌物质的的藻类附生菌[31-32]。根据以往的报道, 多管藻本身具有较好的抗菌能力[35-36], 由于藻际菌藻相互作用的关系, 多管藻的附生细菌也可能有较好的抗菌能力。本文所分离附生细菌中Psychrobacter、Pseudoalteromonas和Salinibacterium属菌株占有优势, 这3个属菌株均具有较强的低温酶及小分子抗菌物质产生能力[29,37-39], 对可能有琼胶降解能力的菌株进行了初步筛选, 通过表2我们可以发现降解菌株主要集中在Pseudoalteromonas和Psychrobacter两个细菌属中, 与前人研究一致, 但是对于本文所获得藻类附生细菌其他低温酶和抑菌活性物质的进一步筛选研究工作正在进行中。
本研究对北极新奥尔松地区海洋藻类多管藻可培养附生细菌多样性做了初步研究, 获得了较多的藻类附生细菌菌株, 这为研究极地藻类附生细菌的生态作用及其开发应用奠定了基础。
