儿童侵袭性肺炎链球菌感染的血清型和耐药性
2021-07-23吕志勇姚开虎宋文琪甄景慧孟庆盈苏建荣
吕志勇,姚开虎,宋文琪,董 方,甄景慧,孟庆盈,苏建荣
(1. 首都医科大学附属北京友谊医院临床检验中心,北京 100050; 2. 国家儿童医学中心 首都医科大学附属北京儿童医院检验中心,北京 100045; 3. 国家儿童医学中心 首都医科大学附属北京儿童医院 北京市儿科研究所 儿科学国家重点学科 教育部儿科重大疾病研究重点实验室,北京 100045)
肺炎链球菌(Streptococcuspneumoniae)是儿童社区获得性肺炎的主要病原菌,为条件致病菌,可引起肺炎、鼻窦炎、中耳炎等非侵袭性疾病以及脑膜炎、败血症、胸膜炎等侵袭性疾病(invasive pneumococcal disease,IPD)。青霉素是临床治疗肺炎链球菌感染的首选药物,随着抗菌药物的广泛使用,肺炎链球菌的耐药率不断升高,给肺炎链球菌感染的治疗带来了挑战,尤其是侵袭性肺炎链球菌感染的治疗挑战更严峻。侵袭性肺炎链球菌感染导致的疾病负担沉重,且可造成持久不良后果。了解侵袭性肺炎链球菌感染的临床特征,肺炎链球菌血清型及对抗菌药物的耐药特点,可为疫苗设计、免疫策略和临床预防提供数据支持。本研究回顾性分析2014年1月—2018年12月74例侵袭性肺炎链球菌感染患儿的临床资料、药敏试验和血清分型结果,分析感染患儿的临床特征,对抗菌药物的耐药性,以及疫苗对其血清型覆盖的情况。
1 对象与方法
1.1 研究对象 2014年1月—2018年12月首都医科大学附属北京儿童医院收治的无菌部位(血液、脑脊液、胸腔和腹腔积液、硬膜下积液)分离出肺炎链球菌,并有完整的住院病历记录的侵袭性肺炎链球菌感染患儿,回顾性收集患儿的临床资料,包括性别、年龄、患病季节、临床表现和预后等。
1.2 菌种来源 研究对象无菌部位标本中分离的肺炎链球菌,剔除同一患儿标本中分离的重复菌株。若患儿血及脑脊液标本中均分离出肺炎链球菌,则将脑脊液分离株纳入分析;若患儿血和胸腔积液标本同时分离出肺炎链球菌,则将血标本分离株纳入分析。
1.3 菌株培养方法 参照《全国临床检验操作规程》[1]进行操作,将胸腔积液,耳后硬膜下积液和腹腔积液标本接种于哥伦比亚血平板,37℃ 5% CO2孵育16~18 h。血标本和脑脊液标本注入血培养瓶,放入BD BACTEC FX血培养仪,仪器报阳后转种哥伦比亚血平板37℃ 5% CO2孵育16~18 h。
1.4 菌株分离与鉴定 按照《全国临床检验操作规程》,根据典型菌落形态进行Optochin试验,初筛阳性菌株,使用美国BD公司Phoenix 100 全自动微生物分析仪进行菌株鉴定。
1.5 血清型分型 采用荚膜肿胀试验进行血清型分型,分型试剂盒Pneumotest kit和分型特异性血清购自丹麦血清研究所。
1.6 药敏检测 回顾性分析药敏试验结果,按照2020年临床实验室标准化协会(CLSI)推荐的药物敏感性试验标准统一对结果进行判读。质控菌株为肺炎链球菌ATCC 49619。
1.7 统计学方法 应用WHONET 5.6和SPSS 17.0软件进行数据分析。非正态分布计量数据采用中位数(P25,P75)表示,组间比较采用卡方检验或Fisher’s确切概率法,P≤0.05为差异具有统计学意义。
2 结果
2.1 一般资料 共纳入74例侵袭性肺炎链球菌感染患儿,其中男性38例,女性36例,男女比例为1.06∶1。年龄为2.0(0.92,3.0)岁,其中脑膜炎组年龄为2.5(0.95,3.0)岁,非脑膜炎组年龄为2.0(0.83,3.0)岁。患儿年龄分布主要为幼儿期(1~3 岁,占55.4%),其次为婴儿期(<1 岁,占24.3%)。感染部位以单部位血液为主(占44.6%),但两个部位感染者占28.4%。感染季节以春季为主(占32.4%),其次为冬季(占28.4%)。见表1。
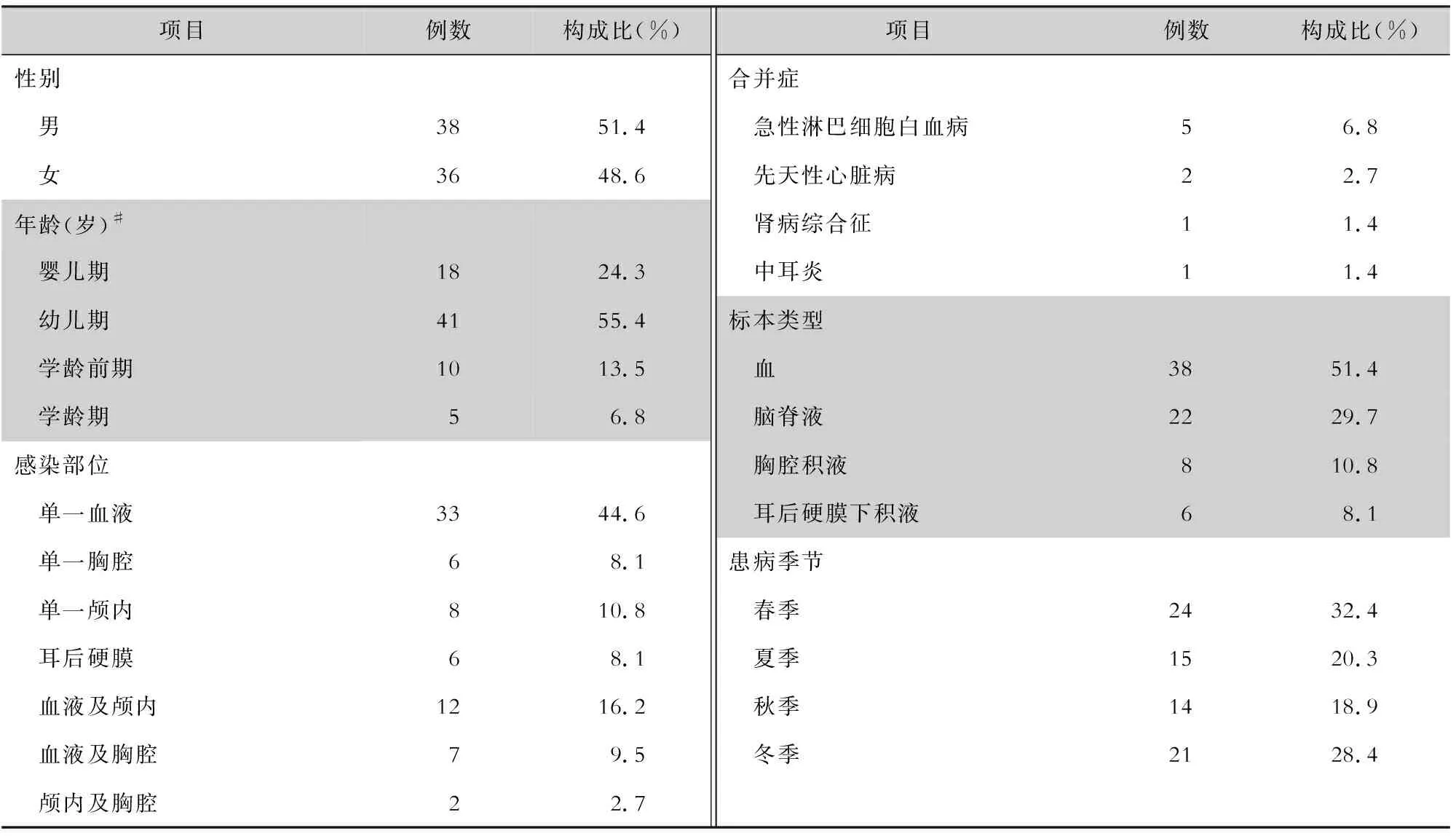
表1 74例侵袭性肺炎链球菌感染患儿的临床资料
2.2 血清型分布 74株肺炎链球菌分为13种血清型,其中血清型19F的检出率最高,占36.5%(27株),其次为血清型19A(21.6%,16株)、血清型14(14.9%,11株)、血清型23F(8.1%,6株),其他血清型占18.9%(14株)。脑膜炎组与非脑膜炎组肺炎链球菌血清型均以19F检出率最高,各年龄组肺炎链球菌血清型除学龄期组外,其余组均以19F和19A检出率最高。见表2。
2.3 疫苗覆盖情况 肺炎链球菌疫苗PCV7对肺炎链球菌菌株的总覆盖率为63.5%,PCV13的覆盖率为97.3%。其中PCV7对分离自脑脊液和非脑脊液菌株的覆盖率分别为59.1%、65.4%; PCV13对分离自脑脊液菌株和非脑脊液菌株的覆盖率为100.0%、96.2%。见表2。

表2 儿童侵袭性肺炎链球菌不同来源分离株血清型分布及疫苗覆盖情况
2.4 药敏结果 74株肺炎链球菌中,包括32株青霉素敏感肺炎链球菌(PSSP)和42株青霉素不敏感肺炎链球菌(PNSP),未检测出对利奈唑胺、万古霉素、莫西沙星和左氧氟沙星耐药的菌株,对红霉素和克林霉素耐药率高,耐药率>96%。非脑脊液标本分离株中,26株对青霉素敏感,22株对青霉素中介,4株对青霉素耐药;对头孢噻肟、头孢吡肟、美罗培南的耐药率分别为23.1%、26.9%、63.5%。脑脊液标本分离株中,6株对青霉素敏感,16株对青霉素耐药。脑脊液分离的耐青霉素肺炎链球菌(PRSP)菌株,对青霉素、头孢吡肟和美罗培南的耐药率>75%,对头孢噻肟和氯霉素的耐药率分别为37.5%、6.3%;脑脊液分离的PSSP菌株对所有测试抗菌药物除四环素、红霉素和克林霉素外均敏感。对青霉素、头孢吡肟和美罗培南的耐药率,脑脊液分离株与非脑脊液分离株比较差异均有统计学意义(均P<0.05)。见表3。
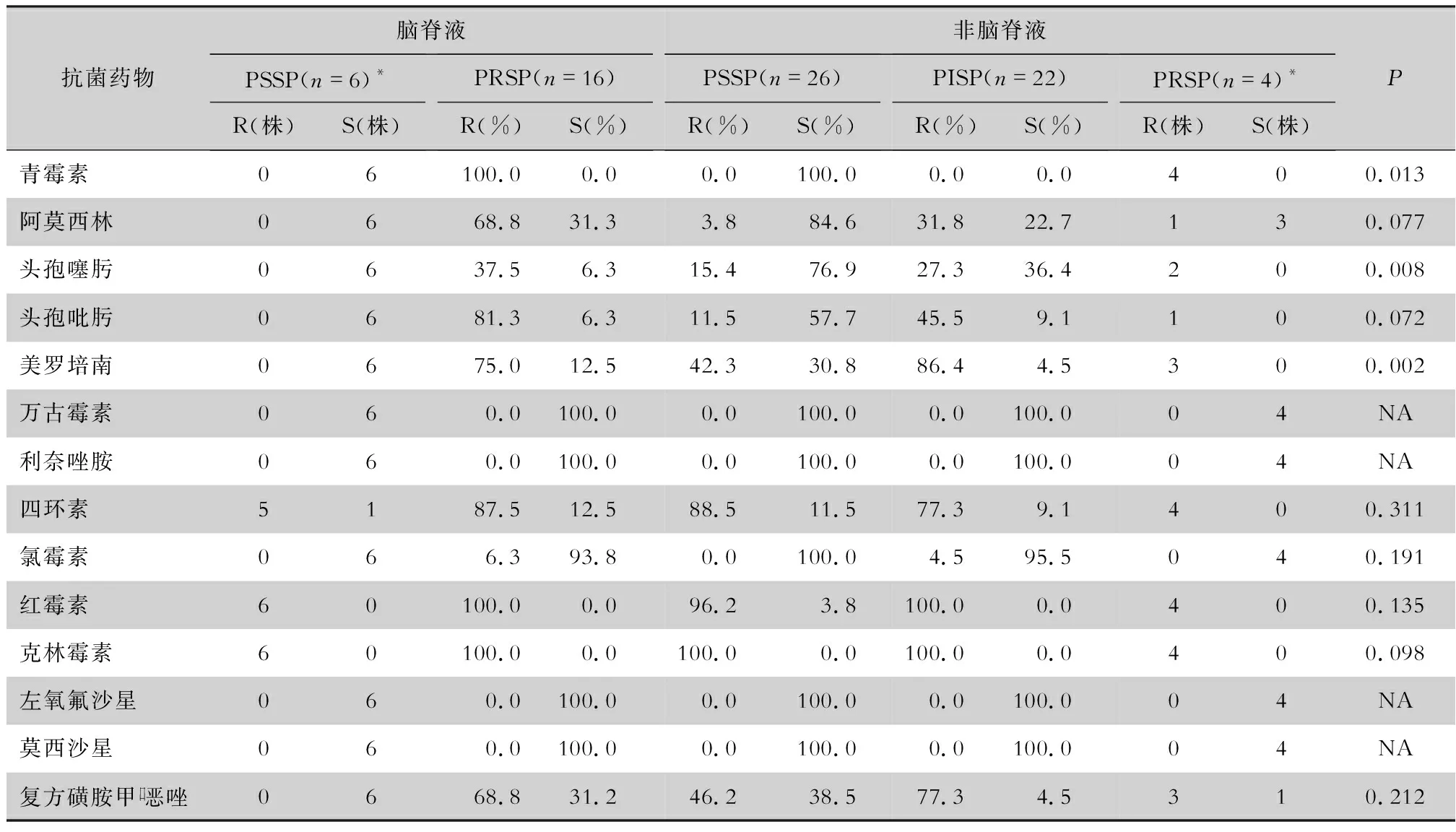
表3 肺炎链球菌对抗菌药物的药敏结果

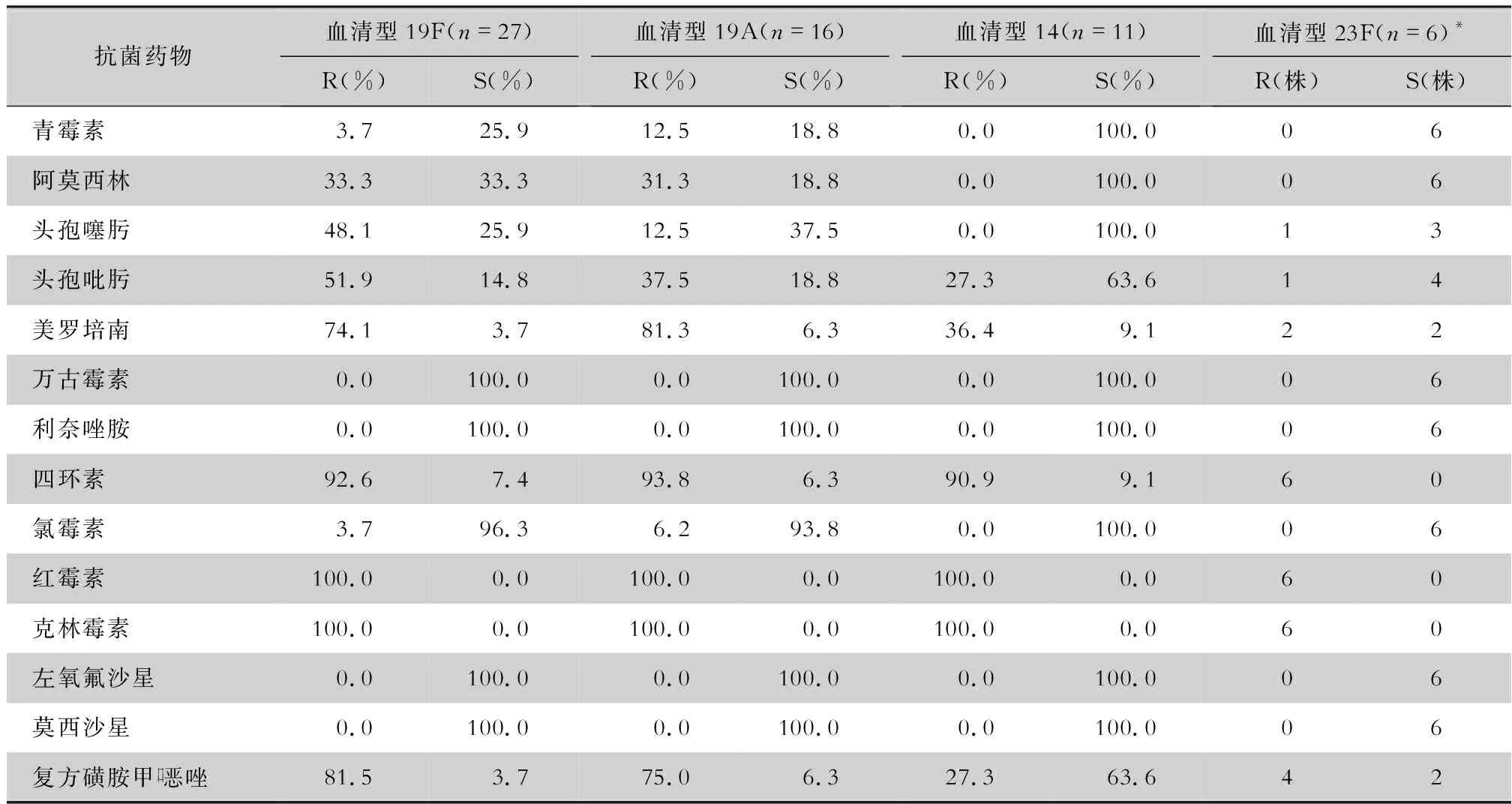
表4 不同血清型肺炎链球菌对抗菌药物的药敏结果
2.6 转归与预后 62例患儿痊愈出院,10例患儿死亡,2例患儿未治愈放弃治疗出院。直接死因为枕骨大孔疝或化脓性脑膜炎继发枕骨大孔疝。
3 讨论
肺炎链球菌可正常定植于鼻咽部,属于条件致病菌,当机体免疫力低下时可引起中耳炎、鼻窦炎等非侵袭性疾病,若细菌入血可引起更严重的菌血症、败血症和骨髓炎等IPD[2]。世界卫生组织(WHO)报道,全球每年约160万人因肺炎链球菌感染而死亡,而5岁以下儿童的死亡人数约为70万~100万,已成为儿童健康的主要威胁[3]。
IPD存在年龄相关易感性,主要侵犯6月龄~2岁的婴幼儿[4]。本研究肺炎链球菌感染病例中1岁以下患儿占比为24.3%,3岁以下患儿占比79.7%,6岁以下患儿的占比更是达到93.2%,与WHO有关发展中国家以幼儿发病率高的报道[5]相符。随着儿童自身免疫水平的提高,3岁以上患儿肺炎链球菌感染率逐渐下降,但由于IPD的病情复杂且致死率更高,已引起全球健康工作者的重视。本研究患儿患病季节以春季和冬季为主,与有关文献[6-7]报道结果相似,但与深圳地区的报道[8]不同,表明不同地区IPD的流行季节存在差异。IPD多见于血流感染及中枢神经系统感染[9],本研究中单一血流感染的患儿为33例(44.6%),为最常见的感染类型,高于国内一项IPD多中心研究中血流感染的占比(20.4%)[10]。本研究中血流感染占比高,可能与临床医生病原学检测意识提高,血培养采集时间合理、送检及时,以及与微生物室检验人员大量的临床沟通有关。存在基础疾病的患儿IPD发生风险高,特别是免疫抑制、血液肿瘤[11]以及先天性心脏病的患儿。本研究中发现血液系统疾病以及先天性心脏病患儿更易发生IPD,提示应加强对血液肿瘤以及先天性心脏病患儿的疾病管理,降低肺炎链球菌感染发生率。
肺炎链球菌外表面附着一层不易着色的荚膜,是其重要的致病因子,荚膜具有群、型特异性,根据肺炎链球菌荚膜多糖结构差异,目前可将肺炎链球菌划分为46个血清群和90多个血清型。本研究中脑膜炎分离株与非脑膜炎分离株均以血清型19F、19A、14和23F为主,各年龄组血清型分布也以19F、19A、14和23F为主。尤其以19F的占比最高,与国内相关文献[12]报道结果相似,也有报道[13]苏州地区人群以血清型6、19F和14为主。国外研究表明,肺炎链球菌血清型美国主要以血清型35B为主[14],加拿大主要流行血清型为19A、7F和3[15],德国地区流行血清型为14、3、7F、1和23F[16],日本流行血清型为6B、23F和19F[17],与本研究结果有较大差异,不同国家、不同地区的肺炎链球菌血清型流行情况不同,存在明显的地区差异。肺炎链球菌荚膜多糖疫苗是目前预防肺炎链球菌感染最主要的措施,疫苗的设计基于肺炎链球菌荚膜多糖的群、型特异性。应用于儿童的疫苗主要是7、10和13价疫苗(PCV-7,PCV-10,PCV-13),而应用于成人的是23价肺炎球菌纯多糖疫苗(PPV-23)。PCV-7对本研究中分离自脑脊液和非脑脊液分离株的覆盖率均低于PCV-13,因PCV-13包含了本院占比第二高的血清型19A。目前常见的肺炎链球菌疫苗PCV13涵盖了占比最高的四种血清型,对脑脊液分离株及非脑脊液分离株的覆盖率达100.0%和96.2%,说明推广疫苗接种对肺炎链球菌侵袭性感染的预防会起到十分明显的效果。值得注意的是,学龄期患儿组中这4种常见血清型的构成比明显下降,而除此以外的其他血清型比例则明显升高。此现象一方面反映了疫苗接种在降低疫苗覆盖血清型的流行率方面非常成功,另外一方面也说明了肺炎链球菌血清型重排现象,及非疫苗血清型(non-vaccine types,NVT)与其所致的IPD比例有所增高[18]。此现象能够对美国在进行PCV-7免疫接种数年后,非疫苗覆盖血清型19A比例升高的现象作出合理的解释。同样的情况,欧洲国家在引进肺炎链球菌7价疫苗(PCV-7)后,血清型 19A、7F、3和1成为流行的主导血清型[19]。因此,在推广肺炎链球菌疫苗接种的同时,也应监测血清型的变化,为新疫苗的研发及卫生策略的调整提供数据支持。
青霉素是治疗肺炎链球菌感染的首选药物,但随着临床治疗上抗菌药物的大量使用,肺炎链球菌对抗菌药物的耐药率在逐渐升高,给临床治疗干预带来了严峻考验[20]。非脑脊液分离的PRSP和PISP检出率分别为7.7%、42.3%,高于2018年CHINET监测数据的1.7%、8.9%[20],脑脊液分离的PRSP和PSSP检出率分别为72.7%、27.3%,高于2018年CHINET监测数据的24.6%、24.2%[21]。本院PRSP和PISP的检出率高与收治来自全国各地重症患儿有关,且转院的患儿很大一部分在首诊医院进行过抗菌药物治疗。肺炎链球菌对青霉素的主要耐药机制是细菌细胞壁上青霉素结合蛋白(PBPs)的构象发生改变,使其与抗菌药物亲和力发生改变,导致对青霉素不敏感。肺炎链球菌对红霉素的高耐药率提示大环内酯类抗生素已不能作为治疗链球菌感染时青霉素的替代药物。本研究未检出对利奈唑胺和万古霉素耐药的菌株,与既往报道[22]结果一致。氯霉素和喹诺酮类抗菌药物(莫西沙星、左氧氟沙星)的敏感率均大于95%,但喹诺酮类药物可对儿童软骨发育造成不良影响,因此儿童禁止使用。
本研究提示肺炎链球菌血清型和耐药性有一定的相关性,与国内相关报道[23-24]一致。不同血清型的肺炎链球菌对抗菌药物的耐药性有明显差异,流行率越高的血清型其耐药率往往也偏高,与其暴露于抗菌药物的频率增加有关,从而更易引发菌种变异及耐药率的升高。
综上所述,肺炎链球菌感染多见于婴幼儿,可引发多种IPD,通过接种疫苗可获得预防效果。非脑脊液分离的肺炎链球菌对β-内酰胺类抗生素敏感性好,尤其是青霉素,但对多种抗菌药物的耐药率总体上在逐年升高,多重耐药模式也日趋显著,不同血清型菌株对抗菌药物的耐药率存在一定的差异,流行率高的血清型往往表现出更高的耐药性。因此,在临床工作中应加强肺炎链球菌的培养鉴定和耐药性的监测,根据药敏试验结果合理选用抗菌药物。
