piggyBac转座子AgoPLE1.1在黑腹果蝇种系转化中的应用
2021-07-20张浩淼王晓芳罗光华韩湘豫王秋霞韩召军
张浩淼, 王晓芳, 罗光华, 韩湘豫, 王秋霞, 韩召军, 吴 敏,*
(1. 南京农业大学植物保护学院, 南京 210095; 2. 江苏省农业科学院植物保护研究所, 南京210014)
在转基因研究中发挥重要作用的DNA转座子有果蝇Drosophila的P因子、Tc1/Mariner家族的Minos、hAT家族的Hermes、Mariner家族的Mos1和piggyBac转座子(PB)家族的IFP2。研究表明,果蝇P因子在天然宿主以外的生物中没有活性(O′Brochta and Atkinson,1996);Tc1/Mariner家族转座子不仅转座频率较低(Drabeketal., 2003),并且其携带外源基因的能力有限(Dingetal., 2005);Hermes因子转化整合完整基因的精确度和可靠性有问题(Sarkaretal., 1997)。只有PB家族的IFP2因子,不但能够在生物染色体中精确地剪切和转座,能够携带较大的外源基因,而且具有广泛的适用范围。事实证明,PB转座系统不仅在半翅目、鞘翅目、鳞翅目、双翅目和膜翅目的几十种昆虫中实现了种系转化,而且在真涡虫、疟原虫、斑马鱼、大鼠、猪、人和小鼠等哺乳动物细胞体内也实现了高效转化(Handleretal., 1998; Horn and Wimmer, 2000; Loboetal., 2006; Carotietal., 2015)。由于PB转座系统的安全高效,该系统在细胞免疫疗法中显示出巨大的潜力,正在开发针对多种人类疾病的相关细胞,如人体诱导多功能干细胞(human induced pluripotent stem cells, hiPSCs)和人T细胞等的修饰(Kajietal., 2009; Nakazawaetal., 2009; Wangetal., 2018);此外PB转座系统可以与靶向基因编辑技术CRISPR/Cas9结合,提高CRISPR/Cas9系统所敲入基因的持续表达能力(Chenetal., 2015; Chengetal., 2016)。综上所述,PB转座系统是一个非常具有应用潜力的转基因工具。
PB转座子最初是从粉纹夜蛾Trichoplusiani中分离得到的真核生物DNA转座子。经基因组序列分析和同源基因克隆发现,PB转座子广泛分布于真菌、植物、尾索动物、甲壳动物、昆虫、鱼类、两栖动物以及哺乳动物等生物的基因组中(Sarkaretal., 2003)。由于受宿主选择压的作用,PB转座子大部分已经发生了不同程度的变异,但仍有部分保留着完整结构与转座酶活性,甚至转座活性。Hikosaka等(2007)在爪蟾Xenopustropicalis中发现了一个具有天然剪切活性的TxpB_Uribo2因子;我们在棉铃虫Helicoverpaarmigera、银锭夜蛾Macdunoughiacrassisigna、小地老虎Agrotisypsilon和棉蚜Aphisgossypii中也发现了大量的PB类似因子,其中有些因子,例如棉蚜的AgoPLE1.1,不仅结构完整,而且可以在果蝇S2细胞中进行精确的剪切(Sunetal., 2008; Wuetal., 2008, 2011; Luoetal., 2011)。本研究在前期研究的基础上,拟通过系列试验阐明AgoPLE1.1因子在黑腹果蝇Drosophilamelanogaster中的转化活性及其转座特点,探讨该PB类似因子AgoPLE1.1开发为新型昆虫转基因载体的可能性。
1 材料与方法
1.1 供试昆虫
黑腹果蝇W1118品系由东南大学发育与疾病相关基因实验室提供。黑腹果蝇用由玉米粉 50 g/L、酵母粉25 g/L、蔗糖110 g/L和琼脂4 g/L做成的人工饲料饲养,实验室饲养条件为温度25±2℃,相对湿度60%~70%,光周期16L∶8D。
1.2 供试试剂
LA Taq DNA聚合酶, dNTP, DNA Marker和Genome Walking试剂盒都购自宝生物工程(大连)有限公司;凝胶纯化试剂盒购自Axygen公司;质粒小提试剂盒购自Omega公司;无内毒素质粒提取试剂盒购自Qiagen公司;pEASY-T3 Cloning Kit和感受态细胞Trans5α购自北京全式金公司;限制性内切酶购自Thermo公司; T4连接酶购自Promega公司;地高辛杂交检测试剂盒Ⅱ(化学发光法)购自Roche公司。
1.3 转基因载体构建
将质粒pBacHsp(由美国加州大学河边分校T.A.Miller教授惠赠)用ApaⅠ和Pf123Ⅱ进行双酶切去除IFP2转座酶序列,在AgoPLE1.1转座酶序列两端加上ApaⅠ和Pf123Ⅱ酶切位点后与去除IFP2转座酶的pBacHsp载体骨架相连接,构成辅助质粒pAgoHsp。 通过PCR扩增将载体pXLBacII-PubDsRed(由美国农业部Alfred M.Handler惠赠)上的IFP2的末端反向重复序列(ITR)替换成AgoPLE1.1转座子的ITR序列,构建供体质粒pXLAgo-PUbDsRed。PCR反应体系: 10×LA Taq Buffer 5 μL, 上下游引物(10 pmoL)各2.5 μL, dNTP Mixture 8 μL, 模板DNA 200 ng, TaKaRa LA Taq DNA聚合酶0.5 μL, 无菌水补足50 μL。PCR程序: 94℃预变性1 min; 98℃变性 10 s, 68℃退火 15 s, 72℃延伸2 min, 共30个循环; 72℃ 10 min, 12℃保持。载体构建引物见表1。分别提取无内毒素的辅助质粒和供体质粒DNA,置于-20℃备用。
1.4 黑腹果蝇的显微注射
显微注射的方法参考Spradling和Rubin(1982)。 用1.3节构建好的辅助质粒pAgoHsp和供体质粒pXLAgo-PubDsRed DNA分别以170 ng/μL∶400 ng/μL, 90 ng/μL∶200 ng/μL和90 ng/μL∶100 ng/μL的浓度进行混合,分别注射1 083, 1 000和1 023粒新鲜的W1118黑腹果蝇胚胎。将注射完成的胚胎放入培养箱。经6~24 h培养后,把孵化出的幼虫转移至培养瓶中饲养。每头羽化出的成虫分别与W1118黑腹果蝇回交,挑取后代中发出红色荧光的个体即为转基因黑腹果蝇。
1.5 Southern杂交
以供体质粒pXLAgo-PubDsRed DNA为模板,在其3′端设计上游引物和下游引物进行PCR扩增。PCR反应体系: 2×PrimeSTAR Max Premix 12.5 μL, 上下游引物(10 pmoL)各1 μL, 模板DNA 200 ng, 无菌水补足25 μL。PCR程序: 94℃预变性5 min; 94℃变性 30 s, 52℃退火 30 s, 72℃延伸40 s, 共35个循环; 72℃ 10 min, 12℃保持。获得573 bp DNA片段的纯化PCR产物。以纯化后的573 bp DNA片段为模板,根据地高辛探针合成试剂盒步骤合成DNA探针。提取黑腹果蝇3个转基因株系F1, F2和F3的基因组DNA,将10 μg基因组DNA用限制性内切酶EcoRV完全酶切后用等体积酚∶氯仿抽提纯化,进行Southern杂交检测,以供体质粒pXLAgo-PubDsRed DNA作为阳性对照。用化学发光检测系统扫描发光信号,曝光时间为3 h,记录实验结果。
1.6 转座子插入位点旁侧序列的PCR扩增
为了获得AgoPLE1.1转座子在黑腹果蝇基因组中插入位点的旁侧序列,采用染色体步移技术根据供体质粒pXLAgo-PubDsRed序列设计特异引物(表1)。以转基因果蝇基因组DNA为模板,以Genome Walking试剂盒中提供的兼并引物与特异引物进行热不对称PCR反应,通过3次巢式 PCR 扩增即可获取AgoPLE1.1转座子插入位点的序列,将克隆的旁侧DNA序列送至公司进行序列测定后利用Genedoc软件与供体质粒pXLAgo-PubDsRed序列进行比对分析,去除载体序列后在Flybase数据库中进行BLAST比对,明确AgoPLE1.1转座子插入位点所在的黑腹果蝇的染色体。

表1 本研究所用引物
2 结果
2.1 AgoPLE1.1在黑腹果蝇中的转化
将供体质粒pXLAgo-PubDsRed和辅助质粒pAgoHsp以400 ng/μL∶170 ng/μL, 200 ng/μL∶90 ng/μL和100 ng/μL∶90 ng/μL 3种不同的浓度混合,分别注射了1 083, 1 000和1 023粒新鲜W1118黑腹果蝇胚胎,3组胚胎分别孵化并羽化出成虫(G0)155, 151和234头;将羽化的每一头成虫分别单独与W1118黑腹果蝇回交,3组中分别有138, 130和146对回交产生了后代(G1),可育率分别是89.03%, 86.09%和62.39%。;3组可育后代中各筛选到1株转基因果蝇,它们分别被命名为F1(2♂+1♀), F2(1♂+1♀)和F3(1♂+3♀)。这3个株系(F1, F2和F3)及其后代果蝇可在激发光波长下产生红色荧光(图1)。因此,AgoPLE1.1转座子可以在黑腹果蝇中进行种系的转化,3次转化实验的转基因频率分别为1.94%, 1.32%和1.71%。

图1 AgoPLE1.1转座子转化的转基因黑腹果蝇
2.2 AgoPLE1.1转座子在黑腹果蝇染色体中的插入
Southern杂交结果表明,探针在阳性对照样品中杂交获得一条大小为7 kb左右的条带,与供体质粒pXLAgo-PubDsRedDNA 7 155 bp的大小相符;3个转基因株系(F1, F2和F3)的果蝇各检测到3个清晰的杂交条带,F1和F2有一条大小一致的4.3 kb条带,F2和F3有两条大小一致的6.5和8.5 kb杂交条带(图2)。因此,3个株系的杂交条带一共有6个,大小分别为3.9, 4.3, 6.5, 7.2, 8.5和9.4 kb,说明AgoPLE1.1转座子在每个转基因株系的黑腹果蝇中至少有3个插入位点。
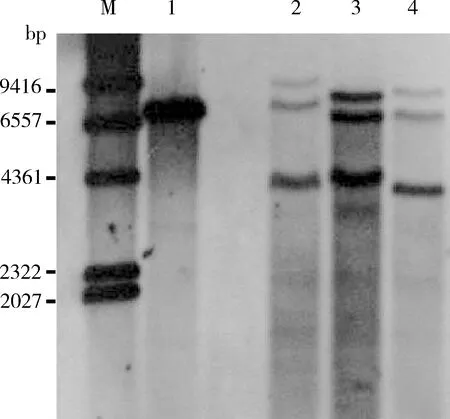
图2 AgoPLE1.1转座子转化的转基因黑腹果蝇的Southern杂交分析
2.3 AgoPLE1.1转座子插入位点旁侧序列
为了进一步验证AgoPLE1.1转座子在黑腹果蝇染色体中的插入特性,我们利用染色体步移技术克隆获得了转基因果蝇中AgoPLE1.1转座子插入位点的旁侧序列。通过与供体质粒pXLAgo-PUbDsRed序列的比对,把转座子供体序列与果蝇染色体序列进行区分,并将染色体序列在Flybase数据库中进行BLAST比对。结果表明,F1株系中AgoPLE1.1转座子插入黑腹果蝇3R和2L染色体,F2株系中AgoPLE1.1转座子插入3L和2L染色体,F3株系中AgoPLE1.1转座子插入3L和X染色体。其次,插入位点的旁侧序列表明,AgoPLE1.1转座子在黑腹果蝇中的剪切和转座是非精确的,与精确剪切相比,3个转基因株系的AgoPLE1.1转座子插入果蝇染色体时5′端缺失了256~612 bp不等,3′端整合了210~800 bp不等的供体质粒序列(图3)。

图3 AgoPLE1.1转座子插入黑腹果蝇染色体位点序列分析
3 讨论
AgoPLE1.1转座子是在棉蚜基因组中克隆的PB类似因子,AgoPLE1.1编码完整的转座酶并具有17 bp的末端反向重复序列(Luoetal., 2011)。前期的研究表明AgoPLE1.1转座子具有开发为昆虫转基因载体的潜力,本研究率先在黑腹果蝇中检测其转化活性。根据本实验室显微注射果蝇胚胎的经验:辅助质粒和供体质粒不同的比例和浓度会影响DNA转座子在宿主体内的转化频率。因此,本研究将辅助质粒pAgoHsp和供体质粒pXLAgo-PubDsRed的DNA以170 ng/μL∶400 ng/μL, 90 ng/μL∶200 ng/μL和90 ng/μL∶100 ng/μL 3个不同的浓度比例进行混合,并分别注射黑腹果蝇胚胎。结果表明,AgoPLE1.1转座子在黑腹果蝇中具有种系转化的活性,转化频率为1.32%~1.94%;AgoPLE1.1转座子在黑腹果蝇染色体中的插入拷贝数大于等于3个;插入位点旁侧序列揭示AgoPLE1.1转座子在黑腹果蝇中的剪切和转座是非精确的,不仅整合了供体质粒的部分骨架,还缺失了AgoPLE1.1转座子5′端部分的序列。该结果与AgoPLE1.1转座子在果蝇S2细胞中精确剪切的试验结果(Luoetal., 2011)不一致。原因可能是AgoPLE1.1 转座子在不同的细胞环境和活体环境中时,AgoPLE1.1转座酶活性产生差异,转座酶对靶位点的识别作用会有不同,以及酶的剪切活性也会发生变化,从而导致AgoPLE1.1转座子的转座行为发生改变。据此推测,AgoPLE1.1转座子可能具有较强的宿主因子的依赖性。
因此,与普遍应用的PB转基因载体IFP2相比,AgoPLE1.1转座子不能够像IFP2那样在活体昆虫中进行“无缝切除”(Handleretal., 1998),它不仅会携带有供体质粒DNA序列,而且转座子自身序列会产生不确定的缺失;其次,AgoPLE1.1转座子在黑腹果蝇中的转化频率远低于IFP2在黑腹果蝇中的26%(Handler and Harrell, 1999),AgoPLE1.1转座子可能有较强的宿主因子依赖性。基于上述特征的比较得出结论:AgoPLE1.1转座子不具有进一步开发为高效的昆虫转基因载体的潜力,但是其在棉蚜体内仍然保留有转座活性的特点引起对PB转座系统的稳定性和安全性的思考。已有文献报道:hAT家族的hobo转座子能够与类似因子Hermes和Homer产生交互作用,引起转基因的不稳定现象(Sundararajanetal., 1999; Raphaeletal., 2004)。由于PB转座子及其类似因子广泛地存在于诸多生物体中,除了本研究已报道的活性因子AgoPLE1.1,Hikosaka等(2007)报道的爪蟾Xenopus中的一个具有天然剪切活性的TxpB_Uribo2因子外,Wu等(2011)还报道了一个IFP2高度类似因子McrPLE也具有剪切活性。这些报道只是众多活性PB类似因子的冰山一角,尽管这些内源PB转座子的转座活性较低,但是在应用PB转座系统进行基因操作时,这些具有活性的内源性PB类似因子也有可能对PB转座系统介导的外源基因进行切除或转移,使转基因产生不确定的变异。因此,PB转座系统和PB活性类似因子之间的交互识别作用是急需研究和解决的一个科学问题。
