基于锰掺杂硫化锌量子点磷光信号增强快速标定多粘菌素B的研究
2021-07-16杨佳佳
杨佳佳, 赵 禹
山西师范大学生命科学学院, 山西 临汾 041000
多粘菌素B (polymyxin B,PMB)是从多粘芽胞杆菌中分离得到的一种阳离子多肽类抗生素,因具有高效的抗菌活性而广泛用于泌尿系统感染、脑膜炎及皮肤粘膜感染等疾病的治疗.然而,在医学使用过程中PMB剂量控制不当会造成人体急性肾损伤、皮肤色素沉着等副作用[1],因此,口服及注射PMB时一般需要严格的剂量控制.目前可用于PMB测定的方法主要有高效液相色谱-质谱法[2]、毛细管电泳法[3]、化学发光酶免疫分析法[4]等.由于PMB较低的紫外吸收且无本底荧光,用于检测PMB的常规方法一般较为复杂.因此,在医学使用PMB的过程中急需一种能快速检测PMB的方法.近年来,新型纳米光学材料相继涌现,为各种传感与检测方法的构建提供了良好的基底材料.量子点作为一种典型的纳米光学材料,因具备优良的荧光或磷光性能而备受广大学者青睐,相应地,各种荧光、磷光量子点的类型也日趋丰富[5~7].相比于各种荧光量子点,磷光量子点因可有效规避生物基质中自体荧光的干扰从而非常适用于复杂生物样品基质中目标分子的检测,典型的如:锰掺杂硫化锌量子点.目前,以锰掺杂硫化锌量子点为基底材料,基于聚集诱导、电子转移、能量共振转移等多种磷光信号响应策略也成功应用于各种目标分子传感与检测体系的构建[6],这些策略为各种目标物检测体系的构建提供了详尽的技术依据.
鉴于PMB医学使用过程中剂量标定的现实需求,本研究以锰掺杂硫化锌量子点为光学材料,尝试以磷光信号增强为检测体系构建策略,建立一种可快速检测和标定PMB的方法,并考察所建立方法的选择性与实际应用性能,以期为PMB医药制剂及其在医学使用过程中的剂量控制提供一种便捷的检测方法.
1 材料与方法
1.1 试剂与仪器
多粘菌素B(PMB)购于生工生物工程(上海)股份有限公司;3-巯基丙酸(MPA)、Zn2·Ac·2H2O、Mn2Ac·4H2O、Na2S·9H2O 购于北京百灵威科技有限公司;注射用硫酸多粘菌素B购自上海第一生化制药有限公司;其它所用试剂均为分析纯.
MPA包覆的锰掺杂硫化锌量子点溶液及反应溶液的磷光(RTP)强度通过Cary Eclipse型荧光分光光度计进行测定,激发波长与发射波长狭缝均设置为10 nm;MPA包覆的锰掺杂硫化锌量子微观形貌通过JEM-1 200EX 透射电镜进行表征;使用Shimadzu UV-29 100分光光度计进行UV-vis吸收光谱分析;量子点及PMB表面电势通过Zetasizer Nano ZS90 纳米粒度仪进行测定;溶液pH值采用PHS-3C pH计测定.
1.2 方法
1.2.1 量子点合成
MPA包覆的锰掺杂硫化锌量子点(简写为QDs)根据文献报道合成[8],在250 mL圆底烧瓶中依次加入0.1 mol·L-1的Zn2·Ac溶液5 mL、0.01 mol·L-1的Mn2Ac 溶液2 mL、0.04 mol·L-1的MPA 50 mL,充分混匀后,用1.0 mol·L-1的NaOH溶液调节溶液pH至11.0,在氮气氛围中于室温下反应30 min后,加入0.1 mol·L-1的Na2S溶液2 mL,继续反应20 min后,溶液于50 °C 陈化2 h,反应产物经醇沉蒸馏水清洗后真空干燥备用.
1.2.2 检测多粘菌素B
在10 mL系列比色管中依次加入2 mg·mL-1MPA包覆的锰掺杂硫化锌量子点溶液50 μL、500 μL PBS 缓冲液 (20 mM,pH=7.4)及不同浓度的PMB溶液,蒸馏水定容混合溶液至5 mL,混匀反应10 min后,于295 nm激发波长下测定反应溶液的磷光发射光谱,记录590 nm处的磷光发射强度.
1.2.3 多粘菌素B含量标定
PMB注射液用蒸馏水稀释至100 μg·mL-1,按照1.2.2试验步骤进行加标回收试验标定PMB含量.
2 结果与讨论
2.1 MPA包覆的锰掺杂硫化锌量子点的表征
采用高分辨透射电镜对所制备的锰掺杂硫化锌量子点的表观形貌进行表征显示:所制备的量子点分散均匀,粒径小于10 nm(图1A).从图1B可以看出,所制备量子点溶液在295 nm处具有明显的紫外吸收峰(curve 1),且在295 nm激发波长下于590 nm 处具有最大发射强度(curve 2),符合锰掺杂硫化锌量子点的最佳发射光谱[9],说明量子点被成功制备.
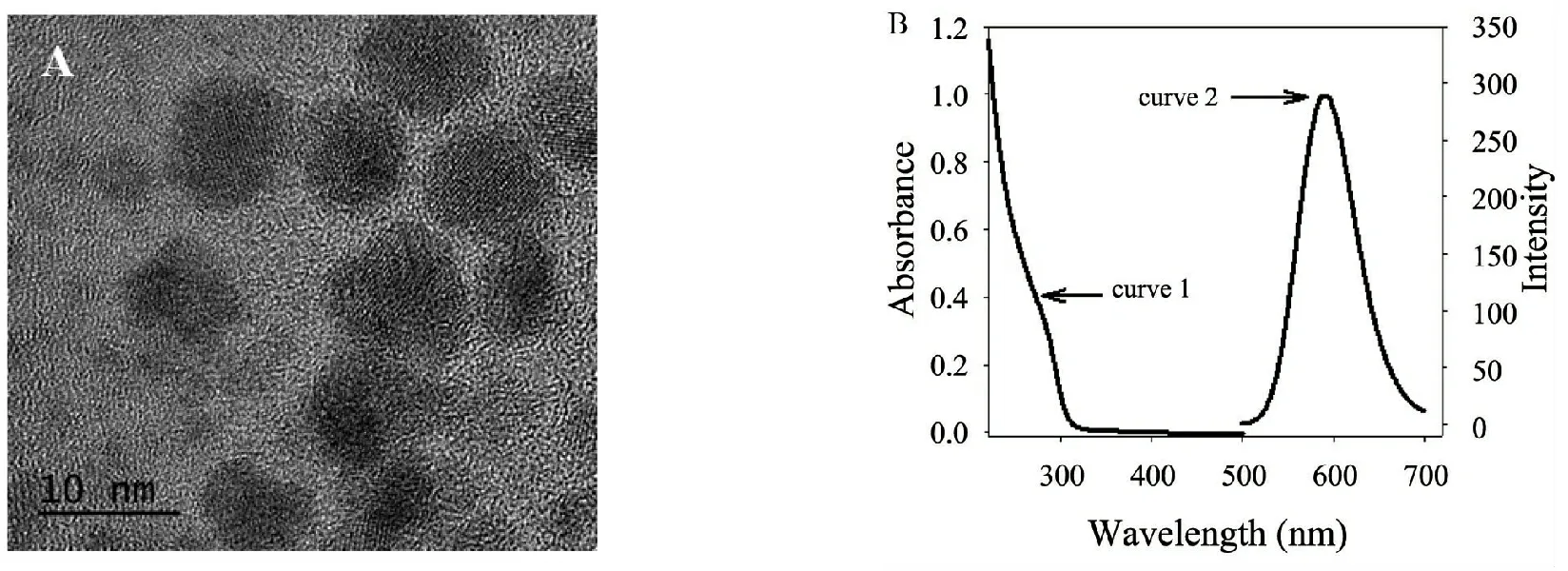
图1 (A)MPA包覆的锰掺杂硫化锌量子点透射电镜形貌(B)MPA包覆的锰掺杂硫化锌量子点的紫外吸收光谱(curve 1)及磷光发射光谱(curve 2)
2.2 检测方法构建
量子点发光性质与其表面性质及与化学物质之间的相互作用密切相关[10].一些无机离子、小分子或生物大分子与量子点的相互作用过程会导致量子点表面结构及电荷组成的改变,并改变量子点的发光性能[11,12].锰掺杂硫化锌量子点经MPA包覆后表面会呈现为明显的负电性,通过Zeta电势测定显示:水溶液中MPA包覆的锰掺杂硫化锌量子点表面电势约为-22.0,而PMB 作为一种阳离子多肽类抗生素Zeta电势约为+3.1(图2A).因此,PMB可通过静电相互作用使量子点发生聚集并影响量子点的室温磷光(RTP)强度.为了证实这一假设,首先分析了PMB对锰掺杂硫化锌量子点的磷光光谱的影响,结果如图2B所示:MPA包覆的锰掺杂硫化锌量子点溶液中加入PMB后,体系磷光强度随着PMB浓度的增加而逐渐增强,说明PMB可有效增强锰掺杂硫化锌量子点的RTP强度.为了确定PMB对锰掺杂硫化锌量子点RTP增强的原因,利用紫外-可见吸收光谱及共振光散射光谱(RLS)分析了PMB与锰掺杂硫化锌量子点之间的相互作用机制.从图2C可以看出,PMB无明显紫外吸收(curve 1),锰掺杂硫化锌量子点在200 nm~400 nm范围内存在明显的紫外吸收(curve 2),当在锰掺杂硫化锌量子点溶液中加入PMB后,体系的紫外吸收明显加强(curve 4),且这种加强效应并非量子点与PMB各自紫外吸收叠加所致(curve 3), 意味着二者之间存在明显的相互作用.进一步通过RLS光谱分析显示(图2D):PMB自身的 RLS强度非常低(图2D插图),但当PMB加入锰掺杂硫化锌量子点溶液后,随着PMB浓度的增加,锰掺杂硫化锌量子点溶液RLS强度逐渐增强,说明PMB与量子点相互作用的过程中可以使量子点发生聚集并形成更大的散射粒子.在量子点聚集过程中,量子点之间的距离相应缩短,量子点表面缺陷可被邻近量子点所修复,从而增强了量子点电子空穴复合发光[13].由此说明基于PMB锰掺杂硫化锌量子点之间的静电相互作用可用于PMB检测体系的构建.
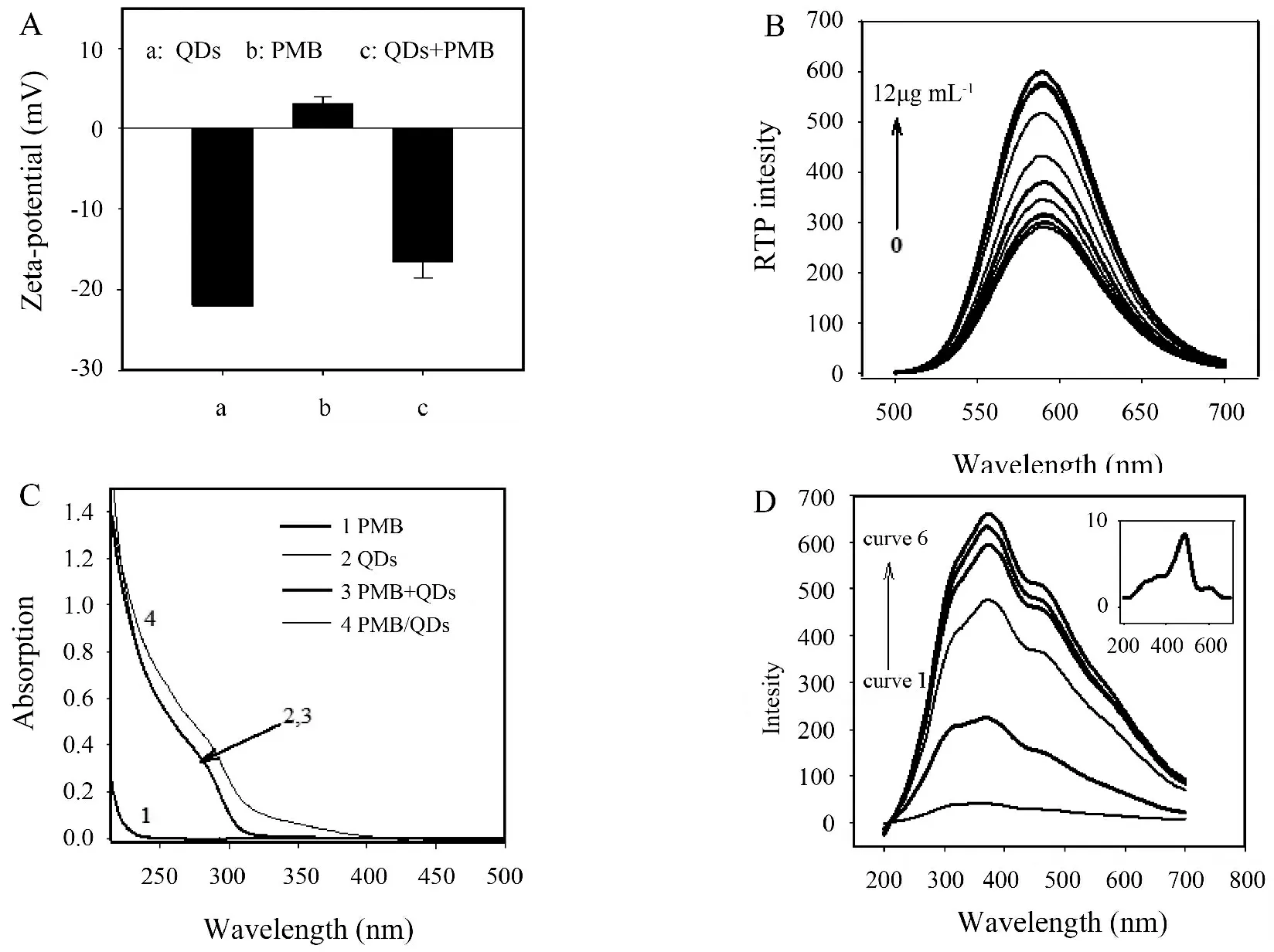
图2 (A)锰掺杂硫化锌量子点的Zeta电势(a), PMB的Zeta电势(b),锰掺杂硫化锌量子点/PMB复合体系Zeta电势(c);(B)锰掺杂硫化锌量子点和PMBS共存体系磷光发射光谱,PBS浓度为20 mmol·L-1, pH=7.4,PMB浓度分别为0 μg·mL-1、0.1 μg·mL-1、0.2 μg·mL-1、0.5 μg·mL-1、1.0 μg·mL-1、2.0 μg·mL-1、4.0 μg·mL-1、6.0 μg·mL-1、8.0 μg·mL-1、10.0 μg·mL-1、12.0 μg·mL-1;(C)紫外吸收光谱,PMBS (curve 1),锰掺杂硫化锌量子点(curve 2),锰掺杂硫化锌量子点与PMB紫外吸收光谱的叠加曲线(curve 3),锰掺杂硫化锌量子点与PMB 共存体系的紫外吸收曲线(curve 4),锰掺杂硫化锌量子点浓度:20 μg·mL-1,PMB:8 μg·mL-1,PBS 缓冲液:20 mmol·L-1,pH=7.4;(D)不同浓度PMB作用下,锰掺杂硫化锌量子点(20 μg·mL-1)的RLS 光谱,PMB浓度分别为0 μg·mL-1、2.0 μg·mL-1、4.0 μg·mL-1、8.0 μg·mL-1、10.0 μg·mL-1、12.0 μg·mL-1,插图为PMB的RLS 光谱(12.0 μg·mL-1).
2.3 检测条件优化
在pH为6.0~8.5范围内考察了PMB对锰掺杂硫化锌量子点RTP强度的影响,如图3A所示,当PMB存在时,锰掺杂硫化锌量子点RTP强度比(P/P0)随着pH值的增加而逐渐增强,当溶液pH值介于6.8~7.8之间时,QDs-PMB体系的RTP强度比保持相对稳定.因此,后续试验均在pH=7.4的PBS缓冲液中进行分析测定;通过考察不同反应时间下PMB对锰掺杂硫化锌量子点RTP强度的影响显示(图3B):在锰掺杂硫化锌量子点溶液中加入PMB反应10 min后,溶液RTP强度比(P/P0)不再随反应时间的增加而变化,因此选择10 min作为反应检测时间.
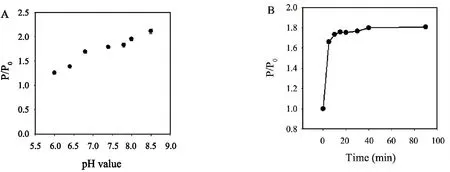
图3 (A)pH值对PMB增强锰掺杂硫化锌量子点RTP信号的影响;(B)反应时间对PMBS增强锰掺杂硫化锌量子点RTP信号的影响;PMB与量子点浓度分别为20 μg·mL-1与6.0 μg·mL-1.
2.4 灵敏性
通过分析不同浓度PMB对锰掺杂硫化锌量子点磷光强度的影响显示:随着PMB浓度的增加,锰掺杂硫化锌量子点溶液磷光强度逐渐增强,且磷光强度比(P/P0,P和P0分别表示加入与不加入PMB条件下锰掺杂硫化锌量子点的磷光强度)与PMB浓度在0.1 μg·mL-1~8.0 μg·mL-1范围内呈现出良好的线性响应关系(图4),线性方程为:P/P0=0.117CPMB+1.15,R2= 0.994;依据3σ/k检测限计算方法所计算的检出限为0.03 μg·mL-1.
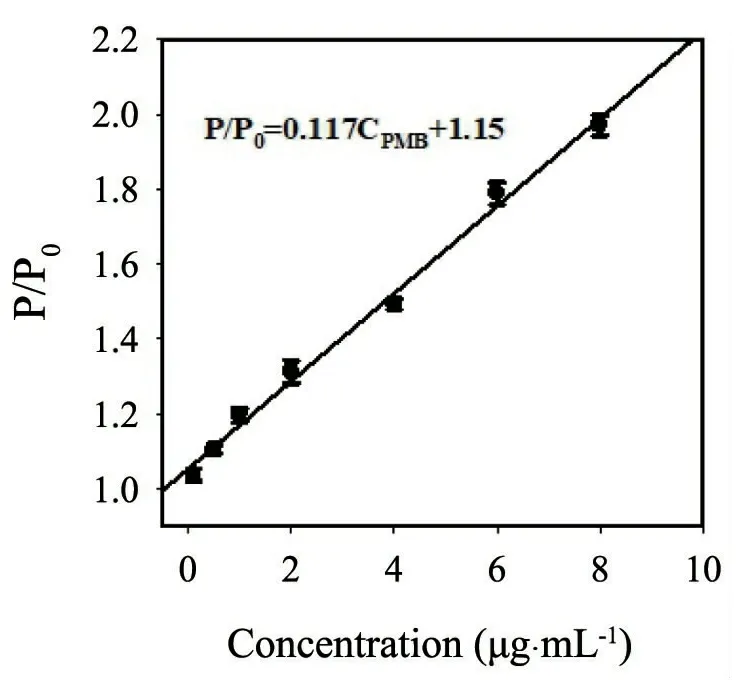
图4 P/P0与PMB浓度线性响应关系,锰掺杂硫化锌量子点浓度为20 μg·mL-1,PBS缓冲液浓度为20 mmol·L-1,pH=7.4
与之前报道的一些方法相比(表1),所建立方法的检出限低于毛细管电泳法[14]、毛细管胶束电动色谱法[15],接近于高效液相色谱法[16]、压力测量法[17]与荧光法[18].此外值得一提的是,所建立的检测方法不需要复杂的探针设计与繁琐的操作步骤,检测过程方便快捷;此外,相比于荧光光谱法,磷光光谱法可有效规避样品基质中背景荧光的干扰,从而可增强检测过程的选择性.
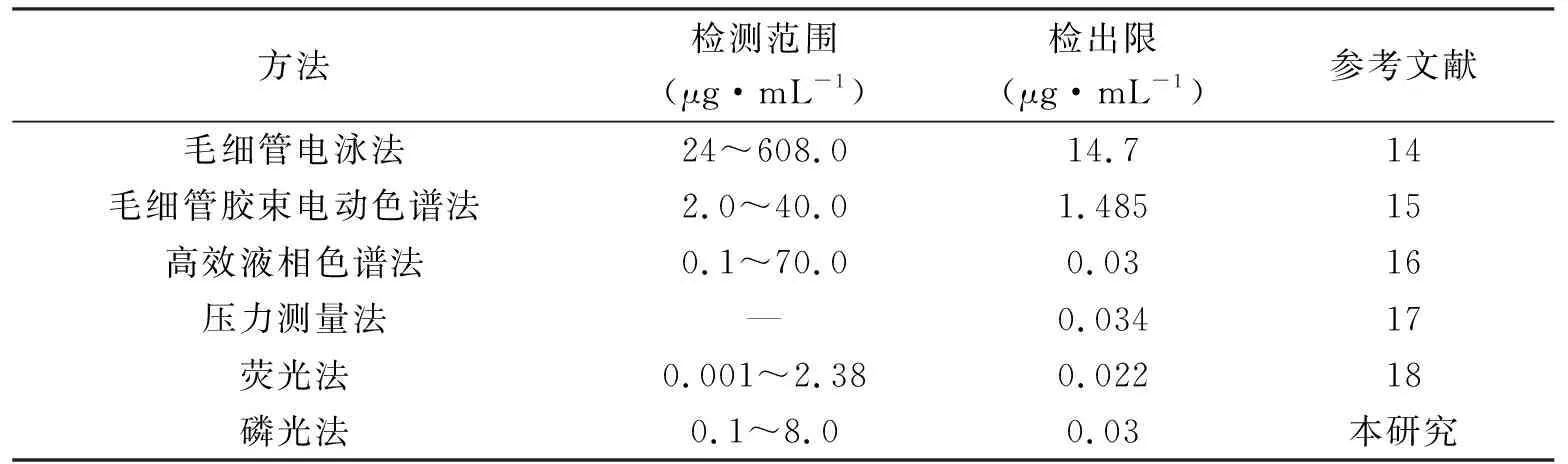
表1 建立方法与其它方法灵敏性的比较Tab.1 Comparison of the sensitivity of the proposed method with other methods for the detection of PMB
2.5 选择性
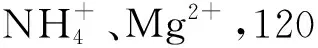
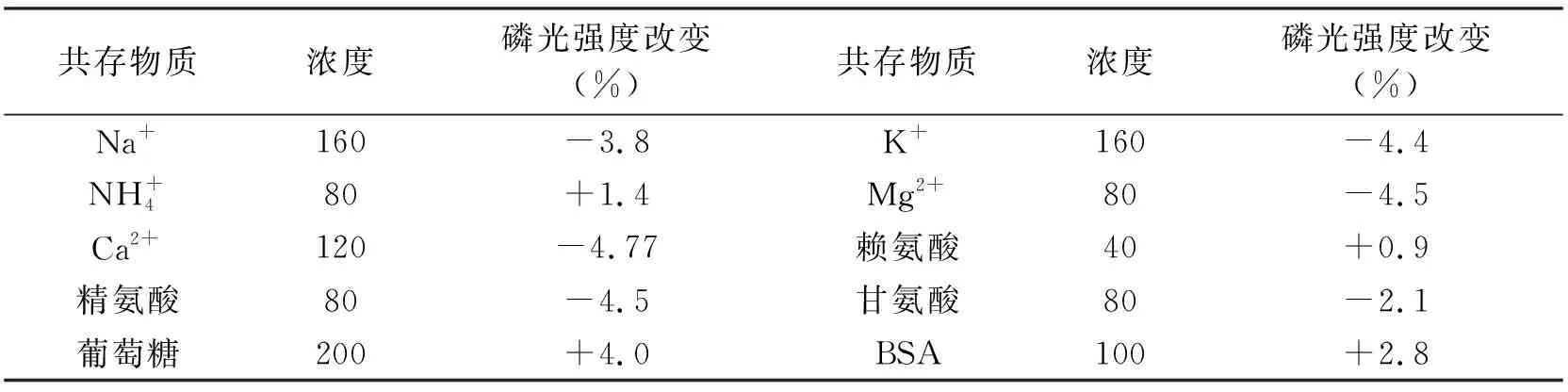
表2 共存物质对QDs-PMB检测体系的干扰Tab.2 Effect of coexisting substances for MPA-capped Mn-doped ZnS QDs-PMB detection system
2.6 应用性能分析
为了考察所建立方法的实际应用性能,选择注射用硫酸多粘菌素B作为实际样品进行了加标回收试验,从表3可以看出,PMB平均回收率在97.5 %~105.5 % 之间,RSD小于2.5 %,说明所建立的方法可用于医用药品中PMB含量的快速标定.

表3 实际样品加标回收试验结果Tab.3 The spiked recovery for the real sample
3 结论
基于锰掺杂硫化锌量子点建立了一种检测PMB的磷光方法,在水溶液中 PMB可通过静电相互作用诱导锰掺杂的硫化锌量子点聚集并使其磷光发射强度增强,检测线性范围为0.1 μg·mL-1~8.0 μg·mL-1,检出限为0.03 μg·mL-1.所建立的方法可用于医用药剂中PMB的检测与标定,且与之前报道的一些方法相比,检测过程更为简单、便捷.
