不同炮制时间的荆芥炭色度值与多项指标的相关性研究
2021-07-12田甜彭帮贵徐杰洪婉敏刘路芳何海兵魏梅
田甜 彭帮贵 徐杰 洪婉敏 刘路芳 何海兵 魏梅


摘 要 目的:研究不同炮制時间(0~40 min,下同)的荆芥炭色度值与多项指标的相关性,揭示荆芥炭在炮制过程中的质量变化规律,确定炮制终点时间。方法:测定不同炮制时间的荆芥炭饮片中醇溶性浸出物的含量;建立荆芥饮片及不同炮制时间荆芥炭饮片的超高效液相色谱(UPLC)指纹图谱并进行相似度评价,通过与对照品比对确认色谱峰;采用相同的UPLC条件测定不同炮制时间荆芥炭饮片中指标成分(橙皮苷、迷迭香酸、胡薄荷酮)的含量;运用色差仪测定不同炮制时间荆芥炭饮片的色度值,以炮制0 min样品为对照,计算总色值(E)和总色差值(ΔE)。对荆芥炭饮片中醇溶性浸出物、指标成分含量及色谱峰峰面积与色度值参数进行Pearson相关性分析、聚类分析和正交偏最小二乘法判别分析。确定荆芥炭炮制终点时间并验证。结果:随着炮制时间的延长,荆芥炭饮片中醇溶性浸出物的含量逐渐降低。12批荆芥饮片中共标定17个色谱峰,与对照指纹图谱的相似度均大于0.9。不同炮制时间荆芥炭饮片中共标定21个色谱峰,与炮制0 min样品图谱的相似度随着炮制时间延长而降低,其中炮制18 min后的相似度均低于0.9。确认色谱峰峰9为橙皮苷、峰10为迷迭香酸、峰17为胡薄荷酮。含量和色度值测定结果显示,随着炮制时间的延长,橙皮苷、迷迭香酸、胡薄荷酮含量均逐渐降低,荆芥炭饮片粉末颜色L、b、E值均逐渐减小,a、ΔE值均逐渐增大。Pearson相关性分析显示,荆芥炭饮片中醇溶性浸出物含量、橙皮苷含量、迷迭香酸含量、胡薄荷酮含量以及15个色谱峰(峰2、7~15、17~21)的峰面积与E值成显著正相关(P<0.01),5个色谱峰(峰1、3~6)的峰面积与E值成显著负相关(P<0.01),而峰16的峰面积与E值无关(P>0.05)。聚类分析结果显示,不同炮制时间的荆芥炭饮片被分成2类,炮制0~16 min为第1类、18~40 min为第2类。正交偏最小二乘法判别分析结果显示,荆芥炭饮片的峰6峰面积(2.800 75)、L值(2.327 54)、峰3峰面积(1.793 39)、b值(1.735 78)、峰5峰面积(1.244 04)的变量投影重要性(VIP值)均大于1。荆芥炭炮制终点时间为18 min;3次验证实验结果显示,荆芥炭饮片的L、a、b值分别为20.22~22.00、4.44~7.67、9.78~13.00,ΔE为13.50~14.12。结论:不同炮制时间荆芥炭饮片的色度值与其醇溶性浸出物含量、橙皮苷含量、迷迭香酸含量、胡薄荷酮含量以及20个色谱峰的峰面积密切相关。建议荆芥炭炮制终点时间为18 min。
关键词 荆芥;荆芥炭;炮制时间;超高效液相色谱法;指纹图谱;色度值;含量;相关性
ABSTRACT OBJECTIVE: To study the correlation of the chromaticity value of Schizonepeta tenuifolia charcoal of different processing time (0-40 min, similarly hereinafter) with multiple indicators, and to reveal the quality change law of S. tenuifolia charcoal during processing and confirm the terminal time. METHODS: The contents of ethanol-soluble extracts from S. tenuifolia charcoal decoction pieces of different processing time were determined. UPLC fingerprint of S. tenuifolia decoction pieces and S. tenuifolia charcoal decoction pieces of different processing time were established, and the similarity evaluation was also conducted. The chromatographic peaks were confirmed by comparison with substance control. The same UPLC conditions were used to determine the contents of index components (hesperidin, rosmarinic acid, menthone) in S. tenuifolia charcoal decoction pieces of different processing time. The colorimetric method was used to measure the chromaticity value of S. tenuifolia charcoal decoction pieces of different processing time. Meanwhile, sample of processing 0 min was used as a control to calculate the total color value (E) and the total color difference value (ΔE). Pearson correlation analysis, cluster analysis and orthogonal partial least squares discriminant analysis (OPLS-DA) were performed on the ethanol-soluble extracts, index component contents, chromatographic peak area and chromaticity value. The terminal time of processing S. tenuifolia charcoal was confirmed, and validation test was also conducted. RESULTS: With the extension of processing time, the content of ethanol-soluble extract in S. tenuifolia charcoal decoction pieces gradually decreased. A total of 17 chromato- graphic peaks were identified in 12 batches of S. tenuifolia decoction piece, and its similarity with the control fingerprint was greater than 0.9. 21 chromatographic peaks were identified in S. tenuifolia charcoal decoction pieces of different processing time, and its similarity with the chromatogram of sample of processing 0 min decreased with the processing time, and the similarity after 18 min was lower than 0.9. The chromatographic peak 9 was hesperidin, peak 10 was rosmarinic acid and peak 17 was menthone. The determination of content and chromaticity value showed that with the extension of processing time, the contents of hesperidin, rosmarinic acid and menthone decreased gradually; the color L, b and E values of S. tenuifolia charcoal decoction piece powder decreased gradually, and the a and ΔE values increased gradually. Pearson correlation analysis showed that the contents of ethanol-soluble extract, hesperidin, rosmarinic acid and menthone, the peak areas of 15 chromatographic peaks (peak 2, 7-15, 17-21) were significantly positively correlated with E value (P<0.01); the peak areas of 5 chromatographic peaks (peak 1, 3-6) were significantly negatively correlated with E value (P<0.01), but peak area of peak 16 was not related to E value (P>0.05). Results of cluster analysis showed that S. tenuifolia charcoal decoction pieces of different processing time were divided into 2 categories; the first category was processed for 0-16 min, and the second category was processed for 18-40 min. The results of OPLS-DA showed that the VIP values of peak 6 area (2.800 75), L value (2.327 54), peak 3 area (1.793 39), b value (1.735 78) and peak 5 area (1.244 04) were greater than 1. The final processing time of S. tenuifolia charcoal was 18 min. The results of validation experiment showed that the L, a and b values of S. tenuifolia charcoal decoction piece were 20.22-22.00, 4.44-7.67, 9.78-13.00, and ΔE were 13.50-14.12, respectively. CONCLUSIONS: The chromaticity value of S. tenuifolia charcoal decoction pieces of different processing time is closely related to the contents of ethanol-soluble extract, hesperidin, rosmarinic acid, menthone and the area of 20 chromatographic peaks. It is suggested that the terminal time of processing S. tenuifolia is 18 min.
KEYWORDS Schizonepeta tenuifolia; Schizonepeta tenuifolia charcoal; Processing time; UPLC; Fingerprint; Chromaticity value; Content; Correlation
荆芥始载于《神农本草经》,别名假苏,为唇形科植物荆芥Schizonepeta tenuifolia Briq.的干燥地上部分。该药多在夏、秋二季花开到顶、穗绿时采割,除去杂质,晒干。其味辛、性微温,归肺、肝经,具有解表散风、透疹、消疮的功效,可用于治疗感冒、头痛、麻疹、风疹、疮疡初起等病症[1]。荆芥主要含有挥发油类、黄酮及其苷类、萜类、酚类、甾醇类等化学成分,具有抗病毒、抗炎镇痛、抗肿瘤、免疫调节、抗菌、止血等药理作用,是传统中药材之一[2]。
荆芥经炒炭后,辛散作用减弱,专于收敛止血,常用于便血、崩漏、产后血晕的各种出血证[3]。2020年版《中国药典》(一部)收载了荆芥、荆芥炭两种饮片,并规定荆芥炭饮片的炮制方法如下:取荆芥段,照炒炭法(2020年版《中国药典》(四部)通则0213)炒至表面焦黑色,内部焦黄色,喷淋清水少许,熄灭火星,取出,晾干[1,4]。传统的外观控制认为饮片表面焦黑色、内部焦黄色即符合荆芥炒炭标准[5]。这种感官评判标准主观性太强,缺少客观数据,容易导致炮制程度不一、荆芥炭饮片的质量难以有效控制。
已有研究表明,色度值可为中药饮片质量评价和炮制工艺评价提供技术支持和参考,现已被广泛应用于中药领域[6-8]。本研究通过测定荆芥炭炮制过程中醇溶性浸出物含量、指纹图谱、指标成分(橙皮苷、迷迭香酸、胡薄荷酮)含量和粉末的色度值,结合多元统计学分析方法对色度值与多项测定指标的相关性进行分析,揭示荆芥炭在炮制过程中的质量变化规律,为快速评价其质量提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括HP-C220型精密色差仪(深圳汉普光彩科技有限公司),UPLC H-Class型超高效液相色谱(UPLC)仪(美国Waters公司),C21-WK2102型多功能电磁炉(美的集团有限公司),111B型二两装高速中药粉碎机(浙江瑞安市永历制药机械有限公司),ME204E型万分之一天平、XP26型百万分之一天平(梅特勒-托利多仪器有限公司),HWS28型电热恒温水浴锅(上海一恒科技有限公司),Milli-Q-Direct超纯水系统[默克化工技术(上海)有限公司],KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司),DHG-9147A型电热恒温干燥箱(上海精宏实验设备有限公司)等。
1.2 主要药品与试剂
橙皮苷(批号110721-201818,纯度96.2%)、迷迭香酸(批号111871-201706,纯度90.5%)、胡薄荷酮(批号111706-201907,纯度99.8%)对照品均购自中国食品药品检定研究院;甲醇(分析纯)购自西陇科学股份有限公司;乙醇(分析纯)购自天津富宇精细化工有限公司;乙腈(色谱纯)购自默克化工技术(上海)有限公司;磷酸(色谱纯)购自天津市科密欧化学试剂有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
12批荆芥饮片由广东一方制有限公司提供,经广东一方制药有限公司魏梅主任药师和广州中医药大学第二中医院孙冬梅教授鉴定均为唇形科植物荆芥S. tenuifolia Briq.的干燥地上部分,其来源信息见表1。
2 方法与结果
2.1 荆芥炭饮片样品的制备
取荆芥饮片(编号S8),按照2020年版《中国药典》(四部)通则0213项下的荆芥炭炮制方法規定[4],置热锅内,用武火炒制40 min,从炮制0 min起,每隔2 min进行取样,同时用红外测温仪测定出锅温度,放凉,即得荆芥炭饮片(编号JT00~JT20)。
2.2 醇溶性浸出物测定
按照2020年版《中国药典》(四部)通则2201项下的热浸法测定荆芥炭饮片(编号JT00~JT20)中的浸出物[4],溶剂为70%乙醇。结果,随着炮制时间的延长,荆芥炭饮片的醇溶性浸出物含量逐渐减少,详见表2。
2.3 指纹图谱的建立
2.3.1 色谱条件 以Waters CORTECS UPLC T3(150 mm×2.1 mm,1.6 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~6 min,10%A;6~11 min,10%A~13%A;11~14 min,13%A~15%A;14~27 min,15%A~20%A;27~46 min,20%A~30%A;46~56 min,30%A~50%A;56~66 min,50%A~60%A),流速为0.30 mL/min,检测波长为235 nm,柱温为30 ℃,进样量为2 ?L。
2.3.2 单一对照品溶液的制备 取橙皮苷、迷迭香酸、胡薄荷酮对照品各适量,精密称定,加甲醇分别制成每1 mL含橙皮苷61.361 ?g、迷迭香酸31.675 ?g、胡薄荷酮61.756 ?g的单一对照品溶液,备用。
2.3.3 供试品溶液的制备 取荆芥饮片粉末(过二号筛,下同)0.5 g,精密称定,置于具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称定质量,超声(功率250 W,频率40 kHz)处理30 min,取出,放冷,再次称定质量,用70%甲醇补足减失的质量,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3.4 精密度试验 精密吸取“2.3.3”项下同一供试品溶液(编号S1)适量,按“2.3.1”项下色谱条件连续进样测定6次,以橙皮苷色谱峰为参照,计算各色谱峰的相对保留时间和相对峰面积。结果,各色谱峰相对保留时间的RSD均小于0.5%,相对峰面积的RSD均小于3.0%(n=6),表明该方法精密度良好。
2.3.5 重复性试验 按“2.3.3”项下方法平行制备供试品溶液(编号S1)6份,按“2.3.1”项下色谱条件进样测定,以橙皮苷色谱峰为参照,计算各色谱峰的相对保留时间和相对峰面积。结果,各色谱峰相对保留时间的RSD均小于1.0%,相对峰面积的RSD均小于3.0%(n=6),表明该方法重复性较好。
2.3.6 稳定性试验 精密吸取“2.3.3”项下同一供试品溶液(编号S1)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.3.1”项下色谱条件进样测定,以橙皮苷色谱峰为参照,计算各色谱峰的相对保留时间和相对峰面积。结果,各色谱峰相对保留时间的RSD均小于1.0%,相对峰面积的RSD均小于3.5%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
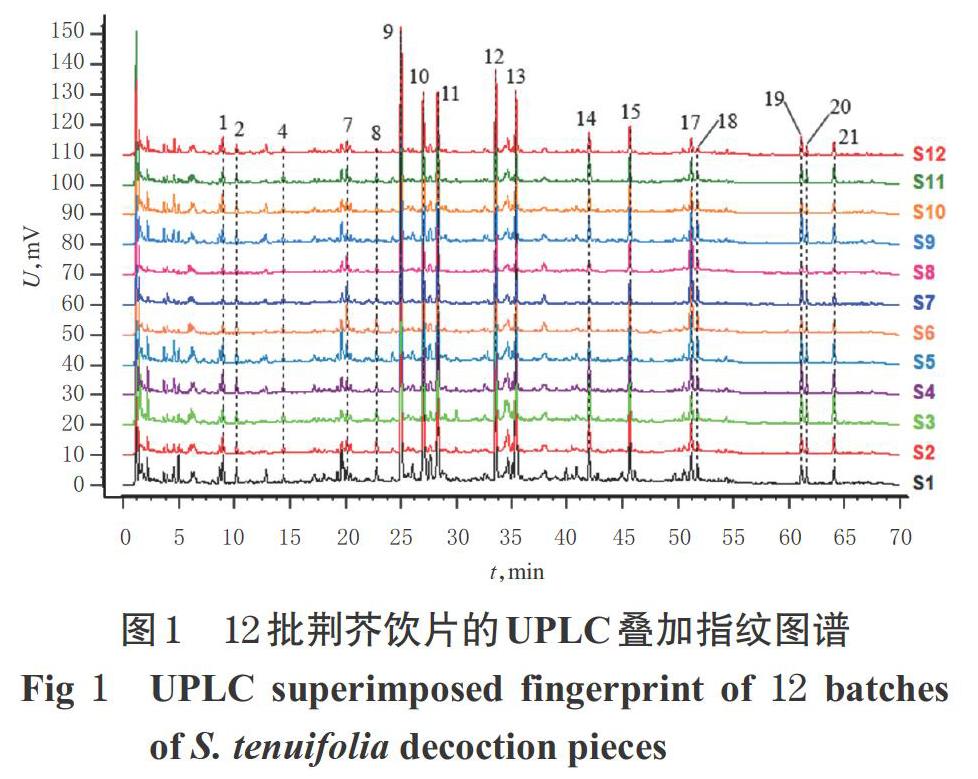
2.3.7 指纹图谱的建立和色谱峰的指认 取荆芥饮片(编号S1~S12)和不同炮制时间的荆芥炭饮片(编号JT00~JT20),按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录色谱图。将色谱图分别导入《中藥色谱指纹图谱相似度评价系统(2012A版)》,以编号S1样品和编号JT00样品的色谱图为参照图谱,将时间窗宽度设为0.1 min,采用多点校正法进行峰匹配,建立荆芥饮片和不同炮制时间的荆芥炭饮片的UPLC叠加指纹图谱,采用中位数法生成对照指纹图谱(R)。结果,12批荆芥饮片共标定17个色谱峰,不同炮制时间的荆芥炭饮片共标定21个色谱峰。与对照品(“2.3.2”项下单一对照品溶液以“2.3.1”项下色谱条件测得)比对,确定峰9为橙皮苷、峰10为迷迭香酸、峰17为胡薄荷酮,详见图1~图3。
2.3.8 荆芥饮片的相似度评价 以荆芥饮片的对照指纹图谱为对照,利用《中药色谱指纹图谱相似度评价系统(2012A版)》对12批荆芥饮片的指纹图谱进行整体相似度评价。结果,12批荆芥饮片指纹图谱的相似度依次为0.902、0.993、0.980、0.993、0.967、0.952、0.916、0.914、0.966、0.990、0.985、0.995,均大于0.9,表明12批荆芥饮片与对照指纹图谱具有较好的一致性,饮片批间差异较小。
2.3.9 荆芥炭饮片的相似度评价 以编号JT00样品图谱为对照,利用《中药色谱指纹图谱相似度评价系统(2012A版)》对不同炮制时间的荆芥炭饮片(编号JT01~JT20)进行相似度评价。结果,随着炮制时间的延长,荆芥炭饮片指纹图谱与编号JT00样品图谱的相似度逐渐降低;当炮制18 min后,两者的相似度低于0.9;至炮制40 min时,相似度仅为0.396,详见表3。
2.3.10 炮制时间对荆芥炭饮片色谱峰的影响 对比图1和图2可知,12批荆芥饮片中均未能检测到峰3、5~6、16,但经炮制后峰3、5~6、16均逐渐被检测到,说明此4个色谱峰可能为荆芥炒炭后的新增成分,可作为区分荆芥饮片与荆芥炭饮片的关键指标。通过比较不同炮制时间荆芥炭饮片色谱峰的峰面积发现,随着炮制时间的延长,峰1、3~6的峰面积逐渐增加,峰2、14~16的峰面积先增加后减小,其余12个峰的峰面积逐渐减小。
2.4 含量测定
2.4.1 色谱条件 同“2.3.1”项。
2.4.2 单一对照品溶液的制备 同“2.3.2”项。
2.4.3 供试品溶液的制备 同“2.3.3”项。
2.4.4 标准曲线的绘制 分别精密吸取“2.4.2”项下单一对照品溶液0.5、1、2、4、6、8 mL,置于25 mL量瓶中,加甲醇稀释至刻度,混匀,得系列混合对照品溶液。分别吸取上述混合对照品溶液适量,按“2.4.1”项下色谱条件进样测定,以各成分的质量浓度为横坐标(x,?g/mL)、对应峰面积为纵坐标(y)进行线性回归。结果,橙皮苷、迷迭香酸、胡薄荷酮的回归方程分别为y=11 100.0x-1 958.9、y=4 866.8x-2 375.7、y=15 794.0x-57 036.0,R 2分别为0.999 2、0.999 5、0.999 9,表明橙皮苷、迷迭香酸、胡薄荷酮质量浓度分别在1.227~19.636、0.634~10.136、1.235~19.762 ?g/mL范围内与峰面积线性关系良好。
2.4.5 精密度试验 精密吸取“2.4.4”项下混合对照品溶液(橙皮苷、迷迭香酸、胡薄荷酮质量浓度分别为9.818、5.068、9.881 ?g/mL)适量,按“2.4.1”项下色谱条件连续进样6次,记录峰面积。结果,橙皮苷、迷迭香酸、胡薄荷酮峰面积的RSD分别为0.77%、0.89%、2.40%(n=6),表明仪器精密度良好。
2.4.6 稳定性试验 精密吸取“2.4.3”项下同一供试品溶液(编号S1)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.4.1”项下色谱条件进样测定,记录峰面积。结果,橙皮苷、迷迭香酸、胡薄荷酮峰面积的RSD分别为0.94%、0.70%、3.20%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.4.7 重复性试验 按“2.4.3”项下方法平行制备供试品溶液(编号S1)6份,按“2.4.1”项下色谱条件进样测定,记录峰面积。结果,橙皮苷、迷迭香酸、胡薄荷酮含量的RSD分别为0.63%、0.79%、0.81%(n=6),表明该方法重复性较好。
2.4.8 加样回收率试验 称取已知含量的荆芥饮片粉末(编号S1)9份,每份0.5 g,精密称定,分别按对照品加入量与所取供试品中待测成分量之比0.5 ∶ 1、1 ∶ 1、1.5 ∶ 1精密加入橙皮苷、迷迭香酸、胡薄荷酮对照品(各比例均平行3次),按“2.4.3”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果,橙皮苷、迷迭香酸、胡薄荷酮的平均加样回收率分别为95.88%、96.79%、95.65%,RSD分别为1.15%、0.58%、1.54%(n=9),表明该方法回收率良好。
2.4.9 样品含量测定 取不同炮制时间的荆芥炭饮片(编号JT00~JT20)粉末,按“2.4.3”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录峰面积并代入回归方程计算橙皮苷、迷迭香酸、胡薄荷酮的含量。结果,随着炮制时间的延长,橙皮苷、迷迭香酸、胡薄荷酮含量均逐渐降低,详见表4。
2.5 色度值的测定
2.5.1 测定方法 取不同炮制时间的荆芥炭饮片(编号JT00~JT20)粉末(过三号筛,下同),作为供试品。采用精密色差仪测定色度值:黑白校正后将供试品分别压制于载玻片上,压制厚度约为1 mm;测定条件为D65光源,8°视角,孔径8 mm,LED蓝光激发,仪器误差值小于0.4,记录供试品的色度值(L、a、b值代表物体颜色的色度值,其中L值越大表示颜色越亮/浅,a值越大表示颜色越偏红,b值越大表示颜色越偏黄[9])。各样品平行测定3次,取平均值。
2.5.2 精密度试验 取荆芥炭饮片(编号JT01)粉末,按“2.5.1”项下方法连续测定6次,记录色度值。结果,其L、a、b值的RSD均小于3.0%(n=6),表明该方法精密度良好。
2.5.3 重复性试验 取荆芥炭饮片(编号JT01)粉末6份,按“2.5.1”项下方法测定,记录色度值。结果,其L、a、b值的RSD均小于2.5%(n=6),表明该方法重复性良好。
2.5.4 稳定性试验 取荆芥炭饮片(编号JT01)粉末,按“2.5.1”项下方法分别压制于载玻片上,在室温下放置0、2、4、6、8、10、12、24 h时测定色度值。结果,其L、a、b值的RSD均小于2.0%(n=8),表明样品在室温下放置24 h内色度值的稳定性良好。
2.5.5 总色值和总色差值计算 取不同炮制时间的荆芥炭饮片(编号JT00~JT20)粉末,按“2.5.1”项下方法测定,记录色度值并计算各样品的总色值[E=(L2+a2+b2)1/2]、总色差值[ΔE,与编号JT00样品比较,ΔL=L样品-L0,Δa=a样品-a0,Δb=b样品-b0,ΔE=(ΔL2+Δa2+Δb2)1/2;式中,L0、a0、b0均为编号JT00样品的色差值][9-10],结果见表5。
由表5可知,荆芥炭饮片在炮制过程中E值随炮制时间的延长而逐渐减小,主要与L、b值明显减小有关。L、b值逐渐减小,表明炮制过程中饮片粉末的明亮度由明变暗,蓝色加深;a值逐渐增大,表明炮制过程中饮片粉末红色加深。荆芥炭饮片在炮制过程中ΔE值随炮制时间的延长而逐渐增大。按照CIELAB均匀色空间系统理论,当ΔE相差6~12个色差单位时,其色差可被人眼识别[9-11];当ΔE≥12时,荆芥炭饮片的外观颜色符合《中国药典》相关要求[1]。当炮制18 min后,荆芥炭饮片的ΔE值均大于12;且随着炮制时间的延长,荆芥炭饮片的ΔE值进一步增大。
2.6 炮制过程中荆芥炭颜色与成分动态关联分析
2.6.1 Pearson相关性分析 利用SPSS 20.0软件对不同炮制时间的荆芥炭饮片(编号JT00~JT20)中醇溶性浸出物含量、指标成分含量、色谱峰峰面积与各色度值参数进行Pearson相关性分析,结果见表6。
由表6可见,荆芥炭饮片中醇溶性浸出物含量、橙皮苷含量、迷迭香酸含量、胡薄荷酮含量以及15个色谱峰(峰2、7~15、17~21)的峰面积与E值成显著正相关(P<0.01),5个色谱峰(峰1、3~6)的峰面积与E值成显著负相关(P<0.01),而峰16的峰面积与E值无关(P>0.05)。
2.6.2 聚类分析和偏正交最小二乘法判别分析 将不同炮制时间的荆芥炭饮片(编号JT00~JT20)的色度值参数、醇溶性浸出物含量、指标成分含量及色谱峰峰面积导入SIMCA 14.1软件进行聚类分析和正交偏最小二乘法判别分析(OPLS-DA),从而预测影响荆芥炭饮片中成分变化的重要变量。聚类分析结果显示,不同炮制时间的荆芥炭饮片被分成了2类,其中炮制时间0~16 min的聚为第1类、18~40 min的聚为第2类,详见图4。OPLS-DA结果显示,模型参数累积贡献率(R 2)为0.949,预测优度系数(Q 2)为0.898,均大于0.5,表明此模型为优质模型,可用于变量的预测;通过此模型预测得到5个变量投影重要性(VIP值)均大于1的变量,分别是峰6峰面积(2.800 75)、L值(2.327 54)、峰3峰面积(1.793 39)、b值(1.735 78)、峰5峰面积(1.244 04),詳见图5。上述5个变量的变化程度较为明显,其中通过L、b值可以直观判断荆芥炭饮片的炮制终点。
2.7 荆芥炭炮制的终点时间确定与验证
在确保荆芥炭饮片符合《中国药典》相关外观性状要求的前提下[1],为避免因炮制时间过长而导致的橙皮苷、迷迭香酸、胡薄荷酮含量下降,故本研究选择荆芥炭饮片炮制终点时间为18 min。按照炮制时间为18 min的炮制工艺对3批荆芥饮片(编号S3~S5)进行炮制,按“2.5.1”项下方法测定其色度值并计算ΔE值。结果,经过18 min炮制后,所得荆芥炭饮片的L、a、b值分别为20.22~22.00、4.44~7.67、9.78~13.00,ΔE为13.50~14.12,详见表7。
3 讨论
颜色和表观性状是中药材及饮片质量评价的重要指标之一。传统上,中药炮制过程及炮制终点的色泽评价方法主要是经验鉴别及直观判断,容易受主观个体差异和不敏感性的影响,造成产品质量的差异[9-13]。由于色度值能客观、准确地体现荆芥炭炮制过程中的颜色动态变化,因此本研究以不同炮制时间的荆芥炭饮片粉末为对象,运用精密色差仪对其表观颜色进行量化,结果更具客观性。由色度值分析结果可知,随炮制时间的延长,荆芥炭饮片粉末的颜色逐渐加深,L、b、E值均逐渐减小,a、ΔE值均逐渐增大,粉末颜色由黄绿色逐渐变成焦黑色,炮制程度可被肉眼识别,与传统性状评价标准较为一致[13]。可见,将主观化经验判定的颜色描述转化为客观的检测数据,可对荆芥炭炮制过程中的质量变化进行实时动态监测,为荆芥炭炮制过程的质量控制及快速评价提供新的手段。
本研究结合色度值、UPLC指纹图谱、浸出物及多指标含量等对不同炮制时间的荆芥炭饮片进行了多元统计分析。通过比较荆芥饮片及不同炮制时间的荆芥炭饮片的指纹图谱,发现荆芥经过炒炭,UPLC指纹图谱存在较大差异。荆芥饮片的UPLC指纹图谱未能检测到峰3、5~6、16,而经炮制后上述成分被检出,推测峰3、5~6、16可能为炮制后荆芥炭新产生的化合物。随着炮制时间的延长,荆芥炭饮片中橙皮苷、迷迭香酸、胡薄荷酮等12个色谱峰的峰面积较荆芥饮片逐渐减小,表明荆芥饮片所含化学成分在炒炭后发生了变化。荆芥饮片经过炒炭后,辛散作用减弱,产生止血作用,因此猜测峰3、5~6、16这4种新产生的化合物可能与止血的药效密切相关[13],后续拟进一步验证。
Pearson相关性结果显示,醇溶性浸出物含量、橙皮苷含量、迷迭香酸含量、胡薄荷酮含量以及15个色谱峰(峰2、7~15、17~21)的峰面积与E值成显著正相关,5个色谱峰(峰1、3~6)的峰面积与E值成显著负相关,说明荆芥炭饮片的成分与其粉末色度值具有紧密相关性。OPLS-DA结果显示,L、b值的VIP值均大于1,a值的VIP值接近1,说明L、a、b值是荆芥炭炮制过程中的重要变量,通过测定色度值可以预测荆芥炭饮片的炮制程度,以实现对荆芥炭炮制质量的控制。本研究结果显示,炮制18 min以上的荆芥炭饮片的ΔE均大于12,且随炮制时间的延长,橙皮苷、迷迭香酸、胡薄荷酮的含量逐渐减少,综合考虑确定炮制终点为18 min。然而,颜色与药效水平的关系还需进一步的实验验证,以期为荆芥炭饮片质量评价提供更全面的数据支撑。
综上所述,荆芥炭饮片粉末的色度值与其醇溶性浸出物含量、橙皮苷含量、迷迭香酸含量、胡薄荷酮含量以及20个色谱峰的峰面积密切相关。建议荆芥炭饮片炮制终点时间为18 min。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:243.
[ 2 ] 刘英男,牛凤菊,辛义周,等.荆芥的化学成分、药理作用及临床应用研究进展[J].中国药房,2020,31(11):1397- 1402.
[ 3 ] 吴皓,李飞.中药炮制学[M]. 2版.北京:人民卫生出版社,2016:225.
[ 4 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:31-32,232.
[ 5 ] 高明亮,蓝锦珊,单鸣秋,等.中药炭药研究进展与研究策略思考[J].南京中医药大学学报,2020,36(5):696-703.
[ 6 ] 黄瑶,张雪兰,罗宇琴,等.山萸肉及其不同酒制品的UPLC特征图谱建立及色度值的差异性研究[J].中国药房,2021,32(2):206-213.
[ 7 ] 黄梦婷,潘玲,邓李红,等.基于UPLC指纹图谱与色度值的桑白皮生品和炮制品的鉴别及炮制终点研究[J].中国药房,2021,32(1):56-63.
[ 8 ] 杨丽,龚燚婷,许铭珊,等.基于“表里关联”的大黄炭炮制过程颜色和成分变化关系研究[J].中草药,2020,51(22):5705-5713.
[ 9 ] 孟庆安,刘恩顺.实现中药颜色客观化表达的研究思路探讨[J].天津中医药,2014,31(11):696-699.
[10] 张雪,李晓庆,王云,等.焦栀子炒制过程中HPLC图谱变化与外观颜色的动态关联研究[J].中草药,2018,49(17):4029-4037.
[11] 干丽,钟如帆,魏梅,等.狗脊炮制工艺优选及色度值测定[J].中成药,2020,42(9):2382-2388.
[12] 杨丽,温雅心,刘洋,等.大黄炭加热过程颜色特征与14种化学成分含量变化关系研究[J].中国中药杂志,2020,45(17):4230-4237.
[13] 儲兆铮,王淑英,易剑平,等.荆芥炒炭成分变化趋势初探[J].时珍国医国药,2019,30(8):1886-1888.
(收稿日期:2021-02-03 修回日期:2021-05-11)
(编辑:邹丽娟)
