基于特征图谱的人参属药材西洋参、人参、三七的比较
2021-07-09严华张慧秀白宗利乐智勇魏锋马双成
严华 张慧秀 白宗利 乐智勇 魏锋 马双成
摘要 目的:建立同时适用于五加科人参属西洋参、人参和三七药材高效液相色谱(HPLC)特征图谱鉴别和含量测定方法,为同属药材的鉴定及质量评价提供科学依据。方法:西洋参、人参、三七均以甲醇提取,特征图谱及含量采用同一液相色谱条件:C8色谱柱,乙腈-水为流动相,梯度洗脱,紫外光(203 nm)检测,特征图谱采用Chempattern化学计量学软件进行数据处理、计算相似度、主成分分析。结果:西洋参特征图谱有11个共有峰相似度为0.86~0.99,特征成分为人参皂苷Rc、人参特征图谱有9个共有峰,相似度为0.98~0.99,特征成分为人参皂苷Rf,三七特征图谱有8个共有峰,相似度为0.96~1.0,特征成分为三七皂苷R1,品种内相似度均很高,品种间相似度低为0.54。主成分分析可将3种药材显著区分,并显示特征成分及共有成分人参皂苷Rg1、Re、Rb1和Rd峰对区分3种药材累积贡献权重值为87%,其中人参皂苷Rg1与人参皂苷Re峰面积比值在3个药材中的差異有统计学意义,比值范围稳定,三者比值依次为0.13±0.08、1.20±0.60、8.30±3.0,对于药材的鉴定有重要意义。各共有成分的单体含量及其总含量均以三七为最高,西洋参次之,人参最低,人参皂苷Rg1在西洋参与人参中的含量基本一致。结论:新建立的HPLC特征图谱方法在鉴别同属药材品种的同时测定了主要皂苷成分的含量测定,方法的专属强,稳定性高,重复性好,且大幅缩短了分析时间,提高分析效率,为药材的质量评价提供科学便捷的方法和依据。
关键词 西洋参;人参;三七;特征图谱;主成分分析;人参皂苷;含量测定;共性成分;特征成分;成分比值
Comparison of Panax quinquefolium,Panax ginseng,and Panax notoginseng Based on Specific Chromatograms
YAN Hua1,ZHANG Huixiu2,BAI Zongli2,LE Zhiyoung2,WEI Feng1,MA Shuangcheng1
(1 National Institute for Food and Drug Control,Beijing 100050,China; 2 Kangmei Pharmaceutical Co.,Ltd.,Beijing 102629,China)
Abstract Objective:To establish a high-performance liquid chromatography (HPLC) method for identification and content determination of Panax quinquefolium,Panax ginseng,and Panax notoginseng,which belongs to Araliaceae,to provide scientific basis for the identification and quality evaluation of the same medicinal materials.Methods:Panax quinquefolium,Panax ginseng,and Panax notoginseng were all extracted with methanol,and the feature map and content were under the same liquid chromatography conditions:C8 chromatographic column,acetonitrile-water as mobile phase,gradient elution,ultraviolet light (203 nm) detection,Chempattern chemometrics software was used for data processing,similarity calculation and principal component analysis (PCA).Results:The feature map of Panax quinquefolium had 11 common peaks,the similarity was 0.86-0.99,and the diagnostic component was ginsenoside Rc.The feature map of Panax ginseng had 9 common peaks,the similarity was 0.98-0.99,and the diagnostic component is ginsenoside Rf.The feature map of Panax notoginseng had 8 common peaks,the similarity was 0.96-1.0,and the diagnostic component is Panax notoginseng saponin R1.The similarity within the varieties was very high,and the similarity between the varieties was as low as 0.54.Principal component analysis could distinguish the 3 medicinal materials significantly,and display the diagnostic components and common components.The ginsenoside Rg1,Re,Rb1 and Rd peaks had a cumulative contribution weight value of 87% for distinguishing the 3 medicinal materials.Among them,the peak area ratios of ginsenoside Rg1 and ginsenoside Re were significantly different among the 3 medicinal materials,and the ratio range was stable.The ratios of the three were 0.13±0.08,1.20±0.60,and 8.30±3.0.Identification was significant.Regarding the monomer content and total content of each common component,Panax notoginseng was the highest,Panax quinquefolium was the second,and Panax ginseng is the lowest.The content of ginsenoside Rg1 in Panax quinquefolium was basically the same.Conclusion:The newly established HPLC feature map method determines the content of the main saponin components while identifying the same medicinal materials.The method is exclusive,has high stability,and has good repeatability.It also greatly shortens the analysis time and improves the analysis efficiency.Quality evaluation provides scientific and convenient methods and basis.
Keywords Panax quinquefolium; Panax ginseng; Panax notoginseng; Feature map; Principal Component Analysis (PCA); Ginsenoside; Assay; Common elements; Diagnostic component; Content ratio
中图分类号:R282.5;R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.06.006
西洋参(Panax quinquefolius L.)、人参(P.ginseng C.A.Mey)和三七(P.notoginseng F.H.Chen)均为来源于五加科人参属的名贵中药材,《中华人民共和国药典》描述它们的药性和功效有显著差别:西洋参性凉,功效补气养阴,清热生津,人参性微温,功效大补元气,复脉固脱,补脾益肺,生津,安神,三七性温,功效散瘀止血,消肿定痛[1],三者内在化学成分相同或相近,皂苷类成分是其中重要的一类具有生命活性的物质,三者有很多的共性成分,如人参皂苷Rg1、Re、Rb1、Rb2、Rb3、Rd等,也各含特有成分,如西洋参中含拟人参皂苷F11,人参含人参皂苷Rf、三七含三七皂苷R1,R2等[2-5],共有成分中有的对药性和药效有显著影响,如二醇型皂苷人参皂苷Rb类,具有中枢镇静作用,表现出降血脂的作用较强,原人参三醇型皂苷人参皂苷Rg类,具有较强的中枢神经兴奋作用,表现出升血压、增加心肌收缩力等作用,二者在药材中比例的不同,最终表现出对中枢神经系统的双向调节作用的不同,如人参常用于厥、脱症的抢救[6-8];而三七中的三七素和人参皂苷Rg1是三七止血与活血双向调节作用的物质基础,由此可见三者不能相互混淆使用[9],但在市场三者价格波动显著时,常易发生替代或混杂使用的现象,尤其易发生在加工成粉末饮片,或中成药投料中[10-11]。为了从内在成分区分3种药材,使其在临床用药上更加科学化、合理化,本研究以皂苷类成分为指标,建立特征图谱[12-14],通过主成分分析[15],对具有代表意义的共有成分降维处理,鉴别药材品种,并测定共有成分中4个主要成分的含量,比较其分布和比例关系,为3种药材的质量控制提供了可靠的方法及依据。与现行标准方法相比,统一了提取方法、色谱条件,分离效果好,专属性强,在鉴定一个未知样品时,大大提高检定效率。
1 仪器与试药
1.1 仪器 Waters2695-2996系列液相色谱仪(包括2695型高精度四元梯度泵、真空在线脱气机和柱温箱,2996型二极管阵列检测器,Empower@3色谱工作站,Waters公司,美国);Alltech ES2000蒸发光散射检测器(Alltech公司,美国,型号:ES2000);超声波清洗仪(功率250 W,频率40 kHz,昆山市超声仪器有限公司,型号:KQ-300DA)。ChemPattern化学计量分析软件[科迈恩(北京)科技有限公司,型号:2.0版本,下文简称“指纹图谱软件”]。
1.2 试剂与试药 对照品:人参皂苷Rg1(批号:110703-201530,纯度92.4%)、人参皂苷Re(批号:110754-201525,纯度93.4%)、人参皂苷Ro(批号:111903-201805)、人参皂苷Rb1(批号:110704-201424,纯度91.2%)、人参皂苷Rb2(批号:111715-201203,纯度93.8%)、人参皂苷Rb3(批号:111686-201504,纯度97.0%)、人参皂苷Rd(批号:111818-201302,纯度92.1%)、人参皂苷Rf(批号:111719-201505,纯度90.0%)、三七皂苷R1(批号:110745-201820,纯度93.1%),西洋参对照药材(批号:120997-201309)、人参对照药材(批号:120917-201712)、三七對照药材(批号:120941-201409),均由中国食品药品检定研究院提供;人参皂苷Rc标准品(批号:180608/11021-14-0,纯度大于98%)购于四川省维克奇生物科技有限公司,乙腈为色谱纯(Fisher Chemical,加拿大,批号:144248/CAS-No:75-05-8);甲醇为分析纯(国药集团化学试剂有限责任公司,批号::20190812/CAS,No:67-56-1);水为MILI-Q超纯水(25 ℃,18 Ω,密理博公司,型号:MILLI-Q A10)。
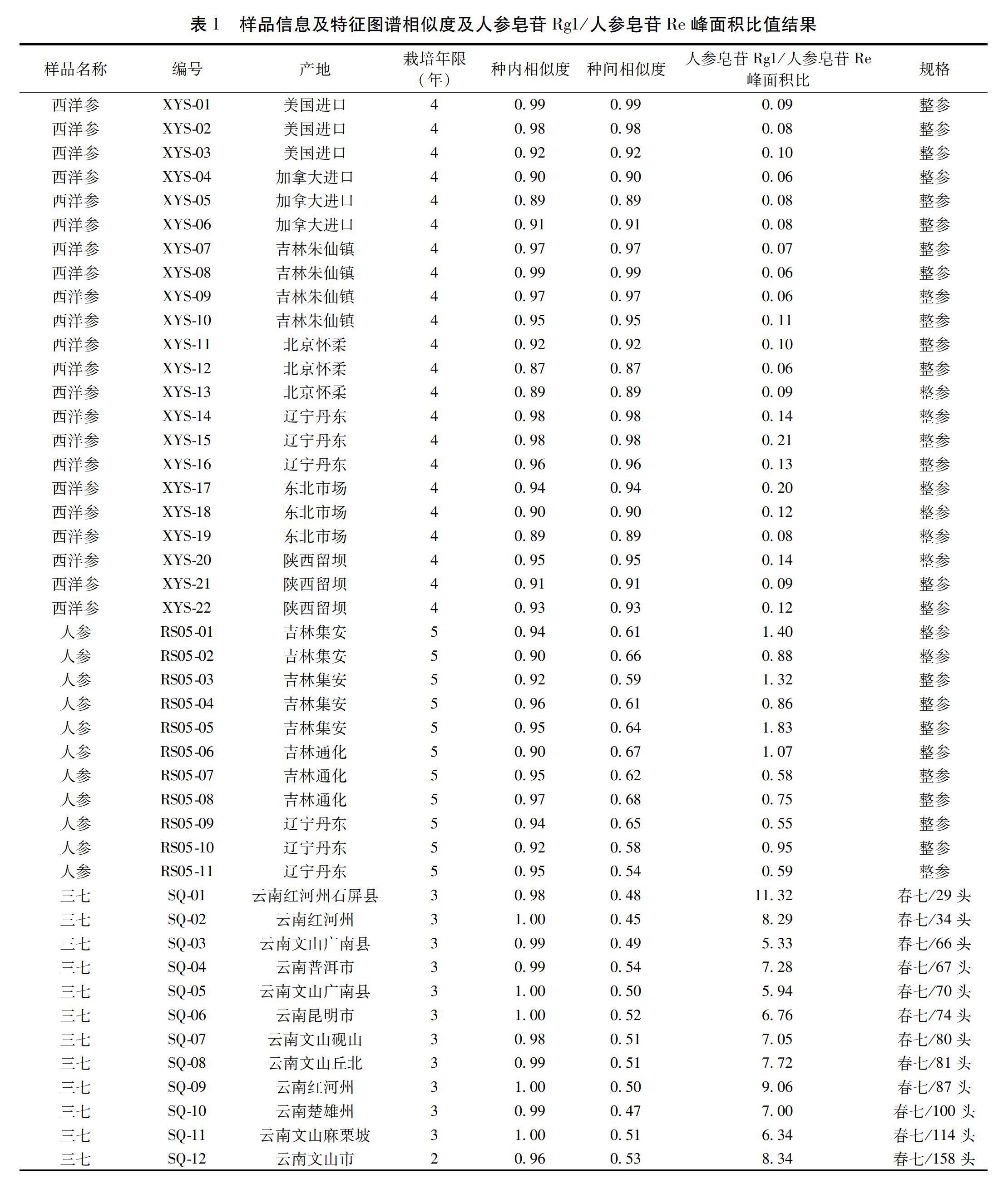
1.3 分析样品 西洋参(P.quinquefolius L.),4年生,栽培品22批[16];人参(P.ginseng C.A.Mey),5年生[17],栽培品,12批,三七(P.notoginseng F.H.Chen),3年生,栽培品,春七,12批[18],各样品的产地信息详见表1,由康美药业股份有限公司种植基地、及中国食品药品检定研究院提供,经本论文作者严华鉴定,样品留存于中国食品药品检定研究院中药所。样品实验前粉碎,过四号筛,测定水分,备用。
2 方法与结果
2.1 西洋参、人参、三七特征图谱的建立
2.1.1 色谱条件 色谱柱为Grace C8色谱柱,4.6 mm×250 mm,5 μm,流动相以乙腈为流动相A,水为流动相B,梯度洗脱程序:0~10 min,20%A;10~11 min,25%A;11~33 min,33%A;33~38 min,46%A;38~40 min,80%A;40~45 min,100%A;46 min,20%A;流速为1.0 mL/min,检测波长203 nm,柱温为30 ℃;理论板数按人参皂苷Rb1计算应不低于5 000,进样量10~20 μL。
2.1.2 对照品溶液的制备 取人参皂苷Rg1、Re、Ro、Rb1、Rb2、Rb3、Rc、Rd、Rf对照品和三七皂苷R1 10种对照品,分别加甲醇溶解,制成每1 mL各含0.5 mg溶液作为对照品母液,再分别精密吸取各对照品母液2 mL,置于同一25 mL量瓶中,加甲醇稀释至刻度摇匀,作为混合对照品溶液。
2.1.3 供试品溶液的制备 取西洋参样品粉末0.5 g,精密称定,置50 mL锥形瓶中,精密加甲醇25 mL,摇匀,称定重量,静置1 h,超声提取30 min,放置至室温,称重,以甲醇补足减失的重量,混匀,通过微孔滤膜(=0.45 μm),取续滤液,作为西洋参供试品溶液;另取人参、三七样品粉末各0.5 g,同法制成人参供试品溶液及三七供试品溶液。
2.1.4 精密度 精密吸取同一批西洋参(批号:XYS-07)供试品溶液20 μL,按3.3项色谱条件连续进样测定6次,分别记录色谱图。以人参皂苷Rb1为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰的相对保留时间的RSD<1.2%,单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD<2%,相似度评价结果为0.98,结果表明仪器精密度良好。
2.1.5 供试品溶液稳定性试验 精密吸取同一批西洋参(批号:XYS-07)供试品溶液20 μL,分别于0、2、4、6、8、12、24 h按3.3项色谱条件进样测定,记录色谱图。以人参皂苷Rb1为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰的相对保留时间的RSD<1%,单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD<2%,计算相似度结果为0.99,表明西洋参供试品溶液在24 h内稳定性良好。取同一批次的人参(批号:RS05-01)、三七(批号:SQ-01)供试品溶液,同法操作,结果人参和三七特征图谱中各特征峰的相对保留时间的RSD<1%,单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD<2%,相似度分别为0.98和0.99,表明人参、三七供试品溶液在24 h内稳定性均良好。
2.1.6 重复性试验 取同一批西洋参(批号:XYS-07)样品粉末6份,精密称定,同法平行制备6份供试品溶液,分别精密吸取供试品溶液20 μL,按上述色谱条件进样测定,记录色谱图。以人参皂苷Rb1为参照峰,计算特征峰的相对保留时间及相对峰面积,结果各特征峰的相对保留时间的RSD<1%,单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD<2%,计算相似度为0.95,表明该方法检测西洋参时重复性良好。同法操作,分别取人参(批号:RS05-01)、三七(批号:SQ-01)样品粉末,同法制备供试品溶液,注入液相色谱仪,测定,特征图谱结果显示,各特征峰的相对保留时间的RSD<1%,单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD均<2%,表明该方法检测人参、三七时均具有良好的重复性。
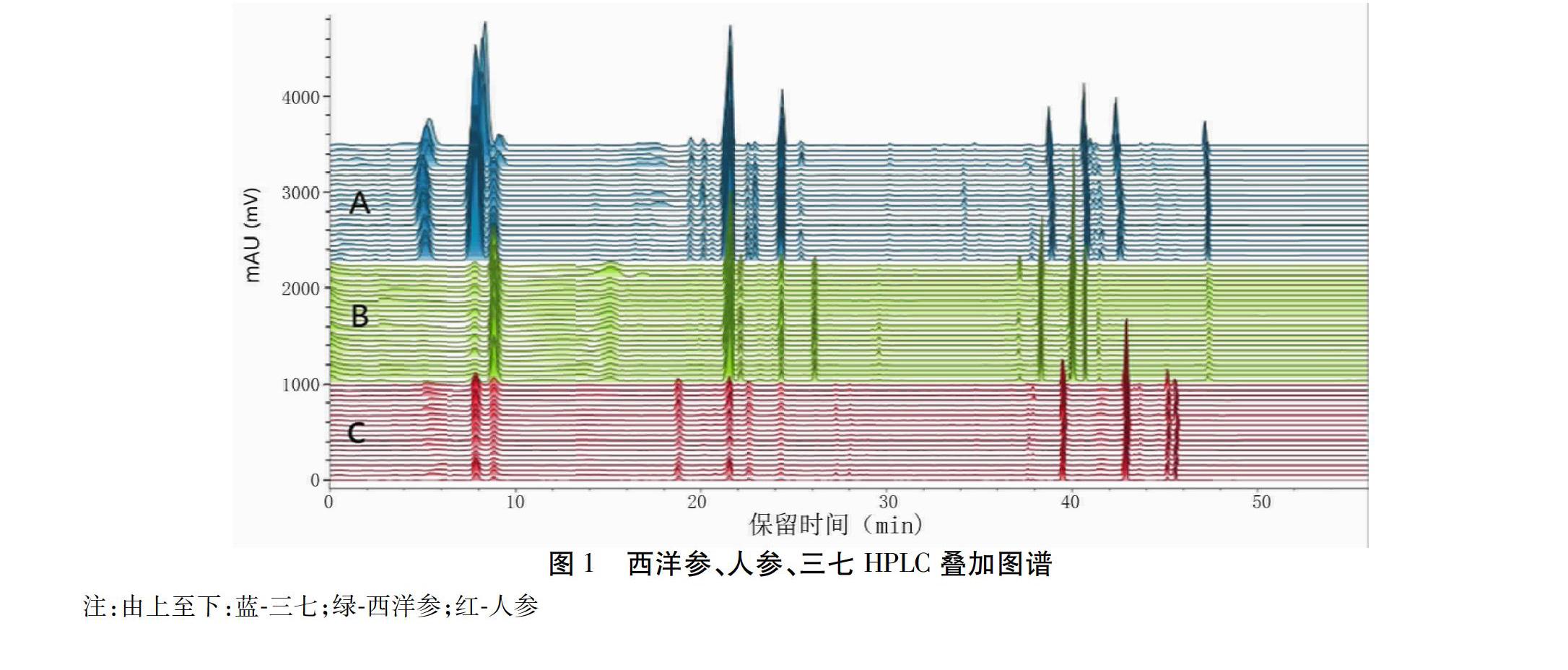
2.1.7 西洋参、人参、三七特征图谱构建及相似度评价 取全部西洋参样品粉末,分别精密称定,照2.1.3项供试品溶液制备方法制成供试品溶液,照2.1.1色谱条件注入液相色谱仪,测定,记录60 min HPLC色谱图,图谱以AIA文件格式导入Chempatter指纹图谱分析软件,以进口西洋参(XYS-04)为代表样品,其他所有图谱与之比对,拟合特征图谱,利用夹角余弦法计算特征图谱的相似度,范围在0.86~0.99;另取全部的人参、三七样品粉末,分别精密称定,同西洋参特征图谱建立方法,以人参对照药材、三七为代表样品,分别拟合生成人参特征图谱和三七特征图谱,相似度范围分别在相似度范围在0.96~0.99、0.96~1.0,各品种特征图谱种内相似度均大于0.85,而种间相似度低,分别在0.38~0.54、0.26~0.43,说明各特征图谱说明相似性均良好,且具备较强的专属性;样品信息及相似度计算结果见表1,样品叠加图谱见图1,生成的特征图谱见图2。
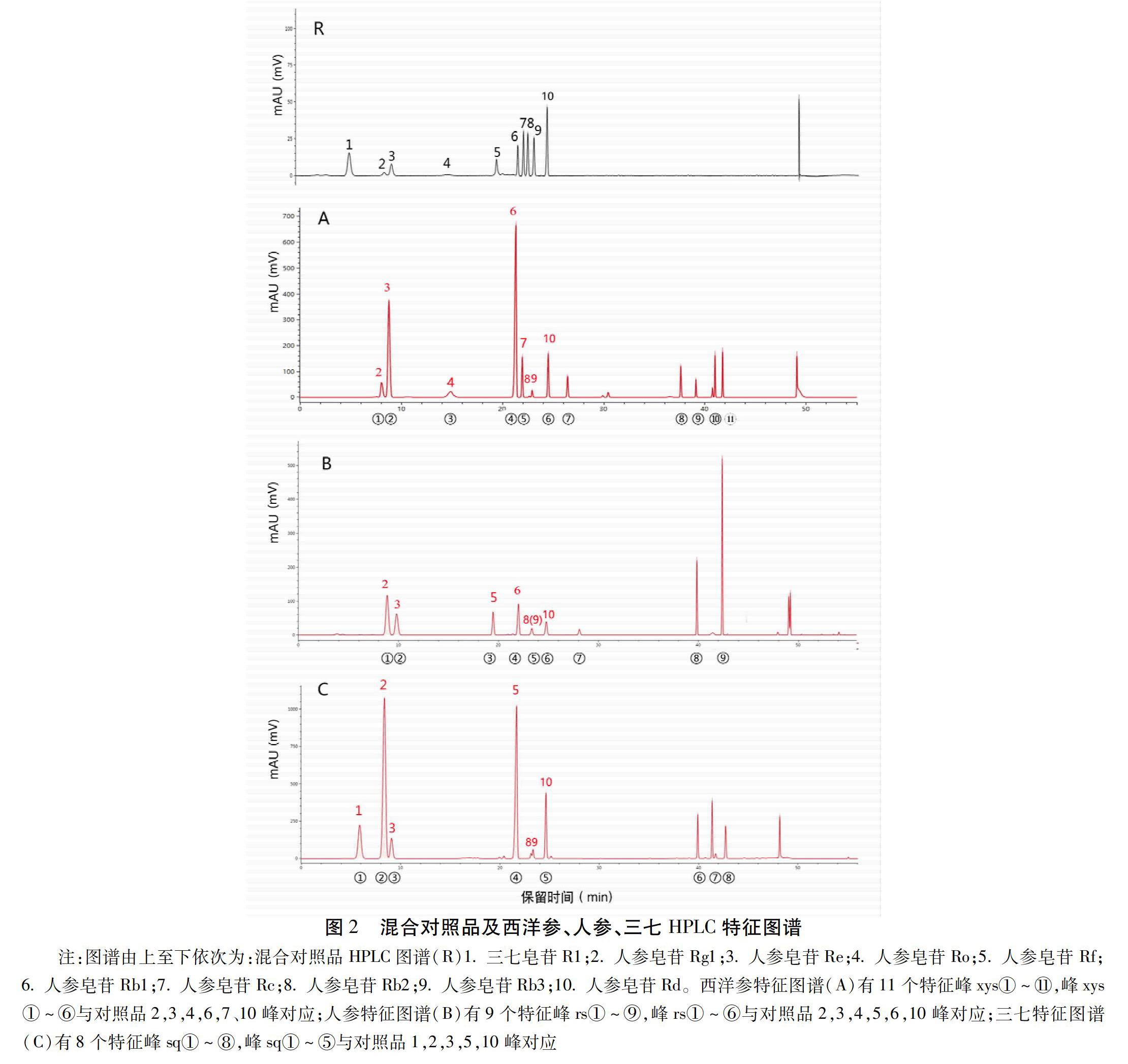
2.1.8 特征峰的确认 按峰面积最小面积占总峰面积2%积分处理所有图谱,西洋参全部的样品图谱拟合生成11个主要的特征峰的特征图谱,标记为xys①~B11,經与对照品色谱峰比对,并结合DAD光谱,确认其中6个主要特征峰:xys①、人参皂苷Rg1、xys②(人参皂苷Re)、xys③(人参皂苷Ro)、xys④(人参皂苷Rb1)、xys⑤(人参皂苷Rc)、xys⑥(人参皂苷Rd),同法人参全部样品生成9个特征峰的特征图谱,标记为rs①~⑨,确认其中5个主要特征峰:rs①(人参皂苷Rg1)、rs②(人参皂苷Re)、rs③(人参皂苷Rf)、rs④(人参皂苷Rb1)、rs⑤(人参皂苷Rd);三七全部样品生成8个特征峰的特征图谱,标记为sq①~⑧,确认其中5个主要特征峰:sq①(三七皂苷R1)、sq②(人参皂苷Rg1)、sq③(人参皂苷Re)、sq④(人参皂苷Rb1)、sq⑤(人参皂苷Rd);西洋参特有人参皂苷Ro、Rc,人参特有人参皂苷Rf,三七特有三七皂苷R1,三者的共有峰主要有4个:人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd,人参皂苷Rb2、Rb3(图2中8号、9号峰)为同分异构体,虽在3种药材中均可检出,但因含量均相对很低,保留时间接近易混淆,故未作为主要的共有峰分析。见图2。
2.1.9 共有峰比值关系 人参皂苷Rg1、Re为3种药材特征图谱共有峰,二者峰面积的比值差异有统计学意义:西洋参该在0.13±0.08,人参该在1.20±0.60,三七在8.30±3.0,这对于药材的鉴定具有重要意义。见表1。
2.1.10 主成分分析 采用Chempattern化学计量学软件,特征色谱峰标准化处理,进行主成分分析(Principal Component Analysis,PCA)。可见,建立的特征图谱方法能够将3种药材分成3组,从而达到鉴别的目的。箭头所指为主成分中变量的权重,箭头距离原点越远,表明该成分在区分样品中发挥的权重值越大,通过降维处理可见,对区分3种药材具重要鉴别贡献的变量PC1载荷51.34%、PC2载荷35.68%,二者之和解释了大于87%的变量的影响,说明提取PC1、PC2反映所有样品的87%的。特征向量指标由大至小依次为人参皂苷Re、xys⑨、Rf、Rg1、Rb1、sq⑧、Rc、Rd。见图3。
2.2 皂苷类成分的含量测定
2.2.1 色谱条件 同2.1.1项下色谱条件,以人参皂苷Rb1计算,理论塔板数大于6 000,分离度大于1.3。对照品及样品色谱图见图2。
2.2.2 对照品溶液的制备 同2.1.2项。
2.2.3 供试品溶液的制备 同2.1.3项。
2.2.4 线性关系考察 分别精密吸取三七皂苷R1、人参皂苷Rg1、Re、Rf、Rb1、Rc、Rd对照品储备液各0.1,0.2,0.3,0.5,1.0 mL分别置于同一个25 mL量瓶中,分别加甲醇稀释至刻度,摇匀,即得各个对照品系列浓度的混标溶液。分别精密吸取各系列浓度的混标溶液10 μL,注入液相色谱仪,测定,以各对照品进样量(ng)为x轴,以峰面积为y轴,进行线性回归,得各对照品回归方程及线性范围。见表2。
2.2.5 检测限(LOD)与定量限(LOQ) 取2.2.4项下混合对照品溶液继续稀释,当峰面积信噪比为3的进样量时,即作为检出限;当信噪比为10时,即作为定量限。见表2。
2.2.6 精密度试验 精密吸取2.2.4项中间浓度的混合对照品溶液10 μL,连续进样6次,记录峰面积。结果三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rd峰面积的RSD分别为0.26%,0.25%,0.37%,0.58%,0.29%(n=6),表明仪器的精密度良好。
2.2.7 供试品溶液稳定性试验 见2.1.5。西洋参、人参、三七供试品溶液在24 h内稳定性均良好。
2.2.8 重复性试验 取西洋参样品(批号:XYS-07)粉末,精密称定6份,每份0.5 g,按2.1.3项方法分别制备供试品溶液,按2.1.1色谱条件进样测定,记录峰面积,外标法计算含量。结果各份供试品溶液中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rd含量测定结果的RSD(n=6)分别为1.09%,1.16%,1.81%,1.20%,1.22%,结果表明西洋参采用该方法的重复性良好。同法取人参、三七样品粉末,分别精密称定6份,制备成人参供试液、三七供试液,分别精密注入仪器,测定峰面积,外标法计算含量,结果人参供试品溶液中人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rb1、人参皂苷Rd含量测定结果的RSD(n=6)分别为1.75%、1.01%,0.65%,1.10%,1.28%,三七供试品溶液中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd含量测定结果的RSD(n=6)分别为0.87%、0.99%,1.05%,1.5%,1.2%,结果表明人参、三七采用该方法的重复性均良好。
2.2.9 回收率试验 取已测知含量的西洋参样品(批号:XYS-07)粉末、人参样品(批号:RS05-01)粉末、三七样品(批号:SQ-01)粉末,分别精密称定0.5 g,各6份,置具塞锥形瓶中,照表3按品种分别精密加入相应体积的对照品溶液,按照2.1.3项方法制备供试品溶液,按2.1.1 项色谱条件测定,记录峰面积,计算回收率。结果各品种中各皂苷成分的平均加样回收率(n=6)及RSD(%),结果表明方法准确性良好。见表3。
2.2.10 样品含量测定 分别取西洋参、人参、三七样品粉末,照2.1.3项下方法制备供试液,再按2.1.1项色谱条件测定峰面积,用外标法计算含量,结果见表4。人参皂苷Rg1、Re、Rb1、Rd 4个共有单体成分的含量在三七均为最高;西洋参与人参中人参皂苷Rg1含量基本一致,西洋参中人参皂苷Re、Rb1、Rd含量均显著高于人参,西洋参中人参皂苷Rd与人参皂苷Rb1的含量分布基本一致;依据药典标准规定:人参中人参皂苷Rg1与Re的总量不得少于0.30%,人参皂苷Rb1不得少于0.20%,西洋参中人参皂苷Rg1、Re与Rb1的总量不得少于2.0%,三七中人参皂苷Rg1、人参皂苷Rb1与三七皂苷R1的总量不得少于5.0%,为此计算比较了3种药材中人参皂苷Rg1与Re的总量(第1组总量)、人参皂苷Rg1、Re与Rb1的总量(第2组总量),以及4种共有成分总含量(第3组总量)3组皂苷的总量,结果均显示出三七>西洋参>人参(含量由高至低顺序),也可见人参皂苷Rb1、Re的含量对总量的影响最为显著。见图4、图5。3种药材中特有成分与共有成分总量的比值为:西洋参在0.37%~4.96%范围内,人参在8.64%~14.48%范围内,三七在6.96%~15.51%范围内。
3 讨论
3.1 同科同属药材采用统一检测方法利于鉴别及应用 药典中同科同属的西洋参、人参、三七各自有含量测定方法,从供试品提取、仪器测定方法,到成分及含量限度各不相同,其中虽测定了共有成分,如3种药材均测定人参皂苷Rg1、Rb1,但因未在同一水平上,无法比较高低。本研究基于同一高效液相色谱(HPLC)方法分析测定人参属西洋参、人参、三七药材的共有和特有成分,更有效地比较共性及差异成分,有利于真伪鉴定及供临床应用参照。建议药典标准在研究同科同属药材品种时,在研究单个品种的同时,结合其他同屬其他品种综合研究,制订一致的评价标准,更便于标准的使用。
3.2 样品的选择 西洋参、人参、三七药材的产地、规格、品种繁多[19],特征图谱应建立基于地道产地,符合规范化生产的优质药材,因此本研究以大批量道地产地规范化种植的药材为基础,建立特征图谱并测定比较成分分布差异,保证数据更具代表性。
3.3 提取方法的选择 西洋参、人参、三七为同属不同种植物,含有很多相近的成分,现行标准检测中采用的样品前处理方法各不相同,如西洋参前处理采用水饱和正丁醇加热回流,再以50%甲醇定容的方法,人参采用置索氏提取器,以三氯甲烷回流处理后,弃去三氯甲烷液,残渣再以水饱和的正丁醇浸泡过夜提取,再以甲醇定容的方法提取,三七采用甲醇浸泡过夜,水浴回流提取的方法,为了比较3种药材中主要皂苷成分的分布状况,本研究在现行国内外标准研究的基础上,如香港中药材标准及美国、欧洲药典标准,分别考察了以50%、80%、100%甲醇为溶剂,浸泡过夜超声、浸泡2 h后超声及浸泡2 h后回流的方法,结果采用样品粉末加甲醇,浸泡2 h,超声提取30 min的方法制备样品溶液,方法学验证适用于3种药材的提取,较原方法缩短提取时间,保留了更多成分信息,有利于化学计量统计分析。
3.4 色谱柱的选择 本研究采用C8色谱柱代替了现行标准采用的C18色谱柱,达到有效分离多个同分异构体人参皂苷的目的,如人参皂苷Rb2和人参皂苷Rb3、人参皂苷Rf与拟人参皂苷F11,拟人参皂苷F11为西洋参的一个特征成分,而人参皂苷Rf为人参的一个特征成分,以C18色谱柱,紫外光检测波长(203 nm)检测时,拟人参皂苷F11吸收弱,对人参皂苷Rf的检测影响微弱,但在蒸发光散射器检测时,二者因不易分离造成误判。
3.5 流动相的选择 目前文献报道测定3种药材中人参皂苷类成分的研究较多,已发现西洋参中含有30余种,人参中有50余种人参皂苷类成分,三七中有20余种,多采用HPLC-UV法,或HPLC-UV-ELSD法,人参皂苷类成分的结构极为类似,实验分析要求较高,目的均为分离出不同种皂苷,鉴别或测定含量。本研究和色谱条件选择乙腈-水替代药典标准中的磷酸溶液[20],既有利于环保,也利于蒸发光散射器的安全使用,经过流动相梯度的优化,大幅度地缩短了测定时间,由药典标准的近2 h缩短至1 h以内,主要皂苷类成分色谱峰分离良好。
3.6 分析成分的选择 实验中还曾分析比较3种药材中多种皂苷成分的含量,如人参皂苷Rb2、Rb3等,它们虽在3种药材中均含有,但含量微少(远低于西洋参中人参皂苷Rg1的含量),对3种药材的差异比较贡献微弱,故最终选择性分析了正文中的特有及共有皂苷类成分,目的是在同一分析条件下比较更清晰地比较3种药材皂苷类成分的差异性与一致性,为临床应用提供参照依据。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:8,11,131.
[2]刘永利,雷蓉,王晓蕾,等.基于中药质量标志物的人参、西洋参、三七及相关中成药质量控制方法研究[J].中国药学杂志,2019,54(17):1402-1410.
[3]刘洋.西洋参质量等级标准研究[D].长春:吉林农业大学,2019.
[4]赵立春.人参化学成分的提取及测试方法的优化研究[D].北京:中国农业科学院,2019.
[5]赵静.三七中皂苷类成分的裂解规律探究及其化学特征的道地性研究[D].北京:北京中医药大学,2015.
[6]舒盼盼,朱鹏飞,杨鑫龙,等.6种人参属药材体外抗凝血活性与皂苷含量的相关性研究[J].中草药,2019,50(4):918-924.
[7]都晓伟,刘艳艳,李滨.从化学和药理学的角度探讨人参、西洋参和三七的传统应用[J].中医药学报,2005,33(4):66-69.
[8]王海波.人参、西洋参和三七抗凝血活性及与药性关系的研究[D].长春:吉林农业大学,2011.
[9]董晓强,董文天,洪霞,等.三七、人参和西洋参化学成分与药效学之间的关系[J].承德医学院学报,2011,28(3):307-309.
[10]黄河.西洋参中掺杂人参的鉴别研究[J].中国当代医药,2012,19(9):18,21.
[11]宋晓娜.三七遗传多样性及三七粉的分子鉴定方法研究[D].北京:北京中医药大学,2015.
[12]严华,张慧秀,白宗利,等.人参属西洋参人参和三七特征图谱[J].中国现代中药,2019,21(11):1512-1518.
[13]张海江,蔡小军,程翼宇.高效液相色谱-电喷雾质谱法鉴别人参、西洋参和三七的皂苷提取物[J].中国药学杂志,2006,41(5):391-394.
[14]王龙星,肖红斌,梁鑫淼.一种提高色谱指纹谱保留时间重现性的新方法[J].分析化学,2003,31(10):1232-1236.
[15]伍红年,谭诗涵,王元清,等.白三七及近源种药材指纹图谱与识别模式的构建及其应用研究[J].中草药,2019,50(1):217-224.
[16]魏晓明,林秀渠,李英科,等.无公害西洋参规范化栽培技术[J].中国农技推廣,2011,27(11):29-31.
[17]徐江,沈亮,陈士林,等.无公害人参农田栽培技术规范及标准[J].世界科学技术-中医药现代化,2018,20(7):1138-1147.
[18]国家质量监督检验检疫总局.GB/T19086-2008,地理标志产品文山三七[M].北京:中国标准出版社,2008:161.
[19]曹欣欣,曹庆军,杨粉团,等.影响西洋参中皂苷含量的因子分析[J].东北农业科学,2018,43(5):43-46.
[20]ZENG F,WANG XM,YANG M,et al.Fingerprint analysis of different Panax herbal species by HPLC-UV method[J].J Chin Pharm Sci,2007,16(4):277-281.
(2019-09-17收稿 责任编辑:王明)
