塔玛亚历山大藻产麻痹性贝类毒素能力的研究
2021-07-08张海燕隋延鸣汤云瑜刘淑晗蔡友琼沈晓盛
汪 宇,张海燕,隋延鸣,汤云瑜,孔 聪,王 媛,刘淑晗,蔡友琼,沈晓盛
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学食品学院,上海 201306)
麻痹性贝类毒素(paralytic shellfish poisoning,PSP)是一类海洋生物毒素的统称,常被发现于双壳贝类中,主要作用于钠离子的传输通道,阻碍神经冲动的传输,从而产生麻痹作用。人类食用携带PSP的贝类后极易引起食物中毒,甚至死亡,死亡率可达1.5%[1]。目前,已发现的PSP组分至少有24种[2],主要来源于有毒的海洋甲藻,包括亚历山大藻属(Alexandrium)、链状裸甲藻(Gymnodiniumcatenatum)和巴哈马麦甲藻(Pyrodiniumbahamense)等。而最近的一些研究发现,某些海洋蓝细菌也能够产生PSP[3]。已有专家探究了温度、光照、盐度、养分、pH等对亚历山大藻属的微小亚历山大藻(A.minutum)和塔玛亚历山大藻(A.tamarense)生长及毒素组成的影响[4-11]。研究这些地理上广泛分布的有毒海洋甲藻产PSP的能力,有助于对藻类毒性引起的海洋污染风险进行评估。
就我国来看,PSP污染情况不容乐观,仅2017—2019年,我国福建漳州和河北秦皇岛就发生多起PSP中毒事件,不仅威胁到人类的生命安全,也造成了海水养殖业的巨大经济损失。对此,我国政府高度重视,组织开展PSP监测项目,完善PSP风险监控体系。相关科研人员也积极投入PSP研究中,比如,研发更高效的PSP检测手段、探究PSP在贝类中的代谢规律、分析产PSP藻类在不同环境中的生长及产毒能力等[12-13]。有研究表明,全球绝大多数PSP事件皆由亚历山大藻属藻类引起,该属藻类目前已通过形态学确定的有30多种,其中一半以上被发现能够产生PSP,且毒素成分多样[1,14]。ZOU等[15]对67株分离自我国沿海的塔玛亚历山大藻PSP组分研究发现,不同藻株PSP成分存在较大差异,但主要成分基本相似。然而,对于该物种产PSP能力的研究仍然较有限。
塔玛亚历山大藻是一种典型的产PSP的甲藻,全球分布广泛,是造成我国贝类受PSP污染的主要藻类之一。相关专家对塔玛亚历山大藻产毒情况进行了 研究[5,8,11,16-17],但对该 藻产PSP能力的研究仍不够透彻,迄今尚少见外界环境因素对塔玛亚历山大藻中PSP组成影响的研究报道[18],其毒性强弱对人类生命安全的风险也未见评估。因此,本文选取塔玛亚历山大藻作为研究对象,将塔玛亚历山大藻置于不同盐度、生长空间和营养素浓度下培养,分析其总毒素及各毒素组分含量,探究其产PSP能力,以期为PSP的基础研究以及标准品制备等提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1 藻株来源
塔玛亚历山大藻GY-H31于2018年9月购自光语生物科技有限公司,藻株分离自我国东海长江入海口。
1.1.2 基础培养基及海水
藻类培养所需培养基参考GUILLARD和RYTHER[19]的改良f/2培养基,自行配置。
海水由天然海盐配置,海盐购自以色列Red Sea公司,按照25.0 g海盐∶1 L超纯水配置成盐度为25的海水。
1.1.3 化学试剂
冰乙酸(分析纯),购自国药集团化学试剂有限公司;甲酸(色谱纯)、甲酸铵(色谱纯)、乙腈(色谱纯),购自美国J.T.Baker公司。
PSP标准品,包括石房蛤毒素(saxitoxin,STX)、新石房蛤毒素(neosaxitoxin,NEO)、膝沟藻毒素1-4(gonyautoxin 1-4,GTX1-4)、N-磺酰氨甲酰基类毒素1-2(N-sulfocarbamoylgonyautoxin 1-2,C1-2)、N-磺 酰 氨 甲 酰 基 类 毒 素5(gonyautoxin 5,GTX5)、脱氨甲酰基石房蛤毒素(decarbamoylsaxitoxin,dcSTX)、脱氨甲酰基新石房蛤毒素(decarbamoylneosaxitoxin,dcNEO)、脱氨甲酰基膝沟藻毒素 2-3(decarbamoylgonyautoxins 2-3,dcGTX2-3)均购自加拿大国家海洋生物研究所(National Research Council Canada)。
1.1.4 主要仪器
Ultimate 3000超高压液相色谱-Q-Exactive静电场轨道阱高分辨质谱联用系统,美国Thermo Fisher公司;16RXⅡ高速冷冻离心机,日本HITACHI CF公司;Milli-Q超纯水机,美国Millipore公司;VCX500超声波破碎仪,美国Sonics公司;MGC-300B光照培养箱,上海一恒科学仪器有限公司;XSP-44X9多用途生物显微镜,上海光学仪器一厂;超洁净工作台,北京东联哈尔仪器制造有限公司;LT-CPS80D高压蒸汽灭菌锅,澳大利亚LERD-Tech公司。
1.2 实验方法
1.2.1 藻株的活化与确认
藻株4℃转移至实验室后,取出1 mL置于显微镜下进行鉴定[20],其余藻液立即接种于盐度为25的f/2培养基中,置于25℃、光照4 000 lx、12∶12光暗循环的光照培养箱中培养。约十天取出1 mL于显微镜下观察,视野中藻细胞均处于游动状态,且存在细胞壁相连的细胞,表明藻种活力良好,可用于实验。
1.2.2 藻株的保存
塔玛亚历山大藻培养二十天左右后,传代接种,并按照活化条件培养,以保留藻种。
1.2.3 空间效应对塔玛亚历山大藻产毒影响
设置0.1、0.5、1.0 L共3个生存空间(即f/2培养基体积)梯度,每个梯度3组重复。将指数生长期的塔玛亚历山大藻分别接种于含有以上体积培养基的250 mL、1 L、2 L锥形瓶中,初始密度400个·mL-1、温度25℃,盐度25、光照4 000 lx、12∶12光暗循环。每天定时振荡锥形瓶。在培养期第18天(以接种日期为第0天计算)收集相同数量的藻细胞进行PSP测定。
1.2.4 盐度对塔玛亚历山大藻产毒影响
依据塔玛亚历山大藻能够存活的盐度范围,设置15、25、35共3个盐度梯度,每个梯度3组重复。将指数生长期的塔玛亚历山大藻接种于含有1 L f/2培养基的2 L锥形瓶中,初始密度为400个·mL-1、温度25℃、光照4 000 lx、12∶12光暗循环。每天定时振荡锥形瓶。在培养期第18天收集相同数量的藻细胞进行PSP测定。
1.2.5 营养素浓度对塔玛亚历山大藻产毒影响
设置1/4倍、1倍、4倍3个营养素浓度梯度,每个梯度3组重复。将指数生长期的塔玛亚历山大藻分别接种于含有1 L的1/4倍、1倍和4倍f/2培养基浓度的2 L锥形瓶中,初始密度为400个·mL-1、温度25℃、盐度25、光照4 000 lx,12∶12光暗循环。每天定时振荡锥形瓶。在培养期第18天收集相同数量的藻细胞进行PSP测定。
1.2.6 PSP测定
1.2.6.1 毒素提取
离心收集相同数量的藻细胞于50 mL聚丙烯离心管中,加入20 mL 0.05 mol·L-1的乙酸溶液,在冰浴条件下于细胞破碎仪中超声处理5 min(200 W,超20 s停40 s),随后超声波辅助提取15 min。4℃下4 000 r·min-1离心10 min,取上清液1 mL于超滤离心管(10 000 u)中,4℃下10 000 r·min-1离心10 min,取超滤液于进样小瓶中,4℃下保存待分析。
1.2.6.2 仪器条件
仪器条件参考GB 5009.213-2016中液相色谱-质谱条件[21]。样品分析在Ultimate 3000超高压液相色谱-Q-Exactive静电场轨道阱高分辨质谱联用系统上进行。色谱柱为TSK-gel Amide-80(3μm,2 mm×15 cm)。
色谱条件:柱温30℃,样品温度为4℃,进样量10μL,流动相A为甲酸铵缓冲溶液(含5 mmol·L-1甲酸铵和0.1%甲酸),B为酸化乙腈(含5 mmol·L-1甲酸铵和0.1%甲酸),梯度洗脱条件:0~3 min,70%B;3~4 min,70%~60%B;4~16 min,60%B;16~19 min,60%~5%B;19~23 min,5%B;23~27 min,5%~70%B;27~35 min,70%B。
质谱条件:采用电喷雾离子源(ESI)平行反应监测(PRM)模式,喷雾电压:3 200 V(+),2 800 V(-);鞘气:40气体流速单位(arb);辅助气:10气体流速单位(arb);吹扫气:1气体流速单位(arb);气体加热温度:350℃;离子传输管温度:325℃。
1.3 数据分析
实验数据采用SPSS 22.0和Origin Pro 8软件进行处理。采用单因子方差分析,并进行事后多重比较(Duncan检验),P<0.05表示差异显著。
试样中PSP总毒素含量(STXeq)参考如下公式计算:
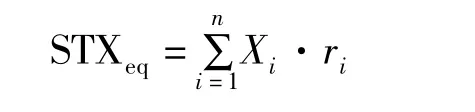
式中,STXeq为试样中PSP总毒素含量(μg);Xi为各种PSP的含量(μg),ri为PSP的毒性因子(表1)。

表1 PSP毒性因子Tab.1 Toxicity factor of PSP
2 结果与分析
2.1 塔玛亚历山大藻中PSP组分分析
表2是塔玛亚历山大藻经培养后收集获得的1.0×106个藻细胞中PSP组成及含量。从表2中可以看出,塔玛亚历山大藻至少含有13种PSP组分,可以推测塔玛亚历山大藻是贝类中PSP的来源之一。ANDERSON等[14]的报道也证实了这一点。从各组分的含量来看,不同组分的含量差异较大,每1.0×106个塔玛亚历山大藻细胞能够检出17.171μg毒素,GTX1、GTX4、GTX5、C1、C2为主要成分,占毒素总含量的97.2%(质量分数),其中仅GTX1和GTX4为高毒性成分,表明塔玛亚历山大藻的毒性强弱主要体现在GTX1和GTX4含量的高低。

表2 塔玛亚历山大藻中PSP毒素成分及含量Tab.2 Toxin profile and content of PSP in A.tamarense
2.2 不同PSP组分定量的最低藻细胞数量分析
塔玛亚历山大藻中PSP组分定量与藻细胞数量关系如图1所示。不同毒素组分的定量与藻细胞数量高低存在明显差异,当藻细胞数量低于4.0×103个时,13种组分均不能定量检出;当藻细胞数量在4.0×103个至5.9×106个之间时,不能完全定量出13种组分;只有当藻细胞数高于5.9×106个时,13种组分才均能够检出。从PSP各组分定量所需藻细胞数量表明,GTX1和GTX4检出定量所需藻细胞量最少,高于4.0×103个藻细胞就可以达到定量分析要求;dcSTX和dcNEO定量所需藻细胞数量最多,藻细胞数量必须分别为3.0×106个和5.9×106个以上;STX、NEO、GTX2和GTX3需要至少1.0×105个藻细胞才可被定量;其余组分定量所需藻细胞数基本处于1.0×104~1.0×105个。该结果与表2中毒素含量百分比不完全相同,质量分数高的毒素其定量所需藻细胞数不一定高,说明各组分定量所需藻细胞数还与毒素本身响应值有关。为保证13种毒素成分均能够更方便、快捷地被检出,本实验将藻细胞数均取值在6.0×106个以上。
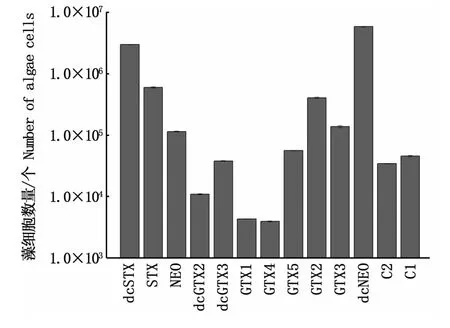
图1 不同PSP组分定量限与藻细胞数之间的关系Fig.1 Relationship between LOQ of each PSP toxin and the number of A.tamarense cells
2.3 空间效应对塔玛亚历山大藻产毒能力的影响
图2是3种不同空间效应培养条件下收集的相同数量的藻细胞的总毒素含量。可以看出,空间效应对塔玛亚历山大藻产毒能力的影响存在一定的差异,0.1 L与1.0 L培养条件下的总毒素含量表现出显著性差异(Duncan检验,P<0.05),说明在相同环境下,培养空间与PSP的合成存在一定相关性。图3的结果表明,空间效应会影响总毒素含量,但对各组分的定量检出没有影响,13种PSP均能检出。但毒素组分的含量在不同空间效应下存在一定差异,其中dcSTX、STX、GTX2含量均表现出显著性差异(P<0.05),dcSTX、STX在0.1 L培养条件下含量最高,分别为0.27、0.33μg,GTX2在1.0 L培养条件下含量最高,为0.12μg。而GTX1、GTX3均未出现由生长空间引起的显著性差异(P>0.05),这表明空间效应不会影响塔玛亚历山大藻合成GTX1、GTX3,其总毒素含量的差异主要体现在其余毒素成分含量的高低。
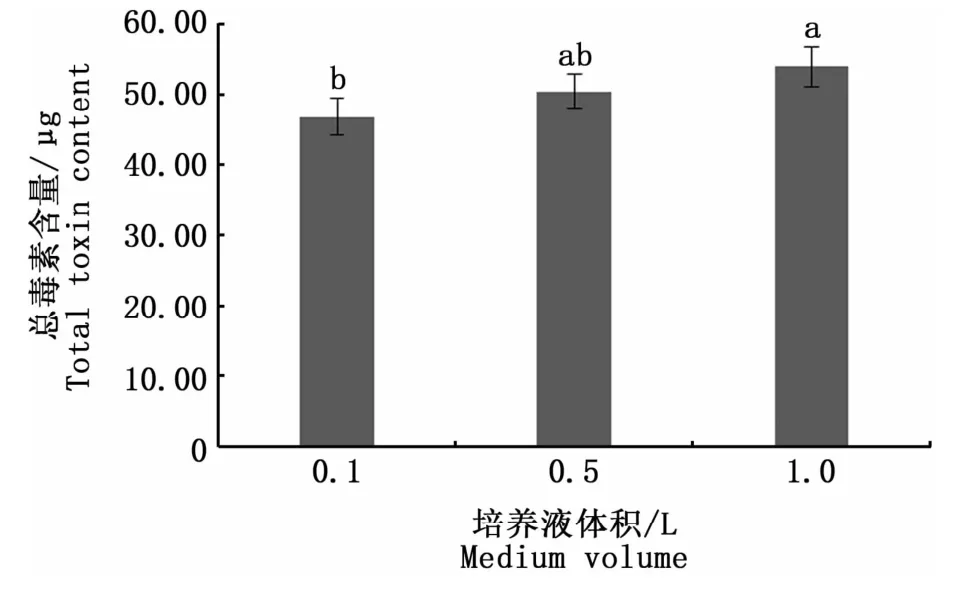
图2 空间效应对塔玛亚历山大藻中总毒素含量的影响Fig.2 Impact of spatial effects on the total toxin content in A.tamarense
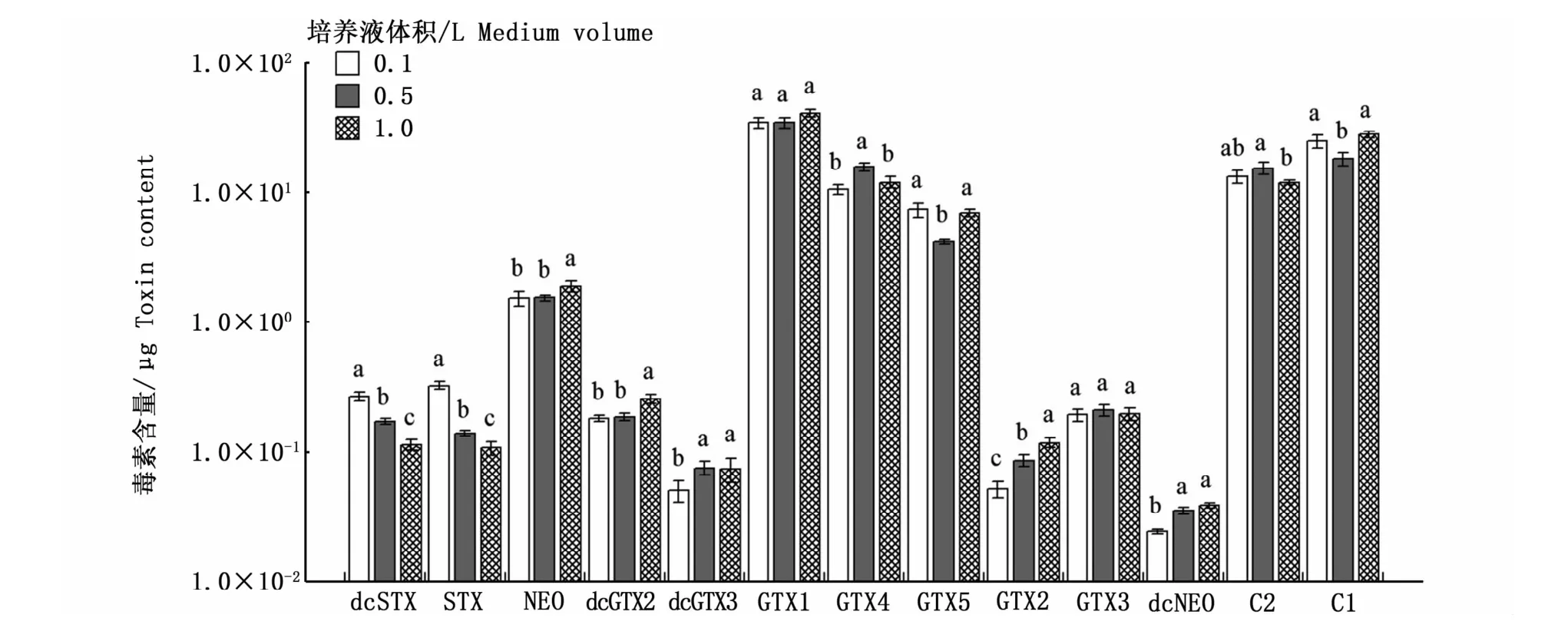
图3 空间效应对塔玛亚历山大藻中PSP各组分含量的影响Fig.3 Impact of spatial effects on each PSP toxin content in A.tamarense
2.4 盐度对塔玛亚历山大藻产毒能力的影响
图4是3种不同盐度培养条件下收集的相同数量藻细胞的总毒素含量,可以看出,盐度25培养组塔玛亚历山大藻总毒素含量与盐度35培养组无显著性差异(P>0.05),但均显著高于盐度15培养组(P<0.05)。说明在相同环境下,盐度对毒素的合成具有一定的影响。图5是盐度对塔玛亚历山大藻中PSP各组分含量影响,观察到各组分均能够定量检出,且单一组分的含量在不同盐度条件下均存在一定的差异。其中盐度对STX、NEO、dcGTX2、GTX4、GTX2、GTX3、dcNEO、C1形成均表现出显著性影响(P<0.05)。NEO、dcGTX2、GTX2、GTX3、dcNEO、C1含量均在盐度35培养组达到峰值,分别为2.18、0.31、0.34、0.32、0.06、34.86μg;STX含量在盐度15培养组最高,为0.20μg;GTX4含量在盐度25培养组最高,为12.00 μg。但盐度不影响塔玛亚历山大藻dcGTX3的合成(P>0.05)。GTX1含量在盐度25培养组与盐度35培养组无显著性差异(P>0.05),这可能是盐度25培养组和盐度35培养组总毒素含量无显著差异的一个原因。
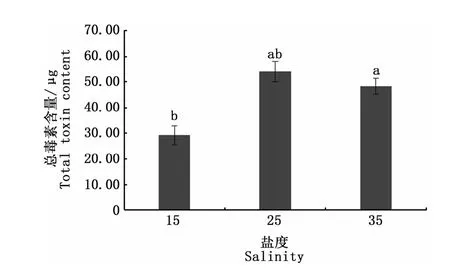
图4 盐度对塔玛亚历山大藻总毒素含量的影响Fig.4 Impact of salinity on the total toxin content in A.tamarense
2.5 营养素浓度对塔玛亚历山大藻产毒能力的影响
图6是3种营养素浓度培养条件下收集的相同数量藻细胞的总毒素含量,可以看出,营养素浓度对塔玛亚历山大藻的总毒素含量有显著影响(P<0.05),总毒素含量在1/4倍营养素浓度下达到最高,为89.15μg;而在4倍营养素浓度时降到最低,仅有42.62μg。表明在相同环境下,塔玛亚历山大藻总毒素含量与营养素浓度呈负相关。图7显示,13种毒素组分均在1/4营养素浓度时达到最高。在本研究中,营养素浓度对dcGTX2、dcGTX3、GTX1、GTX4、GTX5、GTX3、C1、C2的合成均有显著影响(P<0.05)。
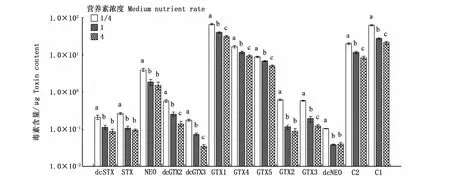
图7 营养素浓度对塔玛亚历山大藻中PSP各组分含量的影响Fig.7 Impact of medium nutrient rate on each PSP toxin content in A.tamarense
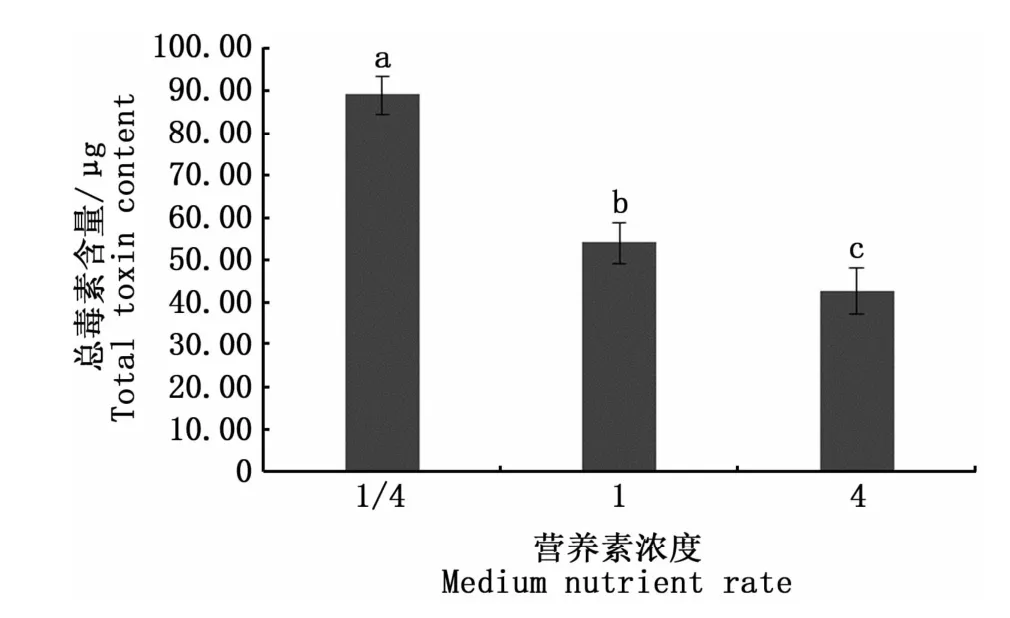
注:不同小写字母表示有显著差异(P<0.05);总毒素含量由6.0×106个藻细胞计算得出Note:Different lowercase letters denote significant difference(P<0.05);total toxin content is calculated from 6.0×106 algal cells
3 讨论
3.1 塔玛亚历山大藻产毒能力
塔玛亚历山大藻是所有能够产生PSP的甲藻中分布最广泛、认知度最高的物种之一[14],而不同地区的藻株产生的PSP成分不尽相同[15,22]。在本研究中,由于受到标准品数量的限制,该塔玛亚历山大藻种共发现有13种PSP组分,这与徐金涛等[11]的研究结果基本一致。DEEDS等[3]、WIESE等[23]以及TAN和RANSANGAN[1]的研究发现,塔玛亚历山大藻中有C4和GTX6存在,这说明该藻种的产毒能力非常强,目前来看至少能够产生15种毒素。本研究采用的塔玛亚历山大藻的毒素成分主要为GTX1、GTX4、GTX2、C1、C2和NEO,其中GTX1含量更是高达40%,并且当藻细胞数高于4.0×103个时即可用于定量分析,表明GTX1的含量直接决定了该藻株毒性的强弱。由此看来,塔玛亚历山大藻种可用于PSP的基础研究,亦是分离提取GTX1的最佳理论藻株。
3.2 环境胁迫下塔玛亚历山大藻产毒能力差异
在海洋中,单细胞藻类用于生长与代谢的空间资源是有限的,在资源限制下,不仅存在种间竞争,也存在种内竞争,而有害藻类的生理条件可随着时间和空间变化而变化[24-25]。在资源有限的环境中,塔玛亚历山大藻处于种间竞争劣势[26],生长及产毒也必然受到抑制;而当环境中仅存在塔玛亚历山大藻时,因为没有其他物种的竞争压力,种内竞争趋势逐渐显现。在本研究中,塔玛亚历山大藻的总毒性与生存空间成正相关,这说明生存空间的增加显然更有利于塔玛亚历山大藻中PSP的合成。较大的生存空间和较低的繁殖速率保证了更多的PSP合成所需前体物质(如精氨酸)的积累[27],同时相对较低的细胞密度意味着单位藻细胞能够利用相对多的营养素,这种协同效应最终促进了塔玛亚历山大藻的产毒能力差异性的形成。
盐度主要是通过调节细胞与外界的离子交换速率来影响塔玛亚历山大藻的产毒能力[28]。塔玛亚历山大藻具有广盐性的特征,本实验结果显示,该藻株在盐度15~35均能够长时间存活,这主要体现在对外界渗透压的适应性[29]。环境盐度越低,细胞内部与外界的浓度差越大,细胞需要消耗更多的能量以维持渗透平衡,这导致毒素合成速率较低;而外界环境过高的渗透压则会使藻细胞更易丢失水分,不利于塔玛亚历山大藻的生长及毒素的合成[30]。在本研究中,塔玛亚历山大藻产毒能力在盐度为25时达到峰值,叶志林等[8]发现塔玛亚历山大藻的产毒能力随着盐度增加而提高,在盐度35时达到最高;而LIM和OGATA[31]的研究表明,塔玛亚历山大藻在盐度25时产毒能力最低。引起这种差异的原因可能是藻株生长的水域不同,环境的差异加上长时间的适应,使得塔玛亚历山大藻对其所处海域的盐度最为适应,其产毒能力也最高[15]。研究还发现G.catenatum和A.peruvianum毒素含量均在盐度30时达到最高[15],本实验结果与其相似。另外,环境盐度的差异性也会改变塔玛亚历山大藻中GTX的组成,随着盐度的上升,毒性强的组分百分比含量增加,如GTX4含量的增加以及GTX5含量的减少[28]。
对于塔玛亚历山大藻,营养素提供了生长所必需的养分,氮元素决定了PSP的合成。有研究表明[22,28],在氮元素不足时,塔玛亚历山大藻的PSP含量和毒性均较低,但本研究中低营养素浓度组中,氮元素含量仍处于相对较高状态,与上述现象不同。在本研究中,营养素浓度对塔玛亚历山大藻产毒能力存在显著影响,营养素浓度越高,产毒能力越弱。推测当环境中营养素含量较低时,塔玛亚历山大藻的种内竞争增加,而适当的竞争有利于个体的生长和代谢。摄入的能量更多地用于增加自身在环境中的竞争力,涉及细胞分裂的营养需求减弱,细胞生化反应增加,更多的精氨酸可用于PSP的合成[32]。WANG和HSIEH[28]发现,增加培养液硝酸盐浓度,塔玛亚历山大藻中GTX1含量比例下降,而GTX5含量比例上升,过低或过高的磷酸盐浓度均会抑制塔玛亚历山大藻产毒;也有研究[28]发现,氮元素的限制有利于GTX1、GTX4的合成,而磷元素的限制有利于GTX2、GTX3的合成。这说明在一定范围内,低营养环境中,塔玛亚历山大藻高毒性成分含量较高,而低毒性成分含量较低,这使得该藻株在营养限制下仍有较高的毒性。此外,笔者在预实验中发现,当营养素浓度低于1/4倍时,塔玛亚历山大藻生长速度逐渐降低,这并不利于毒素的提取与分析。
3.3 海洋中高PSP毒性的有害藻华暴发风险性
海洋生态系统具有自我调节能力,可维持水体环境在一定的范围内波动。而当气候骤变或产生人为干预,外力因素超出了海洋自我调节的可承受范围时,水体环境会发生较大改变,这将对海洋藻类产生巨大影响[33]。一般情况下,海洋环境并不适宜塔玛亚历山大藻大量繁殖,水体中仅可能存在微量的营养细胞,亦或是以孢囊的形式存在于底泥中[34]。我国是贝类养殖大国,养殖区遍布沿海各处,水体交换优良,利于产毒藻的迁移和养分的补充,且我国近海海水盐度基本处于25~35,可见我国海洋环境皆具备满足塔玛亚历山大藻高产毒能力的条件,这提示了高PSP毒性藻类增殖的风险,且该风险在水体富营养化时显著增加。
本研究结果表明,具有高PSP毒性的有害藻华可能发生在盐度高、空间充足、富营养化程度较高的海洋环境中。因此,为降低高PSP毒性的有害藻华暴发的风险,应加大符合以上条件海域的监管力度。
