SLC蛋白对青海湖裸鲤肠道排泄及酸碱平衡的影响
2021-07-08来琦芳史建全高鹏程祁洪芳么宗利
李 航,王 萍,来琦芳,史建全,周 凯,高鹏程,祁洪芳,么宗利
(1.中国水产科学研究院东海水产研究所,农业农村部东海渔业资源开发利用重点实验室,盐碱水域渔业工程技术研究中心(上海),上海 200090;2.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;3.青海湖裸鲤救护中心,西宁 810016)
青海湖裸鲤(Gymnocyprisprzewalskii)俗称湟鱼,属鲤形目(Cypriniformes),鲤科(Cyprinidae),裂腹鱼亚科(Schizothoracinae),裸鲤属,仅分布在青海湖及其周围水域中,是该区域重要的经济鱼类。裸鲤具有生殖洄游的特性,能在淡水、半咸水、碱水中生活[1],具有较强的盐度变化适应性。每年4—7月份为其繁殖季节,裸鲤溯河而上,至布哈河、沙流河和黑马河等淡水河流中产卵,繁殖结束后,随水流进入青海湖继续生活[2]。青海湖裸鲤在淡水和高盐碱湖水之间的洄游过程中,由于需要适应水环境中不同的盐碱度,机体的免疫、呼吸排泄、能量代谢及氨排泄等生理活动以及离子转运酶基因的表达量均会发生变化[3-7]。
肠道是鱼类进行渗透调节及酸碱平衡的主要组织之一,其渗透调节功能与体内碳酸盐或非碳酸盐缓冲体系的缓冲作用关系密切[8]。研究表明,海洋硬骨鱼类肠道上皮细胞是分泌碳酸氢盐的主要场所[9]。肠道中的通过顶膜上的Cl-/交换子分泌[10],SLC4基因家族(solute carrier family 4)和SLC26基因家族(solute carrier family 26)是生物体内编码转运蛋白的典型基因家族,并在海湾豹蟾鱼(Opsanus beta)[11]、青海湖裸鲤[12]肠道中都有高表达。
SLC4基因家族由10个基因组成(SLC4A1~SLC4A5;SLC4A7~SLC4A11),除SLC4A11基因外,SLC4基因家族中其余基因编码的蛋白均具有转运功能,但它们的转运方式存在差异[13-14]。由SLC4A1、SLC4A2和SLC4A3基因编码的同源阴离子转运蛋白AE1、AE2、AE3能介导Cl-和的交换,其中,AE1是红细胞的Cl-交换体,也是红细胞中最丰富的膜蛋白。SLC4A2、SLC4A4分别编码蛋白AE2、NBCe1,并在上皮细胞的基底外侧膜表达,是Na+/的共转运蛋白,可促进的细胞净吸收,并参与血液的输送。其中,NBCe1(SLC4A4)为产电的Na+/联合转运子[15]。
SLC26基因家族编码的阴离子交换蛋白可转运Cl-、、I-、OH-、和草酸根等多种阴 离 子,其 中SLC26A3、SLC26A4、SLC26A6、SLC26A7、SLC26A9和SLC26A11基因是目前被明确发现参与编码Cl-和交换的重要蛋白[16]。细胞内累积后由顶膜上SLC26A6基因编码蛋白通过Cl-/交换排出[17]。SLC26A3基因编码的交换子对Cl-和的转运比例为2∶1,而SLC26A6基因编码的交换蛋白每转运1个Cl-需要2个的参与[18]。
研究表明,SLC26A2、SLC26A3、SLC26A6、SLC26A8等基因编码的阴离子交换子的转运活性均可以被4,4′-二异硫氢基芪-2,2′-二磺酸(4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid disodium salt hydrate,DIDS)抑制[18-20]。多数由SLC4基因家族编码的蛋白也均能被DIDS抑制[19]。基于裸鲤具备在盐碱水与淡水环境之间自主调节酸碱平衡的能力,本实验设置淡水组及青海湖盐碱水组(以下简称湖水组),通过注射DIDS抑制离子交换的主要编码蛋白表达,检测盐碱胁迫下裸鲤血液生理指标的变化以及参与排泄的相关蛋白对应基因SLC4A1、SLC4A2、SLC4A4、SLC26A6在肠道中的相对表达变化,以期为揭示盐碱环境中裸鲤肠道渗透调节和酸碱调节的作用机理提供理论依据。
1 材料与方法
1.1 实验材料
实验用青海湖裸鲤由青海湖裸鲤救助中心提供,实验开始前于室内暂养2个月以上,暂养用水为净水机(型号:开能/AC/KDF150-1)处理后自来水,每天早晚各饱食投喂人工配合商品饲料(粗蛋白32%)1次,选取体长(12.81±0.35)cm、体质量(19.21±2.74)g、大小一致的健康个体开展实验,实验前48 h停止喂食。
1.2 实验设计和样品采集
根据青海湖裸鲤洄游水域水文特征以及青海湖湖水的离子组成和盐碱度特征,设置淡水对照组(FW control)、淡水抑制组(FW DIDS,淡水并注射DIDS)、湖水对照组(LW control)和湖水抑制组(LW DIDS,湖水并注射DIDS),实验用水参数设置见表1。淡水组用水为过滤自来水:盐度0.04±0.02,碱度(1.73±0.03)mmol·L-1;湖水组用水根据青海湖湖水组成特征[3]等比例配制:盐度14.83±0.04,碱度(29.54±0.11)mmol·L-1。裸鲤放入淡水和湖水40 h后,分别向淡水抑制组和湖水抑制组的裸鲤腹腔注射0.1 mL 10 mmol·L-1DIDS,同时,给淡水对照组和湖水对照组的裸鲤注射等体积的0.7%生理盐水。实验用水体积为50 L。每组设置3个重复,每个重复放置9尾裸鲤。为确保实验用水的稳定性,配方试剂全部溶解后曝气24 h使用,实验过程中每天换水50%。实验期间全程监测水体的盐度、碳酸盐碱度、pH及水温。盐度和水温使用YSI 6600多功能水质分析仪(YSI,美国)检测,pH值用DELTA 320型精密pH计(METTLER TOLEDO,瑞士)检测,碳酸盐碱度采用酸碱滴定法测定[21]。
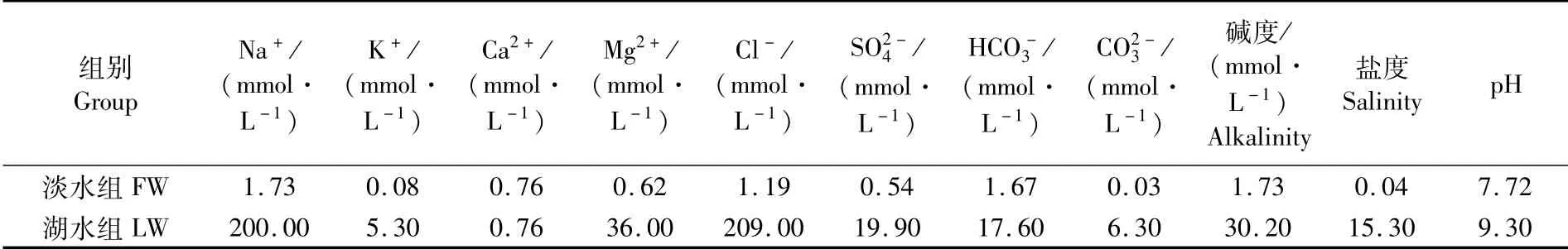
表1 实验用水参数设置Tab.1 Parameters of experimental water
注射8 h后开始收集肠道排泄物。肠道排泄物收集参照GENZ等[22]的方法:用0.2 g·L-1MS-222麻醉裸鲤,将绑有乳胶收集袋的10μL吸头开口端插入裸鲤泄殖腔(适当剪去吸头的顶端部分,以增大开口端口径),用手术缝合线将其固定后,转入实验用水溶液中,实验结束后将收集袋中的液体置于4℃下保存。而后用经抗凝血剂(肝素锂)润洗的1 mL注射器通过尾静脉穿刺采血。随即解剖采完血的裸鲤,取出肠道,分离出具有渗透和酸碱调节功能的中肠,置于液氮中速冻后,于-80℃条件下保存。
1.3 实验方法
用雷度ABL 80血气分析仪(Radiometer,丹麦)测定采集到的裸鲤静脉血血气生理指标。
1.3.2 中肠SLC4A1、SLC4A2、SLC4A4、SLC26A6基因相对表达
将取出的裸鲤中肠组织快速置于1.5 mL RNasefree管中,加入1 mL Trizol(Invitrogen,美国),依据Trizol说明书提取RNA,并用超微量紫外分光光度计(BioTake)测定RNA浓度及纯度,通过1.2%琼脂糖凝胶电泳鉴定RNA完整性。使用ReverTra Ace-α(TOYOBO,日本大阪)试剂盒逆转录合成cDNA第1链,总反应体系50μL,42℃延伸20 min,99℃5 min,4℃5 min后,瞬间离心,反转录产物置于-20℃保存。
将裸鲤β-actin基因(内参基因)、SLC4A1基因、SLC4A2基因、SLC4A4基因、SLC26A6基因的已知序列(由转录组测序获得)分别与GenBank中斑马鱼(Daniorerio)的对应基因进行比对:βactin(AY222742.1)、SLC4A1(NM_198338.1)、SLC4A2(AY876015.1)、SLC4A4(NM_001034984.1)、SLC26A6(FJ170818.1),选择高度保守区域用于引物设计。引物设计使用Primer 3.0软件[26],引物序列见表2,由上海英骏生物技术公司合成。所有引物经验证均具有良好特异性,反转录cDNA产物使用SYBR Premix ExTaqTM(TaKaRa,日本)试剂盒在Light Cycler 1.2(Roche)上进行real-time PCR反应。总反应体系为10μL,扩增程序如下:①预变性:95℃30 s;②扩增反应:95℃变性5 s,60℃退火20 s,72℃延伸20 s,40个循环;③溶解曲线形成:95℃15 s,60℃1 min,95℃15 s,延伸阶段收集荧光信号,每个样本设置3个重复。反应结束后,进行溶解曲线分析。以β-actin作为内参基因,基因的相对表达量使用2-△△Ct法[27]计算。

表2 定量PCR引物序列Tab.2 Primer sequences for real-time PCR assays
1.4 数据分析
文中数据用平均值±标准误(mean±SE)表示。使用SPSS 16.0软件进行数据统计,用单因素方差分析(one-way ANOVA)进行显著性分析,如果方差分析具有显著性,再用LSD法多重比较,显著水平P<0.05,使用Origin 8.6软件制图。
2 结果与分析
2.1 血气指标
相对于淡水对照组,湖水对照组的裸鲤血液pH及离子(包括Na+、Ca2+、Cl-)浓度均显著升高(P<0.05)(图1-A,C,D);二氧化碳分压(PCO2)显著降低(P<0.05),氧分压(PO2)无显著变化(P>0.05)(图1-B)。在注射DIDS后,淡水抑制组裸鲤血液pH及浓度较淡水对照组显著升高(P<0.05),PCO2显著降低(P<0.05),PO2、K+及Ca2+浓度无显著变化(P>0.05)(图1)。湖水抑制组与湖水对照组裸鲤相比,血液pH及浓度显著升高(P<0.05),而PCO2、PO2、K+及Ca2+浓度无显著变化(P>0.05)(图1)。相对于淡水抑制组,湖水抑制组中裸鲤pH显著提高(P<0.05),PCO2和PO2无显著变化(P>0.05)(图1),累积有增加趋势,但两者无显著差异(P>0.05)(图1)。
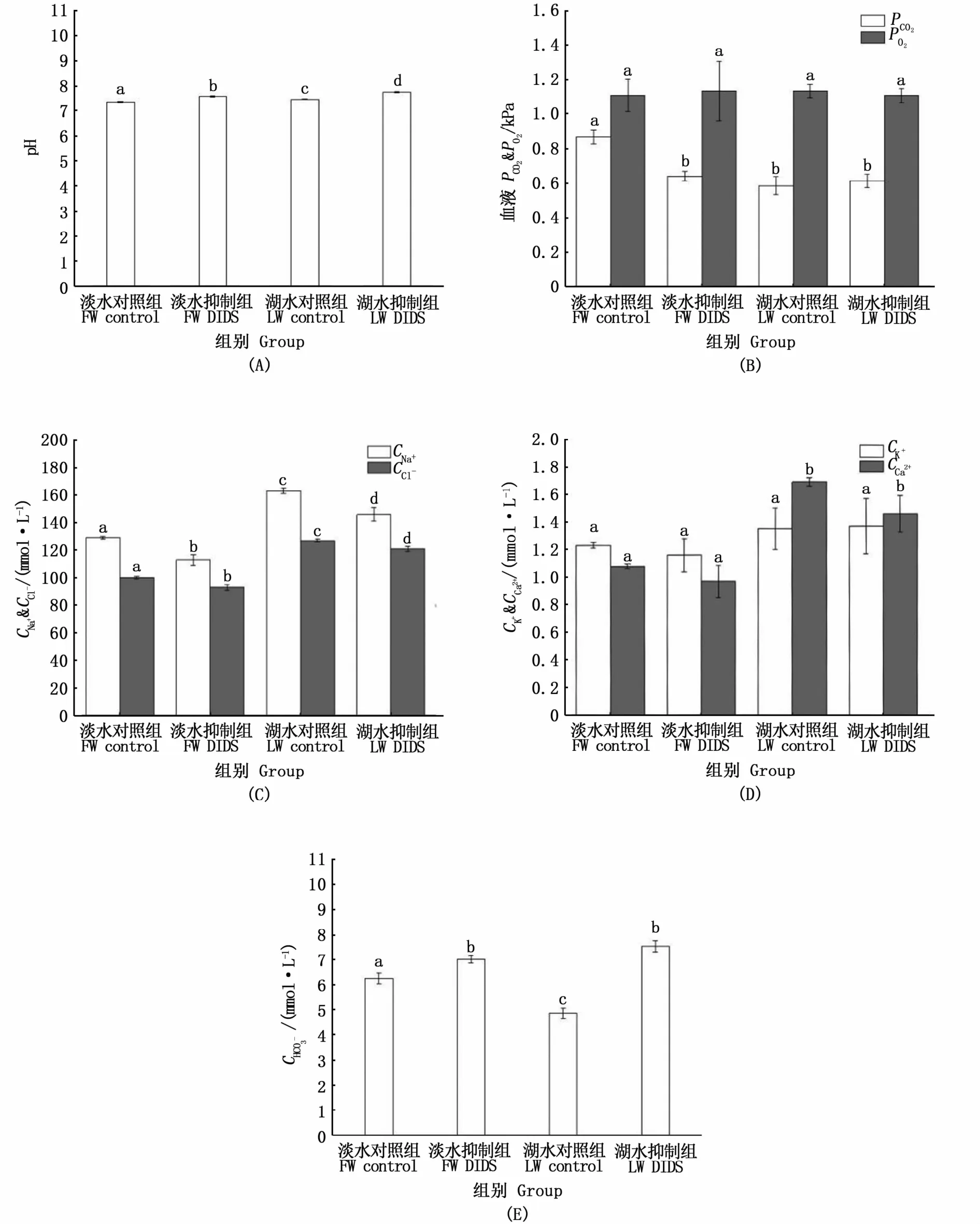
图1 SLC蛋白抑制剂对淡水及湖水环境中青海湖裸鲤血液生理指标变化的影响Fig.1 Effects of SLC inhibitor on blood physiological indices of Gymnocypris przewalskii exposed to fresh water or lake water
2.2 肠道排泄浓度
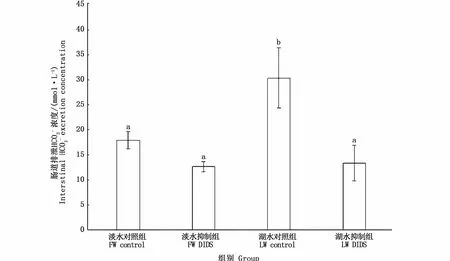
图2 不同组青海湖裸鲤肠道排泄HCO-3浓度比较Fig.2 Comparison of intestinal HCO-3 excretion concentration between different groups
2.3 中肠相关基因表达
由图3可知,湖水组裸鲤中肠SLC4A1、SLC4A4、SLC26A6基因表达量较淡水对照组均显著上调(P<0.05)。其中,SLC26A6基因上调较其他基因更为明显,湖水对照组和湖水抑制组分别上调达到淡水对照组的3.6倍和5.1倍。湖水组SLC4A2基因表达量与淡水对照组无显著差异(P>0.05)。注射DIDS后,湖水抑制组SLC4A1基因相对于湖水对照组表达量降低;淡水抑制组SLC26A6基因表达量较淡水对照组降低。
图3 SLC蛋白抑制剂对青海湖裸鲤中肠SLC4A1、SLC4A2、SLC4A4、SLC26A6基因相对表达量的影响Fig.3 Effects of SLC inhibitor on relative expression of SLC4A1,SLC4A2,SLC4A4,SLC26A6 genes in the mid-intestine of Gymnocypris przewalskii
3 讨论
裸鲤体内血液生理指标的变化是反映其对高盐碱环境适应性的重要指标。在本实验中,湖水对照组裸鲤与淡水对照组相比,血液pH升高,浓度及PCO2降低。研究表明,硬骨鱼类进入高盐碱环境后,由于水体中PCO2水平较低,会促使血液中CO2向水中扩散,导致血液中的PCO2水平下降[28-29]。当鱼类机体发生持续性的碱呼吸中毒时,为了缓解这种症状,机体会启动酸碱调节机制,体内迅速释放出乳酸盐以及H+等酸性物质,会导致短期内血液中浓度降低[30-31]。另外,高盐碱环境中,一部分碳酸盐可能以CO2的形式排出体外,使血液中含量随着PCO2降低而明显下降[32]。在本实验中,盐碱胁迫48 h后,裸鲤血液pH升高,PCO2降低,表明在高碱度胁迫初期,机体出现呼吸性碱中毒症状,这是裸鲤应对盐碱胁迫时的生理反应。裸鲤血液中的Na+、Ca2+和Cl-浓度显著升高,则是高盐度环境下机体渗透失水,血液渗透压升高的表现[33]。SLC家族蛋白通过调控肠道分泌,帮助裸鲤适应高盐碱环境。裸鲤在高盐碱环境下血液中会累积大量的,SLC家族蛋白有助于裸鲤肠道在高盐碱环境下排泄。由于盐碱水会引起类似海水的高渗透环境,与海水鱼类似,裸鲤启动渗透调节反应[34],肠道分泌较多。这种现象在莫桑比克罗非鱼(Oreochromismossambicus)中也有发现。罗非鱼在海水环境下肠道分泌含量是淡水中的几倍,这与参与分泌的SLC家族蛋白在罗非鱼适应海水时的表达量有关[35]。还有研究也证实,海水硬骨鱼的排泄与SLC蛋白相关[36-37]。在本实验中,淡水抑制组与淡水对照组相比,虽然肠道排泄无差异,但淡水抑制组在血液中累积了更多的,这进一步验证了DIDS会抑制SLC蛋白的活性,导致血液中的无法排出,造成在裸鲤血液中的累积。裸鲤在高盐碱环境下会启动SLC家族基因的高表达来提高蛋白表达,以促进肠道的排泄。盐碱处理48 h后,裸鲤肠道SLC4A1、SLC4A2、SLC4A4、SLC26A6基因表达量均上升,且除SLC4A2基因外,湖水对照组裸鲤其余基因表达均与淡水对照组有显著差异(P<0.05)。肠上皮基底膜上的Na+交换子(SLC4A2、SLC4A4)传递至上皮细胞,顶膜Cl-/交换子(SLC4A1、SLC26A6)分泌至肠道。裸鲤这种在盐碱环境下通过上调SLC家族基因表达来促进多余排泄的响应方式,与海水鱼应对高盐胁迫类似,是一种渗透调节的重要方式[38-40]。
