盐度骤变对花鲈血清及肝脏代谢酶、抗氧化酶活力及皮质醇含量的影响
2021-07-08王孝杉彭士明施兆鸿
王孝杉,方 秀,彭士明,汪 睛,施兆鸿
(1.中国水产科学研究院东海水产研究所,上海 200090;2.福建闽威实业股份有限公司,福建福鼎 355200)
海水鱼类对盐度的耐受性和适应性与渗透压调节能力和离子调节酶活力有关,在对盐度的适应过程中,鱼类的生长、代谢、免疫、性腺发育等生理功能都会受到影响[1]。环境中盐度变化可引起鱼类多种生理应激反应,导致产生过量的活性氧分子[2],影响到鱼类的存活、代谢及免疫防御功能[3]。鱼类机体中抗氧化系统的抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等,这3种酶协同作用,有效防护了活性氧对机体的损伤[4],在清除活性氧自由基方面发挥着重要作用[5]。生物机体的部分新陈代谢活动是依赖不同磷酸酶来催化完成分子的磷酸化和去磷酸化[6]。其中,酸性磷酸酶(ACP)和碱性磷酸酶(AKP)是衡量受盐度胁迫后机体免疫机能和健康状况的重要指标[7]。而能反映受盐度胁迫后机体应激程度的转氨酶主要存在于血液和肝脏等组织中,一般认为谷丙转氨酶(GPT)和谷草转氨酶(GOT)是氨基酸代谢过程中两个重要的氨基转移酶[8]。同样,皮质醇(COR)不仅对应激反应和糖代谢有调控功能,对渗透压也有调节作用,能通过增加氯细胞数量和提高Na+-K+-ATP酶活力来增强机体耐盐性[9]。可见,抗氧化酶和代谢酶活力以及皮质醇含量对研究盐度胁迫条件下的鱼类适应性和耐受性具有重要的意义。
花鲈(Lateolabraxmaculatus)是我国一种重要的经济鱼类,其盐度适应范围广,在从淡水到高盐海水等不同盐度的水环境中均能存活生长[10]。有关盐度变化对花鲈生长及生理生态影响的研究,20世纪90年代主要集中在盐度对其胚胎和仔鱼生长发育的影响方面[11-12];21世纪以来开展了盐度及饥饿胁迫相关实验和研究[13-16];近10年来研究则主要集中在盐度胁迫对鱼类生长性能、生理生态、组织结构、基因表达的影响等方面[17-25]。为评估花鲈在养殖环境中对盐度骤变的耐受性和适应性,本实验设置盐度骤降再骤升和盐度骤升再骤降两种处理方式,观察其肝脏代谢酶和抗氧化酶活力及皮质醇含量变化情况,旨在得出花鲈肝脏和血清中抗氧化酶和代谢酶活力以及皮质醇含量在盐度单一骤变及连续骤变过程中的响应规律,并为花鲈应对盐度骤变的生理机制研究提供基础资料。
1 材料与方法
1.1 实验用鱼与实验条件
实验于2018年9月在东海水产研究所福鼎试验基地进行。实验用鱼取自沙埕港内的福建闽威实业股份有限公司养殖网箱,选取大小一致、活力较好的花鲈个体,平均体长(23.23±1.13)cm,平均体质量(203.27±26.55)g。鱼运抵后先在水温(26.0±1.0)℃、盐度20的室内水泥池中暂养14 d。暂养密度为30尾·m-3,每天8∶00和17∶00饱食投喂日本林兼产业株式会社产“虎豚”牌2号配合饲料。不间断向水中充气,每天上午在投饲2 h后换同盐同温水50%,同时吸去底部污物及残饵。实验用水为过滤沉淀处理后的天然海水。
1.2 实验设计
实验在直径1.2 m、深0.8 m的圆形玻璃纤维缸中进行。实验设计见表1,盐度骤变处理分A、B两组:A组从盐度18先骤降至盐度为0的淡水并持续7 d,以A-Ⅰ表示;然后再骤升至盐度33的水体中持续7 d,以A-Ⅱ表示;B组从盐度18骤升至盐度33的水体并持续7 d,以B-Ⅰ表示;然后再骤降到盐度为0的淡水中并持续7 d,以B-Ⅱ表示。另设盐度18养殖水体处理组为对照组(C组)。盐度0的养殖水采用曝气后的淡水;盐度33的养殖水采用盐度18的过滤沉淀后的天然海水添加海水晶配置,配制好的养殖水稳定48 h后使用。用折光式PAL-03S盐度计(爱拓牌,南京晓晓仪器设备有限公司)监测养殖水的盐度。每组均设3个重复,每个重复30尾鱼。实验期间的管理与暂养期间一致,每天观察鱼的活动和摄食状况。
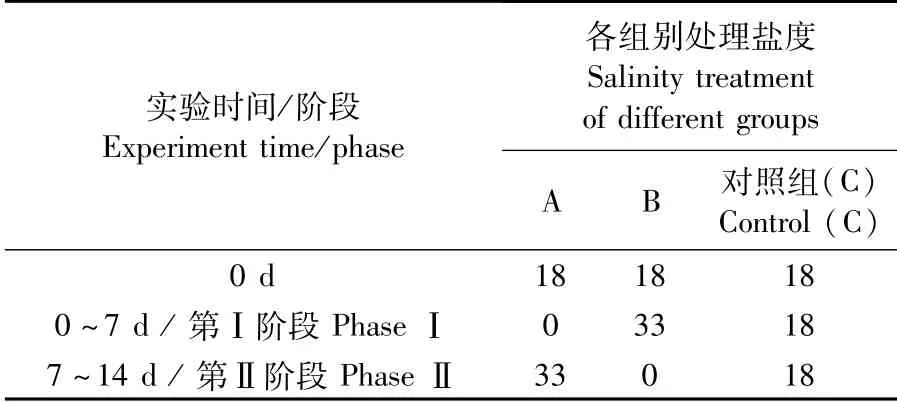
表1 盐度骤变的实验设置Tab.1 Experiment design of abrupt salinity changes
1.3 取样和样品检测
第Ⅰ和第Ⅱ阶段开始后分别于0、0.5、1、3、7 d时取样,每个平行组每次取3尾鱼。取样前禁食半天,用3-氨基苯甲酸乙酯甲基磺酸盐(MS-222,200 mg·L-1)将鱼麻醉后,用1 mL注射器(预冷)从尾部静脉抽取血液置入5 mL离心管中,离心管在4℃下静置12 h,采用安信AXTGL16M型低温离心机2 500 r·min-1条件下离心5 min,取上清液,置于2 mL离心管中放在-20℃冰箱中保存,用于检测血清AKP、ACP、GPT、GOT活力和COR含量。取完血样后将鱼置于冰盘上解剖,取出肝脏,用预冷生理盐水冲洗后再用吸水纸吸干,并置于2 mL的离心管中在-20℃冰箱中保存,用于检测SOD、CAT、GSH-Px活力以及AKP、ACP、GPT、GOT活力。测定前,先将肝脏在匀浆介质(pH 7.4,0.01 mol·L-1Tris-HCl,0.000 1 mol·L-1EDTA-2Na,0.01 mol·L-1蔗糖,0.8%NaCl)中剪碎,用沪析HR-6型匀浆机(15 000 r·min-1)研磨制成匀浆。在4℃、1 500 r·min-1条件下离心5 min。根据需要,取上清液稀释后进行酶活力及总蛋白测定。总蛋白采用考马斯亮兰法(南京建成试剂盒)进行测定。酶活力用南京建成试剂盒检测,按照试剂盒说明书进行操作。
1.4 数据统计与分析
实验结果用SPSS 16.0软件进行统计与分析。采用单因素方差分析(one-way ANOVA)和独立样本t检验对3个组别的差异性进行分析,当P<0.05时表示差异具有显著性,文中数据均以平均值±标准差(mean±SD)表示。用Excel 2010软件作图。
2 结果与分析
2.1 盐度骤变对花鲈活动和摄食的影响
在阶段Ⅰ中,A组从盐度18骤降至0,鱼游动正常,与C组无差异;但盐度骤变后出现停食现象,到3 d时才开始恢复摄食。B组从盐度18骤升至33,鱼活动也正常,到6 d时开始恢复摄食。
在阶段Ⅱ中,盐度骤变首日,A、B组鱼活动均表现为经常卧底、游动迟缓,3 d起各组鱼游动能力逐渐恢复,6 d起游动状态与C组无差异;7 d内均未摄食。
2.2 盐度骤变对花鲈血清代谢酶活力的影响
如图1所示,在A-Ⅰ阶段中,A组血清中AKP、ACP、GPT和GOT活力均出现上升。其中,AKP仅在0.5 d与C组间差异显著(P<0.05);ACP、GPT活力在0.5~3 d时与C组间差异显著(P<0.05);GOT活力在3 d时与C组间差异显著(P<0.05);随后,各代谢酶活力下降至与C组间无显著性差异(P>0.05)。在A-Ⅱ阶段,盐度从0骤变至33,A组各代谢酶活力均又出现上升。其中,AKP在处理后0.5 d和3 d时与C组间差异显著(P<0.05);ACP在0.5 d时与C组间差异显著(P<0.05);GPT和GOT在0.5~1 d时与C组间差异显著(P<0.05);随后各指标下降至与C组间无显著性差异(P>0.05)。

图1 盐度骤变对花鲈血清代谢酶活力的影响Fig.1 Impact of abrupt salinity changes on activity of metabolic enzymes in serum of Lateolabrax maculatus
B-Ⅰ阶段,B组AKP和ACP活力与C组间无显著性差异(P>0.05)。而GPT和GOT活力分别在处理后0.5 d和0.5~3 d时出现下降,并与C组间有显著性差异(P<0.05);随胁迫时间延长,GPT在1 d时恢复至与C组间无显著性差异(P>0.05),GOT则在7 d时恢复到与C组间无显著性差异(P>0.05)。在随后B-Ⅱ(盐度33骤降至0)阶段,B组AKP 0.5 d时先显著上升(P<0.05),随后开始下降,至7 d时降至显著低于C组(P<0.05);ACP活力在0.5~3 d时均与C组间有显著性差异(P<0.05);至7 d时恢复至无显著性差异(P>0.05)。GPT活力在1 d时与C组呈显著性差异(P<0.05),随后下降至无显著性差异(P>0.05);GOT活力出现先升后降的变化,0.5 d和1 d时显著高于C组(P<0.05),7 d时又下降至显著低于C组(P<0.05)。
2.3 盐度骤变对花鲈血清皮质醇含量的影响
如图2所示,在A-Ⅰ阶段中,A组血清中COR含量出现上升,在0.5~3 d时均显著高于C组(P<0.05);7 d时下降至与C组间无显著性差异(P>0.05)。A-Ⅱ阶段,A组COR含量在0.5~1 d时显著高于C组(P<0.05);随后3~7 d时降至与C组间无显著性差异(P>0.05)。
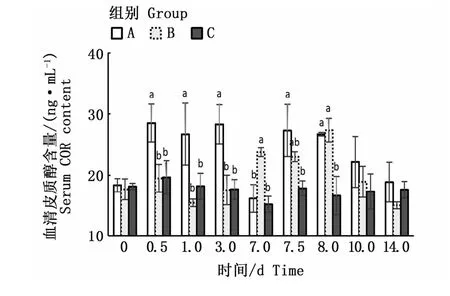
图2 盐度骤变对花鲈血清皮质醇含量的影响Fig.2 Impact of abrupt salinity changes on cortisol content in serum of Lateolabrax maculatus
在B-Ⅰ阶段中,实验3 d内B组COR含量与C组间无显著性差异(P>0.05),7 d时B组与C组间有显著性差异(P<0.05)。B-Ⅱ阶段中,B组COR含量先升高后降低,在1 d时与C组有显著性差异(P<0.05)。
2.4 盐度骤变对花鲈肝脏代谢酶活力的影响
如图3所示,A-Ⅰ阶段中,A组花鲈肝脏中AKP活力先升后降,在0.5~1 d时与C组间有显著性差异(P<0.05);ACP活力先降后升,在0.5 d时与C组有显著性差异(P<0.05);GPT活力呈先升后降的变化,在0.5~1 d时显著高于C组(P<0.05),而3~7 d时又显著低于C组(P<0.05);GOT活力持续高于C组,但仅0.5 d时有显著性差异(P<0.05)。在A-Ⅱ阶段中,A组AKP活力持续升高,且在1~7 d时均与C组有显著性差异(P<0.05);ACP活力在7 d时升高至与C组有显著性差异(P<0.05);GPT活力整个阶段与C组无显著性差异(P>0.05);GOT活力在A-Ⅱ阶段均与C组间有显著性差异(P<0.05)。

图3 盐度骤变对花鲈肝脏代谢酶活力的影响Fig.3 Impact of abrupt salinity changes on activity of metabolic enzymes in liver of Lateolabrax maculatus
B-Ⅰ阶段中,B组AKP活力与C组无显著性差异(P>0.05);ACP活力随时间延长呈波动变化,在1、7 d时与C组间有显著性差异(P<0.05)。GPT活力在0.5~1 d时与C组有显著性差异(P<0.05),在3 d时恢复至与C组间无显著性差异(P>0.05),在7 d时下降至显著低于C组(P<0.05);GOT活力持续上升,0.5~7 d均与C组间有显著性差异(P<0.05)。在B-Ⅱ阶段中,B组AKP活力在3 d时与C组有显著性差异(P<0.05);除了GPT在0.5 d时显著低于C组(P<0.05),整个阶段ACP、GPT和GOT活力与C组差异均不显著(P>0.05)。
2.5 盐度骤变对花鲈肝脏抗氧化酶活力的影响
如图4所示,A-Ⅰ阶段中,A组花鲈肝脏中SOD活力在0.5~1 d时升高,与C组之间呈显著性差异(P<0.05),在3~7 d下降至与C组无显著性差异(P>0.05);GSH-Px活力随时间延长出现波动,仅3 d时显著高于C组(P<0.05);CAT活力也呈波动变化,但与C组无显著性差异(P>0.05);在A-Ⅱ阶段中,A组SOD活力与C组间无显著性差异(P>0.05);GSH-Px和CAT活力均在7 d时升高,与C组间有显著性差异(P<0.05)。

图4 盐度骤变对花鲈肝脏抗氧化酶活力的影响Fig.4 Impact of abrupt salinity changes on activity of antioxidant enzymes in liver of Lateolabrax maculatus
B-Ⅰ阶段中,SOD活力变化不大,与C组之间无显著性差异(P>0.05);而GSH-Px随时间延长呈波动上升变化,从0.5 d起即与C组间有显著性差异(P<0.05);CAT活力在1~3 d与C组间有显著性差异(P<0.05)。B-Ⅱ阶段中,SOD活力随时间延长呈波动式升高变化,0.5、3、7 d时与C组有显著性差异(P<0.05);GSH-Px活力则呈下降变化,在处理1 d后即下降至C组水平(P>0.05);CAT活力先降后升,仅处理后1 d与C组间有显著性差异(P<0.05),其他时间均与C组间无显著性差异(P>0.05)。
3 讨论
3.1 盐度骤变对花鲈活动和摄食的影响
已有的研究和实际养殖生产均已证实,花鲈对盐度的适应范围跨度很大。杜涛等[17]认为,盐度16~17是花鲈的最适生长盐度;刘阳等[21]认为,低盐度环境更有利于花鲈的生长;温久福等[25]发现,5个盐度梯度下(0、10、15、20和30),仅盐度30出现死亡个例。本实验研究了盐度骤变对花鲈活动和摄食的影响,虽然盐度骤变未造成花鲈死亡,但对其摄食和活动状态仍产生了一定影响。盐度从18骤变到0或33会造成花鲈的停食,而且低盐向高盐骤变比高盐向低盐骤变对鱼活动和摄食的影响更大。从盐度0骤变到33或从盐度33骤变到0,不仅造成了停食,而且使其活动状态也发生了变化,但经过7 d的适应,能恢复至正常的活动状态。结果表明,在本实验条件下,花鲈对盐度大幅度骤变具有一定的耐受性和适应性;相对盐度骤升,本实验规格的花鲈对盐度骤降具有更好的适应性。
3.2 代谢酶活力对盐度骤变的响应
鱼类在盐度胁迫下,一般通过加快新陈代谢来为渗透调节提供能量。此时机体内大量营养物质被调动,多种氨基酸参与其中[26]。有研究证明,体内游离氨基酸如谷氨酸、丙氨酸、甘氨酸、脯氨酸和牛磺酸的含量会因盐度胁迫而升高[7]。而机体部分的新陈代谢活动是由物质的磷酸化和去磷酸化来进行调节,这些过程主要依靠不同的磷酸酶催化完成[6]。已有研究显示,海水鱼类在盐度胁迫过程中,肝脏AKP与ACP活力会随着盐度的降低显著升高或者先降低再升高[7]。本研究发现,血清中磷酸酶比肝脏中的磷酸酶对盐度骤变的反应更灵敏;花鲈AKP对盐度骤变的响应特征与其他学者研究结果相似[7,27];AKP与ACP相比,对盐度骤变更敏感,表明其在磷酸化过程中具有更重要的作用。
一般认为,转氨酶主要存在肝脏中,而血清中的转氨酶活力较低。通过检测血清或肝脏中转氨酶活力,可以判断机体的应激程度、评价其摄食水平和生长发育[28]。本实验中,血清转氨酶活力为1.18~9.30 U·L-1,而肝脏转氨酶活力则是4.25~20.40 U·gprot-1,若忽略血清的比重,肝脏中的酶活力是血清中的千倍以上。王涛等[29]发现大黄鱼(Pseudosciaenacrocea)在盐度突降后血清中GPT和GOT活力上升,本研究结果与其相似。本研究还表明,盐度不论骤升还是骤降,均对花鲈形成了胁迫,使其发生应激反应,导致转氨酶活力上升。当鱼体适应了环境变化后,转氨酶活力下降。
3.3 皮质醇含量对盐度骤变的响应
处于应激状态下的鱼类,通过下丘脑—垂体—肾间组织产生皮质醇等类固醇,并释放到血液中,体内的COR含量在数小时内会急剧升高[30]。COR通过对糖代谢的调控等形式来提供抵御环境胁迫所需的能量。但COR含量过高或长期维持在较高的水平,会对鱼体造成负面影响[31]。本研究显示,盐度从18骤降到0时,0.5 d后皮质醇即有显著变化;而盐度从18骤升到33时,7 d后皮质醇才有显著性变化。可见,花鲈对盐度骤降可以作出更快的响应。
3.4 抗氧化酶活力对盐度骤变的响应
有关环境条件改变会引起生物体内活性氧自由基产生的现象已有报道[32-33],机体为抵御环境胁迫会作出免疫反应,产生过量的自由基,为抵御活性氧自由基对细胞的损伤,机体会通过抗氧化酶系统来清除体内自由基和活性氧物质[34]。本实验中,SOD活力在盐度骤降过程中出现升高,这与以往研究得出的结果相似[33,35];而GSH-Px和CAT活力在盐度骤降过程中与对照组相比均无显著性差异(P>0.05)。盐度骤升条件下,SOD活力未出现上升,而GSH-Px和CAT活力均出现上升。本实验结果表明,SOD主要在盐度骤降时发挥作用,而GSH-Px和CAT则在盐度骤升时发挥作用。
一般认为,在清除活性氧的过程中,SOD最早发挥作用,其通过歧化作用来分解超氧阴离子自由基·O-2,并产生H2O2[4]。再 由CAT和GSH-Px将H2O2转化为H2O和O2[36]。本实验中,盐度从18骤降至0时,SOD活力在0.5 d时显著升高,GSH-Px则在3 d时达到峰值;盐度从33骤降至0时,SOD活力持续升高,GSH-Px和CAT活力则在实验过程后期中出现上升,但与对照组相比无显著性差异。这种变化规律可能印证了SOD在活性氧清除反应中处于核心的地位[37]。SOD、GSH-Px和CAT在抗氧化系统中相互协调,发挥着清除自由基的功能[35]。
4 小结
花鲈在本实验盐度大幅度骤变条件下,体内代谢酶和抗氧化酶活力以及皮质醇含量都出现变化,大部分条件下均呈现随时间延长先升高后降低的趋势,表明花鲈在盐度骤变时产生了应激反应。而后可在3~7 d内获得对骤变盐度的适应,说明花鲈对盐度变化具有良好的耐受性和适应性。本实验条件下,从代谢酶、抗氧化酶活力和皮质醇含量等变化特征来看,花鲈对盐度骤降比盐度骤升有更强适应能力。
