一种从菲律宾蛤仔黏附细菌Halomonas sp.GHF11 中提取的多糖絮凝剂的表征其在脱色中的应用
2021-07-06蒋广宁
穆 军,蒋广宁,陈 荫
(浙江海洋大学海洋科学与技术学院,浙江舟山 316022)
絮凝剂广泛用于工业废水处理、饮用水处理、脱色、重金属去除、采矿业和纺织业等[1]。絮凝剂可以使液体中的胶体颗粒形成较大的颗粒以沉降,因此可用于去除污染废水的浊度和悬浮固体等。然而无机絮凝剂和合成类絮凝剂的大量使用,对环境产生了二次污染,微生物絮凝剂应运而生。与传统絮凝剂相比,微生物絮凝剂有安全,无毒,环保且用量少等优点[2-3]。生物絮凝剂的组分主要包括蛋白质、多糖、核酸和纤维素,其中多糖是主要组分[4]。由于多糖化学结构的多样性,人们对胞外多糖的微生物活性进行了许多研究[3-5]。胞外多糖是由细菌和其他微生物分泌的细胞外聚合物,并且在许多方面表现出良好的活性,例如絮凝和脱色。然而,获得纯多糖产品成本高,产率低,发酵过程长,限制了其广泛应用。因此探究其中的作用机制,将有利于通过人工合成、生态仿生等途径来降低絮凝剂的生产成本,促进微生物絮凝剂的发展。
菲律宾蛤仔对海水有着特殊的絮凝效果,推测絮凝效果与蛤仔黏附污泥中的微生物有关。实验室前期从黏附污泥中筛选出14 株絮凝活性菌株,选取菌株Halomonassp.GHF11,从其发酵液中提取细胞外多糖,并通过柱层析纯化多糖进行结构表征。该多糖有约70%的絮凝率外,对染料孔雀石绿的脱色率可达90%。研究表明,多糖是发挥絮凝作用的主要活性物质。通过分析多糖的单糖组成、糖苷键连接方式来探究化学结构与优异性能之间的相关性,有助于理解絮凝机理并充分发挥其潜在的应用价值[6]。
本文从絮凝活性菌株的发酵液中提取微生物多糖,通过柱层析纯化获得多糖纯物质,并通过一系列分析对纯化的多糖进行结构表征,包括单糖组成、红外光谱分析、分子量测定、甲基化分析,对其结构的研究有利于对海洋微生物资源利用,并为新型微生物多糖的开发提供依据。
1 材料与方法
1.1 材料与试剂
菌株Halomonassp.GHF11 是从菲律宾蛤仔黏附污泥中筛选获得,具有较高的絮凝活性。
主要试剂:乙醇、硫酸、苯酚、氯仿、正丁醇、三氟乙酸(TFA)、二甲基亚砜(DMSO)、CH3COOH、吡啶为国产分析纯,1-苯基-3-甲基-5-吡唑啉酮(PMP)和乙腈(HPLC 级),12 种单糖标准品:D-鼠李糖、D-核糖、D-甘露糖、D -葡萄糖、D-氨基半乳糖、L-岩藻糖、D-葡萄糖醛酸、D-阿拉伯糖、D-木糖、D-半乳糖、D-氨基葡萄糖、D-半乳糖醛酸。
菌株GHF11 用以下培养基(g·L-1)培养:K2HPO4,5;KH2PO4,2;CO(NH2)2,0.5;(NH4)2SO4,0.2;酵母提取物,0.5;葡萄糖,20;溶于1 L 人工海水(ASW)中,初始pH 为7.5。
人工海水组分(g·L-1):MgCl2·6H2O,9.68;KCl,0.61;Na2SO4,3.47;NaCl,30.0;Na2HPO4,0.014;NaHCO3,0.17;CaCl2·2H2O,1.36;KBr,0.10;SrCl2·6H2O,0.04 和H3BO3,0.03。
1.2 菌株的发酵及多糖的提取
将GHF11 接种到500 mL 的烧瓶中,每瓶150 mL,于115 ℃高压灭菌30 min,并在28 ℃,180 r·min-1培养4 天。使用乙醇沉淀法从发酵液中提取胞外多糖粗品[7],将培养液(6 L)高速离心除去菌体及代谢物,用旋转蒸发器浓缩上清液至初始体积的1/10。浓缩液透析后,三倍体积的无水乙醇缓慢加入其中,充分混合后于4 ℃下放置过夜,离心收集产生的粗多糖沉淀物。将多糖重新溶解在去离子水中,等体积的Sevag 试剂(其为氯仿和正丁醇(4:1,V:V)的混合溶液)加入到粗多糖溶液中,充分混合,放置30 min,离心以除去其中蛋白质。将上层水相浓缩并冻干,得到脱蛋白粗多糖。
1.3 胞外多糖的纯化
粗多糖的纯化采用JIANG Changxing,et al[8]的方法并稍作修改。将粗多糖重新溶解于5.0 mL 去离子水中,上样到DEAE-52 纤维素柱(2.5×30 cm),用0、0.1、0.3、0.5 mol·L-1的氯化钠溶液以1.0 mL·min-1的流速梯度洗脱。用自动收集器以5 mL/管收集洗脱液。通过苯酚-硫酸法测定多糖,并绘制洗脱曲线[9]。合并相同组分,透析并浓缩。随后,使用Sephadex G-100 凝胶渗透色谱柱(1.5×50 cm),用去离子水以0.2 mL·min-1的流速洗脱,进一步纯化浓缩的组分,收集同一洗脱峰下的级分,浓缩冻干后得到多糖纯品。
1.4 絮凝活性的测定
使用高岭土悬浊液测定絮凝活性[10]。在250 mL 烧杯中依次加入93 mL 高岭土悬浊液液(4 g·L-1),5 mL CaCl2(10 g·L-1)和2 mL 多糖溶液,调节pH 至7.5,将混合液在180 r·min-1下剧烈搅拌1.0 min,60 r·min-1下缓慢搅拌2.0 min,最后静置10 min,用分光光度计测量上清液在550 nm 处的吸光度,使用2 mL 去离子水作为空白对照,所有操作平行3 次,絮凝率通过以下公式计算:
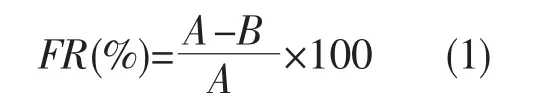
FR 代表絮凝率;A 和B 分别是对照和样品的吸光度值。
1.5 脱色活性的测定
脱色活性的测定参照文献[11],脱色率表示为DC。对3 种染料进行脱色实验,包括亚甲基蓝,结晶紫和孔雀石绿。移取1 mL 的原液(400,400,1 000 mg·L-1),稀释至100 mL,调节体系pH 7.5~8.0,加入1 mL样品溶液,然后将混合物缓慢搅拌1 min 并静置1 h,以9 000g 离心10 min,分别测量3 种稀释溶液在660、580 和620 nm 处的吸光度,用去离子水作为参比。脱色活性计算公式如下:
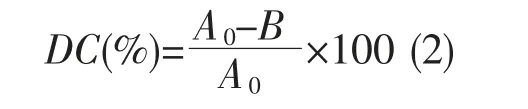
其中DC 代表脱色率;A0和A 分别是对照和样品的吸光度值。
1.6 单糖组成分析
利用HPLC 分析多糖的单糖组成,参考文献[12]。将200 μL 多糖溶液(2g·L-1)和200 μL 三氟乙酸(2 mol·L-1)在安瓿瓶中混合于110 ℃水解4 h。安瓿瓶冷却至室温后,加入500 μL 甲醇并在旋转蒸发器上蒸发至干,重复加入3 次以除去残留的三氟乙酸。然后将干燥的水解样品溶解在200 μL 氢氧化钠(0.3 mol·L-1)中,与200 μL PMP 甲醇溶液(0.5 mol·L-1)充分混合,在70 ℃下反应100 min。冷却至室温后,加入200 μL 盐酸(0.3 mol·L-1)中和。随后,加入二氯甲烷(1.0 mL)萃取数次以除去PMP。用0.45 μm 微孔滤膜过滤,用于HPLC 分析。同时,混合单糖标准品的衍生化过程在相同条件下进行。PMP 单糖衍生糖的分析在配备有光电二极管阵列检测器(Agilent HP 1100,Agilent Technologies,USA)的HPLC 系统上操作。
色谱条件:色谱柱,Zorbax Eclipse XDB-C18(4.6×250 mm,5 μm,Agilent Technologies,USA);柱温,30 ℃;流动相,磷酸盐缓冲盐(0.1 mol·L-1,pH 6.7),比例为17.8%(V/V%)乙腈;流速,1.0 mL·min-1;进样量,20 μL;检测器波长,254 nm。
1.7 红外光谱分析和分子量测定
将纯多糖(1 mg)与KBr(100 mg)充分混合并用红外线干燥,然后用红外光谱扫描仪BIO-RAD FTS3000在4 000cm-1~400 cm-1的范围内扫描,扫描速率为1 cm-1。
通过凝胶渗透色谱柱HPSEC Shodex OH-park SB-805 测定多糖的分子量。色谱条件如下:柱温,30 ℃;注射量:20 μL;流速:0.8 mL·min-1;通过标准曲线计算多糖分子量。
1.8 甲基化分析
使用HAKOMORI[13]的方法并稍做修改,对多糖进行甲基化分析。将多糖(1.0 mg)与1.0 mL DMSO 溶解在烧瓶中,快速加入100 mg 无水氢化钠,并在室温下磁力搅拌0.5 h。然后缓慢加入0.5 mL 碘甲烷,在室温下磁力搅拌反应1.5 h,此过程在氮气保护下避光反应。最后,加入1 mL 水终止反应,用二氯甲烷从溶液中萃取甲基化多糖3 次。合并萃取液后,用水洗涤二氯甲烷层3 次,减压干燥二氯甲烷层,得到甲基化多糖。将甲基化多糖溶于0.5 mL 三氟乙酸(2 mol·L-1)中,并在安瓿瓶中于110 ℃密封水解4 h。待安瓿瓶冷却后,开口加入甲醇(1 mL),蒸发至干,重复多次除去三氟乙酸,将水解的样品并溶解在1 mL NaOH 溶液(0.05 mol·L-1)中,加入10 mg NaBH4,并在室温下反应4 h,然后加入2 滴冰醋酸中和直至无气泡产生,加入甲醇并蒸发至干多次以除去硼酸。将样品干燥并转移到EP 管中,加入0.5 mL 吡啶,将混合物在90 ℃水浴中密封0.5 h。冷却后,加入0.5 mL 乙酸酐,将混合物在100 ℃水浴中密封1 h。最后,将乙酰化样品在旋转蒸发器上蒸发至干,并溶于二氯甲烷(0.5 mL)中,并用水洗涤以除去不溶性盐和吡啶。将溶液通过0.45 μm 铝膜过滤,用于GC-MS 分析。
气相质谱联用仪条件:离子源温度,260 ℃;进样口温度,240 ℃;初始温度,60 ℃;程序升温,3 ℃·min-1,240 ℃保温10 min;色谱柱,DB-WAX(30 m×0.250 mm,0.50 μm,Agilent Technologies,USA);检测器温度:250 ℃;氦气流速,1.5 mL·min-1;进样量,1.0 μL。
2 结果与分析
2.1 多糖的提取纯化
使用sevag 试剂进行脱蛋白操作,从200~400 nm 的扫描结果如图1A,在260 和280 nm 处没有特征吸收,表明没有蛋白质和核酸[14]。使用离子交换柱在水洗条件下洗脱出一个主要组分(图1B),通过SephadexG-100 凝胶渗透色谱进一步纯化显示其为单一组分(图1C)。纯化的多糖用于进一步的活性分析和结构表征。
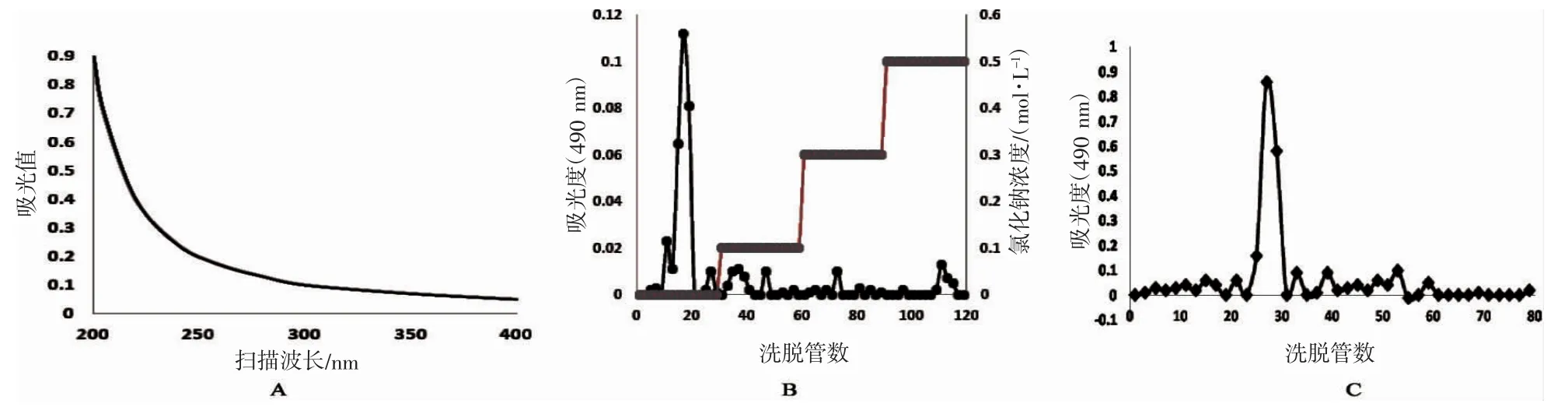
图1 去蛋白后的F11 粗多糖紫外扫描曲线(200~400 nm)(A),F11 菌株胞外粗多糖经过DEAE-52 柱层析所得的洗脱曲线(B);F11 菌株多糖过Sephadex G100 层析柱纯化的洗脱曲线(C)Fig.1 Ultraviolet scanning of F11 polysaccharide at the wavelength of 200 to 400 nm(A);elution curve of crude polysaccharide on DEAE-52 column(B),and elution curves of polysaccharide fraction(C)on Sephadex G-100 column.
2.2 多糖活性测定
图2A 显示了多糖纯品在去离子水系统中浓度从0.1 mg·L-1到1.0 mg·L-1的絮凝活性。实验结果表明,在剂量为0.5 mg·L-1时,最大絮凝率达到71.2%,在较少或较高剂量下絮凝活性逐渐降低。图2B 显示了多糖剂量范围为0.5~3.0 mg·L-1时,对于孔雀石绿的脱色效果变化曲线,在反应剂量1.8 mg·L-1时,达到最佳脱色效果92.4%。当剂量小于0.5 mg·L-1或超过3.0 mg·L-1时,脱色率显著下降。
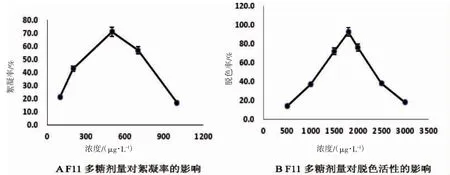
图2 多糖剂量对絮凝率及脱色活性的影响Fig.2 The effect of F11 polysaccharide dosage on flocculation rate and decolorization activity
2.3 红外光谱分析
纯多糖的组成包括葡萄糖,甘露糖,葡糖胺,核糖和半乳糖。葡萄糖和甘露糖占主要比例,这意味着葡萄糖可能是微生物絮凝剂的基本骨架。核糖,葡糖胺和半乳糖可以是多糖的分支结构。
多糖的分子量确定为约31 kDa。如图3 所示,在400 和4 000 cm-1之间扫描纯化的多糖以分析FT-IR光谱。在3 432 cm-1处的强吸收峰证实了羟基的存在。1 393 cm-1和1 641 cm-1处的吸收峰是羧酸盐基团的C=O 不对称和对称伸缩振动的特征[15]。在1 111cm-1处观察到的强峰表明糖环的C-O-C 伸缩振动,也是糖衍生物的典型特征[16]。生物絮凝剂中羟基,羧基和羰基的存在可以改善生物絮凝剂中的结合能力。
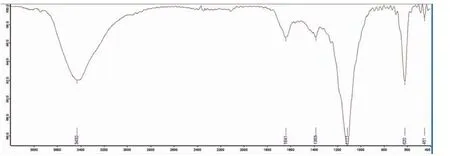
图3 F11 菌株胞外多糖的红外光谱图Fig.3 The infrared spectrogram of F11 polysaccharide
2.4 多糖的单糖组成及分子量
反相HPLC 的结果(图4)表明多糖是一种杂多糖,其质量比由Man,GlcN,Rib,Gal 和Glc 组成,如表1所示。很明显葡萄糖是含量最多的单糖,甘露糖的比例小于葡萄糖,其余组分如GlcN,Rib,Gal 可忽略不计。在所有单糖组成中,中性糖(包括D-甘露糖,D-葡萄糖D-核糖和D-半乳糖)占多糖的总质量比例为97.8%,而氨基糖(GlcN)仅占2.2%,糖醛酸含量可以忽略不计。
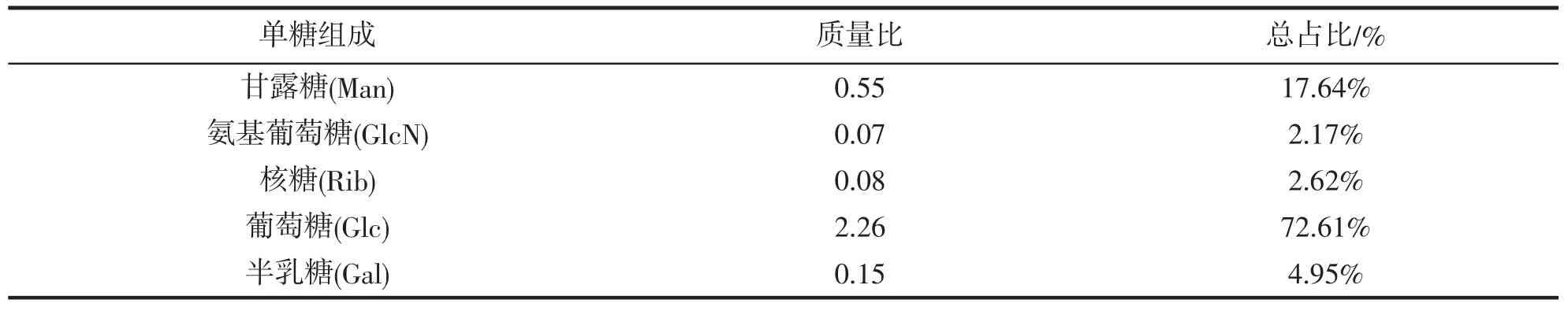
表1 多糖的各单糖组成比例Tab.1 Monosaccharide composition of polysaccharide
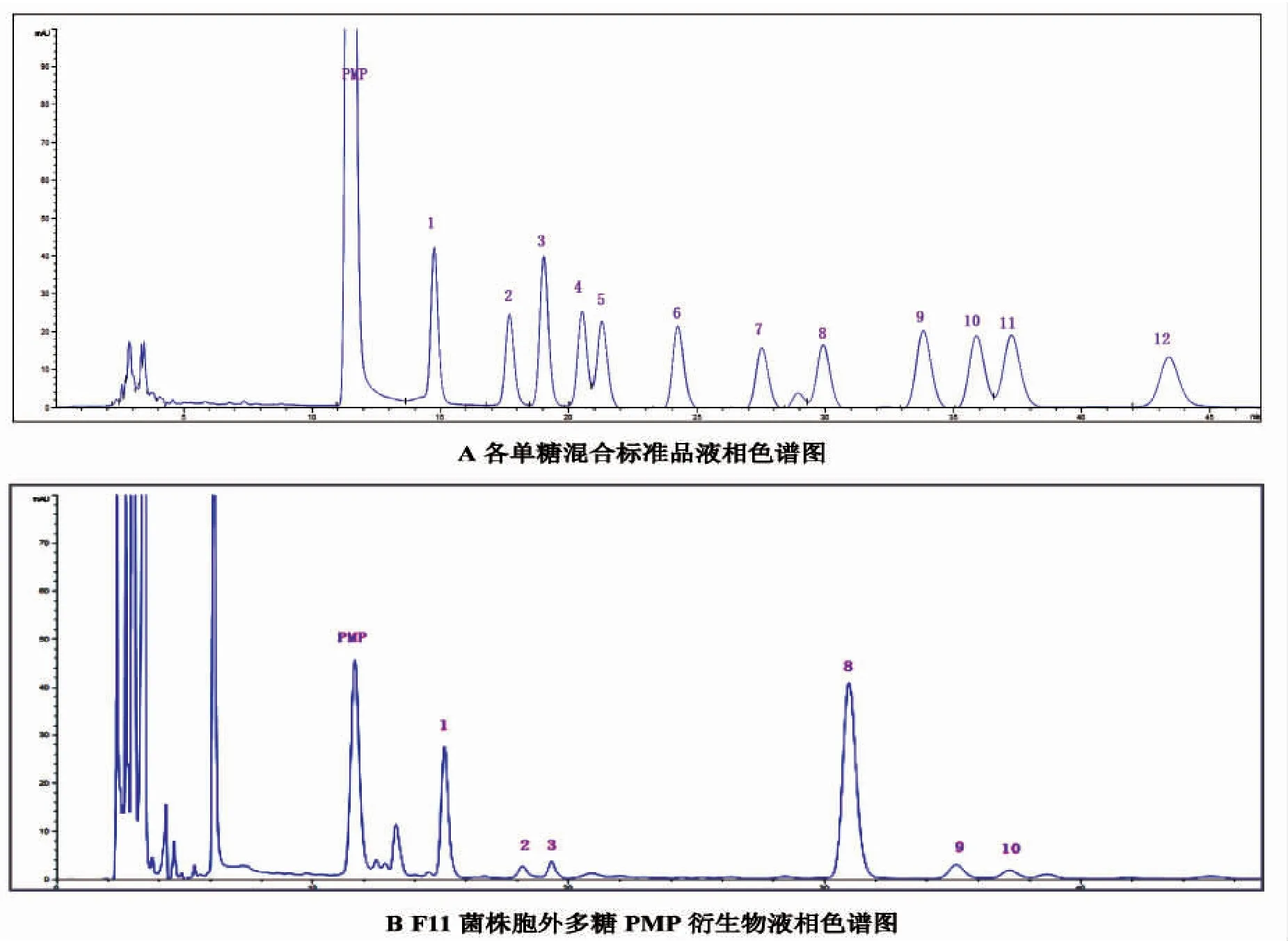
图4 各单糖混合标准品液相色谱图(A),F11 菌株胞外多糖PMP 衍生物液相色谱图(B)Fig.4 HPLC chromatograms of PMP derivatives of standard monosaccharides(A);hydrolyzed monosaccharides derivatives from F11polysaccharide(B)
2.5 甲基化分析
由于复杂的组成和特定的分子量,该多糖絮凝剂有着特殊的结构[17-18]。多糖是微生物分泌的胞外物质的主要成分,胞外多糖的研究有着重要的意义,然而,关于微生物胞外多糖絮凝剂分子结构研究很少,揭示絮凝机制与多糖分子结构的联系,仍然需要进一步的研究。
通过GC-MS 分析,获得质谱(图5)。与标准质谱相比,连接方式由葡萄糖1→2→3→4 连接,甘露糖1→2→3→4→6 连接组成。取代的羟基越多,分支越多。结合红外扫描,可以发现图4 中显示的羟基吸收峰较弱,C-O-C 成环骨架的吸收峰较强,与甲基化分析中的连接方式相吻合。
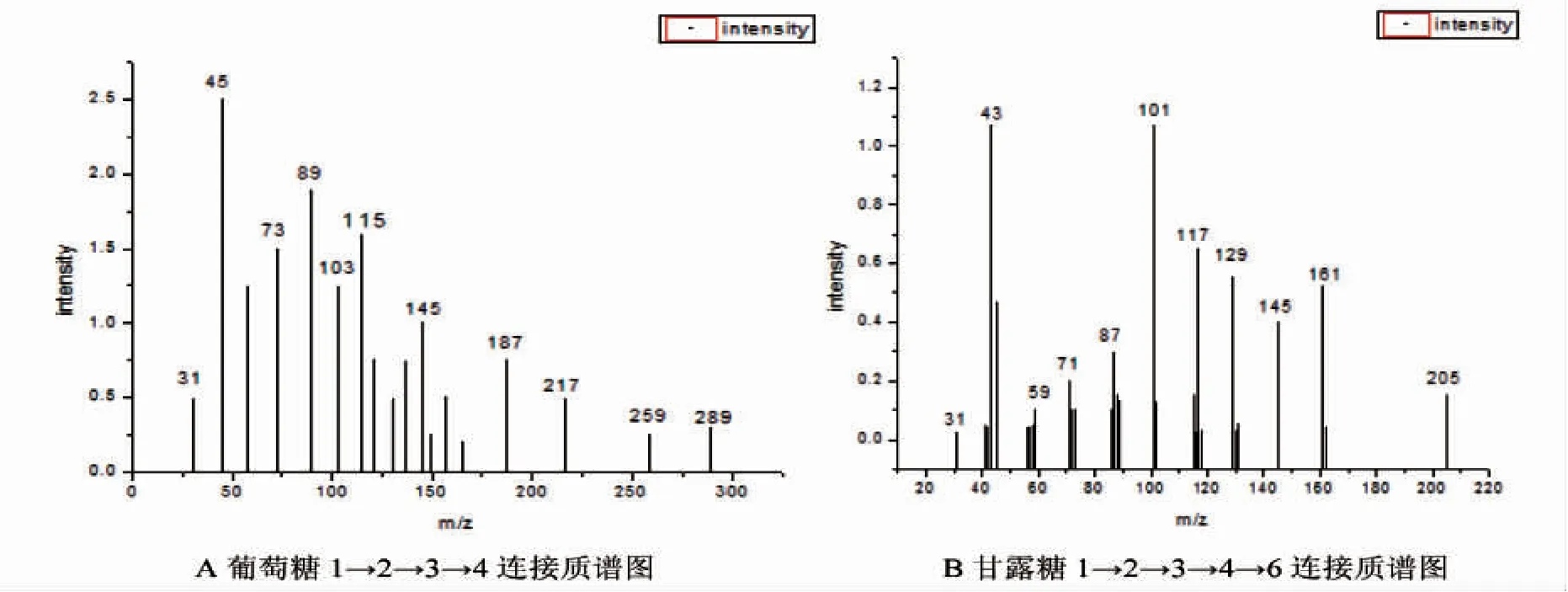
图5 F11 胞外多糖衍生物质谱图Fig.5 Mass spectrum of derivative extracellular polysaccharideof F11
2.6 多糖的絮凝机制
马尼拉贝黏附污泥可用作絮凝资源,从微生物中提取胞外多糖的研究很多[1,4,17,19-21]。胞外多糖是由微生物分泌的,因此絮凝活性的产生与粘性泥浆中的微生物群落有关。
广泛接受的絮凝机制主要包括压缩双电层、电性中和、架桥和网捕卷扫等假设[22-23]。然而,絮凝机制不仅是一种机制的功能,而是多种机制相互协同作用的结果。通过GC-MS 分析,糖苷键连接方式由葡萄糖1→2→3→4 连接,甘露糖1→2→3→4→6 连接组成。结合红外光谱中的较弱羟基峰,多糖具有多支链网络结构,多糖的多支链结构可促进其与悬浮颗粒的结合,实现沉降效果,这与网捕卷扫机制类似。
3 结论
在该研究中,从菌株F11 的发酵液中纯化出一种新型胞外多糖,可用作微生物絮凝剂,并通过GCMS,FT-IR,HPLC 分析方法表征胞外多糖。结果表明,微生物胞外多糖由72.6%葡萄糖和17.6%甘露糖组成。其分子量为31 kDa。高度支化的结构表明对絮凝和脱色有显著影响。在去离子水系统中,对高岭土的絮凝率达到71.3%,对孔雀石绿的脱色率为92.4%。较高的脱色率使其在未来水处理中有巨大的应用前景。絮凝过程有着复杂的机制,为了掌握分子结构和多糖性质之间的关系,需要进一步的深入研究。
