柚皮苷对Aβ25-35 诱导PC12 细胞保护作用的代谢组学研究
2021-06-26悦徐占玲孙慧峰雷霞刘国良姚远张
张 悦徐占玲孙慧峰雷 霞刘国良姚 远张 宁*刘 斌*
(1.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学佳木斯学院,黑龙江佳木斯 154007)
阿尔茨海默病(Alzheimer disease,AD)是一种与衰老密切相关的神经系统退行性疾病[1],以认知缺陷和神经元丧失为特征,迄今缺少有效的治疗药物。所以,研发有效防治AD 的药物是非常必要的。
AD 发病机制十分复杂,β 淀粉样蛋白(amyloid-β,Aβ)被认为是诱发AD 发生发展的关键因素[2]。近年来,黄酮类等天然多酚类物质的抗氧化特性在对神经退行性疾病方面潜在、有益的作用成为科学研究的重点[3]。柚皮苷全称为柚皮素-7-O-新橙皮糖苷,是一种天然的二氢黄酮类化合物,以往对柚皮苷的研究大都集中在治疗骨质疏松[4]、预防动脉粥样硬化[5]等方面。现在,研究人员将注意力转向柚皮苷的神经损伤保护等方面。Okuyama 等[6]将富含橙皮苷和柚皮苷果汁的干燥粉末给予脑缺血小鼠,发现口服后可以显著抑制脑缺血诱导的海马神经细胞死亡,具有改善小胶质细胞活化的能力。Singh 等[7]灌胃给予脑出血小鼠不同剂量的柚皮苷,再对探讨动物进行一系列行为测试,用强迫游泳试验和水迷宫试验评估卒中后抑郁和记忆障碍,研究表明,柚皮苷可改善脑出血诱导的神经认知缺陷,还能通过下调海马中乙酰基胆碱酯酶活性和诱导型一氧化氮合酶(iNOS)信号传导途径来消除顺铂引起的认知缺陷和胆碱能功能障碍[8]。由此可见,柚皮苷可能会成为治疗神经退行性疾病的佼佼者,但作用机制尚不清楚。
代谢组学以代谢产物或代谢网络为基础探究常见复杂疾病的发病机制或宿主环境发病机制的相互影响,在临床前和临床研究上都有广泛的应用[9]。代谢体是基因-环境相互作用的最终产物之一,它能识别并鉴别AD 的病理生理特征[10]。气相色谱-质谱(GC-MS)具有高分辨率、高灵敏度、有可供参考的标准图谱库、可对代谢产物定性等特点,已经成为代谢组学实验室的重要组成部分。
本研究首先采用Aβ25-35诱导PC12 细胞建立细胞损伤模型,将柚皮苷作用于损伤模型,利用GC-MS 技术对细胞进行代谢组学研究,检测并解析给予柚皮苷后Aβ25-35诱导PC12 细胞内小分子代谢物及相关分子通路的变化,为AD病理机制研究提供实验数据和理论依据。
1 材料
1.1 试剂与药物 柚皮苷(纯度98%,批号LL60O53)购自北京百灵威科技股份有限公司。PC12 细胞(北京协和细胞资源中心);Aβ25-35(北京博奥森生物技术有限公司);DMEM 高糖培养基、双抗、活性炭-葡聚糖苷处理的胎牛血清(美国HyClone 公司);二甲基亚砜(DMSO)、噻唑蓝(MTT)购于美国Sigma 公司;磷酸盐缓冲液(PBS)购于北京索莱宝科技有限公司。
1.2 仪器 Agilent 6890N 型气相色谱仪、Agilent 5975B 型质谱仪、DB-5MS 弹性石英毛细管柱(30 m×0.25 mm,0.25 μm)(美国安捷伦公司);MK3 型酶标仪(上海热电仪器有限公司);IX-71-21PH 型倒置显微镜(日本Olympus 公司);HF90 型二氧化碳培养箱(上海立新仪器有限公司)。
2 方法
2.1 细胞实验
2.1.1 细胞培养 PC12 细胞(大鼠肾上腺嗜铬细胞瘤细胞)在含10% 胎牛血清、100 U/mL 青霉素、100 μg/mL链霉素的DMEM 培养液中生长,37 ℃下通入5%的CO2进行培养,每2~3 d 传代1 次,取对数生长期细胞用于实验。
2.1.2 MTT 法测定细胞活力 将细胞分为空白组(加入含10%胎牛血清的DMEM 培养液)、Aβ25-35模型组(分别用10、20、40 μmol/L 的Aβ25-35处理PC12 细胞24 h)、给药组(分别先给予柚皮苷1.0×10-3、1.0×10-2、1.0×10-1μmol/L处理2 h 后,再加入20 μmol/L Aβ25-35孵育24 h),每组6 个平行。
取对数生长的PC12 细胞,消化离心,弃掉上清,沉淀用DMEM 完全培养基重悬至均匀悬液,以2×104/mL 细胞浓度接种于96 孔培养板,放进细胞培养箱中培养约24 h,细胞进入对数期后吸弃旧的培养液,按照分组状况加入相应溶液(200 μL)孵育24 h 后加入MTT 溶液,每孔20 μL,在细胞培养箱中再孵育4 h,取出,吸弃上清,每孔加入150 μL DMSO,在37 ℃恒温振荡器中振荡10 min,充分溶解蓝紫色甲臜结晶,用酶标仪在570 nm 波长下进行吸光度检测,每个样本3 次,取平均值。细胞增殖率=(OD实验组/OD空白组)×100%。
2.1.3 统计学分析 以AIA 格式文件收集获得的原始数据,用MZmine 2.5 软件进行前处理,之后导入SIMCA-P软件中进行PCA 和PLS-DA 分析统计,VIP 预测以及SPSS19.0 软件做t 检验,筛选出潜在的代谢标记物。PC12细胞吸光度值及增值率结果用SPSS 19.0 软件统计。数据以()表示,多组间比较使用单因素方差分析,组间均数两两比较使用LSD 检验,S-N-K 法进行统计后校正,P<0.05表示差异有统计学意义。
2.2 GC-MS 分析
2.2.1 GC-MS 条件 色谱条件为DB-5Ms 弹性石英毛细管柱(30 m×0.25 mm,0.5 μm);进样时温度270 ℃;以高纯氦气为载气;载气体积流量1.0 mL/min,溶剂延迟3 min;分流采样5∶1;进样1 μL。质谱条件为四级杆温度150 ℃;电离方式EI;离子源温度230 ℃;电子能量70 eV;质量扫描方式全扫描,扫描间隔0.2 s;电子倍增器电压0.90 kV。细胞样品梯度加热程序为初始温度70 ℃,运行3 min,以10 ℃/min 升至180 ℃,5 ℃/min 升至290 ℃,运行9 min。
2.2.2 细胞提取及衍生方法 取成对数生长期细胞,丢弃旧DMEM 完全培养基,用生理盐水洗涤3 次,弃去生理盐水,液氮淬灭,加入1.5 mL 乙腈-水(4∶1),用细胞刮刀刮下细胞,将细胞悬浮液转移到离心管中,涡旋,细胞经超声细胞破碎仪破碎(功率为20%,工作2 s,间歇2 s)7 min,4 ℃、4 000 r/min 离心15 min,去除蛋白等大分子物质。取1.2 mL 上清液置于离心管中,在40 ℃下氮吹,残余物用50 μL 甲氧胺盐酸盐(15 mg/mL)复溶,涡旋,30 ℃水加热90 min,37 ℃下加入70 μL MSTFA,持续30 min,取上清进行GC-MS 分析。
2.2.3 分组 空白组为PC12 细胞培养于新鲜的DMEM 完全培养基,不加Aβ;模型组为20 μmol/L Aβ25-35孵育PC12细胞24 h;给药组为1.0×10-1μmol/L 柚皮苷孵育PC12 细胞2 h 后,加入20 μmol/L Aβ25-35后再孵育24 h。
2.2.4 数据提取 GC-MS 得到的原始数据利用自动质谱去卷积鉴定(AMDIS)系统以AIA 的格式导出文件,将其导入Matlab 软件,得到有代谢物保留时间和相应峰面积组成信息的峰表。
2.2.5 模式识别与差异表达代谢物鉴定 将获得的峰表导入SIMCA-P 12.0 软件,进行主成分分析(PCA)和最小二乘法判别分析(PLS-DA),找到差异表达代谢物。再利用NIST 质谱数据库对空白组和模型组共有的内源性代谢物作鉴定,以匹配度>70% 为衡量标准,得到可信的差异代谢物的结构和名称。
3 结果
3.1 细胞增殖率测定 与空白组比较,20 μmol/L Aβ25-35作用于细胞24 h 后细胞增殖率下降(P<0.01),并且增殖率随着Aβ25-35终浓度的增加而减小,说明造模成功。根据实验结果结合文献[11],最后选用20 μmol/L Aβ25-35作用PC12 细胞24 h 来制备AD 的体外细胞模型。见表1。
表1 不同浓度的Aβ25-35处理24 h 对PC12 细胞增殖率的影响(,n=6)
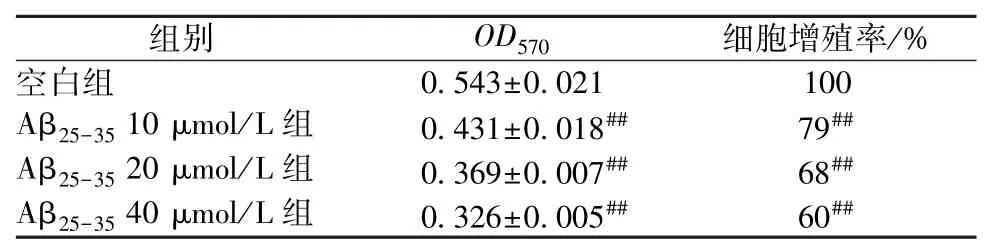
表1 不同浓度的Aβ25-35处理24 h 对PC12 细胞增殖率的影响(,n=6)
注:与空白组比较,##P<0.01。
由表2 可以看出,与Aβ25-35模型组比较,柚皮苷处理后PC12 细胞增殖率增加(P<0.01),说明柚皮苷能够保护细胞,起到抗Aβ 损伤的作用。
表2 柚皮苷对Aβ25-35损伤PC12 细胞增殖率的影响(,n=6)
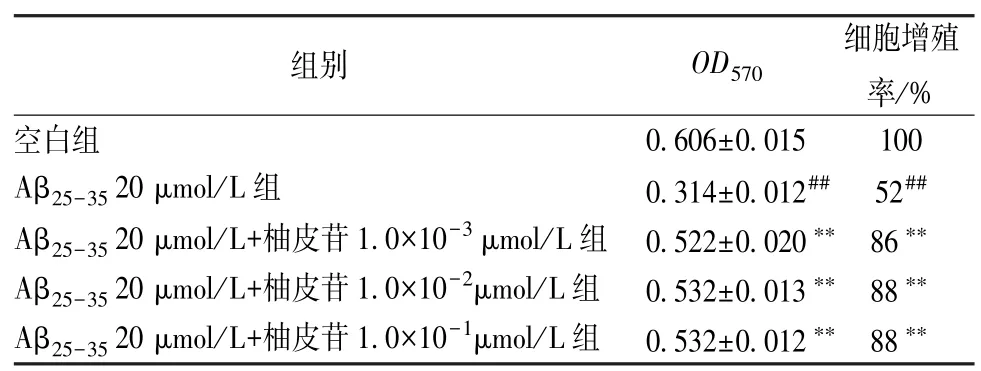
表2 柚皮苷对Aβ25-35损伤PC12 细胞增殖率的影响(,n=6)
注:与空白组比较,##P<0.01;与Aβ25-35 20 μmol/L 组比较,**P<0.01。
3.2 GC-MS 分析 利用GC-MS 法对样品进行扫描,得到细胞代谢样本的总离子流图,见图1。根据各个化合物的质荷比、保留时间、保留指数等进行鉴定,共鉴定出152个化合物,包括氨基酸类、脂肪酸类、糖类等小分子成分。
图1 PC12 细胞代谢物的GC-MS 基峰色谱图
4 讨论
PCA 分析显示,各组样品之间有较好的分离度,说明模型组使细胞代谢通路发生改变,即造模成功,通过三维PLS-DA 示意图进一步地证明了各组之间分离度良好。选取VIP 值>1.0 且P<0.05 的物质,然后对照质谱库信息获得27 个潜在生物标记物,并对化合物含量变化进行了分析,见表3。
表3 潜在生物标记物信息()
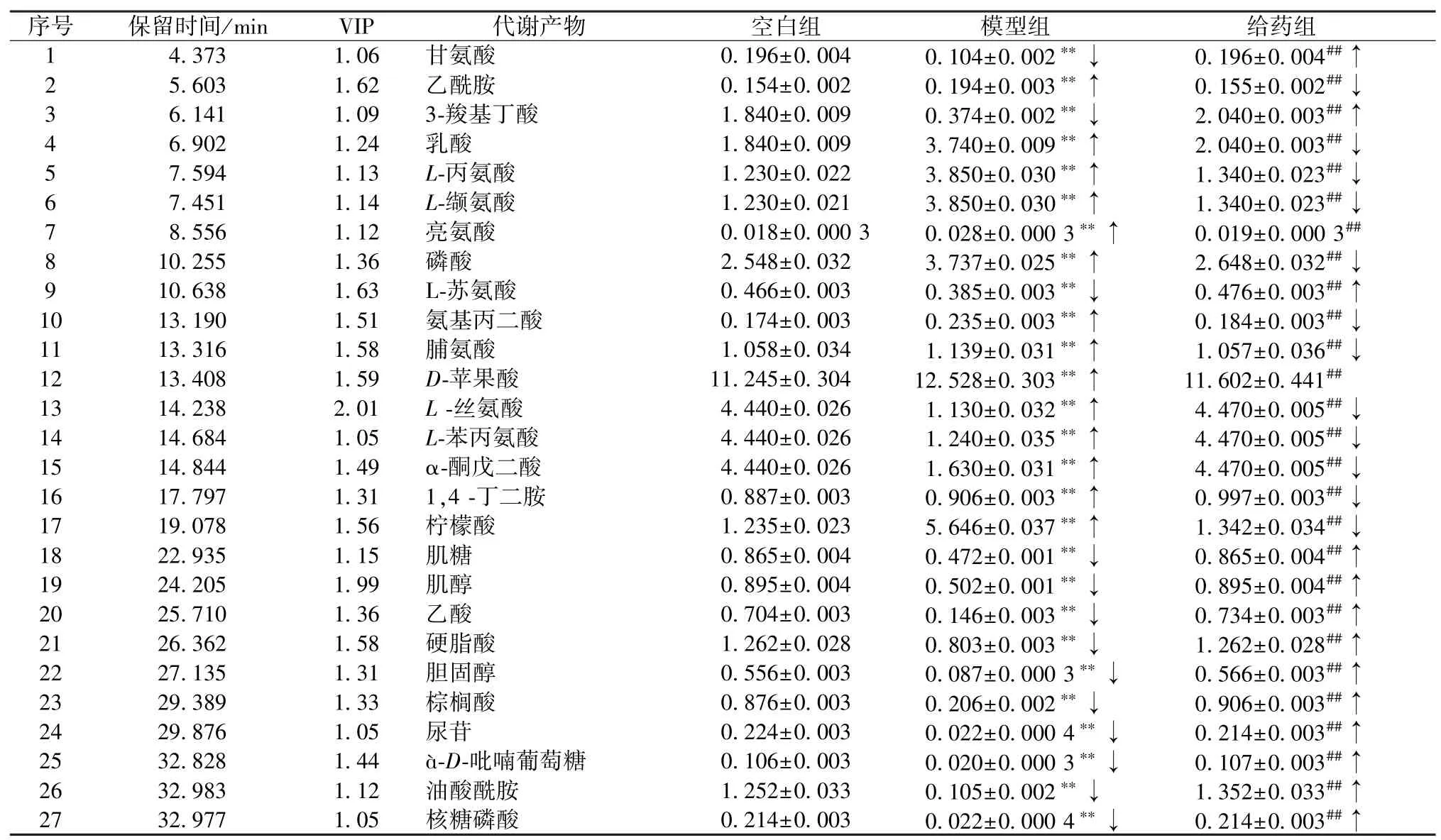
表3 潜在生物标记物信息()
注:↓表示下降,↑表示升高。与空白组比较,**P<0.01;与模型组比较,##P<0.01。
表3 显示,模型组中氨基酸代谢途径发生了变化,包括谷氨酸、丝氨酸、苯丙氨酸等。谷氨酸是神经递质GABA 合成的前体,也是人类中枢神经系统中最丰富的兴奋性神经递质,从突触囊泡释放后将结合NMDA 受体激活细胞[12];丙氨酸由丙氨酸转氨酶胺化而成,涉及丙氨酸、丙酮酸、α-酮戊二酸的相互转化[13];谷氨酸和丙氨酸参与细胞生物能量学,模型组丙氨酸水平较低,表明模型组存在能量缺乏和线粒体功能障碍[14]。以丝氨酸为原料合成甘氨酸和半胱氨酸,前者是一种神经系统抑制性神经递质,本研究中其含量发生了变化。以往发现在AD 大鼠模型中,海马、顶叶皮层D-丝氨酸水平升高[15];L-丝氨酸水平也有所上升;丝氨酸消旋酶产生L-丝氨酸,后者水平降低;苯丙氨酸是芳香族氨基酸神经递质,其改变在痴呆过程中起着关键作用[16],表明模型组细胞内氨基酸代谢紊乱。
高度不饱和脂肪酸可以引起脂质过氧化,促进神经毒性的产生。参与脂质代谢的差异代谢物有棕榈酸、硬脂酸、苹果酸和胆固醇,模型组细胞内棕榈酸、硬脂酸及胆固醇减少,苹果酸增加,柚皮苷可以使这些代谢物的含量恢复到空白组水平。APP/PS1 小鼠组织中磷脂含量明显下降,这与磷脂酶活性增加有关[17]。硬脂酸是磷脂形成的最丰富的脂肪酸,脂肪代谢异常会导致细胞膜的功能异常。在以往对AD 患者血液的研究中,发现患者的棕榈酸明显低于正常组[18],这与本实验结果一致。有研究表明胆固醇异常与AD 发病有关,用T0901317 激活APP/PS1 小鼠脑内的肝X 受体,能使额叶皮层和海马脑区膜胆固醇明显降低,减少老年斑的沉积,改善小鼠记忆能力[19],除了脂质代谢发生变化还有许多与能量相关的代谢产物也发生了变化。
葡萄糖代谢、磷酸肌醇代谢与碳水化合物代谢有着密切的联系,葡萄糖代谢异常是AD 典型病理特征[20]。本研究中与糖代谢相关的代谢物有柠檬酸、α-D-吡喃葡萄糖等,模型组à-D-吡喃葡萄糖和柠檬酸的含有量发生了变化,葡萄糖代谢出现异常。肌醇参与多种细胞功能,如信号传导过程、细胞生长和分化等[21],还是一种重要的膜成分,其脑衍生物参与突触转运和神经递质分泌,并调节自噬[22]。模型组中肌醇含量发生改变,说明碳水化合物代谢异常。
综上所述,本研究以GC-MS 代谢组学为理论依据,对空白组、模型组和给药组代谢物进行多元统计分析,筛选出可能的生物标志物。Aβ25-35损伤组有多种代谢产物的含量发生了改变,这些物质主要与氨基酸代谢、碳水化合物代谢及脂质代谢等相关联,说明柚皮苷主要通过影响多种氨基酸和能量代谢发挥对Aβ25-35损伤的PC12 细胞的保护作用。
