大黄酚白蛋白纳米粒的制备及其体内药动学研究
2021-06-26谈秀凤
辛 娟,易 华,谈秀凤,丁 玉
(1.黄河科技学院,河南 郑州 450063;2.上海中医药大学,上海 201203)
大黄是中药制剂常用药味之一[1-3],大黄酚是其主要成分,具有清热解毒、抗肿瘤、抗氧化、抗衰老、改善脑损伤、调血脂等多种作用[4-5],但该成分在25 ℃时的溶解度仅为0.96 μg/mL,而且容易氧化,导致其口服吸收较差[6],而且对胃肠道也有一定的刺激作用[6]。纳米技术可有效促进药物吸收[7],目前大黄酚相关制剂有脂质体、纳米囊、胶束等[6,8],但存在制备工艺复杂、需使用表面活性剂、载药量低等缺陷。
近年来,采用白蛋白作为纳米载体的研究越来越多[9-11],其分子结构中的氨基酸以肽键一一相连,并在空间上扭曲成团,形成了网状空隙结构和疏水区域,非常有利于携带、镶嵌或结合药物[12],Bioscience 公司开发的NabTM技术所制备的紫杉醇白蛋白纳米制剂Abraxane® 已被FDA 批准用于临床。因此,本实验采用来源广泛的牛血清白蛋白,参考NabTM技术将大黄酚制成白蛋白纳米粒,并对其进行表征,以期通过白蛋白纳米粒促进该成分体外溶出和体内吸收,并为相关制剂革新提供参考。
1 材料
U3000 型高效液相色谱仪(美国戴安公司);Milli-Q 超纯水处理系统(美国Millipre 公司);PL203 型电子分析天平(瑞士梅特勒-托利多公司);DF-101S 型磁力搅拌器(巩义市予华仪器有限责任公司);BDF-86V55 型超低温冰箱(山东博科再生医学有限公司);JY92-II 型超声波细胞破碎仪(宁波新芝生物科技股份有限公司);BKFD10S 型冻干机(山东博科生物产业有限公司);Master-sizer 型粒度分析仪(英国马尔文仪器有限公司);MD200-2 型氮气吹扫仪(杭州奥威仪器有限公司);Nanosep® 超滤离心管(截留相对分子质量10 000,美国Pall 公司);H-7240 型透射电镜(日本Hitachi 公司)。
大黄酚对照品(批号110757-201808,纯度98.6%,中国食品药品检定研究院);大黄酚原料药(批号170915,纯度98.0%,武汉远城科技发展有限公司);牛血清白蛋白(批号201901118,白蛋白纯度≥98%,上海蓝季生物科技公司)。甲醇(批号I1088607-017,德国默克公司)。SD 大鼠购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001,先在实验室饲养3 d,实验开始时选择体质量(300±20)g 者进行研究。
2 方法与结果
2.1 大黄酚白蛋白纳米粒及其冻干粉制备 参考文献[13] 报道的方法,称取处方量大黄酚至一定体积二氯甲烷中,超声处理30 s 溶解,作为有机相;蒸馏水配制含4%白蛋白的溶液80 mL,作为水相,将有机相缓慢滴加至水相中,并于细胞粉碎仪(功率300 W,每间隔2 s 工作2 s)超声处理,得O/W 初乳,在45 ℃下减压旋蒸除去有机相,过0.45 μm 微孔滤膜,加蒸馏水至80 mL,分装至西林瓶中,置于-60 ℃超低温冰箱中冷冻2 d,再迅速转移至-40 ℃冷冻干燥机中2 d,即得。
2.2 大黄酚含量测定
2.2.1 色谱条件 Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);流动相0.1% 磷酸-甲醇(25∶75);体积流量1.0 mL/min;柱温30 ℃;检测波长429 nm;进样量20 μL。
2.2.2 方法学考察 称取大黄酚对照品10 mg 至100 mL 量瓶中,1 mL 二甲基亚砜超声溶解,甲醇定容至刻度,得100 μg/mL 贮备液,取适量,加入0.1% 磷酸-甲醇(25∶ 75)制成10、5、1、0.5、0.1、0.02 μg/mL 对照品溶液,在“2.2.1”项色谱条件下进样测定。以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X)进行回归,得方程为Y=1.821 5X-0.069 2(r=0.999 8),在0.02~10 μg/mL 范围内线性关系良好。
取大黄酚白蛋白纳米粒冻干粉约10 mg 至100 mL量瓶中,蒸馏水复溶后取2.5 mL 至10 mL量瓶中,甲醇沉淀蛋白,超声处理5 min 后甲醇定容至刻度,过0.22 μm 微孔滤膜,即得供试品溶液,平行6 份,在“2.2.1”项色谱条件下进样测定,测得大黄酚峰面积RSD 为1.37%,表明该方法重复性较好。取同一份供试品溶液,在“2.2.1”项色谱条件下进样测定6 次,测得大黄酚峰面积RSD 为0.22%,表明仪器精密度较好。取同一份供试品溶液,于0、2、4、8、12、24 h在“2.2.1”项色谱条件下进样测定,测得大黄酚峰面积RSD 为0.49%,表明溶液在24 h 内稳定性良好。取9 份冻干粉,每份10 mg,置于100 mL量瓶中,分别加入大黄酚对照品0.65、1.30、1.95 mg 各3 份,蒸馏水复溶,取2.5 mL 至10 mL量瓶中,加入甲醇沉淀蛋白,超声提取5 min,甲醇定容至刻度,过0.22 μm 微孔滤膜,在“2.2.1”项色谱条件下进样测定,计算回收率。结果,大黄酚平均加样回收率分别为100.38%、99.26%、100.11%,RSD 分别为0.43%、1.14%、0.83%。
2.3 包封率、载药量测定 采用低温超滤法。取1 mL 大黄酚白蛋白纳米粒混悬液至超滤离心管(截留分子量为20 kDa)中,-4 ℃下6 000 r/min离心20 min,取滤液,HPLC 法测定游离大黄酚的量(m游离);取1 mL 混悬液至10 mL 量瓶中,加入甲醇沉淀蛋白,超声处理5 min 后甲醇定容至刻度,过0.22 μm 微孔滤膜,HPLC 法测定总量(m总),计算包封率、载药量,公式分别为包封率=[(m总-m游离)/m总] × 100%、载药量=[(m总-m游离)/m总质量] ×100%,其中m总质量为大黄酚白蛋白纳米粒的总质量。
2.4 单因素试验 前期预试验结果显示,有机相体积、药物用量、超声功率、超声时间均会对包封率、粒径产生一定影响,故本实验对上述因素进行考察。另外,牛血清白蛋白除了作为载体外,还可当做冻干保护剂,但其质量分数低于3.5%时所制备冻干粉末的性质不理想,故固定为4%。
2.4.1 有机相体积 固定药物用量0.5 g、4%白蛋白溶液体积80 mL、超声功率300 W、超声时间6 min,通过改变有机相(二氯甲烷)体积(5、8、10、12 mL)来考察白蛋白纳米粒对包封率、粒径、PDI 的影响,结果见表1。由此可知,当有机相体积为10 mL 时包封率最高,粒径、PDI 相对理想;为12 mL 时虽然粒径最小,但包封率有所下降,最终确定有机相体积为10 mL。

表1 有机相体积对包封率、粒径、PDI 的影响(n=3)Tab.1 Effects of organic phase volume on encapsulation efficiency,particle size and PDI(n=3)
2.4.2 药物用量 固定有机相体积10 mL、4%白蛋白溶液体积80 mL、超声功率300 W、超声时间6 min,通过改变药物(大黄酚)用量(0.4、0.45、0.5、0.55 g)来考察白蛋白纳米粒对包封率、粒径、PDI 的影响,结果见表2。由此可知,当药物用量超过0.5 g 时包封率有所下降,而且粒径、PDI 均有一定程度的上升,可见在一定条件下白蛋白携带药物能力有一定限制,最终确定药物用量为0.5 g。

表2 药物用量对包封率、粒径、PDI 的影响(n=3)Tab.2 Effects of drug consumption on encapsulation efficiency,particle size and PDI(n=3)
2.4.3 超声功率 固定有机相体积10 mL、药物用量0.5 g、4%白蛋白溶液体积80 mL、超声时间6 min,通过改变超声功 率(200、250、300、350 W)来考察白蛋白纳米粒对包封率、粒径、PDI 的影响,结果见表3。由此可知,随着超声功率增加粒径逐渐下降,为350 W 时包封率开始下降,PDI 明显上升,最终确定超声功率为300 W。
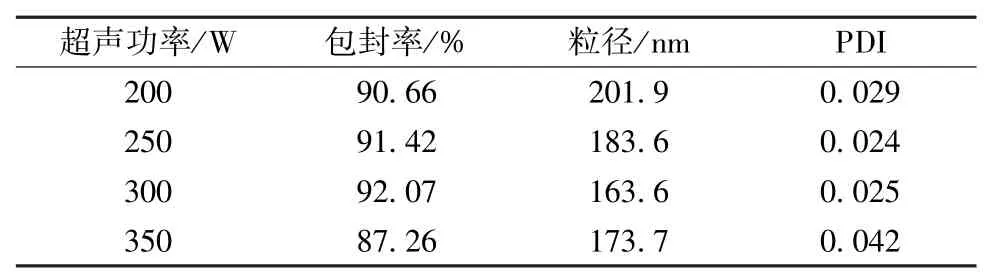
表3 超声功率对包封率、粒径、PDI 的影响(n=3)Tab.3 Effects of ultrasonic power on encapsulation efficiency,particle size and PDI(n=3)
2.4.4 超声时间 固定有机相体积10 mL、药物用量0.5 g、4% 白蛋白溶液80 mL、超声功率300 W,通过改变超声时间(4、6、8、10 min)来考察白蛋白纳米粒对包封率、粒径、PDI 的影响,结果见表4。由此可知,当超声时间超过6 min后粒径变化不大,但PDI 增加,包封率开始下降,最终确定超声时间为6 min。

表4 超声时间对包封率、粒径、PDI 的影响(n=3)Tab.4 Effects of ultrasound time on encapsulation efficiency,particle size and PDI(n=3)
2.4.5 验证试验 根据上述试验结果,选择有机相体积为10 mL,药物用量为0.5 g,超声功率为300 W,超声时间为6 min,所制得的大黄酚白蛋白纳米粒外观见图1,平行3 批,测得平均包封率为(93.61±1.02)%,载药量为(12.19±1.03)%。

图1 大黄酚白蛋白纳米粒外观Fig.1 Appearance of chrysophanol albumin nanoparticles
2.5 粒径、Zeta 电位、形态 取3 份大黄酚白蛋白纳米粒,每份0.1 mL,加入10 mL 蒸馏水稀释,激光粒度仪测定粒径、PDI、Zeta 电位,结果见图2~3,可知其平均粒径为(156.5±6.7)nm,PDI为0.025±0.007,Zeta 电位为(-35.1±3.8)mV。再将白蛋白纳米粒混悬液用1.5%磷钨酸负染,置于透射电镜仪上观察形态,结果见图4,可知它呈球形。

图2 大黄酚白蛋白纳米粒粒径分布Fig.2 Particle size distribution of chrysophanol albumin nanoparticles

图3 大黄酚白蛋白纳米粒Zeta 电位Fig.3 Zeta potential of chrysophanol albumin nanoparticles

图4 大黄酚白蛋白纳米粒透射电镜图Fig.4 Transmission electron microscope image for chrysophanol albumin nanoparticles
2.6 溶解度测定 采用饱和溶剂法。取过量大黄酚及其白蛋白纳米粒冻干粉,置于三角瓶中,加入5 mL蒸馏水得混悬液,25 ℃下800 r/min 磁力搅拌3 d,12 000 r/min离心10 min,取上清液进行测定。结果,大黄酚溶解度为(0.96±0.08)μg/mL,而其白蛋白纳米粒升高至(34.75±0.92)μg/mL。
2.7 体外释药行为研究 取大黄酚及其白蛋白纳米粒冻干粉适量(大黄酚量均为5 mg),加入3 mL溶出介质,振荡混匀后置于透析袋中(截留分子质量为10 000 Da)。溶出介质为900 mL 0.5%十二烷基硫酸钠,转速、溶出介质温度分别设定为75 r/min、37 ℃,根据预实验确定的取样点取样3 mL,同时补充3 mL 空白溶出介质,在“2.2.1”项色谱条件下进样测定,绘制溶出曲线,结果见图5。由此可知,原料药48 h 内累积溶出度仅为24.46%,而白蛋白纳米粒升高至74.81%,表明该剂型对大黄酚具有明显的促溶出作用,有利于增加药物口服吸收,提高其生物利用度。

图5 大黄酚体外溶出曲线(n=6)Fig.5 In vitro dissolution curves for chrysophanol(n=6)
2.8 体内药动学研究
2.8.1 分组、给药与采血 取大鼠12 只,禁食过夜后随机分为大黄酚组、大黄酚白蛋白纳米粒组,每组6 只,自由饮用生理盐水。取大黄酚及其白蛋白纳米粒冻干粉适量,0.5% CMC-Na 溶液配制成5 mg/mL混悬液(临用现配),并按20 mg/kg 剂量灌胃给药。大黄酚组大鼠于0.5、1、1.5、2、3、4、5、6、8 h 眼眶采血约0.2 mL,大黄酚白蛋白纳米粒组大鼠采血点增加10、12 h,血样置于肝素浸润的离心管中,2 500 r/min 离心2 min,上层血浆保存于-15 ℃冰箱中。
2.8.2 血浆样品处理 根据文献[14] 报道的方法,并对处理过程略作修改。精密量取血浆100 μL,加入500 μL 甲醇涡旋1 min,沉淀蛋白,8 000 r/min 离心10 min,分取上清液,置于氮吹仪中,50 ℃下缓慢吹干得残渣,加入100 μL 流动相复溶,在“2.2.1”项色谱条件下进样测定,记录峰面积。
2.8.3 线性关系考察 取大黄酚对照品溶液,空白血浆制成0.05、0.2、1.0、2.0、4.0、8.0 μg/mL血浆对照品溶液,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.159 2X-0.018 5(r=0.996 4),在0.05~8.0 μg/mL 范围内线性关系良好。
2.8.4 方法学考察 空白血浆配制0.05 μg/mL(低)、1.0 μg/mL(中)、8.0 μg/mL(高)血浆样品,在“2.2.1”项色谱条件下进样测定,并与实际质量浓度对比,测得平均加样回收率分别为87.61%、91.02%、93.27%,RSD 分别为4.56%、3.78%、2.87%。取1.0、4.0、8.0 μg/mL 血浆对照品溶液,在“2.2.1”项色谱条件下进样测定6次,测得大黄酚峰面积RSD 分别为2.11%、1.63%、1.02%,表明仪器精密度良好。取血浆样品,于0、2、4、8、12、24 h 在“2.2.1”项色谱条件下进样测定,测得峰面积RSD 为3.47%,表明溶液在24 h 内稳定性良好。取0.05 μg/mL 血浆对照品溶液,空白血浆稀释,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定,测得定量限、检测限分别为4、2 ng/mL。
2.8.5 结果分析 表5、图6 显示,与原料药比较,白蛋白纳米粒Tmax缩短(P <0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度增加至4.02 倍。
表5 大黄酚主要药动学参数(,n=6)Tab.5 Main pharmacokinetic parameters for chrysophanol(,n=6)
注:与大黄酚比较,*P<0.05,**P<0.01。
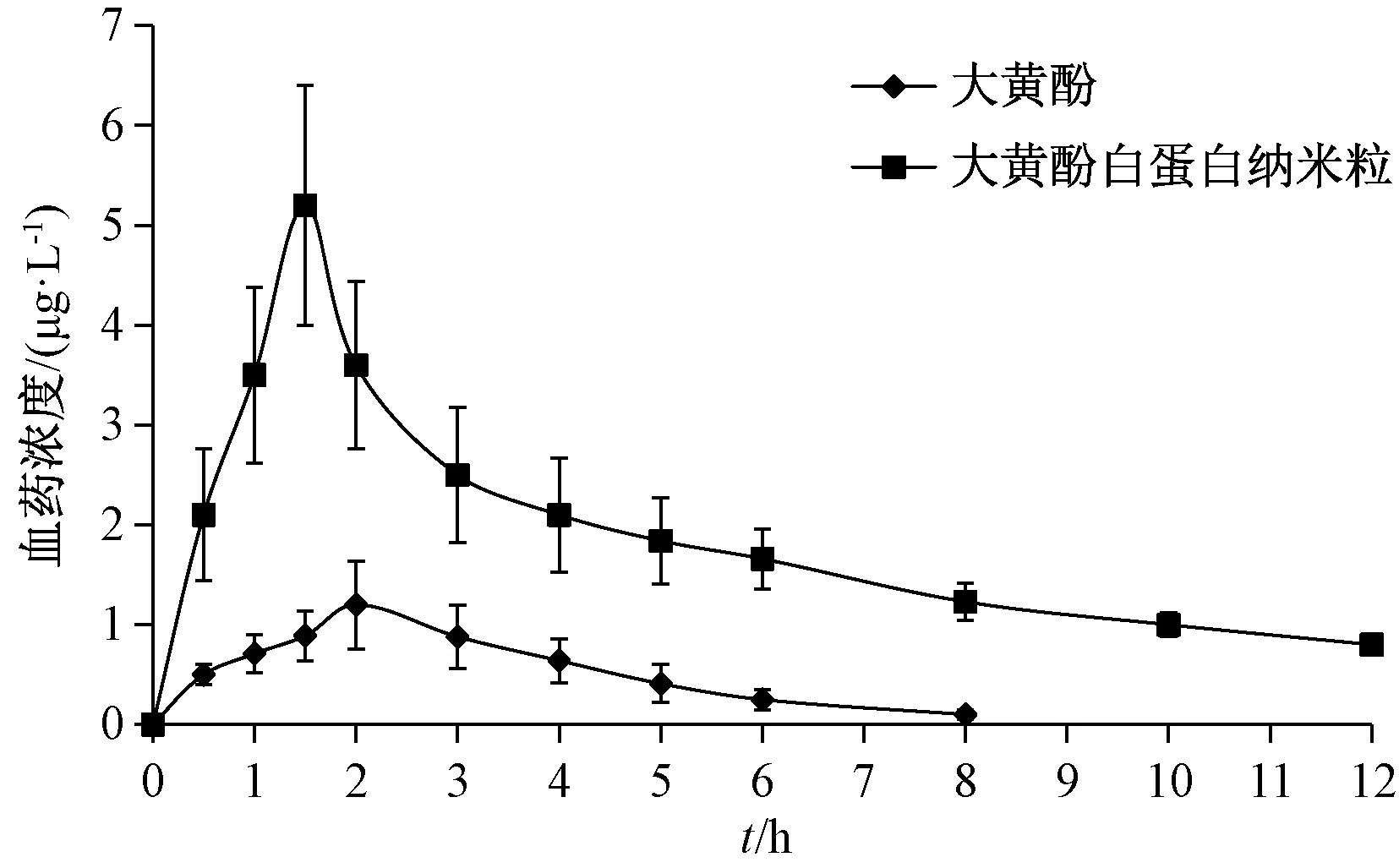
图6 大黄酚血药浓度-时间曲线(n=6)Fig.6 Plasma concentration-time curves for chrysophanol(n=6)
3 讨论
体外释药结果表明,大黄酚白蛋白纳米粒呈现缓释特征,但体内药动学发现其Tmax显著提前,与文献[12,15] 报道一致,其原因可能是纳米粒可在较短时间内经消化道直接吸收进入血液循环[16],而本实验纳米载体采用白蛋白,可能与机体血浆中的白蛋白发生快速交换[10],从而加快药物在血液中的释放速度;也有观点认为,药物与白蛋白分子之间的作用力可能较弱,导致药物在体内释药较快,最终使Tmax提前,也极大促进了药物体内吸收[16-18]。
目前,已报道的大黄酚新型口服制剂有微囊[19]、包合物[20]等。本实验制备的白蛋白纳米粒口服生物利用度提高了4.02 倍,与其他纳米制剂[6,8,21]相比,它不仅载体生物相容性更好,安全性更高,而且载体本身也可作为冻干保护剂,减少了辅料使用,降低了成本,同时无需表面活性剂或交联剂。但该制剂也有不足之处,例如在制备过程中采用有毒试剂二氯甲烷;虽然药物水溶性有所提高,但其体外溶出仍较缓慢,而且脂溶性可能未得到改善,从而限制了其口服生物利用度的提高,今后将对此作进一步改进。
