注射用黄芩苷镁盐冻干粉配伍稳定性及其保肝作用研究
2021-06-26白红红刘喜纲刘翠哲
白红红,金 鹏,李 景,李 卫,刘喜纲,刘翠哲*
(1.承德医学院,河北省中药研究与开发重点实验室,河北 承德 067000;2.晨光生物科技集团邯郸有限公司,河北 邯郸 056000)
黄芩苷(结构式见图1)属黄酮类化合物,是黄芩的主要成分之一。黄芩苷作为提取物被收录于2015 年版《中国药典》,是黄芩通过水提酸沉制备得到,纯度不低于85%,但得到的黄芩苷几乎不溶于水,口服生物利用度低,大鼠口服给药后仅为(2.2±0.2)%,严重限制了其临床应用[1-2]。

图1 黄芩苷结构式
为提高黄芩苷的溶解度,国内外研究人员采用纳米晶药物输送系统[3-4]、靶向脂质体等技术[5],但程度有限。课题组前期研究证明,黄芩苷在黄芩中的原本存在形式是镁盐形式(结构式见图2),并通过提取得到了黄芩苷镁,其溶解度比黄芩苷提高了2 225 倍[6],并已获国家发明专利和美国专利授权[7]。

图2 黄芩苷镁盐结构式
深入研究发现,黄芩苷对病毒性肝炎、酒精肝、化学性肝损伤、肝纤维化、肝衰竭、肝癌等具有一定的作用[8],在临床上已有黄芩苷片、黄芩苷胶囊等制剂,主要用于治疗急慢性肝炎。无论是单体给药还是复方给药,黄芩苷在体内均呈二房室模型,半衰期相对较短(约15 min),消除半衰期相对较长(约200 min),这种药代动力学特征适合静脉给药系统[9]。黄芩苷镁盐作为黄芩苷的原本存在形式,前期研究表明其药代动力学特征与黄芩苷相同[10],而且水溶性好,毒性低,适合做成注射剂,具有很大的成药性和临床应用前景。
本实验制备了黄芩苷镁盐冻干粉,并测定其含量。考虑到临床静脉给药的特点,拟进行配伍稳定性试验,考察它在生理盐水、5% 葡萄糖溶液、10% 葡萄糖溶液中的稳定性。
近期研究表明,黄芩苷对CCl4所致肝细胞的氧化损伤有保护作用,其机制与其诱导HO-1 表达及抑制促炎介质有关[11-12]。同时也有研究表明,镁离子能够降低肝损伤小鼠肝指数、血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)活性、MDA 水平,对抗和清除自由基,提高氧化酶活性,抑制TNF-α 分泌[13]。黄芩苷镁盐含有镁离子,但黄芩苷在发挥对肝脏损伤的保护作用同时,镁离子对肝损伤的保护是否存在协同作用尚不明确,需作进一步研究。
1 材料
1.1 仪器 N-1100 旋转蒸发器(日本理化公司);LGJ-22D 冷冻干燥机(北京四环科学仪器厂有限公司);1260HPLC 色谱仪(美国安捷伦科技公司);HH-6 数显恒温水浴锅(金坛市天竟实验仪器厂);PH 计(瑞士梅特勒-托利多公司),SPESTRO star Nano 全波长酶标仪(德国BMG LABTECH 公司);HP-8453 分光光度计(美国惠普公司);全自动脱水机(北京弘泰嘉业科技发展有限公司);Histocore Arcadia C 石蜡包埋机、RM2235 cwEU 切片机(上海莱卡显微系统有限公司);Nikon DS-Fi1 电子显微镜(日本尼康株式会社);Velocity 14R 高速低温离心机(英国Dynamica 公司);SCIEN-48 高通量组织研磨机(宁波新芝生物科技有限公司);AG-A254 电子分析天平(瑞士Mettler-Toledo 公司);JA-2003 电子天平(上海精科天平有限公司);KQ-300 超声波清洗器(昆山市超声仪器有限公司);GHX-9080B 型隔水式恒温培养箱(上海福玛实验设备有限公司)。
1.2 试剂 黄芩苷原料药(承德颈复康药业集团雾灵药业有限责任公司);黄芩苷对照品(中国食品药品检定研究院,批号110715-201318,纯度≥93.3%)。氢氧化镁(天津市风船化学试剂科技有限公司);生理盐水、5%葡萄糖、10%葡萄糖注射液(石家庄四药有限公司);异甘草酸镁注射液(连云港正大天晴药业股份有限公司);硫酸镁、四氯化碳(天津欧博凯化工有限公司);橄榄油(山东鲁花集团有限公司)。BCA 蛋白浓度测定试剂盒(北京索莱宝科技有限公司);ALT、AST、MDA 试剂盒(南京建成生物工程研究所);GSH 试剂盒(武汉伊莱瑞特生物科技有限公司)。娃哈哈纯净水(高碑店娃哈哈启力饮料有限公司);氨基甲酸乙酯(国药集团化学试剂有限公司);其他试剂均为分析纯。
1.3 动物 wistar 大鼠36 只,雄性,体质量240~260 g,购自北京维通利华实验动物有限公司,动物生产许可证号SCXK(京)2016-0006,在屏障动物房适应性饲养一周,控制室内温度20~22 ℃,相对湿度50%~60%,光照时间8:00 至20:00,给予充足的饲料和饮用水。本实验所涉及的动物相关操作严格遵守有关准则,并经承德医学院实验动物福利伦理委员会的批准。
2 方法
2.1 注射用黄芩苷镁盐冻干粉的制备 在500 mL 圆底烧瓶中先后加入黄芩苷原料药5 g、氢氧化镁0.138 g、蒸馏水200 mL,将圆底烧瓶置于旋转蒸发器上,60 ℃水浴,低速旋转1 h,反应完全后为棕黄色溶液,抽滤,除去不溶性杂质,活性炭吸附除去热源,过0.45 μm 滤膜,固体物冷冻干燥40 h,得黄芩苷镁盐冻干粉。
2.2 HPLC 分析
2.2.1 色谱条件 参考2015 年版《中国药典》 相关规定,黄芩苷镁盐分析方法为phenomenex C18色谱柱(4.6 mm×250 mm,5 μm);流动相甲醇-0.1%磷酸(60∶40);检测波长278 nm;柱温30 ℃;进样量10 μL。
2.2.2 专属性试验 分别取供试品溶液和生理盐水注射液,黄芩苷镁盐加生理盐水注射液,5%、10%葡萄糖注射液,在“2.2.1”项色谱条件下分析,结果见图3。由此可知,3 种溶剂对测定无影响。
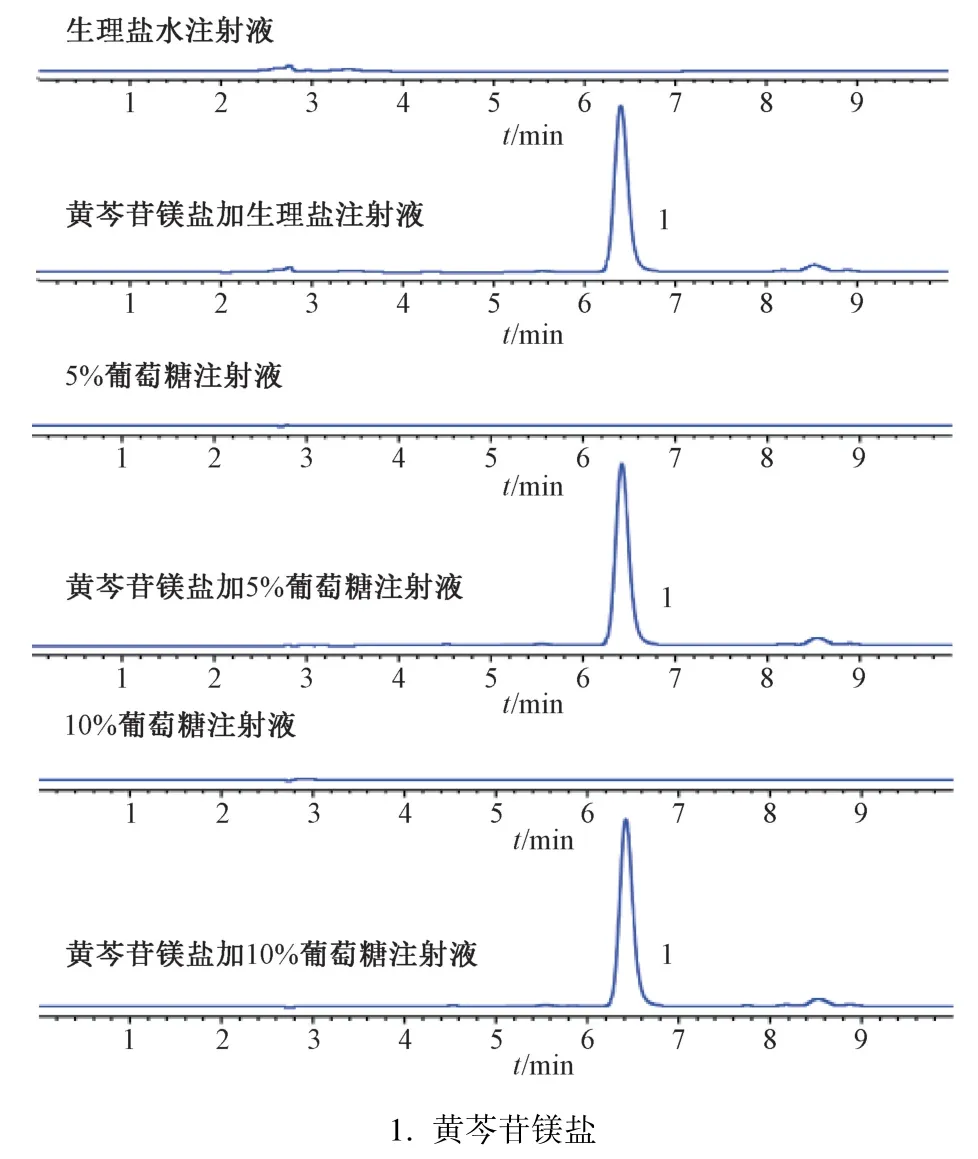
图3 黄芩苷镁盐HPLC 色谱图
2.2.3 线性关系考察 精密称取一定量黄芩苷对照品,配制成500 μg/mL 贮备液,稀释成22.08、22.16、70.656、85.56、176.64、353.28 μg/mL,在“2.1.1”项色谱条件下进样,将质量浓度X 与峰面积Y 进行回归,得方程Y=35.51X+132.27(r=0.999 1),在22.08~353.28 μg/mL 范围内线性关系良好。
2.2.4 方法学考察 在“2.1.1”项色谱条件下分别考察精密度、重复性、加样回收率,测得精密度RSD 为0.90%(n=6);重复性RSD 为1.38%(n=6);平均加样回收率为100.24%,RSD 为1.06%(n=6),均符合要求。
2.3 注射用黄芩苷镁盐在不同溶剂中的稳定性 精确称取黄芩苷镁盐140.0、213.0、427.0 mg 各3 份,分别溶于250 mL 生理盐水注射液、5%葡萄糖注射液、10%葡萄糖注射液中并充分搅拌,25 ℃水浴中于0、0.5、1、2、4、6、8 h 观察外观变化,测定溶液pH 值及黄芩苷镁盐含量,结果见图4。由此可知,在0~8 h 内各组pH 值略有下降,稳定在6.6~7.2 之间;各组约有5% 的黄芩苷镁盐被破坏,稳定性较好,无气泡沉淀产生,颜色无变化,溶液澄清透明,达到了注射液的一般质量要求。

图4 不同浓度黄芩苷镁盐在各溶剂中的pH、含量变化
2.4 药效学实验
2.4.1 分组及给药 大鼠适应性饲养1 周后,随机分为空白组、模型组、黄芩苷镁盐组、异甘草酸镁组、黄芩苷组、硫酸镁组,每组6 只,根据前期预试验选择给药量为50 mg/kg。黄芩苷和硫酸镁组(以镁离子计)给药剂量以黄芩苷镁盐组为标准,分别等量换算为48.8、1.3 mg/kg。异甘草酸镁注射液临床上治疗急性肝损伤指导用药量为0.2 g/d,按式(1)换算大鼠给药剂量为18 mg/kg(Km为表面积和体质量的比值,人为37,大鼠为6)。设计给药方式为每天2 次,每次按给药剂量一半尾静脉注射给药,空白组和模型组给予等体积生理盐水,连续给药1 周,记录大鼠摄食量和饮水量。末次给药2 h 后,空白组大鼠腹腔注射橄榄油(等量),其他各组大鼠腹腔注射50%CCl4(橄榄油稀释)1 ml/kg,禁食,自由饮水。
2.4.2 取材 造模24 h 后,大鼠腹腔注射20%氨基甲酸乙酯10 mg/kg 麻醉,腹主动脉取血5 mL,冰浴静置1 h,离心(4 ℃、3 000 r/min)10 min,取上清测定ALT 和AST水平。取出肝脏,用预冷的生理盐水冲洗2 次,擦拭干净后称重,计算肝指数,结果见表1。取肝左叶,用10%甲醛溶液固定,苏木素-伊红(HE)染色,于光镜下观察肝组织病理变化,结果见图5。剩余肝组织加入9 倍量生理盐水制得10%肝组织匀浆,离心(4 ℃、3 000 r/min)10 min,取上清液测定MDA、GSH 水平。
2.4.3 统计学方法 采用SPSS 19.0 软件处理,计量数据以()表示,组间比较采用单因素方差分析。 P<0.05表示差异有统计学意义。
3 结果
由表1 可知,与空白组比较,模型组ALT、AST 活性和肝指数增高(P<0.01),表明模型复制成功。与模型组比较,给药组大鼠血清ALT、AST 活性和肝指数均有不同程度的降低(P<0.01,P<0.05);黄芩苷镁组血清中ALT、AST 活性低于等浓度的黄芩苷组和硫酸镁组(P<0.05,P<0.01),肝指数低于黄芩苷组(P<0.05)。
表1 用药组对肝损伤大鼠血清ALT、AST 活性和肝指数的影响(,n=6)

表1 用药组对肝损伤大鼠血清ALT、AST 活性和肝指数的影响(,n=6)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,##P<0.01;与黄芩苷镁盐组比较,△P<0.05,△△P<0.01。
由表2 可知,与空白组比较,模型组肝脏中的MDA 水平升高(P<0.01);与模型组比较,给药组MDA 水平均有不同程度降低(P<0.05,P<0.01),黄芩苷镁组中MDA水平低于等浓度的黄芩苷组和硫酸镁组(P<0.05)。与空白组比较,模型组GSH 水平降低(P<0.01),黄芩苷镁盐组GSH 水平高于等浓度的黄芩苷组和硫酸镁组(P<0.05,P<0.01)。
表2 用药组对肝损伤大鼠肝组织MDA、GSH 水平的影响(,n=6)
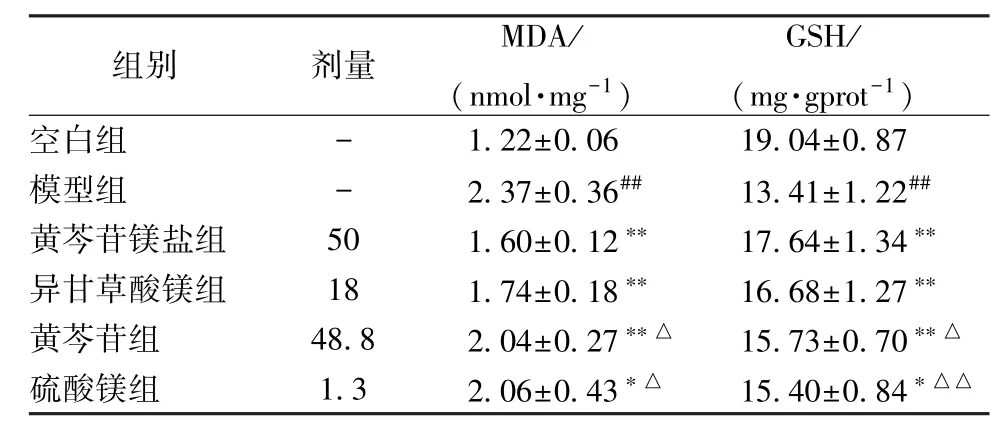
表2 用药组对肝损伤大鼠肝组织MDA、GSH 水平的影响(,n=6)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,##P<0.01;与黄芩苷镁盐组比较,△P<0.05,△△P<0.01。
图5 显示,空白组大鼠肝小叶结构清晰,肝细胞索以中央静脉为中心呈放射状排列,肝细胞结构完整,无炎细胞浸润。模型组肝索排列紊乱,细胞间隙变大,肝细胞结构明显破坏,呈脂肪性泡沫病变。黄芩苷镁组肝细胞病变不明显,肝细胞轻度肿胀,部分肝细胞脂肪变性,汇管区有少量炎细胞浸润。异甘草酸镁组依然可见气球样病变,肝脏保护效果不及黄芩苷镁组。黄芩苷组和硫酸镁组也可降低肝细胞肿胀和组织病变程度,但病变程度均大于黄芩苷镁盐组。

图5 各组肝损伤大鼠肝病理切片(HE,×100)
4 讨论
注射剂的配伍液稳定性问题主要体现在室温条件下溶液颜色变化、产生气泡及产生不溶性微粒、pH 值的变化,一定温度和时间内溶液澄明、颜色无改变、无气泡及肉眼可见的沉淀产生,pH 值稳定,提示药物可配伍。除了从溶液外观、pH 值等理化性质方面考察配伍稳定性外,还测定了药物在溶剂中的含量变化,结果显示不同浓度黄芩苷镁盐在生理盐水、5%葡萄糖、10%葡萄糖注射液中理化性质和含量保持稳定。在配伍稳定性的基础上将黄芩苷镁盐溶解于生理盐水注射液中,配制成一定浓度的注射液开展保肝作用研究。
肝脏是人体的重要器官,目前数以百万计的人因酒精、化学品和感染而使肝脏遭受损害,其中化学物质诸如对乙酰氨基酚、CCl4、亚硝胺和多环芳烃等对肝脏的损害很大。CCl4所致的肝损伤是肝损伤模型的首选,它可引起与肝硬化或肝炎相同的肝脏改变、单个核细胞浸润和肝细胞脂肪性泡沫变性。CCl4诱导的肝毒性被认为涉及2 个阶段,最初阶段是由细胞色素P450 代谢CCl4,导致自由基的形成和脂质过氧化[14];第二阶段由于自由基引起Kupffer 细胞激活,并伴随炎症介质的产生[15]。由于肝损伤,肝细胞膜的渗透性改变,膜的渗透性改变导致细胞中的酶释放到体循环。其中ALT 在肝实质细胞浆合成,其血清中活性增高提示肝细胞膜破坏和肝细胞通透性增加。AST 在肝实质细胞线粒体合成,其血清中活性增高提示肝细胞线粒体损伤。本研究中,大鼠腹腔注射CCl424 h 后,模型组血清中ALT和AST 水平明显增高,而黄芩苷镁盐可以减缓这种趋势。
MDA 是脂质过氧化物的最终产物,它在血清及组织中的水平高低反映了组织过氧化时的损伤程度[16]。因此,肝组织内MDA 水平的变化可反映肝损害的程度及治疗后肝功能恢复的情况。GSH 是抵抗自由基的第一道防线,是组织氧化损伤易感性的重要决定因素,关于CCl4肝毒性机制研究表明,GSH 在CCl4活性毒性代谢产物的解毒中起着关键作用,肝坏死始于GSH 储存的耗尽[17]。本实验发现黄芩苷镁盐能显著降低肝组织中MDA 水平,减缓大鼠GSH 水平的降低,与阳性对照药异甘草酸镁效果相当,明显优于等浓度的黄芩苷组和硫酸镁组。
黄芩苷具有多酚羟基结构,能够清除和抑制自由基,保护线粒体膜的完整性,此外还能够促进血红素对氧酶-1(HO-1)和过氧化物酶体增值物激活受体γ(PPARγ)的表达,下调TGFβ1信号通路抑制肝星状细胞活化[18],同时能够抑制炎症介质因子表达。CCl4可通过抑制细胞膜上和线粒体膜上钙离子泵的活性使钙离子大量内流,激活肝细胞膜上的磷酸化酶从而引起膜的脂质过氧化[19]。镁是体内重要的常量元素,是钙的天然拮抗剂,它能影响钙的膜渗透性及其结合、分布和交换,通过减轻细胞内钙超载达到肝保护作用。临床报道,肝损伤往往伴随低镁血症,适当补充镁离子改善低血镁症对肝细胞有保护作用。
实验结果显示,黄芩苷镁盐对CCl4诱导的肝损伤有保护作用,并优于等浓度的黄芩苷和硫酸镁,其结构中的黄芩苷和镁离子存在协同作用而共同达到保肝效果。其中,黄芩苷主要通过阻断自由基的脂质过氧化,保护细胞内线粒体复制、增生及粗面内质网的变化,恢复肝细胞生物氧化功能,促进相关蛋白质合成,为肝脏再生和修复提供相应的能量。同时,镁离子可以有效抑制肝细胞内钙超载,减轻肝细胞膜的脂质过氧化。
黄芩苷镁盐作为黄芩苷的原本存在形式,本身水溶性较好,在以上3 种溶剂中的理化性质和含量保持稳定,具有很大的成药性和临床应用前景。因此,黄芩苷镁盐作为治疗人类氧化应激和炎症性肝病的一种可能的治疗手段值得研究,在临床上的应用潜力也有待进一步探讨。
