基于HPLC 指纹图谱结合化学模式识别分析相思子叶质量
2021-06-26何翠敏黄伟斌袁旭江
何翠敏,黄伟斌,邱 雨,袁旭江
(广东药科大学新药研发中心/国家中医药管理局中药制剂三级实验室/广东省教育厅现代中药重点实验室,广东 广州 510006)
相思子Abrus precatorius L.为豆科蝶形花亚科相思子属植物的带根全草,俗称印度甘草,原产于印尼,现广泛分布于世界各地的热带和亚热带地区,我国广东、广西等地均有分布,为习用中草药,首载于 《千金要方》,其味甘性凉,归肺、肝、肾经,具有清热解毒、利尿消炎、润肺护肝的功效,民间常用于治疗咽喉肿痛、肺热咳嗽、疥疮乳痈、肝炎等[1-4]。现代研究发现,相思子富含黄酮[5-6],如牡荆素[5]、相思子素[5]、芒柄花黄素[5]、滨蓟黄素[6]、滨蓟黄苷[6]、异柚葡糖苷[5]等;生物碱[6],如刺桐碱、相思子碱等;三萜[6-8],如甘草酸[6],麦角固醇[7],豆甾醇[7],abrusoside A、B、C、D[8]等;醌[9-10],如abruquinone A、B、D、J、K、L、I、H;氨基酸[11],如赖氨酸、亮氨酸、异亮氨酸等,具有镇痛抗炎[12]、抗氧化[13]、免疫调节[14]、杀虫抑菌[15-16]、抗肿瘤[17]等活性。但相思子尚未纳入《中国药典》 中,而相思藤载录于2004年《广东省中药材标准》 第1 版第2 册,缺乏先进的质控标准,也未见相思子叶指纹图谱研究,因此,建立先进全面的药材质量分析和控制方法尤为重要。
指纹图谱具有系统性、特征性和稳定性,能比较全面地反映中药所含化学成分的种类和数量,为评价中药质量、阐明复杂的药效物质基础提供科学的技术手段[18]。化学模式识别主要分析数据的差异性,近年来广泛应用于中药鉴别、定性表征、质量控制、组效关系等研究中,它对HPLC、UPLCQ-TOF/MS、IR、NMR 等多种现代仪器分析获取的数据进行客观分析,既可对多个指标进行统计,又可将整个图谱信息数量化,被计算机识别与处理,从而可以更加客观地反映中药质量信息,达到全面控制评价的目的[19-20]。前期已经开展了相思子叶成分分离、提取工艺、含量测定等相关研究[6,21-23],本实验将在此基础上采用HPLC 技术建立药材指纹图谱,结合聚类分析、主成分分析评价不同来源药材质量情况,进一步结合热图分析揭示其质量差异与成分的关系,以期为其质量评价和今后开发研究提供参考。
1 材料
Agilent 1100 型高效液相色谱仪(含DAD 检测器,美国Agilent 公司);JJ500Y 型电子分析天平(0.01 g,广州市晶博电子有限公司);BS124S 型电子分析天平(0.000 1 g,德国Sartorius 公司);KQ3200 型超声波清洗器(昆山市超声仪器有限公司)。滨蓟黄苷对照品为广东药科大学新药研发中心自制,纯度>99%。甲醇、乙腈为色谱纯;甲酸等其余试剂均为分析纯;水为超纯水。14 批相思子叶采自广东、广西和越南,经广东药科大学新药研发中心袁旭江副研究员鉴定为豆科植物相思子Abrus precatorius L.的干燥叶子。具体信息见表1。

表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相0.1% 甲酸(A)-(甲醇-乙腈)(8∶2)(B),梯度洗脱,程序见表2;体积流量1.0 mL/min;柱温25 ℃;检测波长275 nm;进样量10 μL。

表2 梯度洗脱程序Tab.2 Gradient elution programs
2.2 供试品溶液制备 取干燥相思子叶粉末1 g,精密称定,置于锥形瓶中,加50%乙醇50 mL,加热回流提取2 次,每次1 h,合并2 次滤液并浓缩,50%乙醇定容至50 mL 量瓶中,即得(质量浓度为20 mg/mL)。
2.3 对照品溶液制备 取105 ℃烘箱中干燥至恒定质量的滨蓟黄苷对照品适量,精密称定,加50%乙醇溶解并定容至50 mL,即得(质量浓度为0.05 mg/mL)。
2.4 方法学考察
2.4.1 精密度试验 以滨蓟黄苷色谱峰为参照峰(S),取供试品溶液(S1),在“2.1”项色谱条件下连续进样6 次,计算得到各共有峰相对保留时间RSD 小于0.35%,相对峰面积RSD 小于2.4%;取同一供试品溶液(S1),在“2.1”项色谱条件下连续进样3 次,重复3 d,测得各共有峰相对保留时间RSD 小于0.49%,相对峰面积RSD 小于3.8%,表明仪器精密度良好。
2.4.2 稳定性试验 以滨蓟黄苷色谱峰为参照峰(S),取供试品溶液(S1),在“2.1”项色谱条件下于0、1、2、4、6、8、12 h 进样测定,测得各共有峰相对保留时间RSD 小于0.30%,相对峰面积RSD 小于2.7%,表明溶液在12 h 内稳定性良好。
2.4.3 重复性试验 以滨蓟黄苷色谱峰为参照峰(S),取同一批药材(S1)6 份,按“2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,测得各共有峰相对保留时间RSD 小于0.48%,相对峰面积RSD 小于3.4%,表明该方法重复性良好。
2.5 指纹图谱建立
2.5.1 图谱生成 取14 批样品的供试品溶液,在“2.1”项色谱条件下进样测定,将数据导入“中药色谱指纹图谱相似度评价系统(2004A 版)”,以S12 号色谱图为参考,中位数法建立对照图谱,时间窗宽设为0.1 min,采用多点校正Mark 峰匹配,建立指纹图谱,见图1。

图1 14 批样品色谱图Fig.1 Chromatograms of fourteen batches of samples
2.5.2 特征峰标定 根据保留时间标定特征指纹峰,对14 批样品HPLC 指纹图谱进行分析,发现14 个特征峰为其共有峰,由此确定为特征指纹峰,峰面积总和大于90%。通过对14 个特征峰的紫外光谱图进行分析归类,可知除了峰1 和峰2 为生物碱外,其余均为黄酮类成分,峰3~7、10 为二氢黄酮,峰8~9、11~14 为黄酮,进一步查阅文献和对照品比对,标认峰1 为相思子碱,峰2 为刺桐碱,峰12 为滨蓟黄苷,峰14 为滨蓟黄素。由于滨蓟黄苷(图1 中12 号)色谱峰的峰面积和峰高适中,峰型对称,分离度高,故以其为参照峰(S),测得共有峰相对保留时间RSD 为0.14%~0.45%,相对峰面积RSD 为19%~118%,见表3,表明不同来源样品成分种类稳定,但在含量方面具有差异。

表3 14 批样品14 个共有峰的相对保留时间、相对峰面积RSDTab.3 Relative retention time and relative peak area RSDs of fourteen common peaks in fourteen batches of samples
2.6 指纹图谱评价
2.6.1 相似度分析 将14 批样品指纹图谱数据导入“中药色谱指纹图谱相似度评价系统(2004A版)”,计算相似度,结果见表4,可知S1、S6、S10~S14 相似度最高,均在0.99 以上;S2、S3、S4、S7、S9 样品次之,介于0.949~0.985 之间;S5、S8 最低,分别为0.879、0.858,表明不同来源样品的整体质量较为稳定,但个别存在一定差异。

表4 14 批样品相似度Tab.4 Similarities of fourteen batches of samples
2.6.2 聚类分析 采用SPSS 26.0 软件进行聚类分析,将14 批样品HPLC 色谱图中的14 个共有峰峰面积标准化,形成14×14 原始数据矩阵,采用Ward 联接方法(离差平方和法),以平方欧氏距离为测度,根据样品的相似程度进行分类,结果见图2。由此可知,当判别距离为12 时,14 批样品分为3 类,S9、S11~14 为第Ⅰ类,除S9 产自越南,其余均产自广西;S2、S4、S6~S7、S10 为第Ⅱ类,S6~S7 产自广东,其余均产自广西;S1、S3、S5、S8 为第Ⅲ类,S3、S8 产自广东,其余均产自广西,表明两广药材质量没有明显地域分类;产自广西玉林的样品(S5、S4、S13、S14)在Ⅰ~Ⅲ类中均有分布,批间稳定性有差异,可能与栽培、采收、加工方式等不同有关。

图2 14 批样品聚类树状图Fig.2 Dendrogram of fourteen batches of samples
2.6.3 主成分分析 将14 批样品14 个共有峰的峰面积进行标准化处理后,导入SPSS 26.0 软件进行主成分分析,结果见图3、表5。根据特征值>1提取出4 个主成分(Principal Component,PC),累积贡献率为85.99%,包含了该指纹图谱的大部分信息。碎石图显示,4 种主成分坡度较陡,是评价药材质量的标志性成分。由于PC1、PC2、PC3的累积贡献率达74.24%,可代表药材指纹图谱的大部分信息,反映了其基本特征,故以三者得分绘制三维散点图,见图4,可见样品大多数聚在一起,其中S5、S8 和其他样品的距离相对较远,与指纹图谱相似度、聚类分析结果一致。
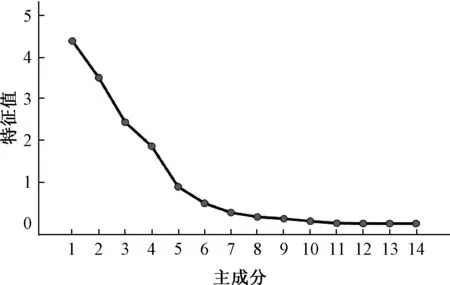
图3 14 批样品主成分分析碎石图Fig.3 Gravel graph of principal component analysis for fourteen batches of samples

表5 主成分初始特征值和方差Tab.5 Initial eigenvalues and variances of principal components

图4 14 批样品主成分分析图Fig.4 Principal component analysis plot for fourteen batches of samples
2.6.4 热图分析 由图5 可知,275 nm 波长下色谱图最具代表性,各色谱峰分离度均大于1.5,塔板数大于10 000;共有峰5~7、11~12 的峰面积之和占总共有峰峰面积的92.41%;峰12 峰面积颜色变动最大,其次为峰5、6、11、7,其余各色谱峰峰面积较小,颜色变化不明显,影响程度依次为峰12>5>6>11>7,其余9 个小峰影响程度依次为峰14>13>2>1>9>8>10>3>4。

图5 14 批样品共有峰峰面积聚类热图Fig.5 Cluster heat maps of the peak areas of fourteen batches of samples
综上所述,峰5~7、11~12 是药材最主要成分,其次为1~2、13~14,可作为质量评价指标。
3 讨论
本实验考察了不同型号色谱柱Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Agilent ZORBAX SBC18(4.6 mm×250 mm,5 μm)、JADE-PAK ODSAQ(4.6 mm×250 mm,5 μm),有机相甲醇、乙腈、甲醇-乙腈(8∶2),流动相纯水、0.1%甲酸、0.3% 甲酸、0.5% 甲酸、1.0% 甲酸,体积流量0.6、0.8、1.0、1.2 mL/min 对色谱峰分离度的影响,并比较了不同检测波长下色谱峰数量及峰高,最终确定为“2.1”项下条件。
在14 批样品HPLC 指纹图谱中,以滨蓟黄苷为参照峰(S)确定了14 个共有峰,相似度除了2批相对较低外,其余均在0.949 以上,表明相思子叶整体质量相对稳定。聚类分析、主成分分析结果显示,样品质量差异可分成3 类,但与地域无关,关键在于各成分含量及其比例是否稳定,而这种稳定可能与采收期有关。热图分析结果显示,样品质量差异依次与9 种成分色谱峰有关,可作为日后相思子叶质量控制和评价的候选指标。
综上所述,本研究首次建立了相思子叶HPLC指纹图谱评价和化学模式识别分析,该方法稳定、快速、可靠,能够有效、准确地评价相思子叶质量情况及其与成分的关系。
