当归、川芎联合应用对肺纤维化模型大鼠TGF-β1/Smad 信号通路的影响
2021-06-26王丽娟董小鹏
王丽娟,董小鹏,杜 弢
(1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃中医药大学附属医院,甘肃 兰州 730020)
肺纤维化是多种原因引起的慢性肺部疾病的共同结局,一旦形成很难逆转,其死亡率甚至高于某些癌症[1]。目前,肺纤维化常用的治疗药物如糖皮质激素、免疫抑制剂等毒副作用较大。研究表明,中草药在治疗肺纤维化方面有一定应用价值[2-4],当归与川芎单独使用时对于肺纤维化有作用,但两者合用时能否起到协同作用尚未有实验报道。本研究通过检测当归、川芎及其不同配比对肺纤维化模型大鼠肺功能、肺组织病理形态学改变、肺组织TGF-β1/Smad 信号通路的影响,以筛选两者最佳配比,并探讨其潜在机理。
1 材料
1.1 动物 SPF 级SD 大鼠80 只,雄性,体质量(160±20)g,购自甘肃中医药大学SPF 级动物实验中心,实验动物生产许可证号SCXK(甘)2015-0002。
1.2 试剂与药物 博来霉素(北京索莱宝科技有限公司);醋酸泼尼松片(天津天药药业股份有限公司)。当归、川芎均购自甘肃中医药大学附属医院,经甘肃中医药大学杜弢教授鉴定分别为伞形科植物当归Angelica sinensis(Oliv.)Diels 的根、伞形科植物川芎Ligusticum chuanxiong Hort.的根茎。TNF-α、IL-1β、IL-6、NF-κB 双抗体夹心酶联免疫吸附试验(ELISA)试剂盒(北京博奥森生物技术有限公司);羟脯氨酸检测试剂盒(南京建成生物工程研究所);TGF-β1、Smad2、Smad3、α-SMA一抗,二抗、SABC 免疫组化染色试剂盒、DAB 显色试剂盒(AR1022)(武汉博士德生物工程有限公司);TRIzol(美国Invitrogen 公司);反转录试剂盒及荧光定量试剂(日本TaKaRa 公司);PCR引物(上海生工生物工程有限公司合成)。
1.3 仪器 WPB PLT-UNR-RT-2 型动物肺功能检测系统(法国EMKA 公司);Vanox 型光学显微镜(日本Olympus 公司);台式高速低温离心机(德国Heraeus 公司);680 型全波长酶标检测仪(美国Bio-Rad 公 司);Applied Biosystems Step One PlusTM型实时定量PCR 仪(美国Agilent 公司)。
2 方法
2.1 药物制备 称取一定量当归、川芎、两者不同配比(2∶1、1∶1、1∶2)的混合药材,按照常规法制备相应水煎液,即得。
2.2 分组及建模 将大鼠随机分为8 组,即正常对照组,肺纤维化模型组,强的松组(阳性对照组),当归组,川芎组,当归、川芎(2∶1、1∶1、1∶2)水煎液给药组,每组10 只,采用博来霉素气管内滴入法制备肺纤维化模型[5-6]。大鼠用10%水合氯醛(3 mL/kg)腹腔注射麻醉后仰卧固定,无菌操作下作约0.5~1 cm 颈中切口。逐层剥离暴露气管,用1 mL 注射器刺入气管,快速推注盐酸博来霉素生理盐水溶液0.2~0.3 mL(剂量为5 mg/mL,按5 mg/kg 体质量给药),而正常对照组气管内注入等量生理盐水,缝合皮肤后置笼内常规饲养。
2.3 给药 造模后第2 天,当归、川芎各给药组大鼠按照正常成人每1 kg 体质量用药量的15 倍计算,强的松组以5 mg/kg 剂量灌胃,而正常组和肺纤维化模型组大鼠灌胃给予等容积生理盐水,每天1 次,连续4 周。
2.4 标本采集 给药结束并检测肺功能后,大鼠股动脉取血,分离血清,-20 ℃冰箱冻存。处死大鼠并迅速分离双肺,每组取5 只用于制备肺泡灌洗液,剩余5 只取左肺上叶,10%甲醛固定,常规脱水,石蜡包埋,切片,用于组织病理学及免疫组化检测;取左肺下叶制备肺组织匀浆,用于羟脯胺酸水平检测;取右肺上叶液氮冻存,用于RT-PCR检测。
2.5 指标检测
2.5.1 肺功能指标 末次给药后1 h 每组随机取5只大鼠,麻醉后插入气管插管,将其仰卧位固定在小动物呼吸机的密闭体积描记箱平板上,检测频率、吸气时间、呼气时间、每分钟通气量。
2.5.2 肺泡灌洗液中炎症因子水平 采用ELISA试剂盒,检测肺泡灌洗液中TNF-α、IL-1β、IL-6、NF-κB 水平。
2.5.3 肺组织羟脯胺酸水平 采用相应试剂盒,进行肺组织匀浆中羟脯胺酸水平的检测。
2.5.4 肺组织病理形态学 石蜡切片行常规HE及Masson 染色,每张切片选取上、下、左、右、中5 个视野,参考Szapiel[7]等报道,分别用HE、Masson 染色计算肺泡炎、肺纤维化积分。
2.5.5 肺组织TGF-β1/Smad 信号通路关键分子蛋白表达 采用免疫组化法,检测正常对照组、肺纤维化模型组、当归、川芎1∶2 组大鼠肺组织TGFβ1、Smad2、Smad3、α-SMA 表达。以棕黄色为阳性染色,在400 倍镜下每张切片随机选取5 个视野,用Image-Pro Plus6.0 图像分析系统软件测定累积光密度值(IOD),取平均值。
2.5.6 肺组织TGF-β1/Smad 信号通路关键分子mRNA 表达 用TRIzol 法从大鼠肺组织中提取出总RNA,反转录合成cDNA 并以其为模板,采用两步法进行PCR 反应(75 ℃,120 s;95 ℃,5 min;60 ℃,60 s;72 ℃,30 s),共40 个循环,以βactin 为内参,用2-ΔΔCt表示mRNA 相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.6 统计学分析 通过SPSS 23.0 软件进行处理,正态分布以()表示,组间比较用单因素方差分析(One-way ANOVA)。 P<0.05 表示差异具有统计学意义。
3 结果
3.1 肺功能指标 与正常对照组比较,肺纤维化模型组大鼠各项肺功能指标出现异常,强的松组和当归、川芎组可改善上述部分指标,以当归、川芎1∶2 组作用最明显,见表2。
表2 当归、川芎不同配比对麻醉大鼠肺功能指标的影响(,n=5)Tab.2 Effects of different proportions of Angelica sinensis and Chuanxiong on pulmonary function indices in anesthetized rats(,n=5)

表2 当归、川芎不同配比对麻醉大鼠肺功能指标的影响(,n=5)Tab.2 Effects of different proportions of Angelica sinensis and Chuanxiong on pulmonary function indices in anesthetized rats(,n=5)
注:与正常对照组比较,△P<0.05,△△P<0.01;与肺纤维化模型组比较,#P<0.05,##P<0.01;与强的松组比较,*P<0.05,**P<0.01。
3.2 当归、川芎及其不同配比对肺泡灌洗液中炎症因子水平的影响 肺纤维化模型大鼠肺泡灌洗液中炎症因子TNF-α、IL-6、NF-κB 高于正常对照组;强的松组大鼠肺泡灌洗液中炎症因子水平下降,介于正常对照组及模型组之间;当归组、川芎组大鼠肺泡灌洗液中炎症因子TNF-α、IL-6、NFκB 水平接近模型组,高于正常对照组,以当归、川芎1∶2 组抗炎作用较为明显,见表3。
表3 当归、川芎及其不同配比对肺纤维化大鼠肺泡灌洗液中炎症因子水平的影响(,n=5)Tab.3 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the levels of inflammatory factors in alveolar lavage fluid of rats with pulmonary fibrosis(,n=5)
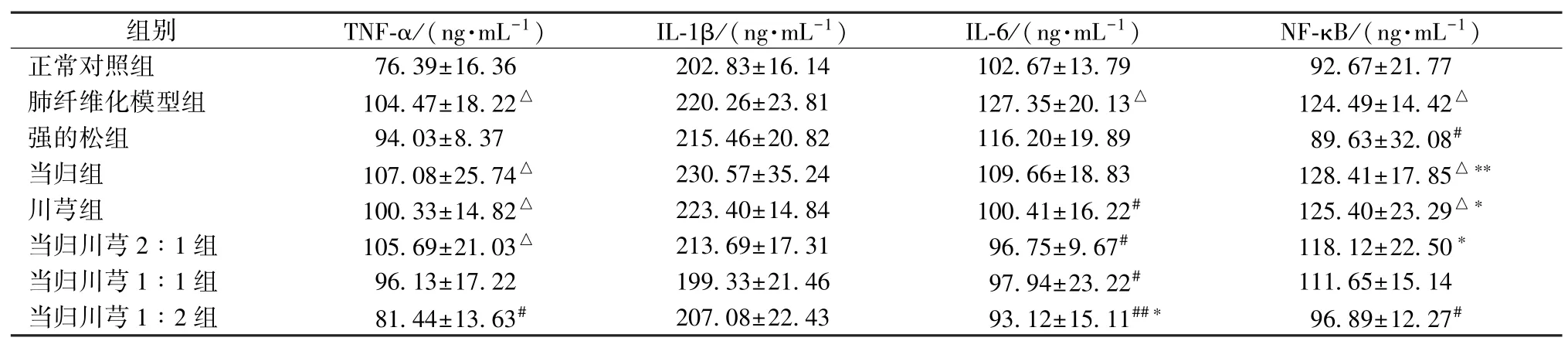
表3 当归、川芎及其不同配比对肺纤维化大鼠肺泡灌洗液中炎症因子水平的影响(,n=5)Tab.3 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the levels of inflammatory factors in alveolar lavage fluid of rats with pulmonary fibrosis(,n=5)
注:与正常对照组比较,△P<0.05;与肺纤维化模型组比较,#P<0.05,##P<0.01;与强的松组比较,*P<0.05,**P<0.01。
3.3 当归、川芎及其不同配比对肺组织羟脯胺酸水平的影响 肺纤维化模型组大鼠羟脯胺酸水平高于正常对照组,而当归、川芎1∶2 组水平减少,与肺纤维化模型组比较有统计学差异(P <0.05,P<0.01),其余各给药组均高于正常对照组,见表4。
表4 当归、川芎及其不同配比对羟脯胺酸水平的影响(,n=5)Tab.4 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the level of hydroxyproline(,n=5)

表4 当归、川芎及其不同配比对羟脯胺酸水平的影响(,n=5)Tab.4 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the level of hydroxyproline(,n=5)
注:与正常对照组比较,△P<0.05,△△P<0.01;与肺纤维化模型组比较,#P<0.05。
3.4 肺组织组织病理学观察 正常对照组大鼠肺组织结构完整,肺泡大小均匀,肺泡间隔无增厚及炎性细胞侵润,Masson 染色显示肺血管壁和气管周围及肺泡间隔可见少量蓝色胶原纤维沉积,无肺泡炎及肺纤维化表现;肺纤维化模型组大鼠肺泡大小不等,结构破坏明显,部分肺泡腔呈囊状扩张或萎陷,肺泡间隔增宽,肺泡壁增厚,有较多炎性细胞侵润,肺间质可见大量的成纤维细胞及细胞外基质堆积,Masson 染色可见肺血管壁、支气管壁和肺泡间隔有大量蓝色胶原纤维沉积,表明大鼠肺纤维化模型构建成功;强的松组大鼠肺组织结构相对完整,部分肺泡萎陷,肺泡间隔缩小,少量炎症细胞浸润,纤维组织增生较模型组减轻,Masson 染色可见肺泡间隔胶原纤维表达较模型组显著减少;当归、川芎组及两者不同配比组大鼠肺泡结构破坏较轻,有部分局灶性改变,肺泡间隔轻度增厚、少量成纤维细胞增生,部分可见中性粒细胞等早期炎性细胞数量,Masson 染色可见蓝色胶原沉积及梭形的成纤维细胞,以1∶2 组织病理学改变最轻。见图1~2。

图1 各组HE 染色结果(×400)Fig.1 Results of HE staining in various groups(×400)
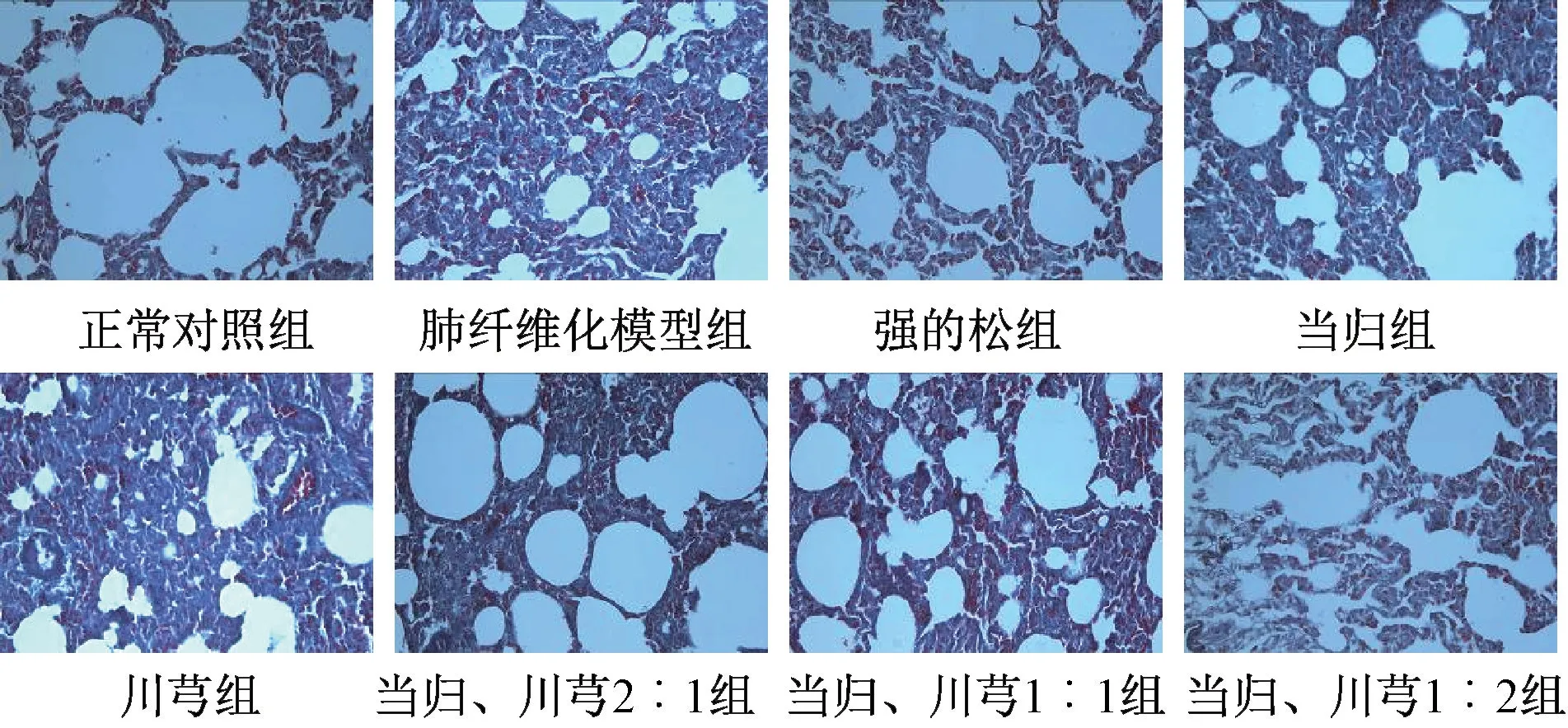
图2 各组Masson 染色结果(×400)Fig.2 Results of Masson staining in various groups(×400)
3.5 肺泡炎和肺纤维化分级计分的定量分析结果 模型组大鼠肺泡炎及肺纤维化计分高于正常对照组,提示模型制备成功;强的松组大鼠肺泡炎及肺纤维化计分低于肺纤维化模型组;当归、川芎配伍后,肺泡炎及肺纤维化计分有下降趋势,以1∶2组更明显,见表5。
表5 当归、川芎及其不同配比对肺纤维化积分的影响(,n=5)Tab.5 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the pulmonary fibrosis grading(,n=5)
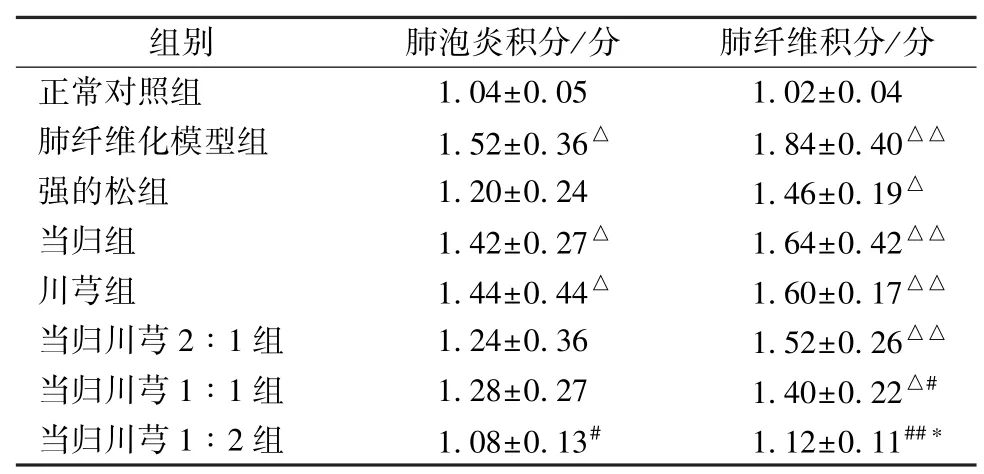
表5 当归、川芎及其不同配比对肺纤维化积分的影响(,n=5)Tab.5 Effects of Angelica sinensis,Chuanxiong and their different compatibility ratios on the pulmonary fibrosis grading(,n=5)
注:与正常对照组比较,△P<0.05,△△P<0.01;与肺纤维化模型组比较,#P<0.05,##P<0.01;与强的松组比较,*P<0.05。
3.6 当归川芎1∶2 配比对肺组织TGF-β1/Smad信号通路的影响 模型组关键分子的mRNA 及蛋白表达均高于正常对照组,而当归、川芎1∶2 组关键分子表达下降,见图3~6、表6~7。
表6 当归、川芎联用对TGF-β1/Smad 信号通路关键分子mRNA 表达的影响(,n=5)Tab.6 Effect of combination use of Angelica sinensis and Chuanxiong on the key molecule mRNA expression of TGF-β1/Smad pathway(,n=5)
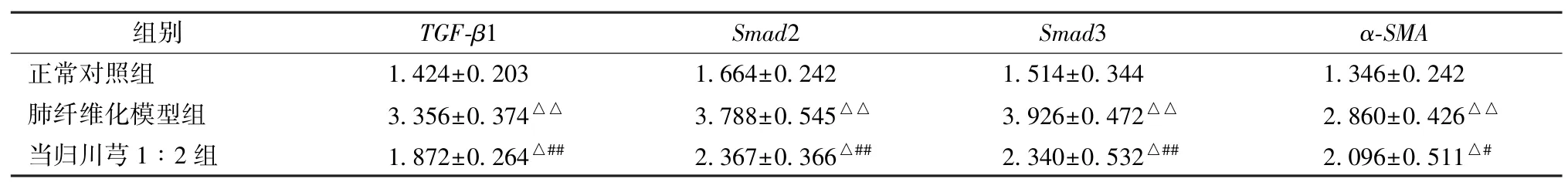
表6 当归、川芎联用对TGF-β1/Smad 信号通路关键分子mRNA 表达的影响(,n=5)Tab.6 Effect of combination use of Angelica sinensis and Chuanxiong on the key molecule mRNA expression of TGF-β1/Smad pathway(,n=5)
注:与正常对照组比较,△P<0.05,△△P<0.01;与肺纤维化模型组比较,#P<0.05,##P<0.01。
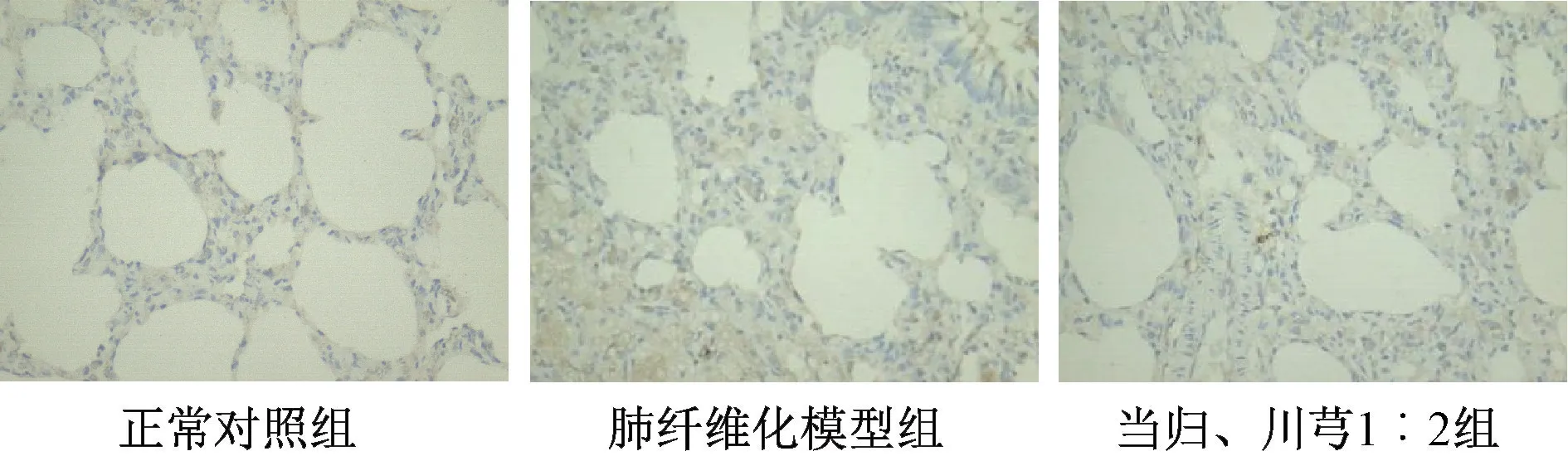
图3 各组TGF-β1 免疫组化染色结果(×400)Fig.3 Results of immunohistochemical staining for TGF-β1 in various groups(×400)
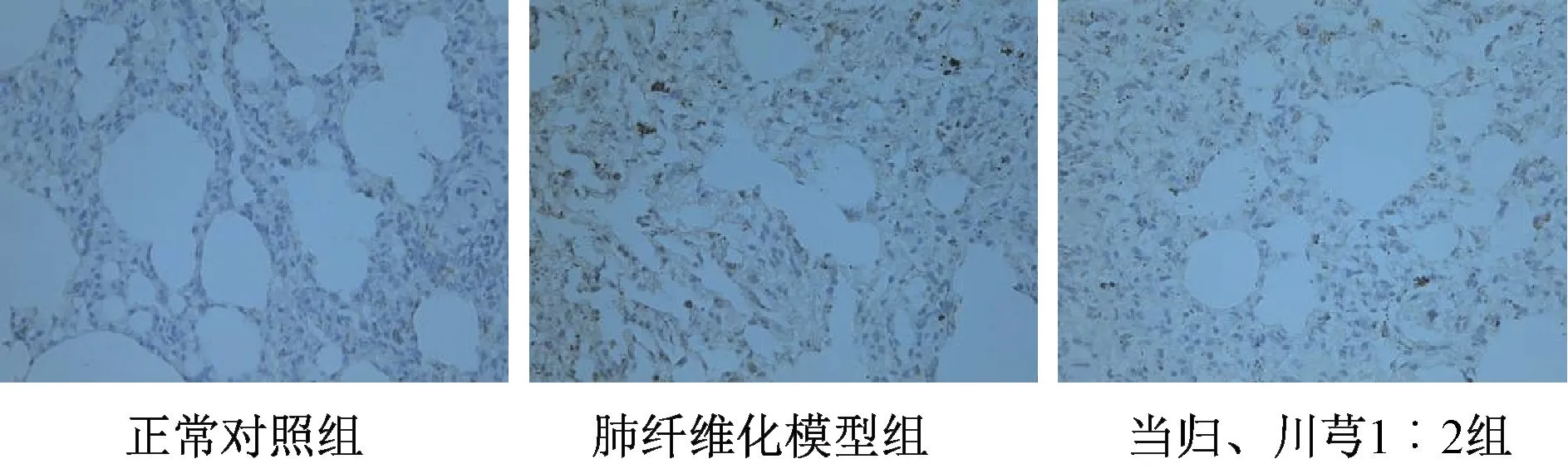
图4 各组Smad2 免疫组化染色结果(×400)Fig.4 Results of immunohistochemical staining for Smad2 in various groups(×400)
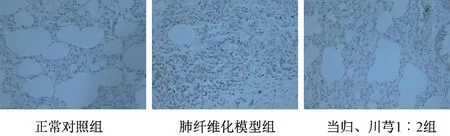
图5 各组Smad3 免疫组化染色结果(×400)Fig.5 Results of immunohistochemical staining for Smad3 in various groups(×400)

图6 各组α-SMA 免疫组化染色结果(×400)Fig.6 Results of immunohistochemical staining for α-SMA in various groups(×400)
3 讨论
肺纤维化主要表现为成纤维细胞增殖、大量细胞外基质(ECM)聚集并伴有炎性损伤和严重的结构破坏,肺泡呈进行性和不可逆性瘢痕化,使得肺泡上皮细胞面积减少,最终导致呼吸衰竭[8]。中医药具有多环节、多靶点的作用特点,从中寻找治疗肺纤维化的有效药物是一种切实可行的思路,益气活血通络法是治疗本病的共识,活血化瘀法贯彻始终[9-10]。当归和川芎都具有活血化瘀的功效,两者组成的药对是临床中常见的配伍形式。当归及其复方具有抗肺纤维化的作用[11-12],川芎也可作为肺纤维化的临床辅助治疗药物[13],但药对是否也具有相同作用尚未见有报道。
表7 当归、川芎联用对TGF-β1/Smad 信号通路关键分子蛋白表达的影响(,n=5)Tab.7 Effect of combination use of Angelica sinensis and Chuanxiong on the key molecule protein expression of TGF-β1/Smad pathway(,n=5)
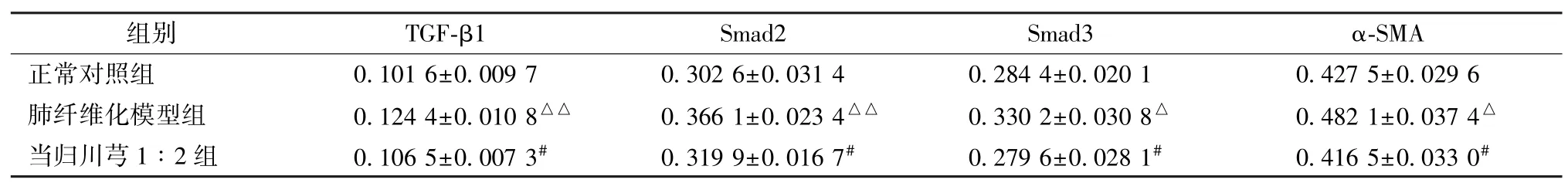
表7 当归、川芎联用对TGF-β1/Smad 信号通路关键分子蛋白表达的影响(,n=5)Tab.7 Effect of combination use of Angelica sinensis and Chuanxiong on the key molecule protein expression of TGF-β1/Smad pathway(,n=5)
注:与正常对照组比较,△P<0.05,△△P<0.01;与肺纤维化模型组比较,#P<0.05。
大量研究表明,肺纤维化的发生机制主要与早期的炎症反应和随后的纤维化增生有关[14]。NFκB 信号通路是介导炎症反应的重要因素,很多抗肺纤维化治疗的药物都以该通路及通路中的重要分子如TNF-α、NF-κB 等为靶点[15-16]。而在随后的纤维化阶段,TGF-β1 则是启动和进程的关键因子。Smad2、Smad3 是TGF-β1 信号转导中最重要的分子,可结合形成复合物转入核内调节反向基因的转录[17-18]。抑制TGF-β1/Smad 信号通路也成为肺纤维化治疗的一个角度[19]。此外,在肺纤维化发生发展过程中,NF-κB 信号通路还可以调节反向TGF-β1/Smad 信号通路[20],正成为肺纤维化治疗的重要靶点。
本研究首先对当归川芎以临床常用的几种比例进行配伍,以肺功能、肺组织羟脯胺酸、肺泡灌洗液中炎症因子TNF-α、IL-1β、IL-6、NF-κB 水平、肺组织病理学评分为观察指标,发现当归川芎配伍使用时具有一定治疗肺纤维化的作用,其中当归川芎以1∶2 配伍时疗效优于其余两种配伍方式。随后,以TGF-β1 信号通路的关键分子TGF-β1、Smad2、Smad3、α-SMA 为检测指标,发现当归川芎以1∶2 配伍时对该通路有部分阻断作用,呈现治疗肺纤维化的潜在价值。
综上所述,TGF-β1/Smad 信号通路的激活是肺纤维化的致病因素之一,当归川芎以1∶2 配伍使用时能有效改善肺功能及减轻组织病理学改变可能与其抑制TGF-β1/Smad 信号通路有关,但具体机制尚需进一步实验论证。
