鳖甲煎丸含药血清抑制肝癌细胞的miRNA-mRNA 调控机制分析
2021-06-26李明芬潘爱萍林英辉陈柳燕邓增富谢杨益林洪升
李明芬,潘爱萍,林英辉,陈柳燕,李 屏,杨 利,邓增富,谢杨益,林洪升*
(1.广西中医药大学第一附属医院检验科,广西 南宁 530021;2.广西中医药大学,广西 南宁 530200)
肝细胞性肝癌(Hepatocellular carcinoma,HCC)是一种高度恶性肿瘤,也是世界上由癌症引起相关性死亡的第三个原因[1]。同时,HCC 也是我国癌症中的第二号杀手[2],严重威胁国人健康,并造成严重的社会经济负担。鳖甲煎丸出自东汉医家张仲景所著《金匮要略》,具有抵抗肿瘤、治疗纤维化和调节人体免疫力等作用[3-4],其防治原则主要包括清热凉血解毒、疏肝理气、活血化瘀、清化湿热和祛瘀理气等。但目前关于鳖甲煎丸治疗肝癌的分子机制研究较少,作用机制未明。本研究通过制备鳖甲煎丸含药血清干预肝癌细胞,通过全细胞转录组学分析微小RNA(MircoRNA,miRNA)和信使RNA(Messenger RNA,mRNA)表达谱,构建miRNA-mRNA 网络及其相关的信号通路,旨在为探索中医药治疗肝癌提供新思路和新的靶点。
1 材料
1.1 动物 60 只SPF 级SD 雄性大鼠,体质量(201.38±17.57)g,均购于广西医科大学动物实验中心,使用许可证号SYXK(桂)2013-0005。所有操作都在国家实验动物使用标准下进行。
1.2 药物 鳖甲煎丸购于武汉中联药业集团股份有限公司,国药准字Z42020772(批号160400),组方药材鳖甲胶、阿胶、蜂房(炒)、土鳖虫(炒)、鼠妇虫、蜣螂、大黄、桃仁、牡丹皮、射干、黄芩、柴胡、干姜、白芍(炒)、桂枝、葶苈子、石韦、厚朴(姜制)、瞿麦、姜半夏、硝石(精制)、党参。
1.3 试剂 DMEM 培养基购于Gibco 公司(美国,批号8169175);胎牛血清购于Gibco 公司(美国,批号1828728);CCK-8 试剂盒购于同仁公司(日本,批号6972-75-8);细胞总RNA 提取试剂盒RNeasy mini Kit 购于Qiagen 公司(德国,批号74104);兔抗人单克隆PNMT 抗体购于Sigma 公司(德国,批号 SAB1410984);兔抗人单克隆ST8SIA5 抗体购于Sigma 公司(德国,批号SAB101183);细胞周期试剂盒购于索莱宝公司(中国,批号20190514);细胞凋亡试剂盒购于索莱宝公司(中国,批号20181219)。
1.4 仪器 Multiskan FC 酶标仪(美国Thermo Fisher Scientific 公司);细胞培养箱(美国Thermo Fisher Scientific 公司);荧光定量PCR(德国Eppendrof 公司);RT-PCR 仪(美国 Applied Biosystems 公司);垂直电泳-转膜装置(美国Bio-Rad 公司);流式细胞仪Accuri C6(美国BD 公司)。
2 方法
2.1 鳖甲煎丸含药血清制备 按成人临床剂量20倍配制(成人剂量为3 g/60 kg,则大鼠给药剂量为1 g/kg),生理盐水配制混悬液,按10 mL/kg 灌胃给药,每天2 次,连续3 d,于第4 天给药2 h后,腹腔注射1% 戊巴比妥钠1~2 mL 每天麻醉,腹主动脉取血,常温静置2 h 后离心分离血清,56 ℃灭活30 min,经0.45、0.22 μm 微孔滤膜过滤除菌,置于-20 ℃下保存。
2.2 空白对照血清制备 生理盐水按10 mL/kg 灌胃,每天2 次,连续3 d,于第4 天灌胃2 h 后,腹腔注射1%戊巴比妥钠1~2 mL 麻醉,腹主动脉取血,常温静置2 h 后离心分离血清,56 ℃灭活30 min,经0.45、0.22 μm 微孔滤膜过滤除菌,置于-20 ℃下保存。
2.3 细胞培养 人肝癌细胞株SMMC-7721 受赠于广西中医药大学生化教研室,人肝癌细胞株Huh7购于中国科学院典型培养物保藏委员会细胞库,人正常肝细胞L-02 购于上海碧云天生物技术有限公司。人肝癌细胞株SMMC-7721 和Huh7 均采用含10%胎牛血清的DMEM 培养基进行培养,人正常肝细胞用含10%胎牛血清的RPMI-1640 培养基进行培养,条件为37 ℃、5% CO2下静置贴壁。
2.4 鳖甲煎丸含药血清干预细胞增殖活性 在96孔板中加入约1 × 104个细胞悬液,每组设3 个复孔,将培养板放在培养箱中预培养24 h(37 ℃,5% CO2),细胞贴壁后向培养板中加入100 μL 血清(鳖甲煎丸含药血清或空白对照血清或胎牛血清)。干预24、48、72 h 后,每孔加入20 μL CCK-8 液,在培养箱中继续培养2 h,酶标仪检测450 nm处光密度(OD),进行统计分析,重复3 次。
2.5 鳖甲煎丸含药血清干预对肝癌细胞周期的影响 取1×106/mL 处于对数生长期的SMMC-7721细胞悬液,接种于细胞6 孔板中培养,待细胞生长至80%左右时弃培养液,加入鳖甲煎丸含药血清(10%)或空白对照血清培养24 h,消化并收集细胞,预冷的PBS 洗涤2 次后加入1 mL 70%乙醇混匀,-20 ℃固定过夜后1 000 r/min、4 ℃下离心10 min,预冷的PBS 重悬洗涤2 次,按照试剂盒要求加入500 mL PI 染色剂,室温避光孵育30 min 后上机检测。
2.6 鳖甲煎丸含药血清干预对肝癌细胞凋亡的影响 取1 × 106/mL 处于对数生长期的SMMC-7721细胞悬液,接种于细胞6 孔板中培养,待细胞生长至80%左右时弃培养液,加入鳖甲煎丸含药血清(10%)或空白对照血清培养24 h,消化并收集细胞,1 mL Bingding Buffer 重悬后在37 ℃下孵育10 min,1 000 r/min 离心5 min 后弃上清,按照说明书要求加入染色剂Annexin V/PI,室温避光孵育15 min 后加入Bingding Buffer,上机检测。
2.7 总RNA 收集 SMMC-7721 细胞以5×106/mL接种于T75 细胞培养瓶中,过夜培养后弃上清液,PBS 洗涤3 次,加入含10%鳖甲煎丸含药血清或空白对照血清的DMEM 培养基培养24 h 后收集细胞,细胞总RNA 提取操作按照Qiagen 公司说明书进行。
2.8 差异表达 miRNA/mRNA 分析 使用NanoDrop 检测样品纯度后,全细胞转录组分析由深圳海一时代基因有限公司完成,测序平台为Hiseq2500 SE50。采用DEGseq 差异分析软件筛选差异表达的miRNA/mRNA,条件为差异倍数大于等于2、P-value 小于等于0.05。
2.9 KEGG 信号通路富集分析 对有显著差异的miRNA 和mRNA 进行KEGG Pathway 显著性富集分析,确定差异表达miRNA 和mRNA 的最主要生化代谢途径和信号转导途径。
2.10 荧光定量PCR 使用PrimeScript Reagent Kit with gDNA Eraser 合成cDNA,操作在Mastercycler ep realplex 实时荧光定量PCR 仪进行,每组样品设置3 个复孔。PNMT(正向5′-CCCAGATCTTGCCAGCTTTC-3′,反向5′-GCCCTTGACATCATCTA CGC-3′)和ST8SIA5(正向 5′-CGGGGCTCTTTAATGTCACG-3′,反向 5′-CCCATTTGCACATCTGGAGG-3′)的循环参数为预变性95 ℃10 min,95 ℃15 s,60 ℃60 s,收集荧光,共40 个循环;溶解曲线参数95 ℃1 min,65~95 ℃以0.1 ℃/s进行升温。通过基于内参照GAPDH 的定量分析,目的基因mRNA 表达量用2-△△Ct计算转录水平。
2.11 Western Bloting 细胞总蛋白提取根据RIPA Lysis Buffer 说明书进行,通过BCA 蛋白浓度测定试剂盒测定蛋白质浓度,按照每孔50 μg 蛋白进行SDS-PAGE 凝胶电泳,用PVDF 膜在半干转膜仪进行转膜,结束后用封闭液室温封闭1 h。去除封闭液后加入目的蛋白特异性抗体,在4 ℃下封闭过夜,其中PNMT(1∶1 000)、ST8SIA5(1∶1 000)和GAPDH(1∶1 000)抗体经抗体稀释液稀释。按照ECL 超敏发光液说明书对膜进行孵育,最后在暗房显影。条带经扫描后,通过Quantity One 软件进行灰度分析。
2.12 生存分析 对TCGA 数据库(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)中的RNA-seq 包含有生存数据和基因表达数据的患者进行总Kaplan-Meier 生存分析,并生成总体生存图。其中,分析样本分为高表达(TPM 值在上四分位数以上)和低/中表达(TPM 值在上四分位数以下),患者状态为死亡或存活。使用PERL 脚本对基因创建一个带有For 列的选项卡分隔的输入文件,包括TCGA 样本id、时间(days_ to_ death 或days_ to_ last_ follow_up)、状态(Alive 或Dead)和表达式水平(高表达或低/中表达),最后对PNMT 基因和ST8SIA5基因进行肝细胞肝癌患者的生存分析。
2.13 统计学分析 应用SPSS 13.0 软件进行处理,数据以()表示,组内比较采用One-Way ANOVA 单因素方差分析。以P<0.05 为差异有统计学意义。
3 结果
3.1 鳖甲煎丸含药血清抑制肝癌细胞增殖活性 鳖甲煎丸含药血清(10%)干预细胞株(SMMC-7721 或Huh7 或L-02)后,SMMC-7721 或Huh7 增殖活性明显受到抑制,在24 h(P <0.01)、48 h(P<0.01)、72 h(P<0.01)节点组间与空白对照血清组比较,差异有统计学意义(P<0.05),见图1A、1B。鳖甲煎丸含药血清干预人正常肝细胞L-02后,其增殖活性与空白对照血清组相比无统计学差异(P>0.05),见图1C。

图1 鳖甲煎丸含药血清对细胞增殖活性的影响(,n=3)Fig.1 Effect of Biejiajianwan-medicated serum on the proliferation activity of hepatoma carcinoma cells(,n=3)
3.2 鳖甲煎丸含药血清干预对肝癌细胞周期影响 鳖甲煎丸含药血清(10%)干预SMMC-7721 细胞24 h 后,与空白对照血清组相比,G0/G1期比例增加(P<0.01),G2/M 期和S 期所占比例减少(P<0.01),见表1、图2。

图2 鳖甲煎丸含药血清对细胞周期的影响Fig.2 Effect of Biejiajianwan-medicated serum on the cell cycles
表1 鳖甲煎丸含药血清对SMMC-7721 细胞周期的影响(%,,n=3)Tab.1 Effect of Biejiajianwan-medicated serum on the cell cycle of SMMC-7721 cells(%,,n=3)

表1 鳖甲煎丸含药血清对SMMC-7721 细胞周期的影响(%,,n=3)Tab.1 Effect of Biejiajianwan-medicated serum on the cell cycle of SMMC-7721 cells(%,,n=3)
注:与空白对照血清组比较,**P<0.01。
3.3 鳖甲煎丸含药血清干预对肝癌细胞凋亡影响与空白对照血清组相比,鳖甲煎丸含药血清干预SMMC-7721 细胞24 h 后细胞早期凋亡率、晚期凋亡率、总凋亡率均提高(P<0.01),见图3、表2。
表2 鳖甲煎丸含药血清对SMMC-7721 细胞凋亡的影响(%,,n=3)Tab.2 Effect of Biejiajianwan-medicated serum on the apoptosis of SMMC-7721 cells(%,,n=3)

表2 鳖甲煎丸含药血清对SMMC-7721 细胞凋亡的影响(%,,n=3)Tab.2 Effect of Biejiajianwan-medicated serum on the apoptosis of SMMC-7721 cells(%,,n=3)
注:与空白对照血清组比较,**P<0.01。
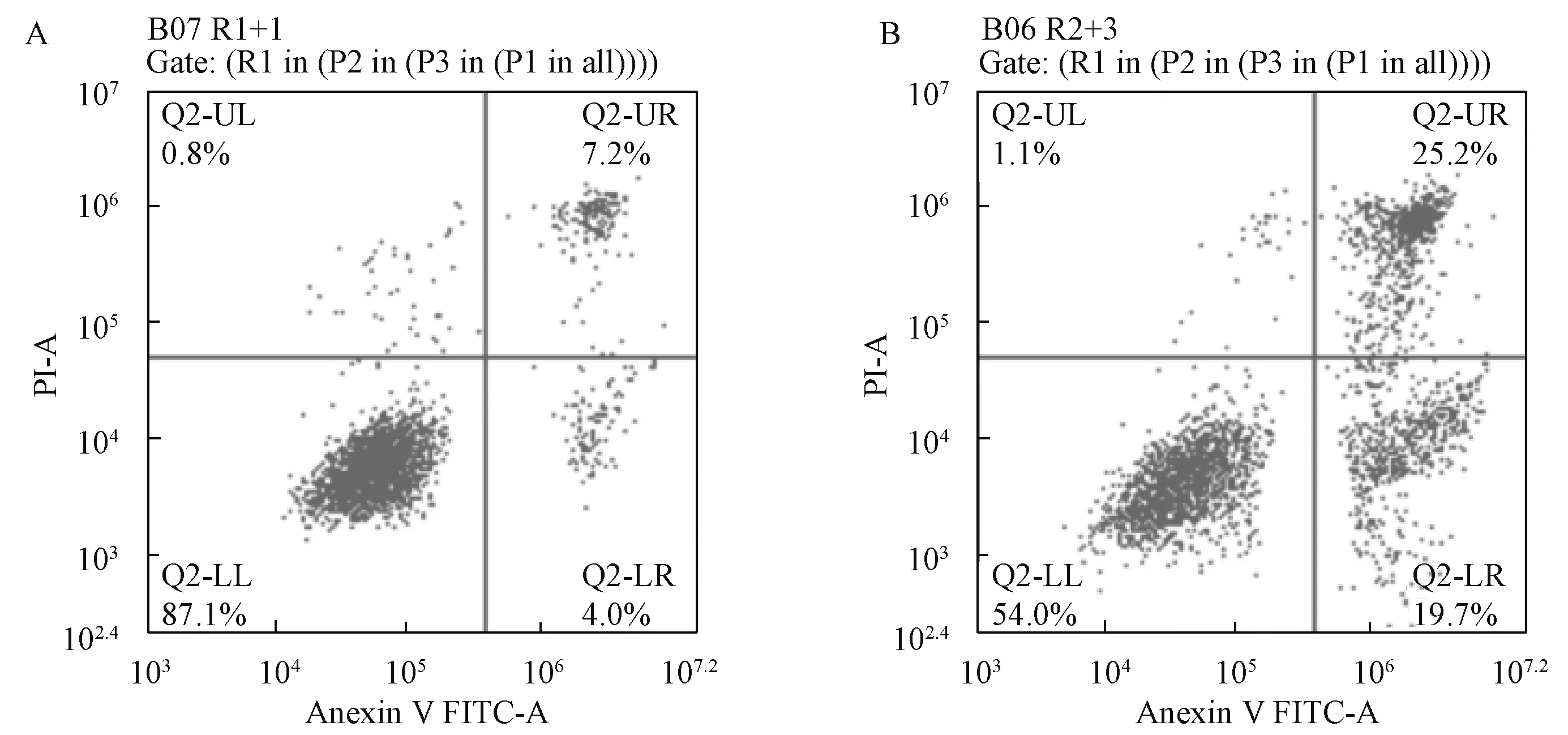
图3 鳖甲煎丸含药血清对细胞凋亡的影响Fig.3 Effect of Biejiajianwan-medicated serum on the cell apoptosis
3.4 差异表达miRNA/mRNA 分析 对鳖甲煎丸含药血清、空白对照血清进行miRNA、mRNA 差异分析,共得到48 个差异表达的miRNA 和168 个差异表达的mRNA,其中差异表达前20 的miRNA见表3,差异表达前20 的mRNA 见表4。

表3 前20 的miRNA 差异表达Tab.3 The 20 most varied miRNA expressions

表4 前20 的mRNA 差异表达Tab.4 The 20 most varied mRNA expressions
3.5 差异表达miRNA/mRNA 的KEGG pathway 富集分析 KEGG Pathway 富集分析发现了差异miRNA/mRNA 背后可能参与调控的信号通路包括有 Metabolic pathway、MAPK signaling pathway、Wnt signaling pathway 和p53 signaling pathway 等,见图 4。miRNA 富集分析提示,代谢通路(Metabolic pathway)是其主要的调控信号通路(图 4A);mRNA 富集分析显示,代谢通路(Metabolic pathway)也是其主要参与的信号通路(图4B)。

图4 差异表达miRNA/mRNA 的KEGG pathway 富集分析Fig.4 KEGG pathway enrichment analysis of varied miRNA/mRNA expressions
3.6 miRNA-mRNA 调控网络的代谢通路(Metabolic pathway)构建 以差异表达的miRNA/mRNA 为基础,按照与Metabolic pathway 信号通路的相关性构建miRNA/mRNA 调控网络的代谢通路,得到以苯乙醇氨基转移酶(Phenylethanolamine N-methyltransferase,PNMT)、唾液酸转移酶8E(ST8 Alpha-N-Acetyl-Neuraminide Alpha-2,8-Sialyltransferase 5,ST8SIA5)为核心mRNA,以hsamiR-3196 和 hsa-miR-6762-5p 为核心 miRNA 的miRNA-mRNA 调控网络代谢通路,见图5。

图5 miRNA-mRNA 调控网络的代谢通路Fig.5 Metabolic pathway of miRNA-mRNA regulatory network
3.7 鳖甲煎丸含药血清对PNMT 和ST8SIA5 表达的影响 分别用0、5%、10%鳖甲煎丸含药血清干预细胞24 h 后检测PNMT 和ST8SIA5 的转录和翻译水平。结果显示,鳖甲煎丸含药血清可依赖浓度梯度下调PNMT 的mRNA、蛋白表达(图6A、7A),依赖浓度梯度上调ST8SIA5 的mRNA、蛋白表达(图6B、7B)。

图6 鳖甲煎丸含药血清对PNMT 和ST8SIA5 mRNA 表达的影响Fig.6 Effect of Biejiajianwan-medicated serum on the expressions of PNMT and ST8SIA5 mRNA

图7 鳖甲煎丸含药血清对PNMT 和ST8SIA5 蛋白表达的影响Fig.7 Effects of Biejiajianwan-medicated serum on expressions of PNMT and ST8SIA5 proteins
3.8 PNMT 和ST8SIA5 表达量对肝细胞肝癌患者的生存时间的影响 PNMT 高表达组的患者生存率低于低/中表达组(P<0.05),而ST8SIA5 高表达组、低/中表达组的患者生存率无显著差异(P >0.05),见图8。
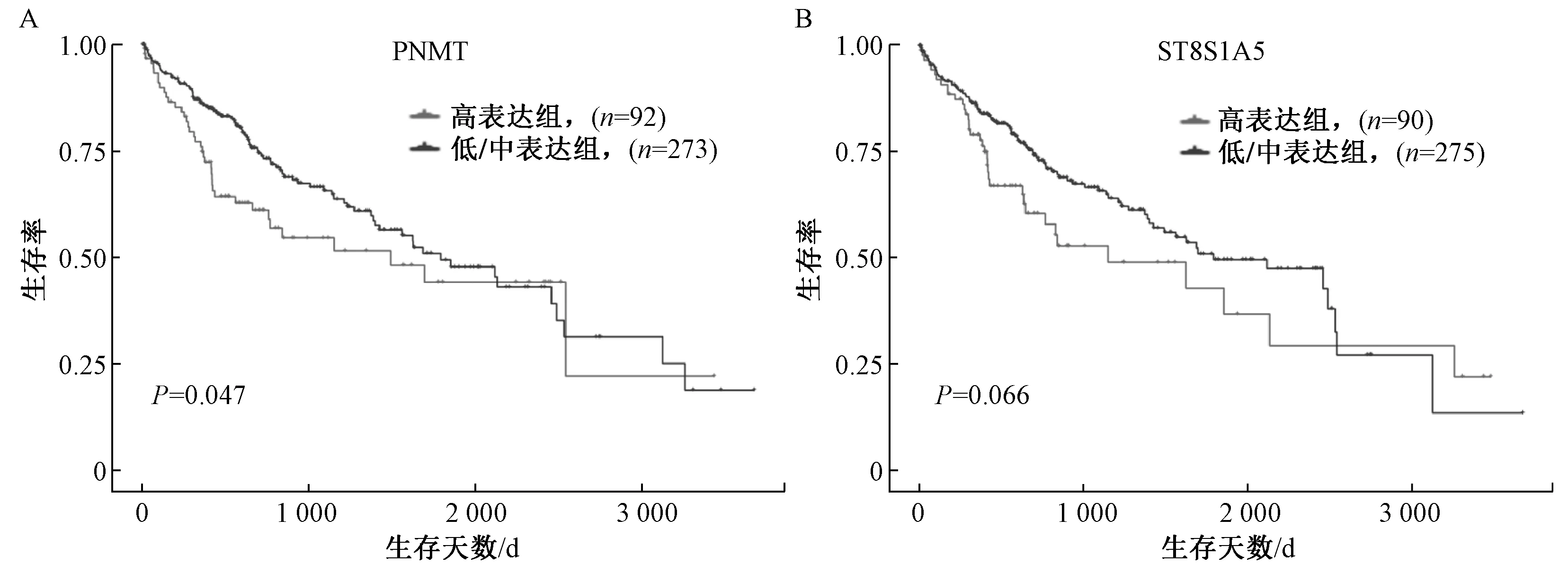
图8 PNMT 和ST8SIA5 在肝细胞肝癌病人的生存分析Fig.8 Analysis of PNMT and ST8SIA5 levels-associated HCC patients survival
4 讨论
根据我国肿瘤登记中心的数据统计显示,我国每年新发HCC 病例在所有恶性肿瘤中位居第3 位,其中,每年因HCC 死亡的病例位居全国恶性肿瘤死亡第2 位,死亡率为16.84/10 万[2],由此可见,HCC 不仅严重威胁国人的健康,也对整个社会造成严重负担。目前,关于HCC 治疗的方法包括手术切除、肝脏移植、放疗、化疗、栓塞、介入治疗和分子靶向治疗等[5],但是效果仍不能令人满意,因此,寻找探索新的HCC 治疗的靶点以及分子机制显得尤为迫切。miRNA 是一类短小且高度保守的内源性非编码RNA[6],在肝癌细胞和组织中都可以检测到其异常表达,它们通过调节癌症相关的基因组区域来影响肝癌的发生、发展和转移等过程[7],通过靶向调控促癌mRNA 或者抑癌mRNA的表达来达到靶向治疗HCC 是一个新的方向。因此,寻找和鉴定出与HCC 相关的miRNA 以及其靶基因,阐明具体作用机制就显得十分重要。
在本研究中首先观察到鳖甲煎丸含药血清(10%)作用于肝癌细胞后通过CCK-8 法检测其增殖活性时,在24、48、72 h 发现鳖甲煎丸含药血清组细胞增殖活性受到抑制,与空白对照血清组比较有显著差异(图1)。其次,在细胞周期实验中发现鳖甲煎丸含药血清(10%)作用于肝癌细胞后,细胞的G0/G1期比例显著增加(表1、图2),这说明鳖甲煎丸可能是通过使肝癌细胞阻滞于G0/G1期,进而抑制其增殖。最后,在细胞凋亡实验中发现鳖甲煎丸干预后,可显著提高肝癌细胞的凋亡率(表2、图3)。
为了进一步明确鳖甲煎丸抑制肝癌细胞增殖和促进凋亡的潜在分子机制,应用鳖甲煎丸含药血清与SMMC-7721 细胞共培养24 h 后,通过全细胞转录组分析技术检测到该过程有48 个差异表达miRNA,包括有hsa-miR-4699-5p、hsa-miR-3196 和hsa-miR-6762-5p 等(表3);有168 个表达差异mRNA,包括PNMT、PDIA2、ST8SIA5 和ACTL8等(表4)。通过差异表达miRNA 和mRNA 的KEGG pathway 富集分析发现,代谢通路(Metabolic pathway)是最关键的信号通路之一(图4)。再构建代谢途径的miRNA-mRNA 网络图,发现PNMT 基因、ST8SIA5 基因、hsa-miR-3196 和hsa-miR-6762-5p 可能是鳖甲煎丸调控代谢通路抑制肝癌细胞的关键调控点(图5)。最后通过实时荧光定量PCR 和Western Bloting 验证,发现鳖甲煎丸可显著下调PNMT 的转录和翻译,且呈剂量依赖(图6A、7A);显著上调ST8SIA5 的转录和翻译,同样呈剂量依赖(图6B、7B)。
PNMT 多见于嗜铬细胞瘤中高表达[8],是Wnt信号通路的重要中间分子[9],而Wnt 通路目前被发现是鳖甲煎丸抑制肝癌细胞的重要通路[10-11],在乳腺癌中处于高表达状态,其蛋白产物及去甲肾上腺素和肾上腺素退化通路可能与乳腺癌的耐药性有关[12]。而生存分析结果显示,高表达PNMT 的肝细胞肝癌患者其生存期显著低于低/中表达组(图8A,P=0.047),这提示鳖甲煎丸可能通过下调PNMT 影响Wnt 信号通路来抑制肝癌细胞。另外,ST8SIA5 是以胞苷-磷酸-β-N-乙酰神经氨酸为底物的糖基转移酶,它是α-2,8-唾液酸转移酶家族的成员之一[13],在不同肿瘤中均存在差异表达,被视作治疗的潜在靶点[14]。有研究发现,在乳腺癌组织和癌旁组织中ST8SIA5 的出现差异表达状态[15],高表达的唾液酸转移酶可增强肿瘤细胞的免疫应答行为[16],这提示鳖甲煎丸可能通过上调ST8SIA5 来影响肝癌细胞与免疫细胞的应答行为。虽然生存分析结果显示,高表达ST8SIA5 的肝细胞肝癌患者生存期与低/中表达组相比无显著差异(图8B,P=0.066),但仍可以继续挖掘ST8SIA5与肝癌复发、转移和耐药性等的关系。目前,关于PNMT 和ST8SIA5 在肝癌中的分子机制仍鲜有文献报道,因此,进一步挖掘两者在鳖甲煎丸抑制肝癌细胞中的作用机制显得十分的有意义。
综上所述,鳖甲煎丸可以抑制肝癌细胞,涉及了许多miRNA、mRNA 和信号通路的参与,其中代谢通路(Metabolic pathway)及PNMT、ST8SIA5分别是其发挥作用的重要通路、核心基因。因此,进一步挖掘PNMT 和ST8SIA5 基因在肝癌发生发展中的作用,对于阐明鳖甲煎丸抑制肝癌的分子机制和探索新的肝癌治疗靶点具有重要意义。
