基于“TF-miRNA”反馈环探讨活血荣络方对脑梗死大鼠的保护作用及机制
2021-06-26杨仁义颜思阳周德生高晓峰傅馨莹龚翠兰刘利娟
杨仁义,颜思阳,周德生,高晓峰,傅馨莹,龚翠兰,刘利娟*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
卒中作为最常见的脑血管病之一,是我国第一大死亡原因[1-2]。《中国卒中防治报告2019》[3]数据显示,我国总体卒中终生发病风险为39.9%,位居全球首位,其中脑梗死约为82%,严重威胁居民身体健康[4]。目前全世界公认的脑梗死有效治疗为静脉溶栓、机械取栓,但严格的时间窗或副作用限制了其应用。脑梗死属中医“缺血性中风”范畴,荣气[5]是一切精微物质的总称,归脏腑之气,而荣气虚滞[6]是缺血性中风的关键病机。基于荣气理论创制的活血荣络方是湖南中医药大学第一附属医院院内制剂,纳入临床路径已12 年,前期临床研究发现[7-10]活血荣络方能降低Glu、Asp、CF6、Ca2+、CD62p 等水平,升高GABA、Gly 等水平,有效抑制血小板聚集、清除氧自由基等,从而改善脑梗死后痉挛性瘫痪、认知能力、神经功能症状;前期实验研究发现[11-15]活血荣络方能上调Caveolin-1、CD31+、下调 MMP-9 表达,激活JAK2/STAT3 信号通路,减轻脑梗死急性期炎症反应,促进血管新生,改善脑梗死后神经功能缺损。但活血荣络方促脑梗死后血管新生的脑保护机制有待进一步深入研究,因此本项目结合生物信息学技术与大鼠脑缺血再灌注模型,以筛选出的“转录因子(TF)-微小RNA(miRNA)”反馈环为机制,在RNA 水平研究活血荣络方改善脑梗死大鼠神经功能的作用机制。
1 材料
1.1 动物 10~12 周龄SPF 级健康雄性Sprague-Dawley(SD)大鼠40 只,体质量230~280 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号SCXK(湘)2016-0002,饲养于湖南中医药大学第一附属医院实验动物中心,昼夜交替各12 h,温度21~26 ℃,相对湿度40%~50%。实验经湖南中医药大学第一附属医院动物实验伦理委员会批准(20201010-13),操作均按照美国国立卫生研究院制定的实验动物使用指南标准[16]。
1.2 试剂与药物 活血荣络方(湘药制字Z20080472),组方药材鸡血藤30 g、石楠藤30 g、生地黄15 g、玄参10 g、黄精15 g、乳香10 g、没药10 g、川芎10 g,均购自湖南中医药大学第一附属医院中药房,经本院张裕民主任药师鉴定为正品,质量均符合2020 年版《中国药典》 规定。制备方法为将乳香、没药粉碎,其余药材混合,10倍量水浸泡12 h 后煎煮2 h,第2 次加8 倍量水煎煮1 h,第3 次加5 倍量水煎煮1 h,合并3 次提取液,旋转蒸发仪上浓缩冷却,即得,4 ℃下保存备用。根据人动物体表面积换算法,用蒸馏水将活血荣络方浸膏稀释为每1 mL 含1.1 g 生药的药液,按1 mL/100 g 剂量灌胃。丁苯酞软胶囊(石药集团恩必普药业有限公司,批号H20050299)。RNA提取试剂盒、RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix(武汉赛维尔生物科技有限公司,货号分别为 G3013、G3330、G3322);三氯甲烷、异丙醇、无水乙醇(国药集团化学试剂有限公司,货号分别为10006818、80109218、10009218);HyPure TMMolecular Biology Grade Water(美国HyClone 公司,货号SH30538.02)。
1.3 仪器 石蜡切片机(美国Thermo Scientific 公司);显微成像系统(麦克奥迪实业集团有限公司);荧光定量PCR 仪(美国ABI 公司);超微量分光光度计(美国Thermo 公司);台式高速冷冻型微量离心机[大龙兴创实验仪器(北京)有限公司];超净工作台(苏州安泰空气技术有限公司);标准试剂型纯水仪(青岛富勒姆科技有限公司)。
2 方法
2.1 脑梗死差异miRNA(DEMs)及差异基因(DEGs)的GEO 数据挖掘
2.1.1 数据检索与下载 通过美国国家图书馆(NCBI)基因表达综合数据库GEO 子数据库(https://www.ncbi.nlm.nih.gov/geo/),以“Cerebral Infarction”或“Cerebral Ischemia”为检索词,获取脑梗死miRNA(如GSE97532)与mRNA(如GSE119121)微阵列分析数据,下载数据集中表达矩阵文件。
2.1.2 数据归一化 采用R 语言,利用Xi=[Xi-min(X1~n)] ∕[max(X1~n)-min(X1~n)]公式将表达矩阵进行归一化处理。
2.1.3 DEMs 与DEGs 挖掘 采用R 语言“limma包”对表达矩阵(如GSE97532、GSE119121)分别进行差异分析,以| logFC | >1;P-value<0.05为筛选条件确定DEMs 与DEGs,分别绘制DEMs热图、DEGs 火山图。
2.2 DEMs 反向靶基因与正向转录因子的预测及对“TF-miRNA”反馈环的构建 TF 的翻译合成受miRNA 调控,同时TF 具有转录miRNA 的功能,所以特定的TF 与miRNA 可形成“TF-miRNA”反馈环在疾病中发挥作用。
2.2.1 DEMs 反向靶基因预测 通过TargetScans[17](http://www.targetscan.org)、starBase[18](http://starbase.sysu.edu.cn/starbase2/)数据库对miRNA 反向靶基因进行预测,整合算法与实验验证的DEMs 反向靶基因。
2.2.2 DEMs正向TF 预测通过 TransmiR v2.0[19-20]数据库(http://www.cuilab.cn/transmir)对miRNA 正向TF 进行反向预测,整合算法与实验验证的DEMs 正向TF。
2.2.3 “TF-miRNA”反馈环中TF 聚焦 通过韦恩图取“DEGs”“DEMs 反向靶基因”“DEMs 正向TF”三者的交集,以获取反馈环中特定TF。
2.2.4 “TF-miRNA”反馈环中miRNA 聚焦 根据聚焦出的特定TF,结合TransmiR v2.0 数据,在DEMs 中检索特定miRNA。
2.3 大鼠脑缺血再灌注损伤模型的制备 各组大鼠适应性喂养1 周,术前12 h 禁食不禁水。以10%水合氯醛(0.35 g/kg)腹腔注射麻醉大鼠,参考Longa 等[21]报道的大脑中动脉阻塞法(middle cerebral artery occlusion,MCAO)梗阻大鼠右侧中动脉,钝性分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),从ECA 与ICA 分叉部约(4±2)mm 处剪口进拴线,插入约(18±2)mm,将ICA 挂线系牢,缺血2 h 后,拔出拴线进行再灌注。假手术组分离CCA、ECA、ICA,不插入拴线,其余过程同造模组,大鼠术后6 h 自由进食饮水。参考Zea-Longa’s 级[21]标准评分法,取1~3 分大鼠进行后续实验。
2.4 分组及给药 将SD 大鼠随机分为4 组,分别为假手术组、模型组、活血荣络方组及丁苯酞组,每组各10 只,实验过程中出现死亡、取材时发现蛛网膜下腔出血或脑出血剔除则根据需要予以补充。术后6 h 灌胃,活血荣络方组予以活血荣络方药液[11](11.7 g/kg),丁苯酞组予以丁苯酞混悬液(60 mg/kg),假手术组与模型组予以生理盐水(10 mL/kg),每天固定时间点灌胃给药1 次,连续7 d[13-14]。
2.5 改良神经功能缺损评分(mNSS)大鼠神经功能采用改良神经功能缺损评分(mNSS)[22]进行评价,包括运动测试、感觉测试、平衡木测试、反射消失或动作异常共18 分,评分越高,损伤程度越严重,于1、3、7 d 开始。
2.6 苏木素-伊红(HE)染色与尼氏(Nissl)染色 大鼠腹主动脉采血后心脏灌注生理盐水200 mL,换4% 多聚甲醛溶液继续灌注,断头取脑,置于4%多聚甲醛溶液中保存。脑组织经过脱水、透明、浸蜡、包埋、切片(3 μm,冠状位)、脱蜡、复水、染色(HE、Nissl 染色)等步骤后,显微成像系统获取脑组织神经元图像,参考丁元元等[23]报道,采用脑组织病理学评分表对大鼠HE染色进行评价,评定标准见表1。

表1 脑组织病理学评分Tab.1 Scores for brain tissue histopathological assessment
2.7 脑组织“TF-miRNA”反馈环miRNA、mRNA的检测 采用荧光定量PCR(real-time PCR,RTPCR)法检测脑梗死大鼠脑组织中“TF-miRNA”反馈环相关KLF4、KLF5、VEGF mRNA 及miR-206、miR-429 miRNA,取脑组织100 mg,用1 mL Trizol Reagent 提取脑组织总RNA,Nanodrop 2000检测RNA 浓度及纯度。采用RT First Strand cDNA Synthesis Kit 逆转录试剂盒进行逆转录,按照试剂盒说明书进行扩增,反应体系为2× qPCR Mix 7.5 μL,2.5 μmmol/L 基因引物1.5 μL,反转录产物2.0 μL,ddH2O 4.0 μL,预变 性95 ℃,10 min,循环(40 次)95 ℃,15 s 至60 ℃,60 s,熔解曲线60~95 ℃,每15 s 升温0.3 ℃。miRNA 以U6 为内参,mRNA 以GAPDH 为内参,相对表达量采用2-ΔΔCt进行分析,引物序列见表2。

表2 PCR 引物序列Tab.2 PCR primer sequences
2.8 统计学分析 通过SPSS 23.0 软件进行处理,计量资料以()表示,组间比较若符合正态性且方差齐性时,采用单因素方差分析LSD、SNK 法进行两两比较;方差不齐时,采用Tamhane T2、Dunnett T3 法进行方差检验和两两比较;若不符合正态性时,采用Kruskal-Wallis 秩和检验。 P<0.05表示差异具有统计学意义。
3 结果
3.1 DEMs、DEGs 筛选 采用R 语言“limma 包”对GSE97532、GSE119121 表达矩阵进行差异分析,将模型组与假手术组进行对比以获取DEMs、DEGs。DEMs(图1)共有36 个,其中有27 个miRNA(miR-206、miR-429、miR-23a-5p 等)在模型组中高表达,9 个miRNA(miR-23b-5p、miR-181a、miR-107-5p 等)在模型组中低表达;DEGs(图2)共有271 个,其中有169 个mRNA(KLF4、TLR2、KLF5 等)上调,102 个mRNA(CD79B、EBF1、HMGN3 等)下调。

图1 DEMs 表达热图Fig.1 Heat map of DEMs expression
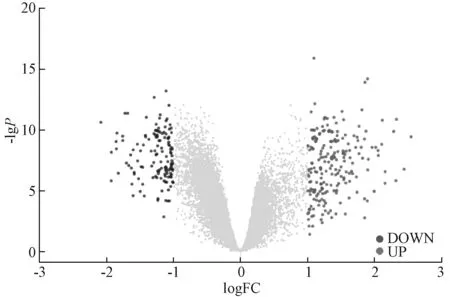
图2 DEGs 表达火山图Fig.2 Volcano map of DEGs expression
3.2 DEMs 反向靶基因与正向转录因子预测及“TF-miRNA”反馈环构建 采用TargetScans、starBase 预测出36 个DEMs 的反向靶基因(如TLR2、BNDF、STAT3 等)共13 764 个,采用TransmiR v2.0 数据库预测出36 个DEMs 的正向TF(如 KLF4、KLF5、STAT3 等)共 309 个。取“DEGs”“DEMs 反向靶基因”“DEMs 正向TF”三者的交集(图3),共获取5 个脑梗死差异表达转录因子基因,分别为 KLF4、KLF5、HMGN3、EBF1、TLR2。

图3 “DEGs”“反向靶基因”与“正向TF”韦恩图Fig.3 Venn diagrams for“DEGs”,“Downstream-Target-Genes”and“Upstream-TF”
根据聚焦出的5 个特定TF 结合TransmiR v2.0数据,在DEMs 中检索特定TF 能转录的miRNA,其中TLR2 能转录的miRNA 与DEMs 无交集,取余下4 个特定TF 转录的miRNA 与DEMs 的交集,可初步构成“TF-miRNA”反馈环(图 4),即“KLF4-miR-206”“KLF4-miR-544”“KLF4-miR-429”“KLF5-miR-429”“EBF1-miR-429”5 个“TF-miRNA”反馈环。KLF4、KLF5 属于转录因子Kruppel 家族蛋白,在神经再生、血管新生、细胞凋亡等机体修复生命进程中发挥重要作用;EBF1 属于早期B 细胞因子家族蛋白,主要与B 细胞介导的免疫反应有关,因此本研究以机体修复为切入点,采用分子和动物实验方法,以“KLF4-miR-206”“KLF4-miR-429”“KLF5-miR-429”为重点研究对象,对生物信息学预测的“TF-miRNA”反馈环进行初步验证,同时为后续研究提供新机制及理论基础。
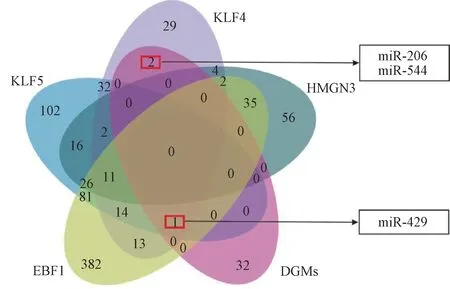
图4 “TF-miRNA”反馈环韦恩图Fig.4 Venn diagrams for“TF-miRNA”feedback loop
3.3 改良神经功能缺损评分 与假手术组比较,模型组、活血荣络方组、丁苯酞组1、3、7 d 评分升高(P<0.01),神经功能缺损严重(P<0.01);与模型组比较,活血荣络方组、丁苯酞组1 d 评分无明显变化(P>0.05),神经功能缺损无明显改善,3、7 d 评分降低(P<0.01),神经功能缺损改善,见表3。
表3 活血荣络方对脑梗死大鼠1、3、7 d 神经功能的影响(,n=10)Tab.3 Effects of Huoxue Rongluo Recipe on rats’ neural function on the 1st,3rd and 7th days after cerebral infarction(,n=10)
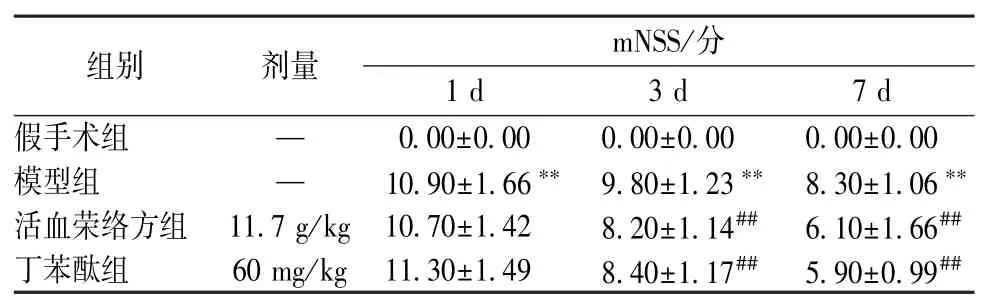
表3 活血荣络方对脑梗死大鼠1、3、7 d 神经功能的影响(,n=10)Tab.3 Effects of Huoxue Rongluo Recipe on rats’ neural function on the 1st,3rd and 7th days after cerebral infarction(,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。
3.4 HE、Nissl 染色 图5A、5C 显示,假手术组神经元形态完整、排列紧密、结构清晰;与假手术组比较,模型组神经元细胞固缩、数量减少、染色质不均匀、部分细胞水肿、细胞间隙增宽(P <0.01);与模型组比较,活血荣络方组、丁苯酞组神经元损伤减轻、数量增多、水肿减轻、间隙变小(P<0.05,P<0.01);图5B、5D 显示,假手术组神经元完整,尼氏体结构清晰,排列紧密。与假手术组比较,模型组神经元结构异常,数量较少,呈空泡样变或坏死,尼氏小体数目减少(P<0.01);与模型组比较,活血荣络组、丁苯酞组神经元形态好转,损伤减轻,尼氏小体数目增多,染色均匀,间隙变小(P<0.05)。各组脑组织皮质、海马区病理学评分及尼氏小体数目见表4。
表4 各组脑梗死大鼠脑组织皮质、海马区病理学评分及尼氏小体数目比较(,n=5)Tab.4 Comparison of pathological scores and Nissl body counts in cerebral cortex and hippocampus of cerebral infarction rats among various groups(,n=5)
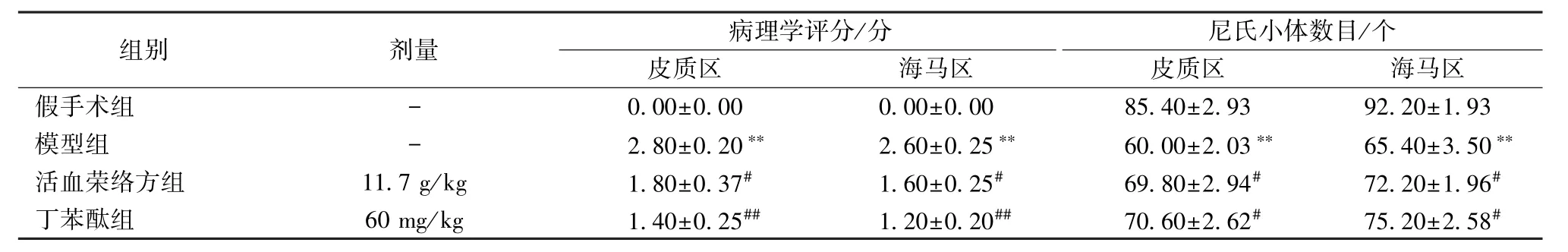
表4 各组脑梗死大鼠脑组织皮质、海马区病理学评分及尼氏小体数目比较(,n=5)Tab.4 Comparison of pathological scores and Nissl body counts in cerebral cortex and hippocampus of cerebral infarction rats among various groups(,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
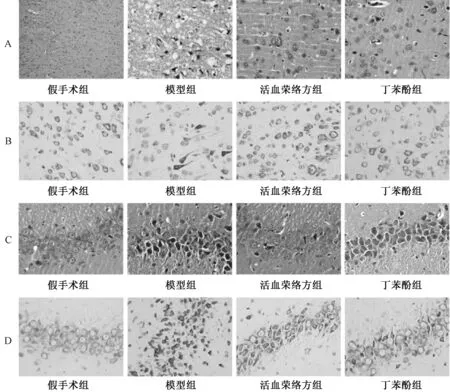
图5 各组脑梗死大鼠病理变化(×400)Fig.5 Pathological changes of cerebral infarction rats in various groups(×400)
3.5 大鼠脑组织“TF-miRNA”反馈环miRNA、mRNA 表达 与假手术组比较,模型组、活血荣络方组、丁苯酞组大鼠脑组织KLF4、KLF5、VEGF mRNA、miR-206 与miR-429 表达升高(P<0.01);与模型组比较,活血荣络方组与丁苯酞组KLF4 表达升高(P<0.01),活血荣络方组KLF5、VEGF 表达升高(P<0.05),丁苯酞组KLF5、VEGF 表达升高(P <0.01),活血荣络方组与丁苯酞组miR-206、miR-429 表达降低(P<0.01),见表5。
表5 活血荣络方对“TF-miRNA” 反馈环miRNA、mRNA 表达的影响(,n=5)Tab.5 Effects of Huoxue Rongluo Recipe on expressions of miRNA and mRNA in“TF-miRNA”feedback loop(,n=5)
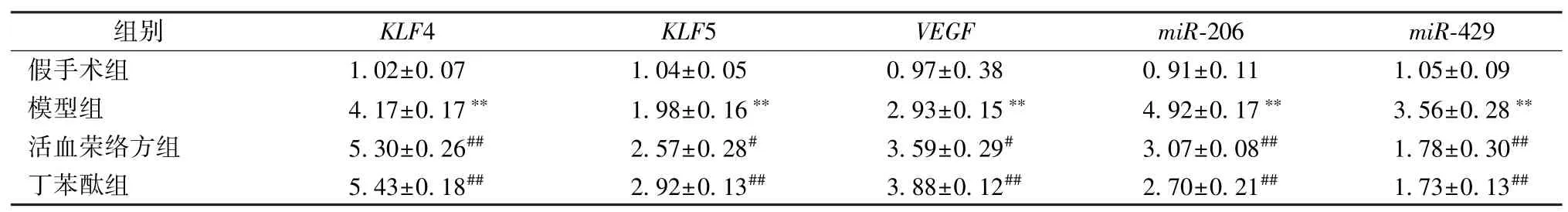
表5 活血荣络方对“TF-miRNA” 反馈环miRNA、mRNA 表达的影响(,n=5)Tab.5 Effects of Huoxue Rongluo Recipe on expressions of miRNA and mRNA in“TF-miRNA”feedback loop(,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
4 讨论
“TF-miRNA”反馈环[24]是TF 与miRNA 之间存在的直接或间接的反馈调控关系。TFs 能转录基因的表达,miRNA 能靶向抑制基因的转录后翻译,脑梗死发生时,细胞中TFs 与miRNAs 会被广泛影响,可构成“TF-miRNA”反馈环,共同影响脑梗死疾病的发生、发展及预后。本研究从GEO 数据库中挖掘出脑梗死相关DEGs 与DEMs,结合“TFmiRNA”反馈环模式,初步构成“KLF4-miR-206”“KLF4-miR-544”“KLF4-miR-429”“KLF5-miR-429”“EBF1-miR-429”5 个脑梗死相关“TFmiRNA”反馈环。反馈环中TF主要由KLF4、KLF5、EBF1 构成,miRNA 主要由miR-206、miR-429、miR-544 构成。研究发现 KLF4[25-27]、KLF5[28]在缺血性脑损伤中被上调,其转录后水平调控主要与miRNA(miR-200b[29]、miR-195[28]等)的靶向抑制翻译作用有关,而KLF4 的过表达能促进miRNA(miR-200b、miR-183[30]等)的表达,KLF5的过表达促进miRNA(miR-29a[31]、miR-200[32]等)的表达,因此本研究初步构成的5 个“TF-miRNA”反馈环可能在脑梗死疾病中发挥作用。同时研究发现缺血缺氧环境下,KLF4 可上调VEGF 的水平[33],促进血管内皮细胞(ECs)增殖、迁移和管形成。Zhou 等[34]研究发现沉默eEF2K 可以有效降低KLF5 转录因子的蛋白水平,降低与VEGF 启动子结合的KLF5 的水平,导致VEGF mRNA 表达下降,抑制血管新生。因此,以KLF4、KLF5 为转录因子构成的反馈环可转录上调VEGF 分子,激活VEGF 信号通路,在脑梗死后血管新生中发挥正向调节作用。
荣气是一切精微物质的总称[5],荣气气化[35]是“精化气→气生变→变成形”的过程,可促进脑梗死后血管再生。本团队首次提出缺血中风辨治理论体系——“荣气虚滞”,并创立活血荣络法,制定了活血荣络方,在临床中颇有疗效。前期研究证实活血荣络方[11,13]以常规剂量干预脑梗死大鼠7 d具有较好的促脑梗死血管新生的作用,因此本研究采用脑梗死大鼠模型,进一步验证构成的“TF-miRNA”反馈环可能在脑梗死疾病中发挥作用,并验证该保护作用可能与此反馈机制介导的血管新生有关。
本研究表明,活血荣络方与丁苯酞可改善脑梗死大鼠神经功能缺损,且具有时间依赖性;HE、Nissl 染色结果显示药物干预下神经元损伤及水肿减轻,细胞间隙缩小,尼氏小体数目增加,表明活血荣络方与丁苯酞均能对脑梗死大鼠起到神经保护作用;RT-PCR 结果显示,脑梗死大鼠脑组织中KLF4、KLF5、VEGF 与miR-206、miR-429 表达均升高,同时活血荣络方与丁苯酞能进一步升高脑梗死大鼠脑组织中KLF4、KLF5、VEGF 表达,而降低miR-206、miR-429 表达,结合反馈环模式,可认为活血荣络方与丁苯酞可能下调miR-206、miR-429,上调KLF4、KLF5,影响脑梗死中存在的“KLF4-miR-206”“KLF4-miR-429”“KLF5-miR-429”负反馈环,进而上调VEGF,促脑梗死后血管新生,从而起到神经保护作用。VEGF[36]能促进ECs 增殖、迁移、分化,介导三级侧支循环血管新生,改善脑梗死后局部血供,代偿性营养神经元。Zhou 等[37]采用同步辐射血管造影(SRA)技术,发现丁苯酞干预 7、14 d,能上调 VEGF、VEGFR2、CD31 等血管新生蛋白表达,增加脑梗死大鼠血流灌注及血管密度,促进脑梗死后血管新生。因此活血荣络方与丁苯酞均能上调TFs(KLF4、KLF5)、下调miRNAs(miR-206、miR-429)的表达,打破脑梗死大鼠中存在的“TFmiRNA”反馈环,介导ECs 中VEGF 的表达,促进脑梗死后血管新生。
综上所述,活血荣络方能抑制miRNA(miR-206、miR-429 等)的表达,促进细胞质中特定的TF(KLF4、KLF5 等)的表达,打破特定“TFmiRNA”反馈环,促进VEGF 分子表达,可能在脑梗死后神经保护方面发挥作用;同时为研究中成药/中医药提供新的研究方向或是思路。
