离子导入技术促进盐酸青藤碱透皮递送的影响因素研究
2021-06-26蒋香云刘占军
蒋香云,朱 丽,陈 勇,刘占军*
(1.华北理工大学药学院,河北 唐山 063201;2.南通大学药学院,江苏 南通 226001)
盐酸青藤碱是从青风藤中提取出的单体生物碱,在祛风除湿、消肿止痛等方面具有较好疗效[1-2],但其口服绝对生物利用度仅30%左右,并会引起白细胞减少等不良反应[3-4]。透皮给药可靶向递送药物,避免肝首过效应,从而减轻药物的系统性不良反应[5-6]。盐酸青藤碱的游离碱型具有适中的相对分子质量(329.4)、较低的熔点(161 ℃)、适宜的油水分配系数(log P 1.24),已有报道将其制成被动透皮制剂,用于局部镇痛和抗风湿[7]。
透皮离子导入可使药物快速吸收[8-9],这对治疗局部肌肉酸痛、关节炎症极为有利。鉴于盐酸青藤碱本身理化性质(溶解度约为9%,可在生理pH 条件下充分解离)[10],已有报道通过对其施加20 mA 电流进行离子导入透皮递送[11],但电流强度一般不得超过0.5 mA/cm2,否则会产生严重的皮肤灼伤。因此,本实验通过对皮肤施加生理可接受的电流强度,探讨离子导入技术在盐酸青藤碱透皮促进作用中的影响因素。
1 材料
1.1 仪器 高效液相色谱仪(配置717 plus 型自动进样器、2487 型紫外检测器、1525 型二元高压泵、Empower 色谱工作站,美国Waters 公司);UV-2550 型紫外可见分光光度计(日本Shimadzu 公司);FiveEasy 型实验室PH 计(瑞士Mettler-Toledo 公司);双臂垂直式Franz 渗透池(扩散面积2.0 cm2,南通科华玻璃仪器厂);APH 1000M 型稳压直流电源(美国Kepco 公司);6727-C10 型Stadie-Riggs 组织切刀(美国Thomas Scientific 公司)。
1.2 试剂与药物 盐酸青藤碱(陕西森弗生物技术有限公司,纯度≥99%,批号SF15082105);2-吗啉乙磺酸(MES)、Ag/AgCl 电极(美国Sigma公司)。甲醇为色谱纯;其余试剂均为分析纯;水为超纯水(美国Milli-Q 超纯水仪生产)。
1.3 动物 新鲜猪耳,取自尤卡坦型生猪[体质量约100 kg,南通市永兴生猪场,合格证号(苏通)动防合字第20150028 号]。
2 方法与结果
2.1 色谱条件 Diamonsil C18色谱柱(4.6 mm×150 mm,5 μm);EasyGuard C18保护柱(4.0 mm×10 mm,5 μm);流动相10 mmol/L 磷酸氢二钾缓冲液(磷酸调pH 至3.0)-甲醇(30∶70);体积流量1.0 mL/min;柱温25 ℃;检测波长264 nm;进样量20 μL。
2.2 线性关系考察 用“2.1”项下流动相配制不同质量浓 度(0.5、2、10、50、100、200、500 μg/mL)对照品溶液,在“2.1”项色谱条件下进样测定。以盐酸青藤碱质量浓度为横坐标(X),峰面积 为纵坐标(Y)进行回归,得方程为Y=157.226X+45.161(r=0.999 8),在0.5~500 μg/mL范围内呈良好的线性关系。分别以信噪比约3、10 时所对应的质量浓度为检测限、定量限,测得盐酸青藤碱两者分别为0.10、0.26 μg/mL。
2.3 专属性试验 取适量空白皮肤于生理盐水中浸泡5 min,取出后吸干水分并剪碎,加入10 mL纯水,搅拌60 min 后0.45 μm 微孔尼龙滤膜过滤,取续滤液,得到空白皮肤提取液。取空白皮肤提取液、100 μg/mL 对照品溶液、离子导入盐酸青藤碱后接收池溶液,在“2.1”项色谱条件下进样测定,结果见图1。由此可知,空白皮肤提取液杂质峰对盐酸青藤碱峰(保留时间约6 min 处)测定无干扰。
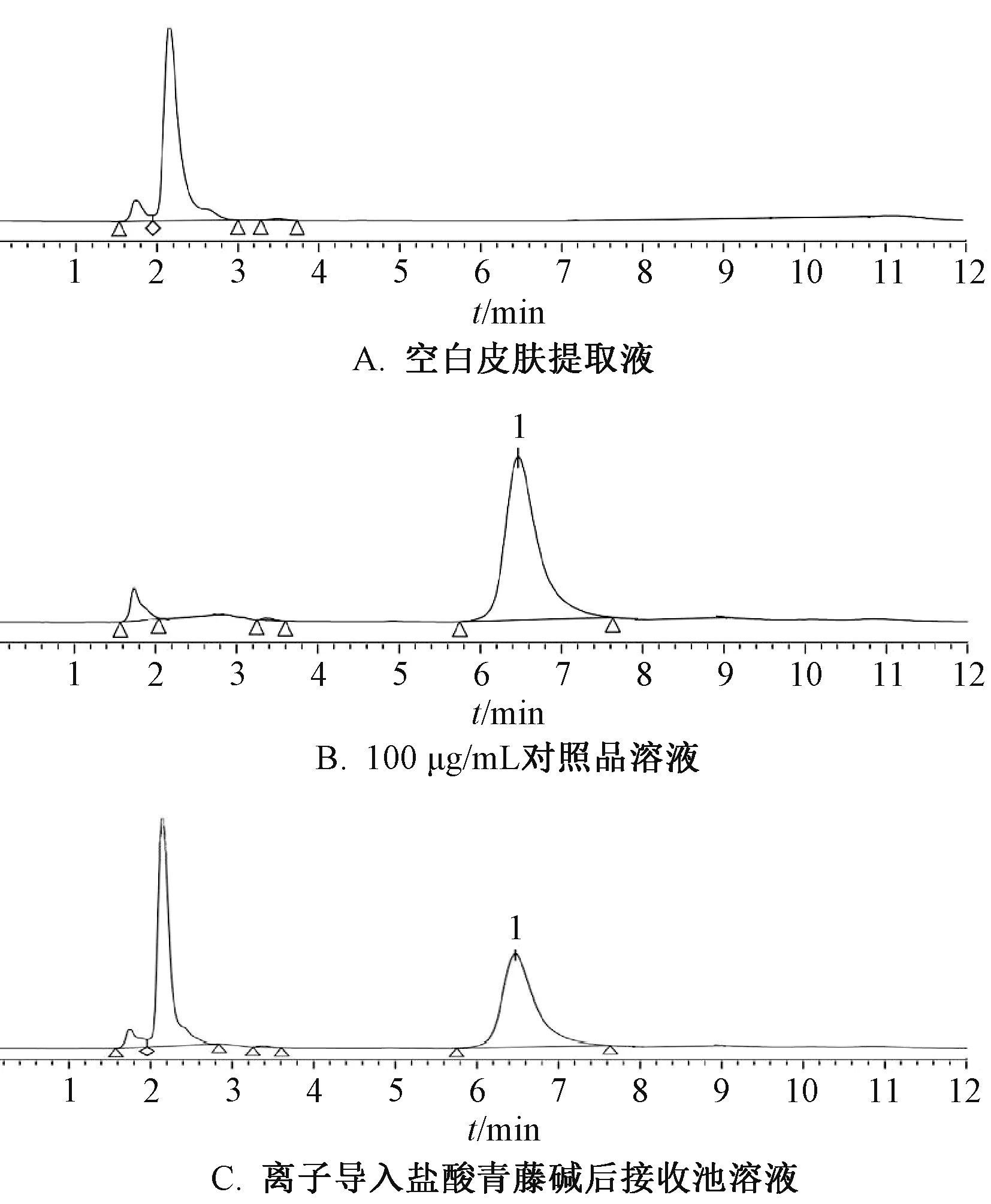
图1 盐酸青藤碱HPLC 色谱图Fig.1 HPLC chromatograms of sinomenine hydrochloride
2.4 精密度试验 精密吸取对照品溶液适量,用“2.1”项下流动相稀释成低、中、高质量浓度(0.5、5、50 μg/mL),每个质量浓度平行3 份,同一天内在“2.1”项色谱条件下进样测定,测得盐酸青藤碱日内精密度RSD 分别为1.58%、1.32%、0.90%;连续测定3 d,测得日间精密度RSD 分别为1.95%、1.53%、1.12%,表明该方法精密度良好。
2.5 重复性试验 精密称取盐酸青藤碱对照品25 mg,置于500 mL 量瓶中,用“2.1”项下流动相溶解并定容至刻度,作为供试品溶液,平行6份,在“2.1”项色谱条件下进样测定,测得盐酸青藤碱含量RSD 为1.69%,表明该方法重复性良好。
2.6 稳定性试验 取“2.5”项下供试品溶液1份,室温下于0、1、2、4、6、8 h 在“2.1”项色谱条件下进样测定,测得盐酸青藤碱峰面积RSD为0.67%,表明溶液在8 h 内稳定性良好。
2.7 加样回收率试验 精密吸取对照品溶液适量,用空白皮肤提取液稀释成低、中、高质量浓度(0.5、5、50 μg/mL),每个质量浓度平行3 份,在“2.1”项色谱条件下进样测定,计算回收率。结果,盐酸青藤碱平均加样回收率分别为98.2%、99.1%、99.6%,RSD 分别为1.74%、1.23%、1.05%。
2.8 稳定性影响因素研究
2.8.1 pH 值 精密称取盐酸青藤碱对照品25 mg,置于50 mL 量瓶中,分别用10 mmol/L MES 缓冲液(氢氧化钠溶液调pH 至5.5)、pH 7.4 的PBS缓冲液(含氯化钠8.0 g/L、磷酸二氢钾0.2 g/L、磷酸氢二钠2.9 g/L、氯化钾0.2 g/L)稀释定容至刻度,摇匀,室温下保存2、4、8 h 后取样,用“2.1”项下流动相稀释,在“2.1”项色谱条件下进样测定,计算盐酸青藤碱含量。结果,盐酸青藤碱含量在MES、PBS 缓冲液中8 h 内保持稳定,8 h后的剩余质量分数分别为99.96%、99.81%。因此,后续采用MES 缓冲液(pH 5.5)配制盐酸青藤碱作为给药池溶液,并以PBS 缓冲液为接收介质。
2.8.2 电流 参考文献[8] 报道,精密称取盐酸青藤碱对照品250 mg,置于25 mL 量瓶中,MES 缓冲液(pH 5.5)溶解定容至刻度,精密移取5 mL 至玻璃样品瓶中,样品瓶之间、样品瓶与阳极池或阴极池(阳极池、阴极池均含20 mL PBS缓冲液)之间都以盐桥(将3% 琼脂糖溶于0.1 mol/L氯化钠溶液,注入硅胶管冷却固化后形成)依次连接,以保持电路连通。
离子导入透皮给药的电流一般不超过0.5 mA/cm2,作用时间也维持在数分钟到数小时之内,以避免产生皮肤刺激。本实验通过Ag/AgCl电极连接直流电源,开通电流1.0 mA,于2、4、8 h后取样,用“2.1”项下流动相稀 释,在“2.1”项色谱条件下进样测定,计算盐酸青藤碱含量。结果,盐酸青藤碱在1.0 mA 电流下8 h 内仅发生轻微降解,实验结束时其剩余质量分数为98.12%,表明电流稳定性可以满足离子导入要求。
2.8.3 皮肤组织 参考文献[12] 报道,取新鲜猪皮,分别将其表皮侧或真皮侧向上,以检验盐酸青藤碱对两者的稳定性。垂直式Franz 扩散池固定,接收池中不加入液体[13],供给池中加入含10 mg/mL盐酸青藤碱的MES 缓冲液1 mL(pH 5.5),于2、4、8 h 后取样,用“2.1”项下流动相稀释后,在“2.1”项色谱条件下进样测定,计算盐酸青藤碱含量。结果,盐酸青藤碱含量在与新鲜猪表皮接触8 h 后基本保持稳定(99.37%),而与新鲜猪真皮接触8 h 后仅逐渐发生轻微水解(97.27%),表明该成分在透皮递送过程中可基本保持稳定。
2.9 体外透皮递送研究
2.9.1 方法 取新鲜猪耳,洗净后将其皮肤和软骨组织分离,用Stadie-Riggs 组织切刀除去皮下脂肪组织和部分不规则真皮组织,得到厚度约为1 mm的皮肤组织。用冲压模具取圆形皮肤组织,直径约3 cm,将其放入-80 ℃冰箱中冷藏备用,处理过程中应保证角质层的完整性。通过双臂垂直式Franz 扩散池(有效扩散面积为2 cm2),将皮肤固定在供给池与接收池之间,表皮侧向上,接收池中加入磁力搅拌子及12 mL PBS 缓冲液,保证皮肤真皮侧与接收液之间无气泡。将扩散池置于恒温循环水透皮扩散仪中,保证接收池大部分浸没在水面以下,控制温度32 ℃,转速200 r/min。实验开始前,供给池加入1 mL PBS 缓冲液,平衡30 min 后用移液枪吸出,纯水冲洗供给池3 次,加入供试液1 mL,每小时从接收池中取样0.8 mL,同时补充同温等量PBS 缓冲液,持续7 h。HPLC 法测定PBS 缓冲液中盐酸青藤碱含量,计算其各时间点累积透皮递送量 Qn,公式 为 Qn=(VCn+其中V 为接收液总体积(12 mL),Cn为第n 个时间点盐酸青藤碱含量,V0为每次取样体积(0.8 mL),A 为有效扩散面积(2 cm2)。以各时间点累积透皮递送量Qn对时间t 作图,得累积透皮曲线,并对其直线部分回归,所得斜率即为透皮稳态流量(J)。
2.9.2 pH 值对盐酸青藤碱透皮递送的影响 分别用MES 缓冲液(pH 5.5)或PBS 缓冲液(pH 7.4)配制10 mg/mL 供试液,被动扩散7 h 后,测得中性介质(PBS 缓冲液)中盐酸青藤碱累积透皮递送量为(8.93±1.67)μg/cm2,高于在弱酸性介质(MES 缓冲液)中的(6.10±0.88)μg/cm2(P<0.05),透皮曲线见图2。另外,实验期间均未出现盐酸青藤碱的透皮稳态流。
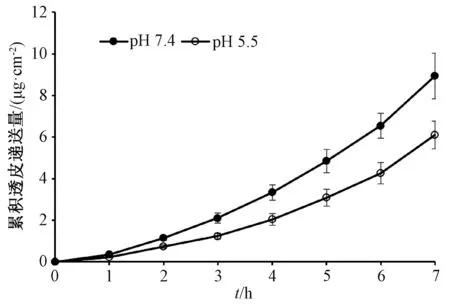
图2 pH 值对盐酸青藤碱透皮递送的影响Fig.2 Effect of pH value on transdermal delivery of sinomenine hydrochloride
2.9.3 化学促渗剂对盐酸青藤碱透皮递送的影响 用MES 缓冲液(pH 5.5)配制10 mg/mL 盐酸青藤碱溶液,加入5% 丙二醇或5% 二甲基亚砜,发现含5% DMSO 的盐酸青藤碱溶液7 h 累积透皮递送量约为不含DMSO 的16 倍[(97.43±13.14)μg/cm2vs(6.10±0.88)μg/cm2],并且添加5%PG 后7 h 内累积透皮递送量也显著升高[(38.82±5.45)μg/cm2],累积透皮曲线见图3,可知DMSO 的促渗效果略优于PG。
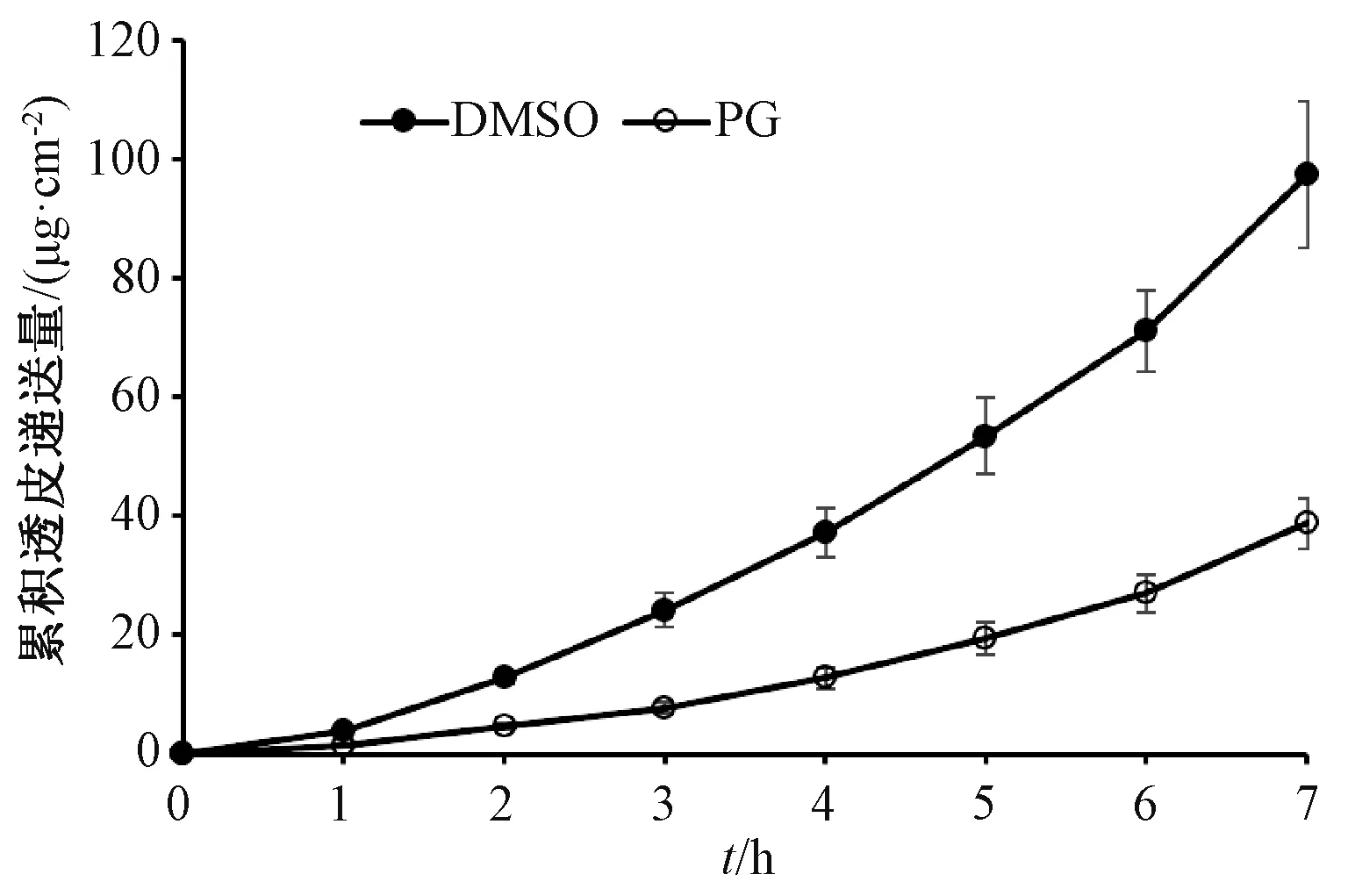
图3 化学促渗剂对盐酸青藤碱透皮递送的影响Fig.3 Effect of penetration enhancer on transdermal delivery of sinomenine hydrochloride
2.10 体外离子导入透皮递送研究
2.10.1 方法 离子导入透皮实验采用0.1~0.5 mA/cm2直流电[8]。皮肤组织用扩散池固定,表皮侧朝上,阳极池、接收池(也作为阴极池)分别加入PBS 缓冲液(pH 7.4)20、12 mL,其中接收池持续磁力搅拌。为降低离子导入过程中无机盐离子对药物离子的同离子竞争,用盐桥连接物理性分隔的阳极池和供给池,将Ag 电极、AgCl 电极分别插入阳极池、接收池。实验开始前,供给池加入1 mL PBS 缓冲液,平衡30 min 后用移液枪吸出,纯水冲洗供给池3 次,加入供试制剂[MES缓冲液(pH 5.5)制成5、10、20 mg/mL 盐酸青藤碱溶液] 1 mL,温度维持在32 ℃,打开直流电源开始实验,每隔一定时间从接收池中取样0.8 mL(迅速补充同温等量PBS 缓冲液),持续7 h,样品用“2.1”项下流动相适当稀释,在“2.1”项色谱条件下进样测定,按“2.9.1”项下方法测定累积透皮递送量及其稳态流量。实验结束后拆除装置,皮肤用流水冲洗10 s 以除去残留药液,吸水纸吸干表面水分后剪碎,加入10 mL“2.1”项下流动相持续搅拌12 h,提取皮肤组织内盐酸青藤碱,提取液经0.45 μm 微孔滤膜过滤,用“2.1”项下流动相适当稀释,在“2.1”项色谱条件下进样测定,计算盐酸青藤碱含量及其在皮肤内部的沉积量。
2.10.2 电流密度对盐酸青藤碱透皮递送的影响 用MES 缓冲液(pH 5.5)配制10 mg/mL 盐酸青藤碱溶液,在供给池中加入1 mL 后开通电流进行离子导入试验,电流密度分别设置为0.1、0.3、0.5 mA/cm2,结果见图4。由此可知,施加0.5、0.3、0.1 mA/cm2直流电7 h 后,其累积透皮递送量分别达(990.69±164.86)、(602.67±102.36)、(141.88±33.71)μg/cm2,比无电流施加时的(6.10±0.88)μg/cm2分别增加了约161、98、22倍,也远超“2.9.3”项下结果;通过离子导入作用,盐酸青藤碱可快速透过皮肤吸收,并在3 h 后达到稳态流量。
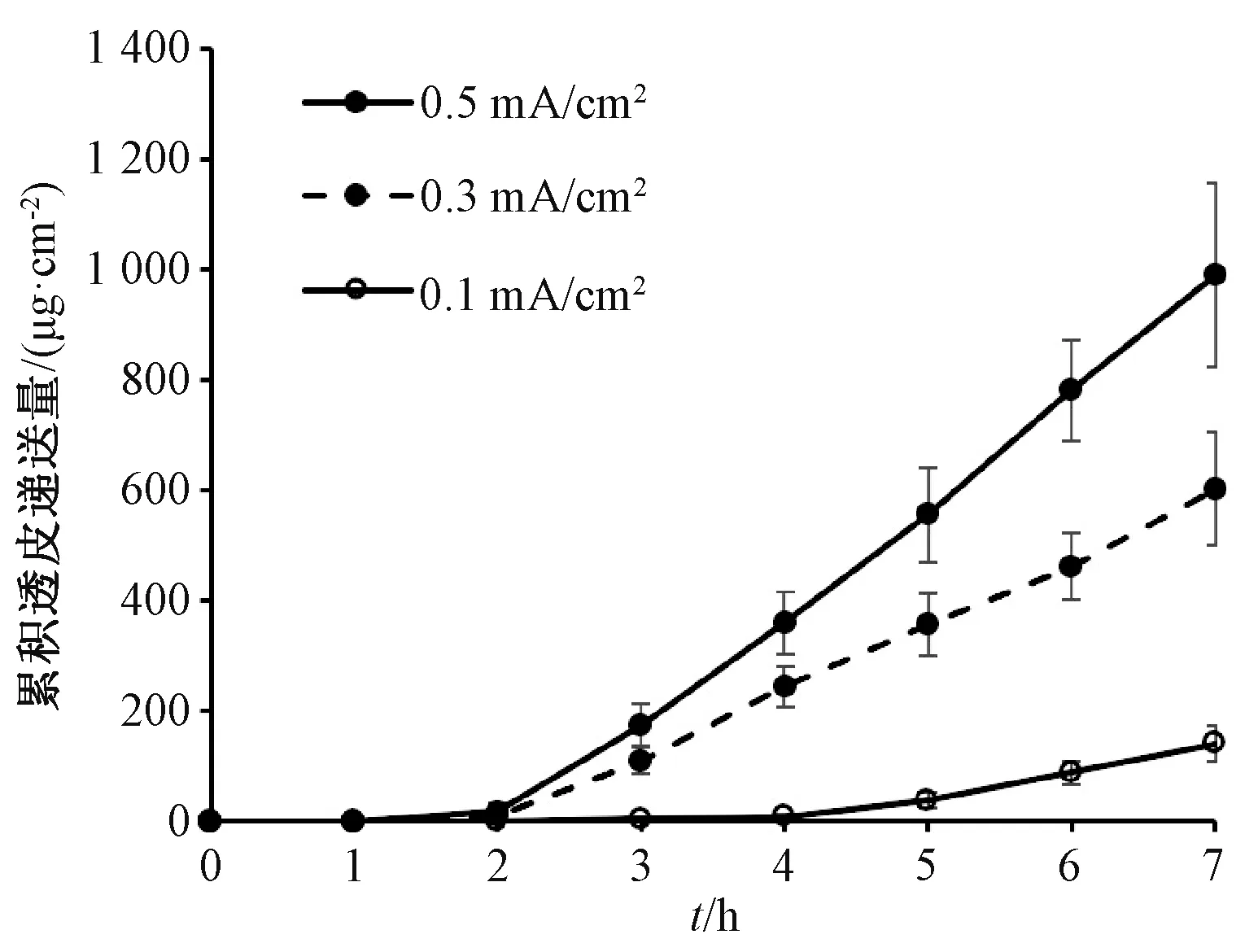
图4 电流密度对盐酸青藤碱透皮递送的影响Fig.4 Effect of current density on transdermal delivery of sinomenine hydrochloride
图5 显示,施加0.5、0.3、0.1 mA/cm2直流电后,3~7 h 的稳态流量分别为(203.92±32.18)、(123.07±33.45)、(44.37±11.53)μg/(cm2·h),回归方程J=205.25I-453.38(r=0.999 3),表明盐酸青藤碱的透皮递送速率可通过改变电流密度来精密调控,有利于实现精确的个体化给药;该成分皮肤沉积量分别为(1 588.80±263.78)、(708.69±250.20)、(340.36±110.44)μg/cm2,均高于相应电流下的累积透皮递送量,但并不与电流密度成正比。皮肤内部存在着大量沉积的盐酸青藤碱,这种药物贮库形式理论上可使其在电流停止后仍能从皮肤中缓慢释放进入体内。
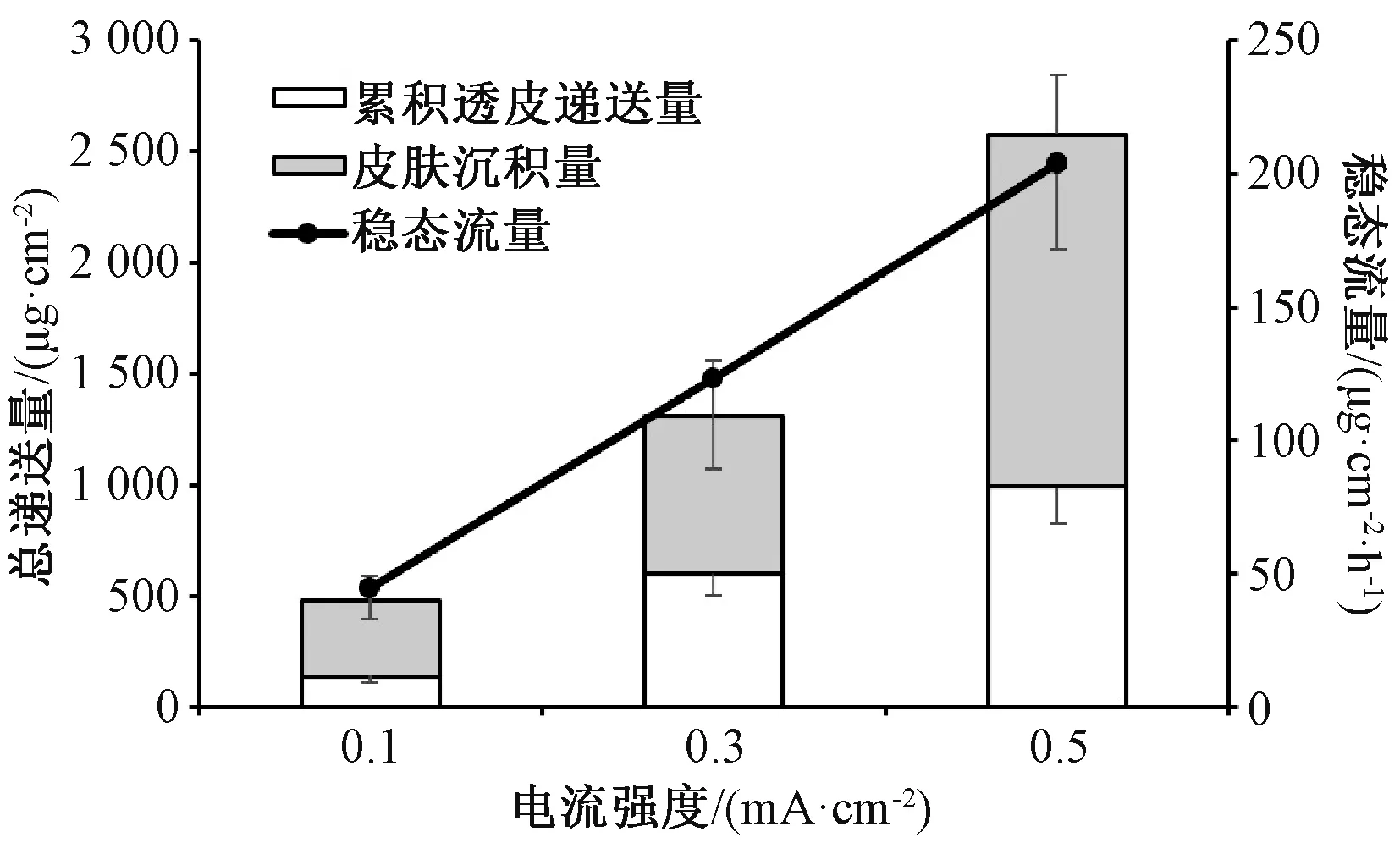
图5 电流强度对盐酸青藤碱总递送量、稳态流量的影响Fig.5 Effents of current density on total delivery and steady-state flux of sinomenine hydrochloride
2.10.3 质量浓度对盐酸青藤碱透皮递送的影响用MES 缓冲液(pH 5.5)配制5、10、20 mg/mL盐酸青藤碱溶液,在供给池中加入1 mL 后开通电流进行离子导入试验,设定电流密度为0.5 mA/cm2,结果见图6。由此可知,5、10、20 mg/mL 盐酸青藤碱溶液离子导入时,累积透皮递送量分别为(887.95±155.50)、(990.69±164.86)、(1 259.50±253.39)μg/cm2,差异无统计学意义(P>0.05);当盐酸青藤碱质量浓度为5、10 mg/mL 时,皮肤沉积量分别为(409.42±128.18)、(1 588.80±263.78)μg/cm2,虽然差异有统计学意义(P <0.05),但不与其质量浓度成正比。另外,在离子导入过程中使用了盐桥,排除了大量竞争性离子(如Na+)与药物共传递,可能是导致离子导入量与药物浓度不相关的重要原因[14]。

图6 质量浓度对盐酸青藤碱透皮递送的影响Fig.6 Effect of concentration on transdermal delivery of sinomenine hydrochloride
2.11 传导效率、递送效率研究 在离子导入过程中,盐酸青藤碱传导效率是荷正电盐酸青藤碱所传递电量占总输出电量的百分比,传导效率越高,表明该成分所载电荷在总输出电量中的份额越高。盐酸青藤碱递送效率是递送进入皮肤的药物量占初始给药量的百分比,递送效率越高,代表被利用的盐酸青藤碱份额越高。不考虑角质层被部分或全部破坏,在最高质量浓度(20 mg/mL)、最高电流密度(0.5 mA/cm2)下可获得最高的传导效率,但此时递送效率不是最高,而是出现在中低质量浓度盐酸青藤碱、最高电流密度时,即10 mg/mL、0.5 mA/cm2,见表1。
表1 离子导入盐酸青藤碱的总递送量、传导效率和递送效率(,n=5)Tab.1 Total delivery,transport efficiency and delivery efficiency of iontophoresis of sinomenine hydrochloride(,n=5)

表1 离子导入盐酸青藤碱的总递送量、传导效率和递送效率(,n=5)Tab.1 Total delivery,transport efficiency and delivery efficiency of iontophoresis of sinomenine hydrochloride(,n=5)
注:总递送量=皮肤沉积量+累积透皮递送量,传导效率=(总递送量对应的电荷量/总输出电量)×100%,递送效率=(总递送质量/供给池中的初始药物质量)×100%。与10 mg/mL、0.5 mA/cm2 比较,*P<0.05。
3 讨论
离子导入的突出优点是可快速可控地将目标化合物透皮递送[15-16]。盐酸青藤碱是镇痛、抗风湿的有效化合物,利用离子导入技术促进其透皮递送已有报道,但其机理和影响因素并未得到详细研究[11]。本实验使用了安全阈值之内的电流密度,并且在体外条件下对离子导入盐酸青藤碱的稳定性及影响因素进行了更详细的考察,证实了该技术可安全、有效、可控地增加其透皮递送量。
盐酸青藤碱的pKa为7.97,依据Henderson-Hasselbalch 方程,该成分在pH 5.5 的弱酸条件下有超过99% 的分子发生电离,适合离子导入,而在pH 7.4 的中性条件下主要以分子形式存在,故其被动吸收更适合中性介质。本实验在盐酸青藤碱的被动吸收中添加了促渗剂DMSO 和PG 以改变角质层的脂质排列,可增加该成分在皮肤内部的分配系数,从而在一定程度上增加透皮吸收。
离子导入一般受到电极、电流密度、药物浓度、角质层状态、载体材料等多种因素影响[15],本实验选择Ag/AgCl 作为电极,避免了使用Pt 电极时阳极池溶液pH 降低的情况[17]。通过调节电流密度,可快速正相关地改变盐酸青藤碱的透皮递送稳态流(r=0.999 3),有利于基于药械一体化的个体化给药。在供给池中存在竞争性离子(如Na+)时,药物离子导入透皮递送速率与电流密度成正相关[14],但由于Na+等离子的电动学活性远高于荷电药物分子,故会降低药物的传导效率和递送效率。本实验采取加入盐桥的方式,将供给池与含有更多竞争性离子的阳极池作物理性分隔,也取得了较好的传导效率(2.6%~6.1%)和递送效率(9.6%~51.6%),可为基于电辅助技术的盐酸青藤碱透皮给药制剂开发提供依据。
