超声辅助提取蝙蝠蛾拟青霉菌丝体多糖工艺优化及其理化性质
2021-06-18武忠伟张朝辉冷豆豆宋琳琳邱立友
武忠伟,张朝辉,冷豆豆,张 广,宋琳琳,王 斌,孟 丽,邱立友
(1.河南农业大学作物学博士后流动站,河南郑州 450046;2.河南科技学院博士后研发基地,河南新乡 453003;3.河南科技学院生命科技学院,现代生物育种河南省协同创新中心,河南新乡 453003)
在多种食药用真菌中,多糖组分由于具有抗氧化、免疫调剂、抗肿瘤、肠道菌群调节等作用,是生物资源开发的重要活性成分[1-3]。传统的如香菇多糖、云芝糖肽、灵芝多糖、虫草多糖、灰树花多糖等均有报道显示它们在体内外具有多种优良的生物活性,已成为多种功能性产品开发的重要来源[4-8]。蝙蝠蛾拟青霉(Paecilomyces hepiali)是从天然虫草生长后期分离出的一种重要内生真菌,从其菌丝体和发酵液中可分离到多种生物活性物质如腺苷类、皂甙类和多糖类[9-11]。研究表明,对于其所产生的多糖类成分,多项研究表明它在体内抗氧化、免疫调节、抗肿瘤方面具有较好的作用效果[12-14]。2005年已被我国卫生部列为可用于真菌类保健食品的开发名录[15]。
由于菌丝多糖常以糖蛋白的形式结合于真菌细胞壁上,传统采用高温水煮的方法加以提取,常存在提取时间长、能耗高、提取率低等特点[16]。研究表明,常见真菌多糖如松茸多糖、灵芝多糖和蝙蝠蛾拟青霉多糖等在高温水提时常需在90 ℃以上的高温提取1~3 h,且有时还需要提取多次,除了提取率低、耗能多外,高温长时间提取还会产生褐变反应,造成后期多糖脱色困难[12,16-18]。超声辅助提取法具有穿透力强、提取时间短、溶剂少等优点,以广泛应用于多种生物物质的提取过程中[19]。且有研究表明,超声提取所获得的生物活性多糖还具有较高温水提条件下更加优良的生物活性[6,20-22]。
为此,本研究分别采用单因素实验和响应面法对蝙蝠蛾拟青霉菌丝体多糖的超声辅助提取条件进行了优化,并采用多种理化分析手段对该菌丝体多糖的化学组成和分子量分布进行了测定,以期为该菌丝体多糖的开发利用提供技术参数和理论基础。
1 材料与方法
1.1 材料与仪器
蝙蝠蛾拟青霉菌丝体 为P.hepialiHN-1菌株经液体发酵后将发酵醪过滤洗涤、干燥粉碎后的菌丝体干粉,具体制备方法见1.2.1;牛血清白蛋白、1-苯基-3-甲基-5-吡唑啉酮(PMP)、葡糖糖醛酸、半乳糖醛酸、鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、重蒸酚、考马斯亮蓝、间羟联苯、钼酸铵、溴化钾 分析纯,美国Sigma公司;甲醇、乙腈 色谱纯,天津市四友精细化学品有限公司;NaH2PO4·2H2O、Na2HPO4·12H2O 分析纯,国药集团化学试剂有限公司。
ZWY-2102恒温振荡器、ZXSD-A1160生化培养箱 上海智诚分析仪器制造有限公司;FB224电子分析天平 上海舜字恒平科学仪器有限公司;GWS100型10 L机械搅拌通风发酵罐 镇江东方生物工程设备技术有限公司;L550型台式离心机湖南湘仪实验仪器开发有限公司;ZN04小型中药粉碎机 北京兴时利和科技发展有限公司;SB-500DYT超声破碎仪 宁波新芝生物科技有限公司;UV-2450紫外可见分光光度计 日本SHIMADZU公司;Agilent1100高效液相色谱仪(配有二极管阵列检测器、Instrument 化学工作站) 美国安捷伦公司。
1.2 实验方法
1.2.1 蝙蝠蛾拟青霉菌丝体干粉的制备 按参考文献[23]中所述方法进行培养,然后将所收获发酵醪用400目滤网过滤后,蒸馏水反复洗涤3次,分散于筛网上于70 ℃下烘干,后用85%的乙醇回流脱脂12 h后70 ℃下再次干燥,干燥后的菌丝体用中药粉碎机粉碎成干粉并过100目筛,备用。
1.2.2 蝙蝠蛾拟青霉菌丝体多糖(PHMPs)的超声辅助提取 精确称取5.000 g 上述蝙蝠蛾拟青霉菌丝体干粉放入三角瓶中,按不同液料比加入蒸馏水,在不同超声条件下提取多糖类物质,提取液于25℃条件下4000 r/min离心10 min后,加3倍无水乙醇于4 ℃条件下沉淀过夜,沉淀用80%的乙醇溶液反复洗涤3次后,加蒸馏水复溶。
1.2.3 多糖含量的测定及提取得率的计算 复溶后溶液中的多糖含量采用苯酚硫酸法[24]测定,具体先采用无水葡萄糖制作标准曲线,可得到含糖量质量浓度ρ(mg/L)与吸光度A 的回归方程:ρ=0.0086A+0.0097(R2=0.9994),用同样的方法测定样品中多糖含量。
PHMPs得率(%)按式(1)计算:
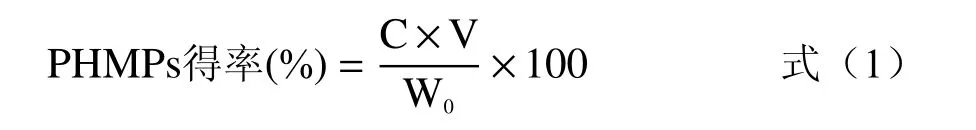
式中:C为提取液中多糖的含量(mg/L);V为提取液的体积(L);W0为样品干粉的质量(mg)。
1.2.4 单因素实验 以多糖得率为指标,在液料比30 mL/g,提取功率250 W,提取时间30 min,提取温度80 ℃为基础条件下,分别试验提取温度(X1,50、60、70、80、90 ℃), 提取时间(X2, 20、30、40、50、60 min),液料比(X3,20、30、40、50、60 mL/g)和超声功率(X4,200、250、300、350、400 W)对超声辅助提取PHMPs得率的影响。
1.2.5 响应面试验 根据单因素实验结果,采用Design-Expert.V8.0.6软件进行响应面试验设计,优化PHMPs的提取条件,具体因素和水平见表1。

表1 PHMPs提取工艺响应面试验因素与水平Table 1 Factors and levels of response surface methodology for PHMPs extraction
1.2.6 菌丝体多糖理化特征的测定 将1.2.2中所述的PHMPs多糖溶液真空冷冻干燥后,可得到PHMPs多糖干粉。对于该多糖干粉中的糖含量采用苯酚硫酸法测定[24];蛋白质含量采用考马斯亮蓝法测定[25],以牛血清白蛋白为标准品测定标准曲线,可得蛋白质量浓度ρ(mg/L)与吸光度A 的回归方程:ρ=0.0043A+0.0639(R2=0.9965);糖醛酸含量采用间羟联苯法测定[26],以葡萄糖醛酸为标准品,可得糖醛酸含量浓度ρ(mg/L)与吸光度A的回归方程ρ=0.0645A+0.0269(R2=0.9971);磷酸基含量采用钼酸铵-分光光度法测定[27],以KH2PO4为标准品,可得磷酸基含量浓度ρ(mg/L)与吸光度A的回归方程ρ=0.01A+0.0049(R2=0.9994)。
1.2.7 菌丝体多糖的红外光谱分析 采用KBr压片法测定PHMPs多糖样品的红外吸收光谱,具体操作为:取干燥后的KBr粉末100 mg左右在玛瑙研钵中研磨均匀后,用压片机压成薄片,然后置于傅立叶变换红外光谱仪上在4000~500 cm-1波数范围内进行背景扫描,然后将1 mg左右的PHMPs多糖样品于KBr粉末混匀后采用同样操作进行样品扫描。
1.2.8 菌丝体多糖分子量测定 采用高效液相凝胶渗透色谱法对不同组分多糖进行均一性和分子量测定,具体色谱条件为:色谱柱TSK-GEL G3000SWxlcolumn (7.8 mm×300 mm,5 μm);示差折光检测器(RID);流动相:0.1 mol/L的Na2SO4的磷酸缓冲液溶液(0.01 mol/L,pH6.8);流速1.0 mL/min,柱温25 ℃,进样量20 μL。以普鲁兰多糖P-800、P-400、P-200、P-100、P-20、P-10和 P-5作为标准品,以标准多糖分子量对数值Y为纵坐标,保留时间t为横坐标制作标准曲线(Y=-2.4046 t+22.29,R2=0.9964)。
1.2.9 菌丝体多糖的单糖分析 采用PMP柱前衍生化法测定多糖的单糖组成[28]。具体方法为先称量5 mg多糖样品配制成5 mg/L的多糖溶液,取100 μL加入具塞玻璃管中,再加入4 mol/L三氟乙酸100 μL封管,在110 ℃下水解2 h,冷却后重复加入200 μL甲醇于50 ℃下减压蒸干3次后,加100 μL去离子水溶解后;取溶解后的水解样品50 μL加入0.6 mol/L的NaOH溶液50 μL混合均匀后加入100 μL的PMP甲醇溶液混合均匀,于70 ℃下反应100 ℃,冷却后加入0.3 mol/L HCl 溶液中和反应并于50 ℃下减压蒸干后,加入1 mL蒸馏水溶解,后用氯仿反复萃取,萃取后的水相用0.45 μL的滤膜过滤后进行HPLC检测。
色谱条件:RP-C18柱(4.6 mm×250 mm,5 μm),流动相为0.1 mol/L 磷酸缓冲液(pH6.7):乙腈为83:17(V:V)的混合液,流速1.0 mL/min,柱温30 ℃,样品量20 μL,检测波长245 nm。
1.3 数据处理
实验数据采用Origin 8.0软件绘图,用SPSS 19.0软件进行数据分析,结果用“平均值±标准差”表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同提取温度对菌丝多糖得率的影响 在超声功率250 W、超声时间30 min、液料比30 mL/g的条件下,分别比较了不同提取温度50、60、70、80和90 ℃条件下对PHMPs得率的影响,结果见图1。PHMPs的得率随着提取温度从50 ℃增加至80 ℃不断增加。温度对多糖得率的促进作用可能是由于在高温条件下可以降低提取液的粘度和密度,从而促进多糖组分的溶出量[29]。另外,在高温条件下超声波的空穴效应及固液接触面积增加也可进一步增加多糖的提取效率[30]。此时,菌丝体多糖的得率为10.27%±0.28%。因此,进一步对温度的优化范围可选择在70~90 ℃之间。
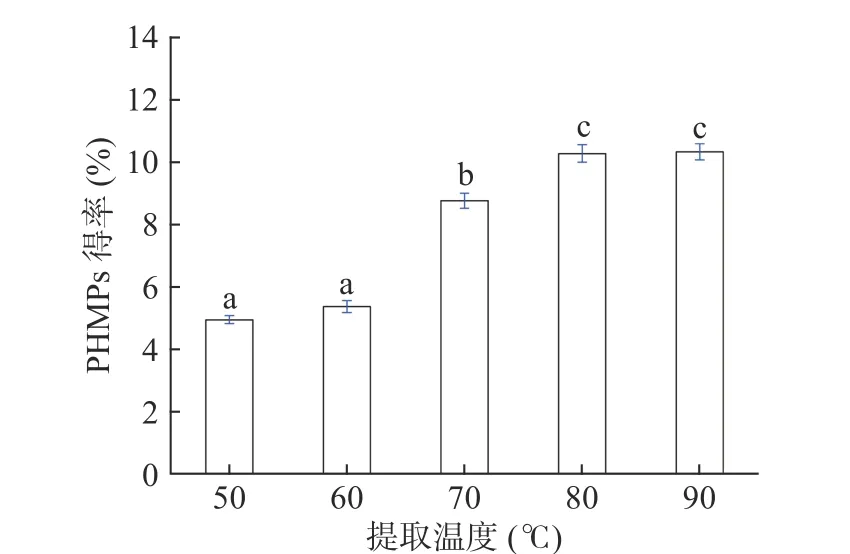
图1 提取温度对PHMPs得率的影响Fig.1 Effect of different extraction temperature on the yield of PHMPs
2.1.2 不同提取时间对菌丝体多糖得率的影响 在超声功率250 W、超声温度80 min、液料比30 mL/g的条件下,分别比较了不同提取时间20、30、40、50和60 min条件下对PHMPs得率的影响,结果见图2。随着提取时间增加至30 min后,多糖得率不再显著增加,且随着提取时间的延长,多糖得率还会出现减少趋势。这可能是由于超声条件下过长的提取时间会造成部分多糖水解从而降低多糖的得率[30]。因此选择超声时间为20~40 min的范围作为优化区间为宜。
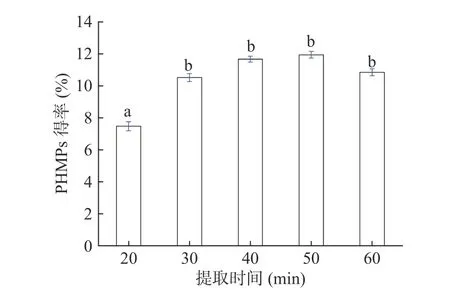
图2 提取时间对PHMPs得率的影响Fig.2 Effect of the different extraction time on the the yield of PHMPs
2.1.3 不同液料比对菌丝体多糖得率的影响 在超声功率250 W、超声温度80 min、提取时间30 min的条件下,分别比较了不同液料比20、30、40、50和60 mL/g条件下对PHMPs得率的影响,结果见图3。随着液料比不断增加,PHMPs的得率呈现逐步上升趋势,但当液料比增加至40 mL/g,则多糖的得率不再显著增加。因此,考虑提取溶剂和后期分离的节约性原则,初步选择30~50 mL/g作为进一步优化的取值区间。
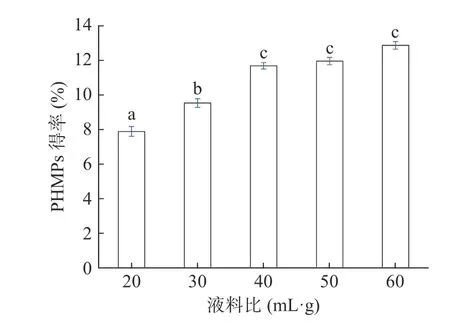
图3 液料比对PHMPs得率的影响Fig.3 Effect of different ratio of water to material on the yield of PHMPs
2.1.4 不同超声功率对菌丝多糖得率的影响 在液料比40 mL/g、超声温度80 min、提取时间30 min的条件下,分别比较了不同功率200、250、300、350和400 W条件下对PHMPs得率的影响,超声功率对菌丝体多糖得率的影响如图4所示。随着超声功率由200 W逐步增加至300 W,PHMPs的得率呈显著增加趋势(P<0.05),但随着超声功率的进一步增加,多糖的得率则有下降趋势。这可能是因为在低超声功率条件下,产生的细胞破碎效应可以提高多糖的溶出效果,但过高的超声功率则可能会造成PHMPs多糖的降解[31]。因此,进一步选择250~350 W作为进一步超声提取优化的取值区间。
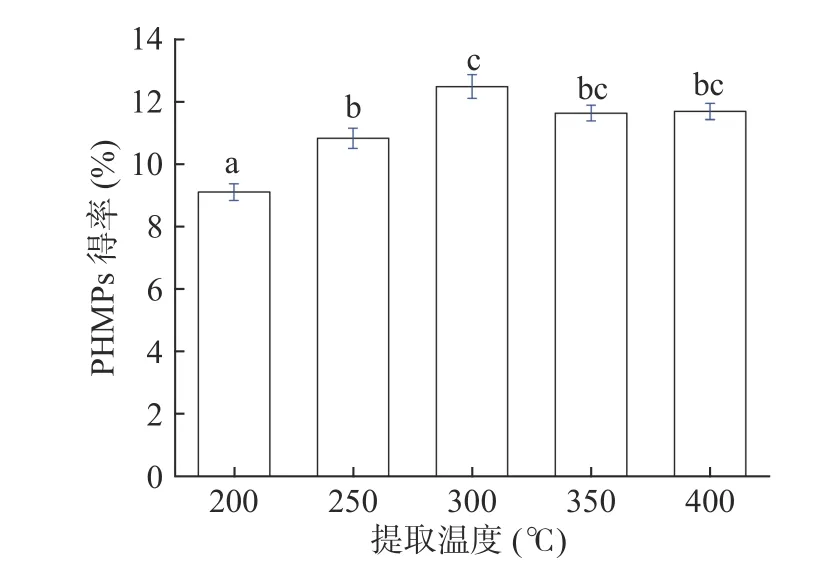
图4 超声功率对PHMPs得率的影响Fig.4 Effect of different ultrasonic power on the yield of PHMPs
2.2 响应面设计及结果分析
综合上述单因素实验结果,根据Box-Behnken原理,以PHMPs得率(Y)为响应值,通过响应曲面分析法优化提取条件。选取影响PHMPs得率的4个主要因素提取温度(X1)、提取时间(X2)、液料比(X3)和超声功率(X4)为自变量,采用四因素三水平共29个试验点的响应面分析试验。试验因素与水平设计及结果见表2。
对上述实验结果采用Design-Expert.V8.0.6软件进行回归拟合,可以得到如下二次多元回归方程:
Y=-165.239+2.709X1+0.810X2+0.453X3+0.291X4-4.375E-003X1X2+1.450E-003X1X3-9.900E-004X1X4+5.150E-003X2X3-1.175E-003X2X4+3.300E-004X3X4-0.014X12-4.63667E-003X22-9.587E-003X32-3.070E-004X42
对上述实验模型进行方差分析,结果如表3所示。可以看出,模型F值为6.82,P值为0.0005,表明该回归模型显著。失拟项的P值为0.1487,相对于纯误差不显著,表明该模型中各变量的变化范围可以用于预测菌丝体多糖产量。因素中X1、X2和X3的一次项和X12、X32和X42的二次项系数显著(P<0.05),但 X4,X22和交互项系数均不显著(P>0.05)。
2.3 响应面结果优化
进一步通过绘制响应面图以直观观察不同提取因素对提取得率的影响,结果如图5所示。X1X2、X2X4、X1X4也即提取温度和提取时间、超声功率和超声时间以及提取温度和提取时间之间的等高线图均成椭圆形,表明他们之间均有较强的交互作用。虽然二次方程系数方差分析不显著,这可能是由于因素设计时步长选择较小的原因。进一步通过软件优化可以得出最优的提取参数为:提取温度81 ℃,提取时间36 min,超声功率297 W、液料比44 mL/g。在此条件下,通过了5次重复试验进行了验证,其菌丝体多糖的平均得率为13.10%±0.22%,与预测值12.61%差异不显著(P>0.05),表明该回归方程可较好的预测菌丝体多糖提取得率。
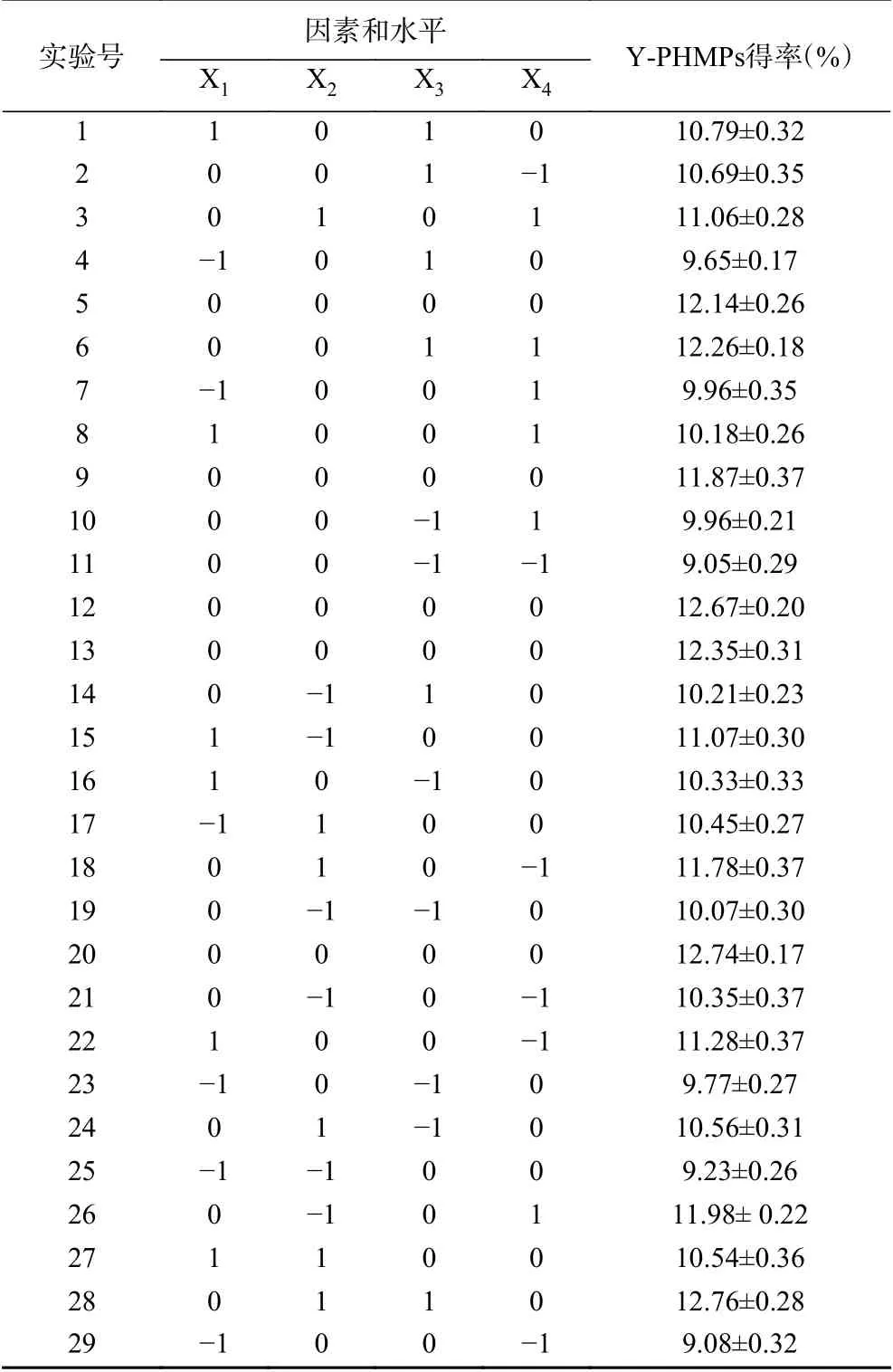
表2 菌丝体多糖得率的响应面实验设计及实验结果Table 2 Box-Behnken design matrix and response values for ultrasonic extraction yields of PHMPs
2.4 菌丝多糖理化成分分析
理化成分分析如表4所示,所提取的蝙蝠蛾拟青霉菌丝体多糖中中性糖含量在78.48%±2.08%,另外还含有9.82%±0.09%的蛋白成分。除此之外,该菌丝体多糖中还含有3.76%±0.11%的糖醛酸及2.23%±0.09%的磷酸基成分。
2.5 菌丝体多糖的红外扫描分析
由PHMPs的红外光谱图6可以看出,3392 cm-1处宽而强的吸收峰可归属为-OH的伸缩振动吸收峰,而2937 cm-1处的吸收峰是为烷基C-H的伸缩振动吸收峰,它们均为糖类物质的特征基团[32]。1654和1419 cm-1处的强吸收峰可归属为C=O的非对称伸缩和对称伸缩振动,表明该多糖中含有羧基基团[33]。1059 cm-1区域内出现的一组强吸收峰可归属为吡喃糖环上C-O-C的伸缩振动和C-O-H的变角振动[34]。910和760 cm-1处的吸收峰可作为D-吡喃糖的特征信号,816和880 cm-1处的吸收峰表明可能同时存在α和β两种构型的吡喃糖存在[35]。
2.6 分子量分布的测定结果
采用高效液相凝胶色谱法对菌丝体多糖的分子量分布进行了测定,结果如图7所示。经超声提取后蝙蝠蛾拟青霉菌丝体多糖的分子量分布主要由保留时间7.74和7.85 min的两个主峰及保留时间10.58~13.05 min的分子量呈连续分布的多糖组成。根据标准曲线,可计算出两个主峰的多糖分子量在638和575 kDa,另外还存在分子量在5.6~285 kDa范围呈连续分布的多糖组分。与报道文献[32]传统热水提取法相比,该多糖的分子量较水提法有一定降低,小分子量多糖比例有一定程度增加,这可能是由于超声提取过程中,对多糖有一定的降解作用造成的[36]。
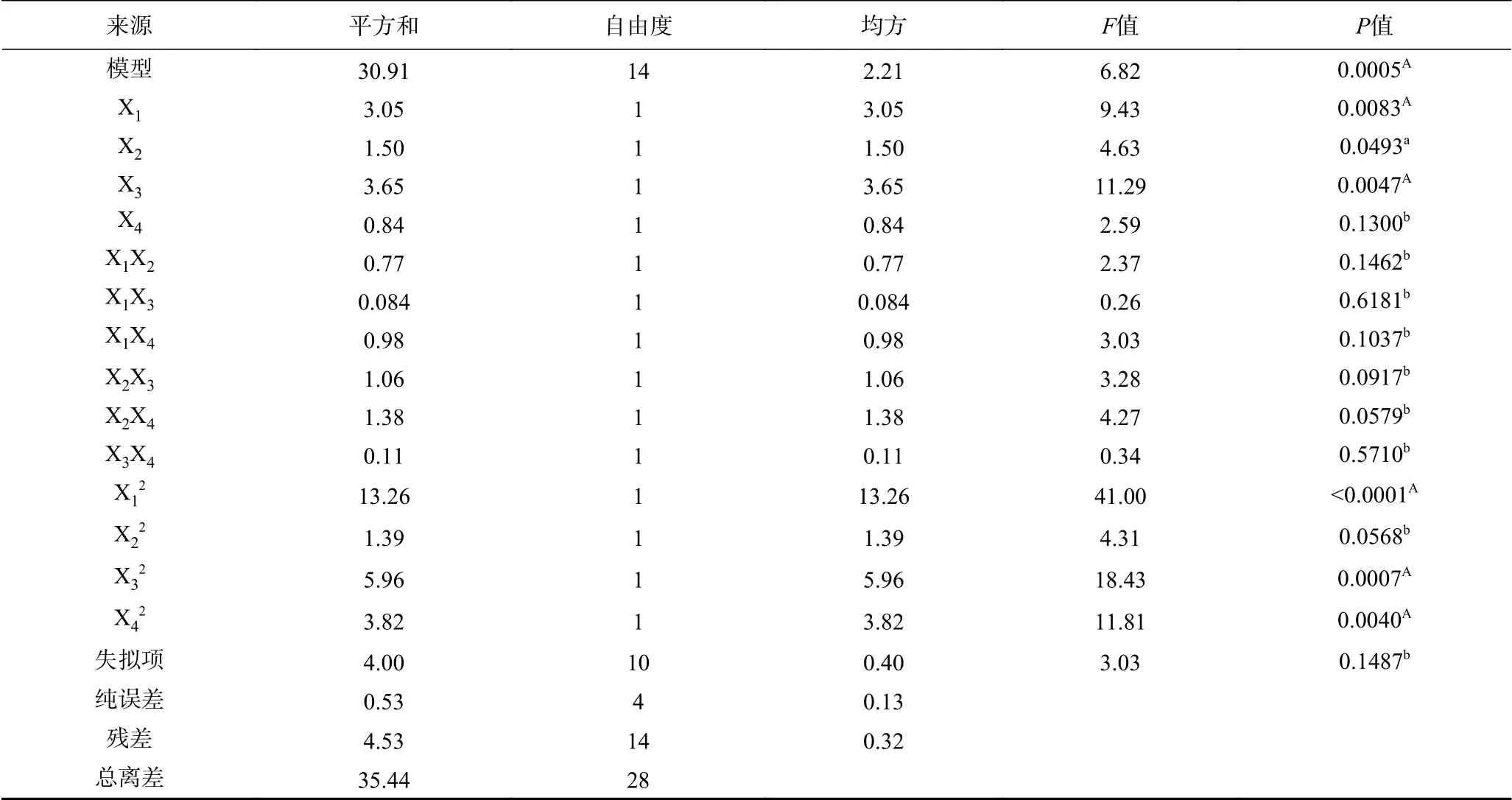
表3 响应面结果的方差分析Table 3 Variance analysis of response surface quadratic model for D-value
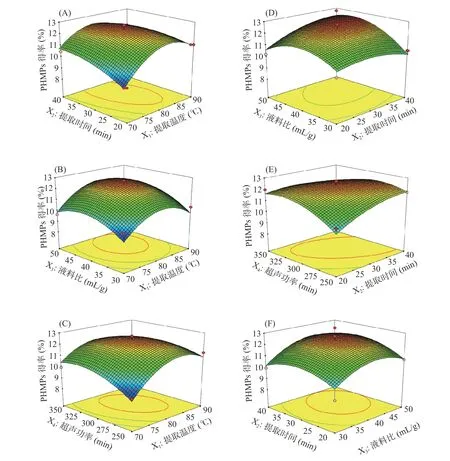
图5 不同超声提取因素对菌丝体多糖得率的相应面图Fig.5 Response surface plots showing the effects of variables and their mutual effects on the extraction yield of PHMPs

表4 菌丝体多糖的理化成分分析Table 4 Physicochemical components analysis of PHMPs
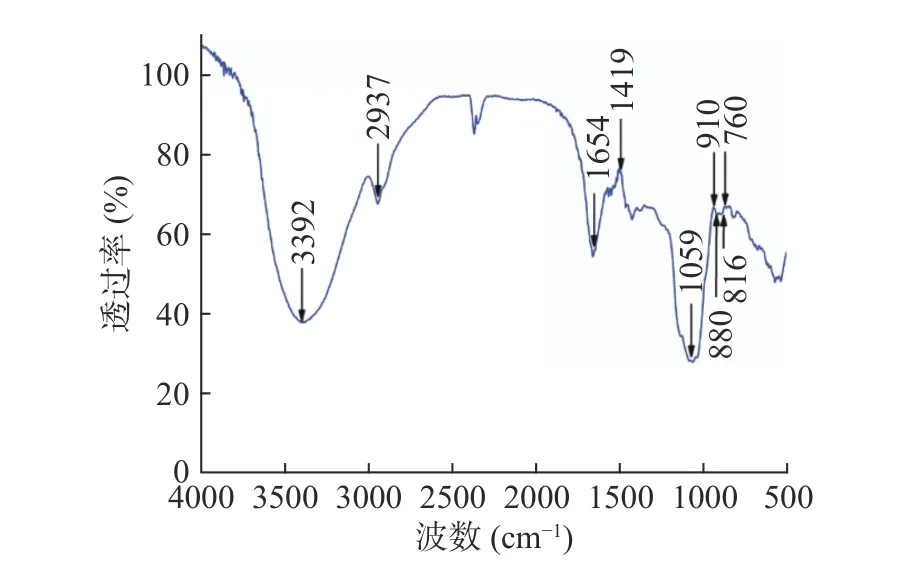
图6 PHMPs的红外光谱图Fig.6 FI-IR spectra of PHMPs
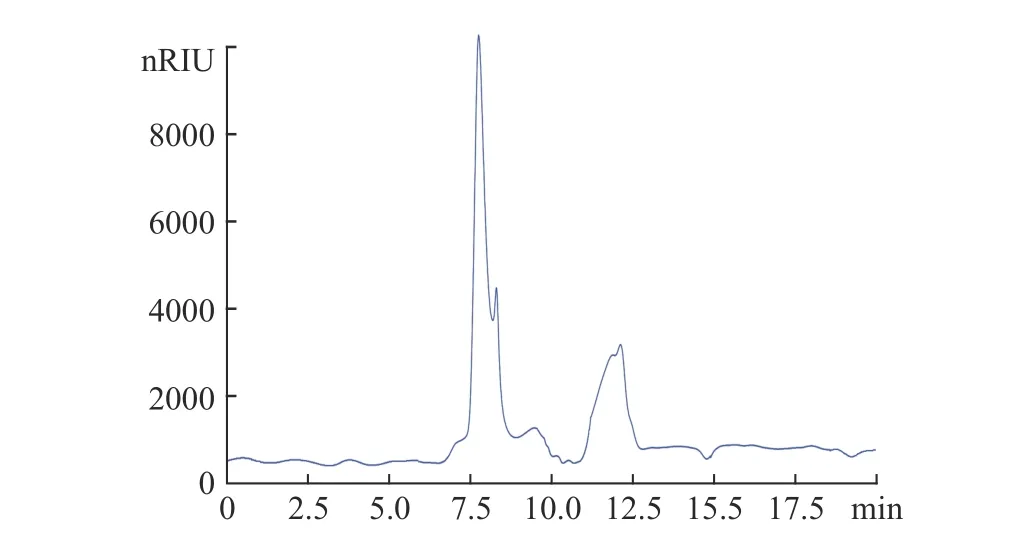
图7 PHMPs多糖的高效凝胶色谱图Fig.7 High-performance gel permeation chromatography showing the molecular weight distributions of PHMPs
2.7 菌丝体多糖的单糖组成分析
采用PMP-衍生化法测定了PHMPs多糖中的单糖组成,结果如图8所示。与单糖标准品的HPLC图谱对照,可发现PHMPs中主要由甘露糖、葡萄糖和半乳糖组成,它们的分子摩尔比在42.32:27.58:21.14,另外还含有少量核糖、鼠李糖、葡萄糖醛酸和半乳糖醛酸及阿拉伯糖,它们所占的分子摩尔比在0.42:2.89:2.25:1.16:2.24。该单糖组成与文献[37]所报道的单糖种类相似,但单糖比例有较大差异,这可能与菌株的培养条件和所用培养基不同有关。除此之外,可以发现PHMPs中的单糖组成与天然虫草多糖的单糖组成也较为接近[38]。
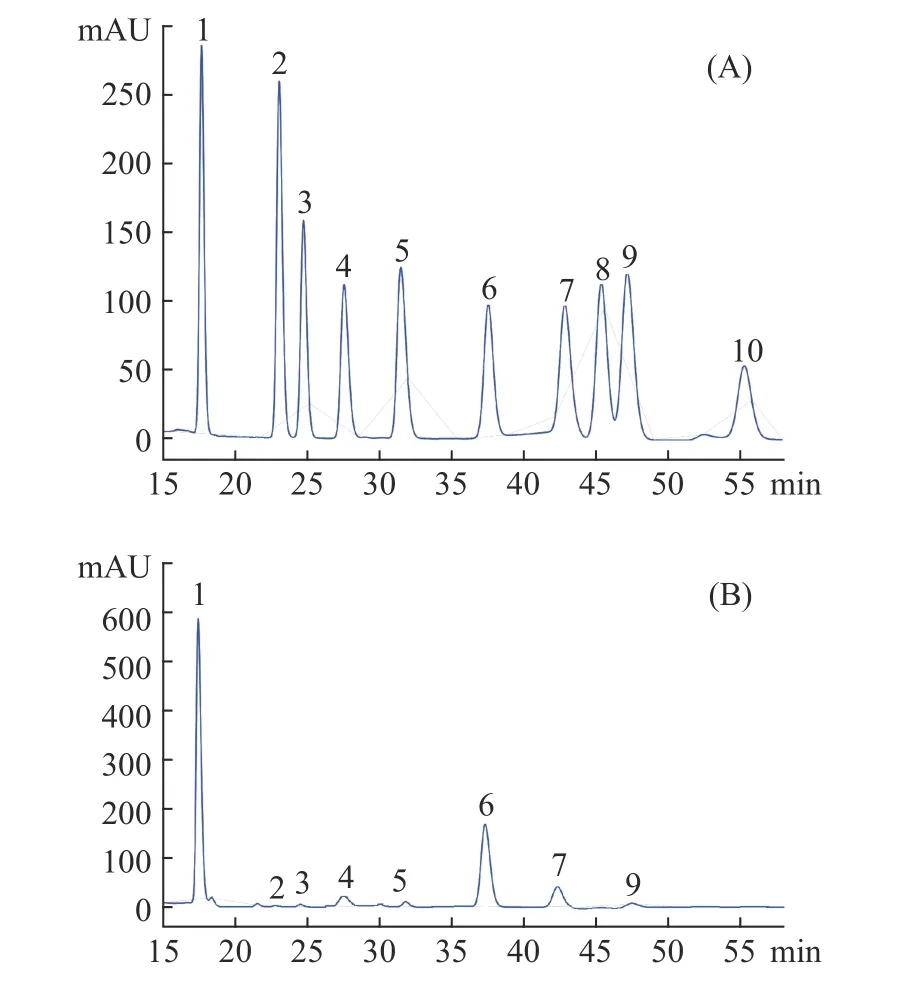
图8 PMP衍生化法测定标准品中的单糖组成(A)和PHMPs中的单糖组成(B)Fig.8 HPLC chromatograms of PMP derivatives of standard monosaccharides (A) and component monosaccharides released from PHMPs (B).
3 结论
通过单因素实验比较了不同提取温度、提取时间、提取功率和液料比对蝙蝠蛾拟青霉菌丝体多糖的提取效果,通过响应面设计优化确定出了蝙蝠蛾拟青霉发酵菌丝体多糖的最佳的超声提取参数为:提取温度81 ℃, 提取时间36 min, 超声功率为297 W,水料比为44 mL/g。在此条件下,菌丝体多糖的提取得率为13.10%±0.22%。
理化分析表明,菌丝体多糖中除含有78.48%±2.08%的糖组分外,还含有9.82%±0.09%的蛋白成分及3.76%±0.11%、2.23%±0.09%的糖醛酸和磷酸基成分;红外光谱分析表明,该多糖具有多种糖类官能团的吸收特征,分子量分布显示该多糖由分子量为638和575 kDa的两个主峰和部分5.6~285 kDa小分子量多糖组成;单糖组成分析表明,PHMPs主要由分子摩尔比为42.32:27.58:21.14的甘露糖、葡萄糖和半乳糖组成,另外还含有少量分子摩尔比为0.42:2.89:2.25:1.16:2.24的核糖、鼠李糖、葡萄糖醛酸和半乳糖醛酸及阿拉伯糖。
