添加不同物质冻藏对鲤鱼肌肉蛋白功能性的影响
2021-06-18李艳青鹿保鑫
李艳青,郭 畅,郑 云,鹿保鑫
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
冷冻鱼糜是将鱼肉经过清洗、采肉、漂洗、脱水等工序制得的初加工鱼肉制品,将冷冻鱼糜擂溃、调味后,利用不同方式成型后进行加热处理,得到的水产制品即为鱼糜制品[1]。鱼糜制品种类丰富,具有高蛋白、低脂肪的特点,因此深受消费者青睐。冷冻鱼糜的生产原料很丰富,可以是海水鱼,也可是淡水鱼,在我国淡水渔业中,鲤鱼所占比例相当大,因此,利用鲤鱼生产鱼糜制品具有广阔的前景[2]。鱼糜经过冻结和长期的低温贮藏,极易发生品质劣变,引发品质劣变的主要原因是蛋白质由于周边的结合水冻结后发生冷冻变性,失去鱼糜的特性,具体表现为肉质发生变化,如失去柔性、保水性降低、凝胶形成能下降等。这些现象可以通过添加冷冻变性抑制物质来缓解,现常用的抑制剂有砂糖、山梨醇、聚合磷酸盐等物质,统称为抗冻剂[3]。除此之外,冷冻鱼糜在冷冻贮藏过程中,蛋白酶引发的蛋白质降解、蛋白质发生氧化、脂肪发生氧化等也容易引起冷冻鱼糜品质的劣变[4],其中由肌肉蛋白质氧化引起的蛋白功能特性变化近些年引起人们极大的关注。有研究表明,蛋白质氧化首先导致其结构的改变,如羰基衍生物的生成、氨基酸残基的暴露、蛋白质的聚集以及肽链的断裂等[5],进而引起蛋白质功能特性如乳化性、凝胶特性、持水性等发生显著的改变[6-8]。
目前国内外已有一些关于冷冻鱼糜蛋白质氧化的研究报道,主要表现在鱼糜在长时间的冻藏过程中,蛋白质发生氧化反应会导致其功能特性下降,从而给食用口感和营养价值带来负面的影响[9-11],但关于如何阻止淡水鱼糜在冷冻过程中蛋白质氧化的研究还相对较少,本文主要针对如何抑制鱼糜冷冻过程中发生的蛋白质氧化进行研究,从而保证鱼糜优良品质。目前食品工业中主要应用抗氧化剂来抑制食品发生氧化反应,使用的氧化剂有合成抗氧化剂,如二叔丁基羟基甲苯(Butylated Hydroxytoluene,BHA)、叔丁基羟基茴香醚(BHA)、没食子酸丙酯(PG)、及TBHQ等,以及天然氧化剂,如香辛料和中草药提取物,茶多酚,抗氧化蛋白多肽等。本实验将两种不同的抗氧化剂代表(PG和乳清蛋白水解肽)结合抗冻剂加入冷冻鱼糜中,研究二者对鱼肉蛋白在冻藏过程中发生的氧化反应有何作用,寻求抑制鱼糜品质劣变的新途径。
本试验前期研究了鲤鱼鱼糜添加不同抗冻剂和抗氧化剂后冻藏过程中肌原纤维蛋白理化特性发生的变化,主要表现在随着冻藏时间的延长,肌原纤维蛋白质羰基含量升高、总巯基含量逐渐降低,蛋白质溶解度下降,表明鲤鱼肌原纤维蛋白在冷冻贮藏过程中发生了氧化变性,导致其理化性质和结构发生变化[12]。结构的变化与其功能性质密切相关,因此本试验主要研究冷冻鱼糜在冻藏过程中添加抗冻剂和两种抗氧化剂对鱼糜肌原纤维蛋白功能特性的影响,对提高冷冻鱼糜的品质具有一定的理论指导意义。
1 材料与方法
1.1 材料与仪器
新鲜鲤鱼(1.5 kg)、金龙鱼大豆油 购买于本地超市;氯化钠、磷酸钠 分析纯,天津市化学试剂一厂;蔗糖、山梨醇 分析纯,黑龙江万太生物试剂公司;十二烷基磺酸钠(SDS) Sigma试剂公司;乳清蛋白水解肽 实验室自制冻干品。
GL-12M型冷冻离心机 上海卢湘仪离心机仪器有限公司;电色ZE-6000型色差仪 日本电色公司;TA-XT plus型质构分析仪 英国Stable Micro System公司;MAL1038384型流变仪 英国马尔文有限公司;S-3400N型扫描电镜 日本日立公司。
1.2 实验方法
1.2.1 样品处理 尸僵后的鲤鱼采肉后在低温下(0~4 ℃)处理成鱼糜,经漂洗后分成4大份(每份约为800 g),分别加入:未添加(对照)、添加抗冻剂、添加抗冻剂;+PG(0.2%)、添加抗冻剂+乳清蛋白水解肽(1.0%),搅拌均匀后的鱼糜,随机分成15小份(每份约为50 g),封口后放置于-25 ℃,经0、30、60、90和180 d后,从每个样品中随机取3份测定肌原纤维蛋白的乳化性、凝胶特性和流变学特性。
1.2.2 鲤鱼肌原纤维蛋白的提取 参照Chin等[13]的方法提取肌原纤维蛋白。取适量冷冻鱼糜加入4倍体积的20 mmol/L的冰磷酸盐缓冲溶液匀浆2次(每次30 s)后置于4 ℃冷冻离心机中,8000×g离心10 min,取沉淀用4倍体积的pH7.5、20 mmol/L的磷酸盐缓冲溶液清洗3次,再次冷冻离心,所得沉淀即为肌原纤维蛋白样品。
1.2.3 肌原纤维蛋白乳化性的测定 采用浊度法[14]测定鲤鱼肌原纤维蛋白的乳化性。乳化活力(EAI)和乳化稳定性(ESI)分别由下面公式来表示:
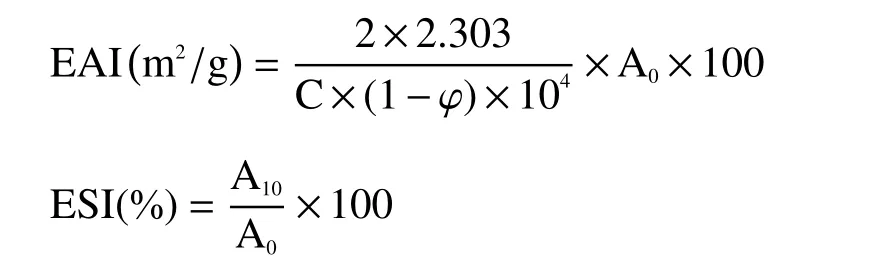
式中:φ为油相体积分数(v/v)(φ=0.2);C为蛋白质浓度;A0、A10为乳状液在0 min、10 min时在500 nm处的吸光值。
1.2.4 鲤鱼肌原纤维蛋白凝胶性测定
1.2.4.1 凝胶质构的测定 制备凝胶参照文献[2],以质构剖面分析方法测定其凝胶的硬度和弹性[2,15]。
质构仪参数设定如下:探头型号为P/0.5(直径为12 mm),物性仪重力传感器选择5 kg,下压距离为10 mm(变形率为40%),测试速度为120 mm/min,每个样品进行三次平行试验,取平均值。
1.2.4.2 凝胶白度值的测定 测凝胶定L、a、b值,利用如下公式计算凝胶白度值:
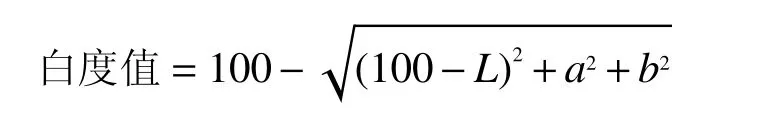
1.2.4.3 肌原纤维蛋白凝胶保水性测定 肌原纤维蛋白根据Salvador等[16]的方法并做适当的修改后测定。
在50 mL的离心管底部称取5 g蛋白凝胶,3000 r/min离心10 min后称重。WHC计算公式如下:
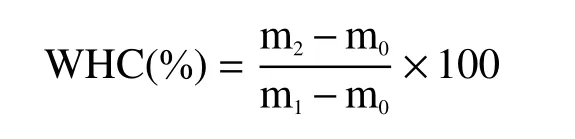
式中,m1,m2为离心前后的重量,g;m0为空离心管的重量,g。
1.2.4.4 凝胶微观结构的观察 凝胶微观结构观察参照王博等方法进行[17]。取待测凝胶样品,固定化处理后,冷冻干燥。扫描时将凝胶样品切片后放置于样品台上,用E-1010(Giko)型离子溅射镀膜仪在样品表面镀上一层15 nm厚的金属膜,将样品放入样品盒中,放大1000倍条件下进行扫描拍摄。
1.2.5 流变学特性测定 肌原纤维蛋白动力流变学特性测试方法参照杨振等[18]的方法。用0.1 mol/L NaCl将提取的鲤鱼肌原纤维蛋白稀释至40 mg/mL后置于检测平板上(直径为60 mm)。
参数设定如下:平行板间的空隙选择1 mm,温度范围为30~85 ℃,加热速率为1 ℃/min,并在85 ℃保持10 min,振荡频率设定为1 Hz,应力振幅为0.02。
1.3 数据分析
除电镜实验外,所有实验重复三次取平均值,数据分析用Statistix 10.0进行,通过Turkey test程序进行平均数之间显著性差异(P<0.05),采用Sigmaplot 12.0作图。
2 结果与分析
2.1 肌原纤维蛋白乳化性的变化
在冻藏过程中,添加不同物质的鱼糜肌原纤维蛋白乳化活性变化如图1A所示。如图可知,随着冻藏时间的增加,各组样品的乳化活性都呈不断下降趋势,乳化活性的降低是由于肌原纤维蛋白在长时间冻藏过程中发生冷冻变性和氧化变性,导致肌球蛋白发生交联,从而丧失了表面吸附脂肪颗粒的能力[2]。添加抗冻剂和抗氧化剂后,在冻藏90 d时,添加抗氧化剂的两组样品的乳化活性高于对照组(P<0.05),但是在冻藏180 d,添加乳清蛋白水解肽的样品的乳化活性略低于对照组,以上结果说明,添加抗氧化剂对蛋白氧化变性起到了很好的抑制作用,有效延缓了蛋白结构的变化,从而保护肌原纤维蛋白的乳化活性,但长期冻藏时(>180 d),添加乳清蛋白水解肽作为抗氧化剂效果较差。
不同样品冻藏过程中肌原纤维蛋白乳化稳定性发生的变化如图1B所示。其变化趋势和乳化活性相似,即随着冻藏时间的增加,样品的乳化稳定性不断降低。从实验结果可知,冻藏90 d之前,各组试样乳化稳定性下降趋势较平缓,说明添加抗冻剂和抗氧化剂对蛋白结构起到较好的保护作用,当冻藏时间达到180 d时,各组试样的乳化稳定性下降明显,甚至低于对照组,说明长时间冻藏后肌原纤维蛋白原有的稳定结构被破坏严重,导致蛋白质发生交联和聚集[12],因此不能作为有效的表面活性剂,从而降低了蛋白的乳化稳定性。
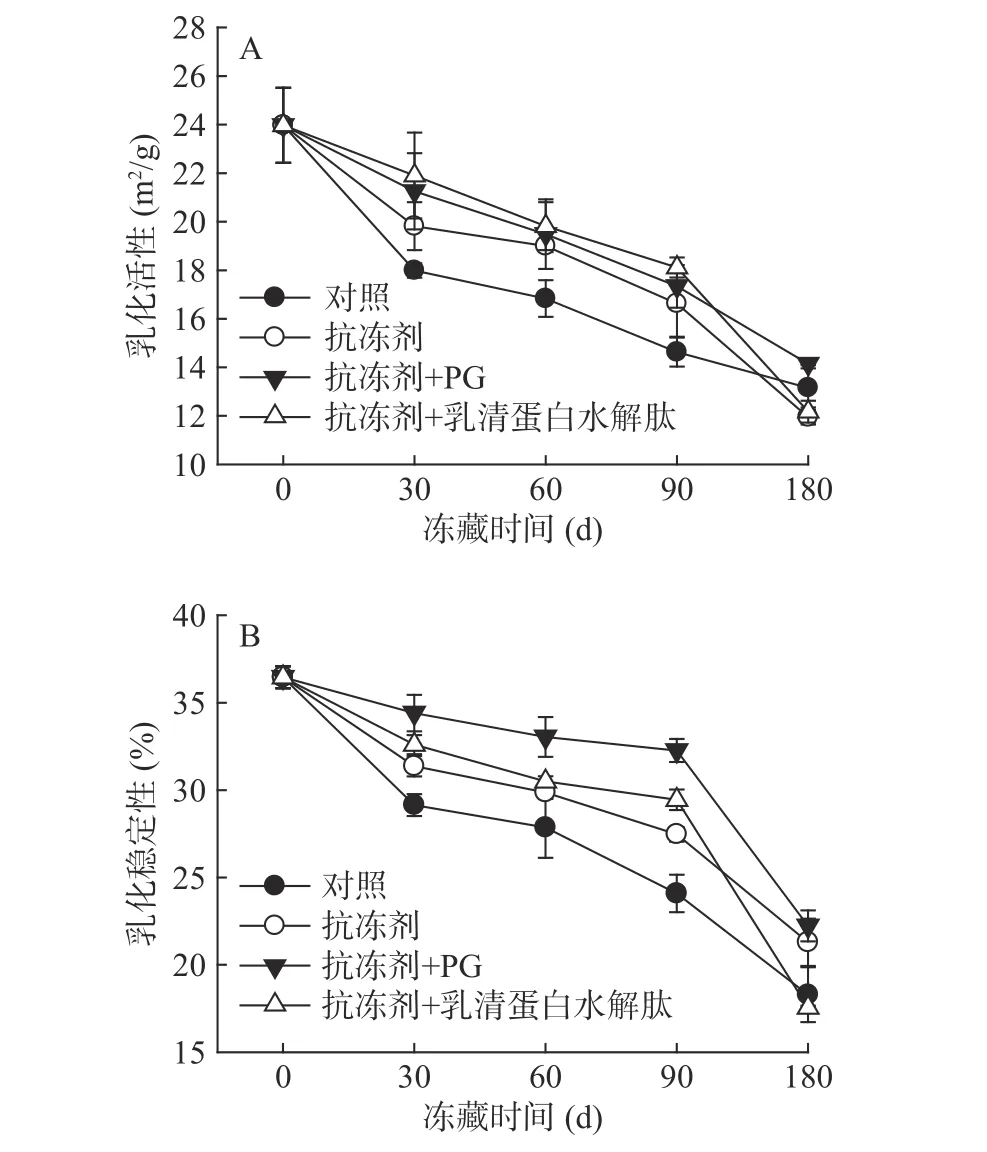
图1 鲤鱼肌原纤维蛋白乳化活性和乳化稳定性的变化Fig.1 Changes of EAI and ESI of common carp MP
2.2 肌原纤维蛋白凝胶性的变化
2.2.1 凝胶质构(TPA)的变化 添加不同物质后冻藏的鲤鱼肌原纤维蛋白凝胶弹性和硬度的变化如图2所示,二者变化趋势相似。从图中可以看出,随着冻藏时间的增加,四组试样的凝胶弹性和硬度都呈不断下降的趋势,如经过180 d冻藏后,对照组、添加抗冻剂组、添加抗冻剂+PG组、添抗冻剂+WPI水解肽组试样凝胶弹性分别降低了47.5%、38.9%、28.6%和34.8%,凝胶硬度分别降低了55.3%、59.2%、42.0%和46.8%,由图还可得出,添加两种抗氧化剂组试样的凝胶弹性和硬度始终优于对照组试样和添加抗冻剂试样(P<0.05)。
冻藏后鲤鱼肌原纤维蛋白凝胶特性的持续下降,主要是由于蛋白质氧化变性导致肌球蛋白间的交联作用减弱,未能形成良好的三维网络结构,蛋白凝胶形成能力下降[19-20]。而抗氧化剂的加入能有效抑制蛋白质氧化的发生,减缓了蛋白质凝胶弹性和持水能力的下降。
2.2.2 凝胶保水性和白度的变化 图3A是添加不同物质冻藏过程中冷冻鱼糜肌原纤维蛋白凝胶保水性的变化。如图所示,四组试样的凝胶保水性随着冻藏时间的延长不断下降,两组添加抗冻剂+抗氧化剂试样的凝胶保水性高于对照组(P<0.05),实验结果表明添加抗冻剂和抗氧化剂后冻藏的鲤鱼肌原纤维蛋白凝胶具有更高的持水性,这意味着形成的凝胶具有更好的三维网状结构。冻藏过程中凝胶保水性降低的主要原因是蛋白质在氧化过程在中发生了羰氨反应,导致维持三维网状结构的氢键形成能力下降[21],加入抗氧化剂抑制了蛋白质发生氧化,从而使得蛋白变性程度较小,因此呈现较好的保水性。

图2 鲤鱼肌原纤维蛋白凝胶弹性和硬度的变化Fig.2 Changes of gel springiness and hardness of common carp MP
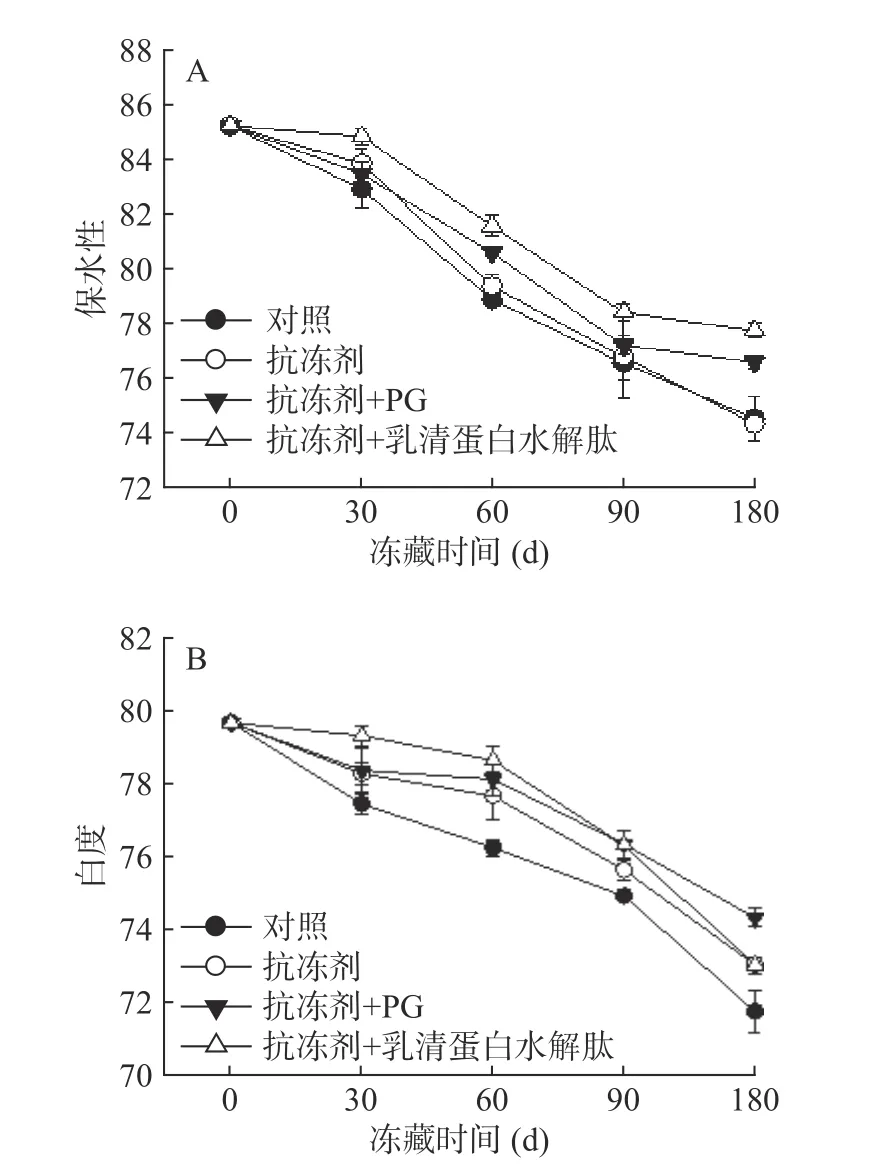
图3 鲤鱼肌原纤维蛋白凝胶保水性和白度的变化Fig.3 Changes of gel water holding capability and whiteness of common carp MP
图3 B是添加不同物质后冻藏过程中鲤鱼肌原纤维蛋白凝胶白度的变化。由图可知,随着冻藏时间的增加,四组样品的凝胶白度值均呈不断下降趋势,添加抗冻剂+抗氧化剂组试样的凝胶白度值始终大于对照组,且差异显著(P<0.05)。凝胶白度值的降低可能是由于冷冻贮藏过程中肌肉蛋白氧化引起的,也可能是由于脂肪氧化引起色素蛋白与肌肉蛋白交联引起的[22]。在相同冻藏条件下,添加抗冻剂和抗氧化剂试样白度值高于未添加抗冻剂试样是因为二者在一定程度上抑制了鲤鱼鱼糜肌原纤维蛋白的氧化。
2.2.3 凝胶微观结构的变化 如图4所示,新鲜肉(图4F)提取蛋白形成的凝胶组织状态好,凝胶表面光滑,孔洞均匀、细致,蛋白束平滑,具有良好的三维网状结构。经过冻藏后样品提取的肌原纤维蛋白形成凝胶的微观结构出现了不同程度的损伤。图中A组(对照组)随着冻藏时间的延长,凝胶微观结构变化最为严重,凝胶网状结构逐渐疏松、不均匀,蛋白质束出现断裂,冻藏180 d时,凝胶网状结构凝断裂严重,出现塌陷。B组(抗冻剂)随着冻藏时间的延长,凝胶微观结构也发生不同程度的损伤,180 d时凝胶微观结构发更明显的断裂并出现更大的孔洞,而添加抗氧化剂的两组样品(图4C和图4D),随着冻藏时间的延长,凝胶结构虽然也发生不同程度的破损,但冻藏30和90 d后,凝胶结构明显优于A和B组,冻藏180 d时,凝胶网状结构也出现大小不等的孔洞并发生断裂。
从总体来看,所有样品经过不同时间的冻藏其凝胶结构都有不同程度劣化,但添加PG和蛋白水解肽的样品凝胶结构变化相对较小,尤其是在短时间冻藏(<90 d),说明二者可以在冻藏过程中防止蛋白质氧化,从而起到保护蛋白质凝胶结构的作用。
2.3 添加不同抗冻剂冻藏对鲤鱼肌原纤维蛋白流变特性的影响
通过测定动力流变学的贮存模量(G')和损失模量(G''),可以阐明蛋白质凝胶及其网状结构形成的机理[23]。如图5所示,新鲜鲤鱼的肌原纤维蛋白加热后,代表弹性性能的G′先上升后下降,然后再次上升,二次峰值分别出现在46和70 ℃,两次峰值分别代表“凝胶形成”和“凝胶加强”的温度,加热结束后,蛋白质之间的产生交联,形成一个坚固的、不可逆的热诱导凝胶。

图4 鲤鱼肌原纤维蛋白凝胶微观结构的变化Fig.4 Changes of microstructure of commom carp MP gels
由图5可以看出,随着冻藏时间的增加,所有样品的G′都呈不断下降趋势,并且G′出现峰值的温度也有所下降。如冻藏30 d时,对照组、添加抗冻剂组、添加抗冻剂+PG、添加抗冻剂+WPI水解肽组的第一个峰值从新鲜鱼肉的3666 Pa分别降至1934、2537、3209、2827 Pa,其对应的峰值温度也从46 ℃分别降至42.9、43.8、45.2、44.3 ℃。冻藏90 d后,四组样品的第一个峰值从新鲜鱼肉的3666 Pa分别降至1653、2013、2911、2310 Pa,其对应的峰值温度也从46 ℃分别降至41.2、42.8、44.2、43.1 ℃,冻藏180 d后,各组样品的G′已无明显差别,故没有对其进行测定分析。以上结果说明,冻藏过程中,各样品的弹性性能均有所下降,冻藏时间越长,弹性性能下降越严重。Wang[24]等指出较低的G′可能是由于蛋白质凝胶的三维网状结构的破裂,也可能是维持α-螺旋结构的氢键发生断裂,α-螺旋结构解折叠造成的。这个解折叠过程主要发生在肌原纤维蛋白中的肌球蛋白上,同时也弱化了肌原纤维蛋白的弹性成分,引起蛋白凝胶弹性的下降。实验中各组样品凝胶弹性下降的主要原因是,在冻藏过程中肌原纤维蛋白质发生氧化变性,引起蛋白结构及蛋白分子间和分子内作用力的变化,从而导致三维网状结构破裂[25],添加抗冻剂和抗氧化剂后,对蛋白起到了保护作用,尤其是添加抗氧化剂组的弹性性能优于其他组。
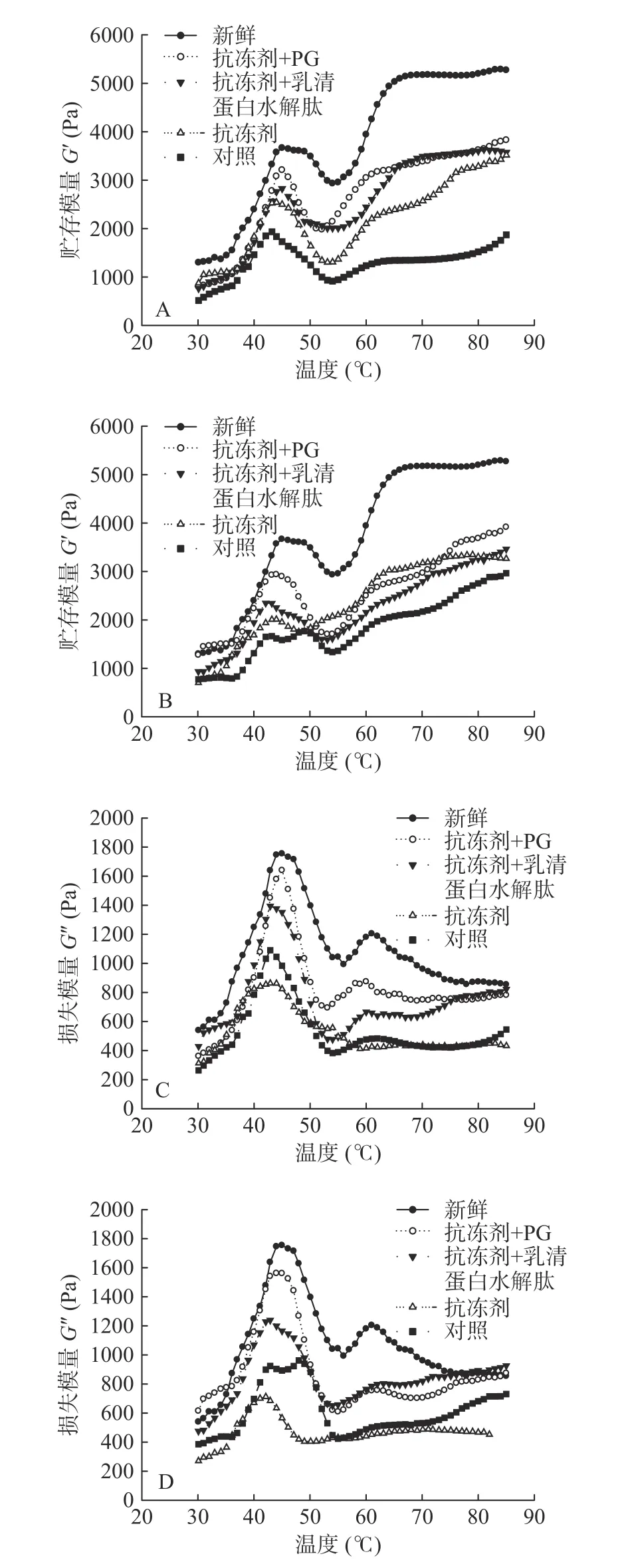
图5 鲤鱼肌原纤维蛋白流变学特性的变化Fig.5 Changes of rheological properties of common carp MP
G′′一般用来描述凝胶体系的粘度性能。G′′的峰值变化趋势一般与G′相似,本实验中添加抗冻剂和抗氧化剂的试样与对照组的损耗模量G′′变化趋势同G′变化,实验结果得出添加抗氧化剂组样品的粘度性能优于其他实验组。
样品的粘弹性的改变可以通过G′′/G′(损失因子)来说明。G′′/G′是蛋白凝胶形成过程中“粘性”与“弹性”的相对分布比值,也就是说G′′/G′值越高,样品系统更粘稠或缺乏弹性[26]。表1比较了各样品在加热终点时的粘弹性(G′′/G′)的变化,在加热结束时,新鲜样品的G′′/G′为0.16,冻藏30 d后,对照组、添加抗冻剂组、添加抗冻剂+PG组、添加抗冻剂+WPI水解肽组的G′′/G′分别为0.29、0.23、0.20和0.21。冻藏90 d后,四组样品对应的G′′/G′分别为0.30、0.26、0.21和0.23。G′/G′数值的改变说明当鲤鱼肌原纤维蛋白在冻藏过程中形成的凝胶粘弹性均有所损失,但添加抗冻剂和抗氧化剂组样品的粘弹性损失较少,说明抗冻剂和抗氧化在一定程度上能抑制蛋白质的冷冻变性,尤其是抗氧化剂的添加,更能有效的保护蛋白质的凝胶性。这一结果与本试验中蛋白凝胶的质构特性、凝胶微观结构等相一致。
3 结论
以冷冻鱼糜为研究对象,在冻藏过程中添加不同抗冻剂和抗氧化剂,以期抑制鱼糜冷冻过程中由水分冷冻和蛋白质氧化引起的品质劣变。实验研究得出,冷冻鱼糜在冻藏过程中肌原纤维蛋白肌原纤维蛋白乳化性、凝胶性、流变特性均降低,但添加不同物质后冻藏,下降程度也有所不同,在冻藏90 d时,添加抗冻剂+PG和抗冻剂+乳清蛋白水解肽组样品的乳化性、凝胶性、流变特性明显优于对照组和只添加抗冻剂组,凝胶微观结构也相对较完整,说明添加抗氧化剂可以在一定程度上抑制冻藏过程中肌原纤维蛋白质氧化的发生,从而抑制其功能性下降,本试验创新性地将蛋白质氧化问题引入冷冻鱼糜冻藏过程,并提出在冻藏过程中添加化学和天然抗氧化剂均可抑制蛋白质功能性的劣变,从而提高其功能性,对冷冻鱼糜的实际生产具有一定的指导意义。
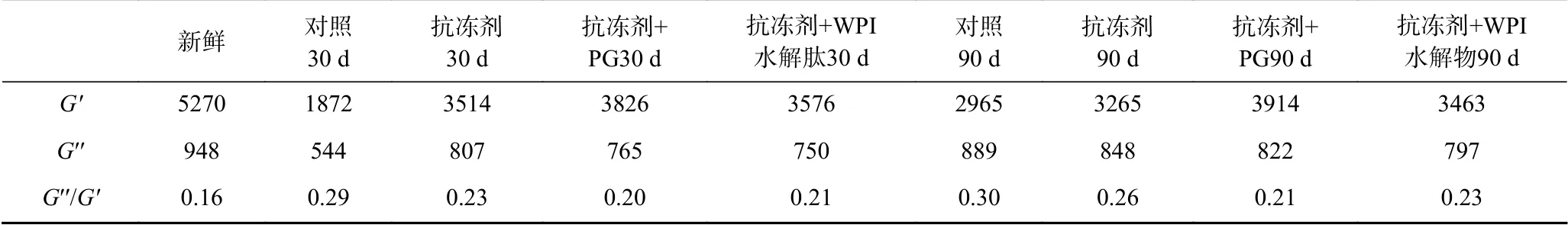
表1 加热终点时添加不同物质样品的G′、G′′、G′′/G′值Table 1 G′、G′′、G′′/G′ of every samples with different additives at the end of heating
