甜玉米芯多糖对α-淀粉酶抑制作用研究
2021-06-18王峙力谢静南马永强
王 鑫,王峙力,谢静南,韩 烨,张 凯,马永强,
(1.黑龙江省谷物食品与谷物资源综合加工重点实验室,哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.黑龙江省林业科学研究院,黑龙江哈尔滨 150081;3.哈尔滨工业大学生命科学与技术学院,黑龙江哈尔滨 150080)
甜玉米芯是甜玉米(Zea maysL.)一种常见的副产物,含有丰富的纤维素,是一种可回收利用的生物资源[1]。但由于利用程度较低,大多数被废弃焚烧处理,造成资源浪费[2]。甜玉米芯多糖(Sweet corncob polysaccharide,SCP)是甜玉米芯中的一种具有多种生物活性的重要物质,其被证明具有降低血糖、改善造血功能等作用,具有一定的研究价值[2]。目前环境保护及推动农业健康发展是广受关注的议题[3],因此探讨如何有效利用农业副产物具有一定研究价值。
如今,糖尿病普遍存在于中老年人群,威胁着人们的健康,中国糖尿病患病数量每年都在增加[4]。现阶段对于糖尿病的治疗方法中,减少小肠对葡萄糖吸收、控制餐后血糖水平是有效的途径[5]。α-淀粉酶在消化途径中发挥重要作用,可将食物中的碳水化合物转化为葡萄糖,经小肠进入血液而升高血糖,一些已投入使用的抗糖药物,如阿卡波糖、米格列醇等,通过抑制α-淀粉酶等肠酶的活性,来控制糖尿病患者饭后的血糖含量[6]。
糖尿病、高血脂、高血糖等疾病都可以使用α-淀粉酶抑制剂来治疗[7],现阶段的糖尿病患者大多数长期依赖于胰岛素或口服药物来维持血糖水平[8],所以寻找无副作用的天然降糖药物就是目前研究的重要方向[9]。多糖是一种大分子碳水化合物,具有α-淀粉酶抑制效果的多糖类物质有很多种,如石莼多糖[10]等,但关于甜玉米芯多糖对α-淀粉酶活性的影响尚未受到关注。
目前关于多糖对α-淀粉酶抑制作用的研究主要集中于抑制类型和竞争方式的研究,而对鼠源小肠酶体外实验的研究相对较少。本研究针对甜玉米芯多糖组分SCP50对α-淀粉酶的抑制作用及抑制类型进行探讨,并在此基础上,评价其对大鼠肠源α-淀粉酶活性的影响,以全面探讨SCP50对肠内碳水化合物消化吸收的影响,及其应用于抗糖尿病保健食品、药品领域的潜力,为之后的动物实验和寻找α-淀粉酶体内抑制作用机制提供基础。
1 材料与方法
1.1 材料与仪器
雄性Wista大鼠 体质量为(200±5)g,在长春亿斯实验动物中心购买,生产许可编号:Scxk(Ji)-2011-0004,合格证编号:201500010264,动物饲料由长春亿斯实验动物中心提供;所有实验均按照实验动物的保护和使用指南进行,并经黑龙江省疾病控制和预防中心的动物护理委员会批准。甜玉米芯 昊伟农业有限公司;链脲佐菌素(streptozotocin,STZ)美国Sigma公司;可溶性淀粉 上海和氏璧化工有限公司;α-淀粉酶 美国Sigma-Aldrich公司;叠氮化钠、氯化钠 天津致远化学试剂有限公司;磷酸氢二钠、磷酸二氢钠 天津科密欧化学试剂有限公司;3,5-二硝基水杨酸 纯度>98,国药集团化学试剂有限公司;KI 天津市光复科技发展责任有限公司;其他试剂 均为国产分析纯。
FW177型中草药粉碎机 天津市泰斯特仪器有限公司;EMS-9A型加热磁力搅拌器 天津市欧诺仪器仪表有限公司;EV241型旋转蒸发仪 北京莱伯泰科仪器股份有限公司;UV 5500PC型紫外可见分光光度计 上海元析仪器有限公司;ALC-1100.2型电子分析天平 北京赛多利斯仪器系统有限公司;HH-4型数显恒温水浴锅 国华电器有限公司;电热恒温鼓风干燥箱 上海一恒科技有限公司;SMP6型酶标仪 SoftMax Pro 6 Software。
1.2 实验方法
1.2.1 甜玉米芯粗多糖的提取工艺流程 甜玉米芯→干燥粉碎→过筛→脱脂→浸提→离心取上清液→脱蛋白→浓缩→脱色→醇沉(体积分数50%酒精)→DEAE 52纤维素柱层析→葡聚糖凝胶G-100柱层析纯化→冷冻干燥→SCP50
将甜玉米芯去除杂质后干燥粉碎过80目筛,得到甜玉米芯粉,加入正己烷试剂,按照质量体积比为3:25 g/mL对其进行脱脂,离心弃上清液,然后称取残渣热水浸提:按料水比1:20 g/mL加水,100 ℃提取3 h,4000 r/min离心10 min后收集上清液,对其脱蛋白(Sevage法)、脱色[11](D301R大孔弱碱性阴树脂法)后加入50%的乙醇醇沉12 h,除去上清液并冷冻干燥得到的醇沉物,得甜玉米芯多糖粉末SCP[11]备用。
1.2.2 甜玉米芯多糖组分分离纯化 称取1.00 g SCP溶解于5.00 mL蒸馏水中,使用纤维素柱层析DEAE-52分离[12]、葡聚糖凝胶柱层析Sephadex-G100纯化[13],全部以蒸馏水为洗脱剂,流速为1 mL/min,5.00 mL/管收集,通过苯酚-硫酸法[14]隔管跟踪检测多糖含量,分别以洗脱液管数和吸光度值为横纵坐标绘制多糖洗脱曲线。根据洗脱曲线,将有效峰值的管进行合并收集,浓缩、冻干后得到甜玉米芯多糖SCP50。
1.2.3 SCP50对α-淀粉酶活性抑制作用 根据邵元元、董丽娟[15-16]的方法并稍作修改,如表1所示,将SCP50配制浓度分别为2、4、6、8、10 mg/mL,取0.3 mL的α-淀粉酶溶液与SCP50均匀混合37 ℃水浴预热5 min,同时加入己预温的1%淀粉溶液(PBS配制)0.3 mL,在37 ℃水浴下反应一定时间,立即加入0.5 mL DNS溶液显色,在沸水中水浴5 min,冷却后经蒸馏水稀释至10 mL,在540 nm处测定吸光值(A3)。用阿卡波糖(2、4、6、8、10 mg/mL)做阳性对照组,蒸馏水替代抑制剂及磷酸盐缓冲溶液(67 mmol/L pH 6.8)替代α-淀粉酶(A2)做空白对照物;磷酸盐缓冲溶液替代α-淀粉酶(A4)做背景对照组;以蒸馏水替代抑制剂(A1)做空白组。抑制率的计算见式(1)。做三次平行实验,根据抑制率算得IC50。
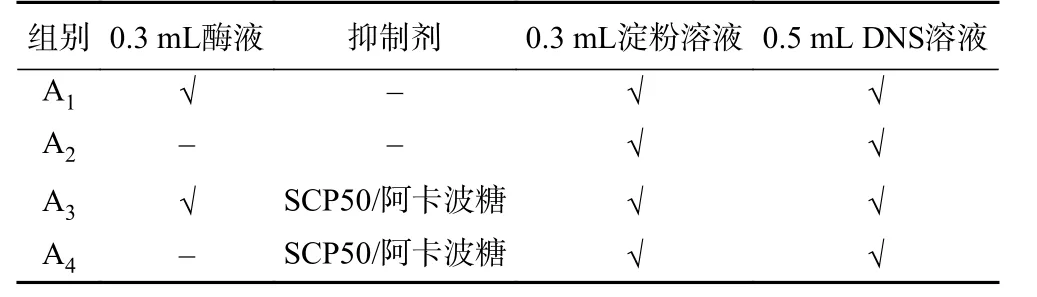
表1 α-淀粉酶活性抑制体系Table 1 Inhibition system of α-amylase activity
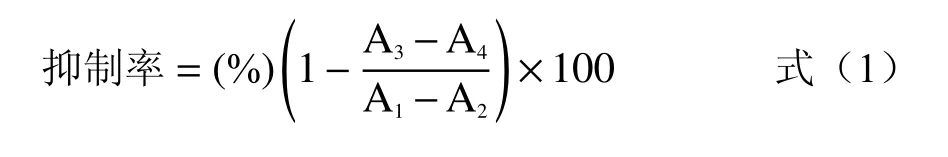
1.2.4 SCP50对α-淀粉酶活性抑制动力学研究
1.2.4.1 确定α-淀粉酶最适酶浓度和作用时间 使用Bernfeld法测定[17],用磷酸盐缓冲液(67 mmol/L pH 6.8)配制1%的淀粉底物,以2 mL 67 mmol/L pH 6.8磷酸盐缓冲液做空白,取不同浓度的α-淀粉酶溶液(0.4、0.8、1.2、1.6、2 U/mL)作对照。在37 ℃下预热0.3 mL的α-淀粉酶5 min,加入预温后的1%淀粉溶液0.3 mL,在酶促反应开始后,准确计时,每过1 min添加0.5 mL DNS终止剂终止反应,沸水浴5 min后,冷却稀释定容至10 mL,在540 nm下测定吸光光度值,共计10 min。空白对照以0.3 mL磷酸盐缓冲溶液代替酶液,通过作图筛选出α-淀粉酶的最适酶量以及反应时间。
1.2.4.2 SCP50对α-淀粉酶抑制类型研究 按照上述1.2.3中实验方法进行操作,在空白管中使用0.3 mL缓冲液代替α-淀粉酶液,分别于540 nm处测定0、1 mg/mL浓度的甜玉米芯多糖SCP50时的吸光值,三组平行实验。将酶浓度与反应速率作为横纵坐标作图,根据反应速率直线是否过原点,确定SCP50对α-淀粉酶的抑制类型[16]。
1.2.4.3 SCP50对α-淀粉酶竞争方式研究 分别配制1、0.05%、0.025%、0.0125%、0.00625%淀粉溶液,按照1.2.3的试验方法进行操作,分别在540 nm下测定有无甜玉米芯多糖SCP50时吸光值,三组平行实验。采用Lineweaver-Burk双倒数作图法,X轴为底物浓度的倒数,Y轴为酶促反应速度的倒数,绘出SCP50对α-淀粉酶的抑制曲线并明确其竞争方式,按式(2)~(4)计算。
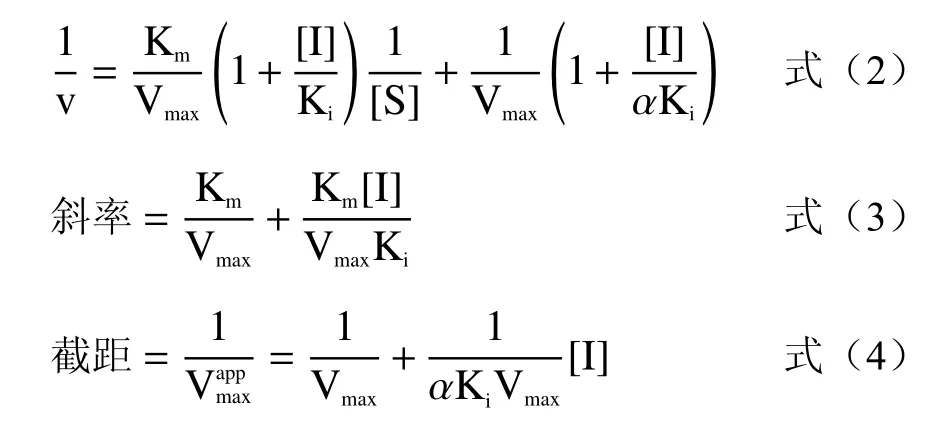
式中:Ki—抑制常数;Km—米氏常数;v—反应速度;[I]—抑制剂浓度;[S]—底物浓度;α—表观系数。
1.2.5 SCP50对大鼠肠源α-淀粉酶的抑制作用
1.2.5.1 大鼠小肠酶液的提取和活力测定 将一只正常大鼠麻醉猝死,立即取出小肠,流水洗净内容物后,加入4 ℃预冷后的PBS溶液,质量体积比为1:3,匀浆后,4000 r/min离心20 min,收集上清液分装备用[18],贮存于-20 ℃。根据α-淀粉酶水解淀粉为还原糖,参照DNS(3,5-二硝基水杨酸)比色法[19],取0.3 mL小肠酶液37 ℃预热5 min,加入己预温的淀粉溶液0.3 mL在37 ℃下反应一定的时间,加入0.5 mL DNS溶液终止反应,沸水浴5 min后,取出冷却,蒸馏水稀释定容至10 mL,以蒸馏水代替小肠酶液作为空白,540 nm下测定吸光值,按式(5)~(6)计算。将在37 ℃,pH 6.8条件下,1 L溶液中1 min生成1 μmol葡萄糖定义为1个酶活力单位。
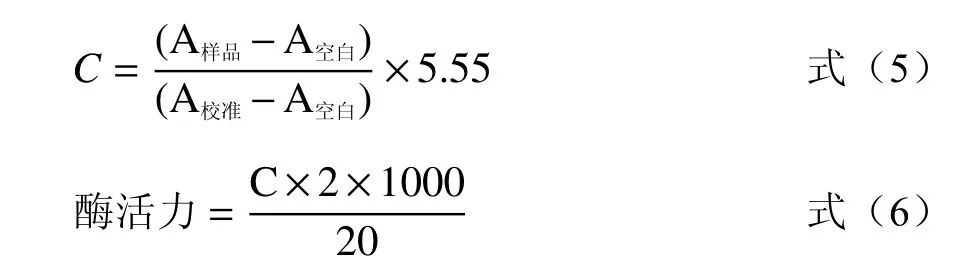
式中:C—葡萄糖浓度,mmol/L;5.55—校准浓度。
1.2.5.2 SCP50对α-淀粉酶的抑制作用鉴别试验根据尚禹东[18]参考文献中的实验方法略作修改,如表2所示,取上述小肠酶液0.35 mL,放入37 ℃的Krebs-Henseleit缓冲液中,阴性对照组,加入2.5 mL、Krebs- Henseleit缓冲液配制的2%淀粉溶液以及2.5 mL的 Krebs- Henseleit缓冲液,不加小肠酶液及降糖药物,其他各组同时加入小肠酶液和2.5 mL的Krebs- Henseleit缓冲液配制的2%淀粉液,分别在实验对照组中加入2.5 mL甜玉米芯多糖SCP50样品高(10 g/L)、中(5 g/L)、低(2.5 g/L);用相同体积的阿卡波糖(5 g/L)替代SCP50溶液作为阳性对照组;用同体积Krebs- Henseleit缓冲液代替甜玉米芯多糖SCP50溶液作为正常对照组,每组3管平行进行测定。
37 ℃下水浴振荡1 h后取混悬液0.5 mL,加入0.1 mL、0.02 mol/L I2-KI溶液,淀粉在I2-KI存在的条件下会呈现特征性的蓝色,620 nm下测其吸光度值,加入2.5 mL 2%淀粉溶液和0.1 mL、0.02 mol/LI2-KI溶液作为空白,计算反应液中SCP50对α-淀粉酶的抑制率,如公式(7)。通过正常对照组和阴性对照组A值的对比,确定在无任何SCP50的干预情况下,反应前和反应后淀粉的水解程度。在加入SCP50后,分别通过与正常对照组和阴性对照组的比较,判断甜玉米芯多糖SCP50对其活性的抑制效果。
表2 分组及给药Table 2 Grouping and administration

1.2.5.3 SCP50及阳性药物抑制作用的量效曲线 用0.1 mol/L、pH 6.8的PBS溶液配制成20.0000、10.0000、5.0000、2.5000、1.2500、0.6250及0.3125 g/L共7个浓度梯度SCP50溶液;用PBS配制1、1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、g/L 7个浓度梯度阿卡波糖溶液,各5 mL。在药物浓度对数值及抑制率的横纵坐标轴中求出直线方程并计算IC50。
绘制阳性药对α-淀粉酶的抑制曲线以及测定IC50:如表3所示,向48孔板中加入0.3 mL、0.5%淀粉溶液(PBS配制),0.4 mL的PBS溶液,在除阴性组外,加入0.3 mL小肠酶液在正常对照组和不同浓度的阳性药物组中;阴性组用等体积的PBS代替。每个浓度三孔平行进行实验,在37 ℃下反应20 min,冰水浴冷却10 min,再加0.2 mL浓度为0.4 mmol/L的I2-KI溶液显色,620 nm下测吸光度值,3管平行测定[20]。
表3 分组及添加量Table 3 Grouping and addition
绘制SCP50对α-淀粉酶的抑制曲线以及测定IC50:按上述实验方法操作,使用SCP50替代阳性药,计算反应液中SCP50对α-淀粉酶的抑制率,绘制抑制曲线并计算出IC50的数值。
1.3 统计学处理
采用DPS软件进行处理。所有数据均用平均值±标准偏差表示,采用单因素方差分析进行统计分析,采用 Origin 8.5完成图表。
2 结果与分析
2.1 甜玉米芯多糖分离纯化
2.1.1 甜玉米芯多糖DEAE-52柱层析纯化 如图1,甜玉米芯多糖经过以蒸馏水为洗脱剂的DEAE-52的柱层析后,得到了一个峰型显著的主峰,还有若干个峰型较小,不利于收集,所以收集经过蒸馏水洗脱后的多糖,仅得到一种非极性多糖,即中性糖。根据上述分析,甜玉米芯多糖经过以蒸馏水为洗脱剂的DEAE-52的柱层析后合并主峰第20管至34管可以得到均一组分的甜玉米芯多糖,备用。
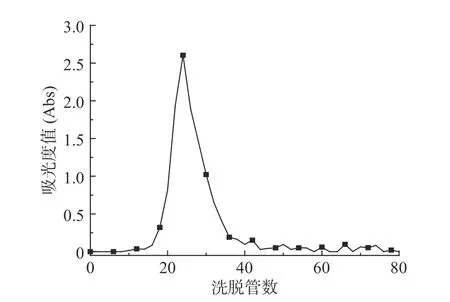
图1 甜玉米芯多糖DEAE-52色谱柱蒸馏水洗脱曲线Fig.1 DEAE-52 distilled water column elution curve of sweet corncob polysaccharides
2.1.2 甜玉米芯多糖葡聚糖凝胶G-100凝胶柱层析纯化 根据图2可知,在第28管至第38管范围内出现了一个峰型显著且较为对称的峰,甜玉米芯多糖组分经过以蒸馏水为洗脱剂的DEAE-52过柱后,再经过G-100凝胶柱层析后,可得到均一的中性糖。合并第28管至第38管中的甜玉米芯多糖组分,备用,命名为SCP50。
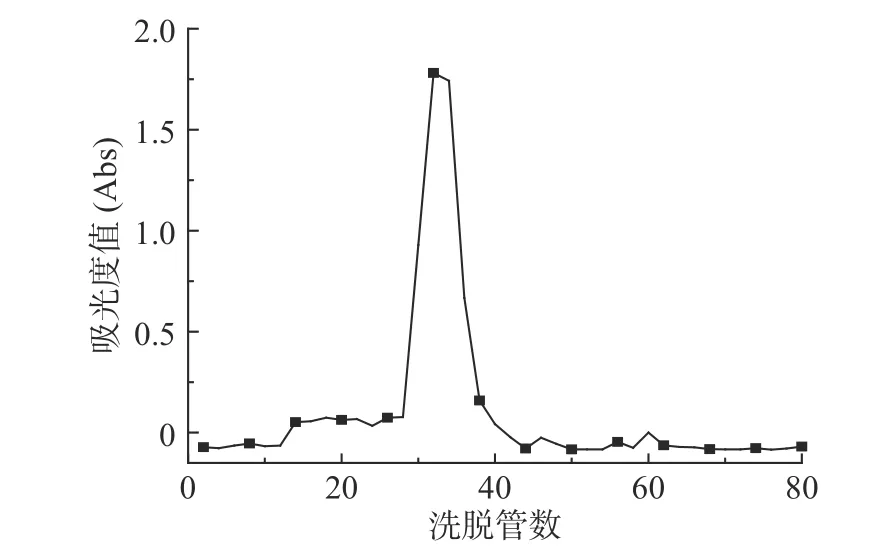
图2 SCP50组分Sephadex G-100凝胶柱洗脱曲线Fig.2 Elution curvesof SCP50 by Sephadex G-100 gel column
2.2 SCP50对α-淀粉酶活性抑制分析
如图3所示,当SCP50的浓度为2 mg/mL时,SCP 50的抑制率达到了26.67%±1.67%,当浓度增大到10 mg/mL时,抑制率达到了75.44%±1.94%。其IC50为5.129±0.34 mg/mL。虽然甜玉米芯多糖SCP50与阳性药阿卡波糖的抑制率相比有一定差距,但SCP50对α-淀粉酶还是具有一定的抑制效果。黄绍华[21]等报道的山药多糖和曾傲琼[22]等人报道的条斑紫菜多糖与本实验结果相似,均对α-淀粉酶产生剂量依赖的抑制作用。
2.3 甜玉米芯多糖SCP50对α-淀粉酶活性抑制动力学
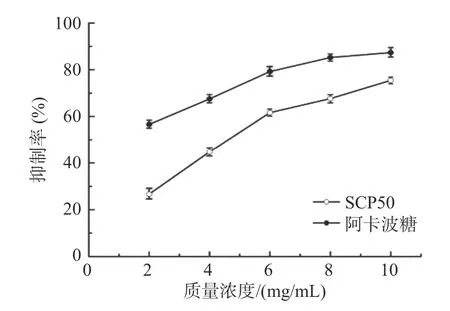
图3 SCP50对α-淀粉酶活性的抑制曲线Fig.3 The activity inhibition curve of SCP50 on α-amylase
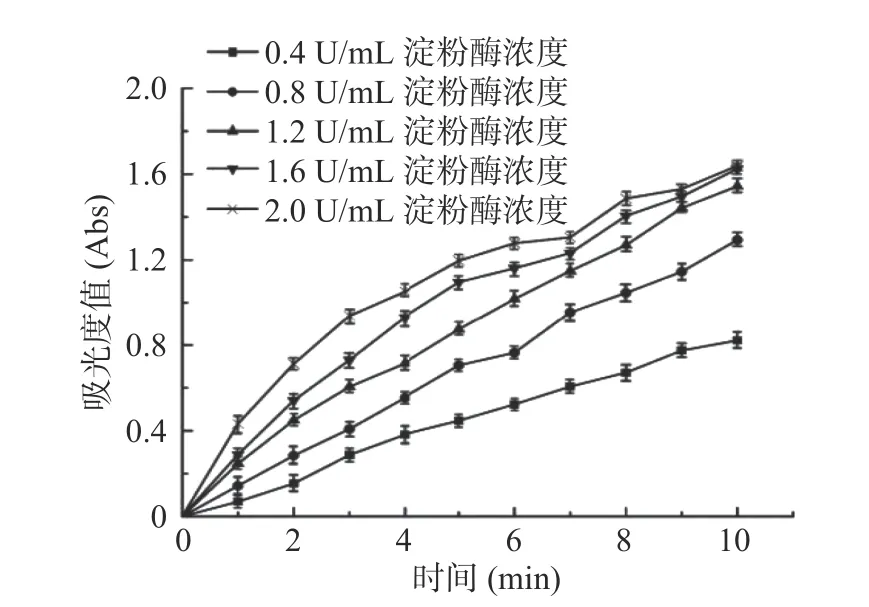
图4 不同浓度α-淀粉酶反应动力学进程曲线Fig.4 Reaction kinetics curves in different concentrations of α-amylase
2.3.1α-淀粉酶最适酶浓度和反应时间的分析 如图4所示,不同浓度α-淀粉酶在10 min内反应速率与酶浓度之间存在线性关系,确定适合的酶量是研究动力学的关键步骤[23]。从图中可以明显看出,反应6 min之前线性关系较良好,酶浓度为0.4、0.8、1.2 U/mL三条动力学的线性关系良好,综上试验数据可看出,为保证反应进程中按照初始速度进行,选择最适酶量为1.2 U,反应时间为5 min为宜[24]。这与杨小倩[25]等报道玉蜀黍不同部位提取物对α-淀粉酶抑制作用得到的最佳反应时间为10 min不同,可能是由于二者的抑制剂不一样导致结果不一样,具体的原因需要更深层的探究。
2.3.2 甜玉米芯多糖对α-淀粉酶抑制类型 由图5可知,在反应过程中没有甜玉米芯多糖SCP50的存在时,反应速率是一条经过原点的直线[23],在原反应体系中加入酶抑制剂甜玉米芯多糖后,反应速度随着酶量多少及加入抑制剂后的变化由图可知,加入甜玉米芯多糖SCP50后得到的反应速率直线通过原点,且斜率低于无抑制剂的曲线。由此可以得出甜玉米芯多糖SCP50对α-淀粉酶抑制类型属于可逆抑制类型[15]。这是由于SCP50与底物共同竞争同一位置,使得SCP50与α-淀粉酶结合,且α-淀粉酶不再与底物结合,从而降低反应速度,且产物形成可逆。

图5 SCP50对α-淀粉酶抑制作用类型Fig.5 The inhibition type of SCP50 on α-amylase
2.3.3 甜玉米芯多糖SCP50对α-淀粉酶竞争方式根据Lineweaver-Burk方法绘制双倒数曲线[26],由图6可知,三条直线在允许误差范围内均交于Y轴,通过y2mg/mL=4.66x2mg/mL+6.958可以得出,α-淀粉酶的Km值为0.669,Vmax为0.1437 mol/L·min-1。随着加入SCP50质量浓度的增加,双倒数直线与横坐标的截距变小,与纵坐标的截距不变,可知Km2mg/mL>Km1mg/mL,且Vmax不变,甜玉米芯多糖与底物结构相似,酶的活性中心由二者共同竞争,故SCP50是一种竞争可逆性的α-淀粉酶抑制剂。这与高粱原花青素[27]和山药多糖[21]对α-淀粉酶活性的竞争方式相似,与甜叶菊毛状根绿原酸类化合物[28]及黑果腺肋花楸多酚[29]对α-淀粉酶活性的竞争方式不同,底物和抑制剂与酶的结合既无互相排斥,也无互相促进,即底物、抑制可同时独立地与酶结合,属于非竞争性抑制。
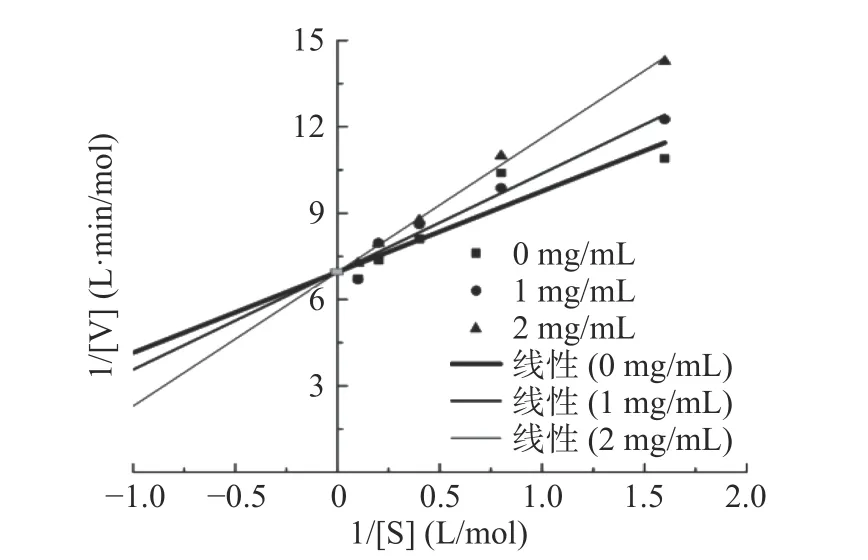
图6 不同SCP50浓度下反应的1/[S]和1/[V]双倒数曲线Fig.6 The 1/[S] and 1/V double bottom graph under different concentration of SCP50 reaction
2.4 SCP50对α-淀粉酶的抑制作用
2.4.1 SCP50对大鼠小肠内α-淀粉酶抑制作用测定的结果 通过实验测得大鼠小肠酶活力值为71.3±1.32酶活单位;由图7可知,阳性药对其抑制率为49.54%±1.93%,且抑制效果较SCP50各剂量组效果明显,其中甜玉米芯多糖SCP50高、中剂量组抑制率与阳性药组抑制率相比显著降低(P<0.05),抑制率为24.65%±1.34%和15.21%±1.43%,SCP50低剂量组与阳性药组相比高度显著降低(P<0.001),抑制率为11.23%±0.56%,且呈现明显的量效关系。
2.4.2 SCP50及阳性药物抑制作用的量效曲线
2.4.2.1 阳性药(阿卡波糖)对小肠内α-淀粉酶的抑制曲线 图8为阳性药对α-淀粉酶的抑制曲线,淀粉酶的抑制率方程为:y=4.318x+26.625,R2=0.9905,IC50为5.413 mg/mL。通过对于测定结果的分析,阿卡波糖浓度越高剂量越大对小肠α-淀粉酶抑制作用也就越强。
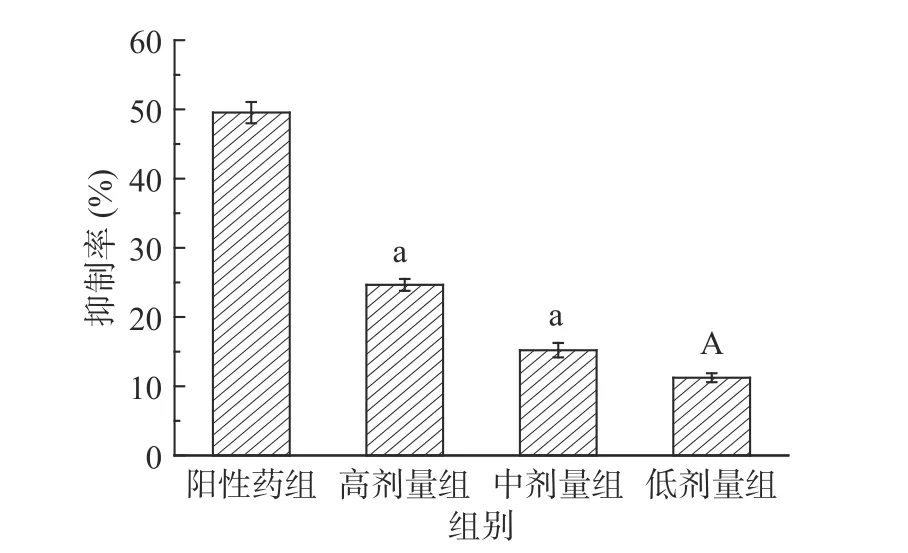
图7 正常大鼠小肠内α-淀粉酶抑制测定Fig.7 Determination of α-amylase inhibition in small intestine of normal rats

图8 不同浓度阳性药对α-淀粉酶的抑制率Fig.8 Inhibition rate of α-amylase under different concentration of positive medicine
2.4.2.2 SCP50对小肠内α-淀粉酶抑制曲线 由图9可知SCP50对α-淀粉酶的抑制率方程:y=1.5697x+7.059,R²=0.9949,IC50为27.263 mg/mL。通过测定结果,得出SCP50对小肠α-淀粉酶具有剂量依赖的抑制作用,因而能够减少餐后血糖的上升,使血糖吸收平缓,降低空腹血糖。李兰等[30]报道绿茶提取物的降血糖研究,温正辉等[31]报道蒲桃不同部位对α-淀粉酶抑制作用与本实验结果相似。
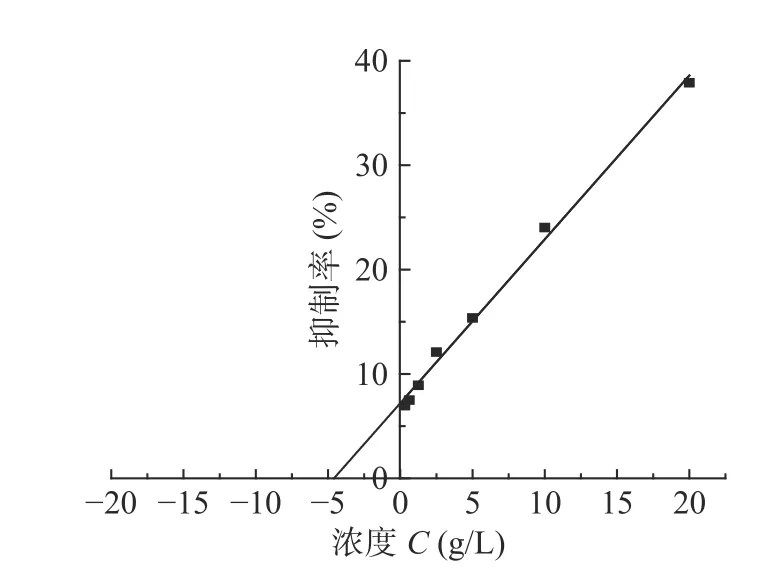
图9 不同浓度SCP50对α-淀粉酶的抑制率Fig.9 Inhibition rate of α-amylase under different concentration of SCP50
3 结论
活性物质对α-淀粉酶和α-葡萄糖苷酶的抑制作用的检测经常使用动物源肠酶。甜玉米芯是一种常见的农业副产物,实验探究其中分离纯化的多糖组分SCP50对α-淀粉酶的抑制效果、抑制类型,并进一步探究了甜玉米芯多糖SCP50对鼠源α-淀粉酶的抑制作用。
实验结果表明:甜玉米芯多糖组分SCP50对α-淀粉酶是一种可逆性竞争性抑制,抑制作用明显,可快速降低α-淀粉酶酶促反应速度,Km值为0.669,Vmax为0.1437 mol/L·min-1;在鼠源肠酶抑制试验中,SCP50可以抑制正常大鼠离体小肠内的α-淀粉酶,IC50为27.263 mg/mL,结果呈剂量依赖。结果提示甜玉米芯多糖组分SCP50具有潜在的抗糖尿病作用,研究为农业副产物的高值利用提供可能途径。
