一株高浓度氨氮耐受的除氨氮菌筛选、鉴定及发酵条件优化
2021-06-17谷雅文于鲲鹏任玉文周晓辉
谷雅文,于鲲鹏,任玉文,闫 珂,周晓辉,
(1.河北科技大学,河北石家庄 050018;2.河北大美环境修复科技股份有限公司,河北石家庄 050000)
随着工农业的快速发展,我国的水土环境受到严重氨氮污染[1]。氨氮[2]主要指水体中以铵离子和游离氨形式而存在的氮,是一种高耗氧污染物,通过使水体富含营养素而导致水体的富营养化[3]。氨氮污染不仅会造成鱼类等其他水体生物大量死亡,给水产养殖业带来严重威胁[4];同时,生活用水的氨氮污染也会严重危害人类的身体健康。氨氮来源广泛,与农药化肥[5]、牲畜粪便[6]等传统氨氮排放途径相比,化工、医药和食品加工等工业产生的氨氮质量浓度大于500 mg/L的废水正成为我国水体氨氮污染的重要来源,据统计,高浓度氨氮工业废水的排放约占总氨氮来源的30%[2]。我国食品企业普遍存在规模小、技术落后的发展现状,企业无力建设高额的环保处理设备,因此亟需寻找快速高效低成本去除氨氮的有效手段。
近半个世纪以来,为解决氨氮废水问题,国内外学者做了大量研究工作。目前报道最多的有物化法和生物法。罗宇智等[7]利用化学沉淀法去除稀土工业废水中的氨氮;Chen等[8]在微波作用下,利用活性炭吸附废水中的氨氮;Li等[9]采用离子交换法去除水体中的氨氮。这些方法工艺成熟、除氨氮效率高,但是耗能大、经济效益低且药剂投入量大,会对水体造成新污染[10-12]。生物法[13-15]是指利用微生物处理氨氮废水,具有成本较低、条件温和、无二次污染等优点。目前,生物法多集中于氨氮浓度范围为50~100 mg/L的中低氨氮浓度废水研究,该浓度范围已有大量氨氮去除微生物菌株被报道:陈猛等[16]研究发现一株对氨氮废水具有较好去除效果的芽孢杆菌ZF2-3,在第24 h时氨氮去除率为85.7%;陈红菊等[17]研究发现一株24 h氨氮去除率为98.5%的凝结芽孢杆菌除氨氮菌株,但菌株盐度耐受性差,水体中盐度超过3%时菌株生长受到抑制;陈锦豪等[18]从对虾养殖水体中分离到一株枯草芽孢杆菌DS5,5 d内氨氮去除率最高为36%;此外还有解淀粉芽孢杆菌、假单胞菌、红球菌、溶杆菌、反硝化细菌等,这些菌株对氨氮的去除能力各不相同,普遍存在耐受力低、应用成本高和接种量大等缺点,不适用于处理高氨氮浓度工业废水。近期,张冠根等[19]研究发现一株解淀粉芽孢杆菌,在氨氮浓度500 mg/L的模拟高氨氮浓度废水中,氨氮降解率仅为21.90%。
本研究利用以NH4Cl为唯一氮源的选择性培养基,通过平板驯化筛选的方法以期从受发酵工业污水污染严重的土壤中筛得一株具有高浓度氨氮耐受的高效除氨氮菌株,对其进行菌株形态分析、菌种鉴定、菌株除氨氮性质研究以及菌株的高氨氮耐受能力测定,并通过单因素、正交试验优化确定菌株最佳氨氮去除条件,为其未来可能开展的工业化应用提供理论基础。
1 材料与方法
1.1 材料与仪器
污染土壤 2018年9月于石家庄栾城区采集受发酵工业污水污染严重的土壤,用采样铲刮去表面0.5~1.0 cm的表层土壤后垂直向下切取约1.0~10.0 cm深度的土壤,约200 g放入无菌采样袋中;C2H3NaO2上海麦克林生化科技有限公司;胰蛋白胨、酵母粉、琼脂、NaCl、MgSO4·7H2O 北京索莱宝科技有限公司;K2HPO4天津市鼎盛鑫化工有限公司;MnSO4·4H2O 天津市河东区红岩试剂厂;FeSO4北京市奥博星生物技术有限责任公司;NH4Cl 北京市奥博星生物技术有限责任公司。
T1000电子天平 常熟市双杰测试仪器厂;ME104/02分析天平 梅特勒-托利多(上海)有限公司;STARTER3100/F电子pH计 奥豪斯(上海)有限公司;HJ-4AS磁力搅拌器 江苏省金坛市荣华仪器公司;移液器 大龙医疗设备有限公司;BCD-189WDPV冰箱 海尔公司;DW-HL100超低温冷冻储存箱 中科美菱;SW-CJ-1FD单人单面垂直净化工作台 上海博讯实业有限公司医疗设备厂;YXQ-30SII立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;ZWYR-4912恒温培养振荡器 上海智城分析仪器制造有限公司;UV-5800(PC)紫外可见分光光度计 上海元析仪器有限公司;BA410E显微镜 麦克奥迪实业集团有限公司。
1.2 实验方法
1.2.1 培养基配制 LB培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH7.0;
微量元素液(g/L):CoCl2·6H2O 0.1,MnCl2·4H2O 0.425,ZnCl20.05,NiCl2·6H2O 0.01,CuSO4·5H2O 0.015,Na2MoO4·2H2O 0.01,Na2SeO4·2H2O 0.01;
富集培养基(g/L):NH4Cl 0.352,胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH7.0;
初筛无机盐培养基(g/L):C2H3NaO22.0,MgSO4·7H2O 0.05,K2HPO40.2,NaCl 0.12,MnSO4·4H2O 0.01,FeSO40.01,NH4Cl 1.76,微量元素液1 mL,pH7.0;
复筛无机盐培养基(g/L):C2H3NaO22.0,MgSO4·7H2O 0.05,K2HPO40.2,NaCl 0.12,MnSO4·4H2O 0.01,FeSO40.01,NH4Cl 0.176,微量元素液1 mL,pH7.0;
斜面培养基:100 mL富集培养基加1.0 g琼脂;
初始培养基(g/L):C2H3NaO22.0,MgSO4·7H2O 0.05,K2HPO40.2,NaCl 0.12,MnSO4·4H2O 0.01,FeSO40.01,NH4Cl 0.352,微量元素液1 mL,pH7.0;
高浓度氨氮培养基(g/L):C2H3NaO211.0,MgSO4·7H2O 0.25,K2HPO41.0,NaCl 0.60,MnSO4·4H2O 0.05,FeSO40.05,NH4Cl 1.76,微量元素液5 mL,pH8.0。
1.2.2 菌株分离筛选 取10 g土壤样品加入到含玻璃珠的100 mL无菌水中,手动振荡打碎10 min,静止片刻后取10 mL液体加入到90 mL富集培养基中于28 ℃,160 r/min培养24 h,获得富集菌液,然后将富集菌液按5%的接种量接种于初筛无机盐培养基中,重复筛选两次。通过稀释涂布平板法将筛选后的菌液以10-3、10-4、10-5、10-6四个浓度梯度涂布于斜面培养基固体平板上,28 ℃倒置培养进行初筛[20]。获得单菌落后对菌落进行纯化(重复2~3次划线)并保存。
1.2.3 菌株生长特性及除氨氮能力分析 将初筛得到的6株单菌株接入LB培养基中,160 r/min,28 ℃培养至OD600nm值为1.0,将菌液离心沉淀,弃去上清液,并重悬于相等体积的复筛无机盐培养基中;按照接种量为5%吸取2.5 mL菌悬液加入到装液量50 mL/250 mL、氨氮初始浓度为50 mg/L的复筛无机盐培养基中,160 r/min,28 ℃培养,每隔2 h测定培养基OD600nm,取6株单菌株发酵20 h时的发酵液各10 mL,12000 r/min离心15 min获取上清液,利用纳氏试剂光度法[21]测定上清液中氨氮的含量,根据式(1)进行氨氮去除率计算,并绘制菌体生长曲线和6株菌20 h氨氮去除情况表格,来验证不同菌株的生长繁殖能力和对氨氮的去除性能,确定最优氨氮去除菌株。
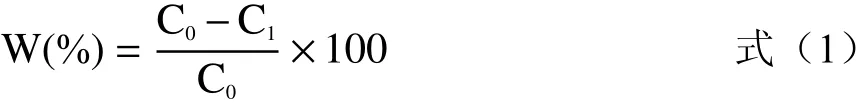
式中:W为氨氮去除率,%;C0为初始氨氮浓度,mg/L;C1为剩余氨氮浓度,mg/L。
将筛选获得的最优除氨氮菌株重复上述培养操作,每隔2 h取样,氨氮(NH4+-N)的测量方法为纳氏试剂光度法,根据参考文献[21-22];NO2-N用N-(1-萘基)乙二胺光度法测定,NO3-N用紫外分光光度法测定。根据测定的氨氮、硝酸盐氮、亚硝酸盐氮含量,绘制菌株除氨氮特性图。
1.2.4 菌株鉴定 将筛得的最优单菌株N-2接种于LB培养基中,28 ℃、160 r/min过夜培养,取1 mL培养液置于离心管中,经12000 r/min离心2 min后,弃上清液,收集菌体,经无菌水漂洗后的菌体,用细菌基因组试剂盒提取DNA。
细菌16S rRNA基因扩增通用引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3'),PCR反应体系为20 μL(10×PCR Buffer 2 μL,10 μmol/L引物各0.5 μL,(10 mmol/L)dNTP 0.5 μL,DNA模板2 μL,ddH2O 14 μL,Taq Plus DNA Polymerase(5 U/μL)0.5 μL),PCR扩增条件:95 ℃ 5 min;94 ℃ 30 s;57 ℃30 s;72 ℃ 90 s;30个循环;最后72 ℃延伸8 min。PCR产物经1.5%琼脂糖凝胶电泳检测后,委托生工生物工程(上海)股份有限公司对细菌序列进行双向测序。将测序完成并拼接后的1481 bp的16S rRNA基因序列上传至NCBI获得登录号GenBank accession number MT084039,并进行BLASTn(www.ncbi.nlm.nih.gov/BLAST)相似性比对。下载BLAST比对序列相似性较高的菌株序列,利用MEGA 5.05软件计算序列相似度,同时用邻接法(neighbor-joining method)构建菌株系统发育树,确定物种的系统发育地位。
1.2.5 N-2菌株氨氮浓度耐受性分析 将初始培养基中0.352 g/L的NH4Cl分别调整为0.176、0.352、1.76、3.52、7.04、10.56、14.08、21.12和28.16 g/L,乙酸钠和其他成分含量也做相应调整,使培养基中氨氮浓度分别为50、100、500、1000、2000、3000、4000、6000和8000 mg/L,制备高浓度氨氮(50 mg/L除外)模拟废水。
将N-2单菌株接入LB培养基中,160 r/min,28 ℃培养至OD600nm值为1.0,按照接种量为5%,分别吸取2.5 mL菌液离心弃上清后重新悬浮于2.5 mL无菌初始培养基中,加入到上述不同氨氮浓度50 mL/250 mL模拟废水中,160 r/min,28 ℃培养10 h测定剩余氨氮的含量,验证N-2菌株对高浓度氨氮的耐受和去除能力。
1.2.6 不同培养条件对氨氮去除率的影响 将单克隆菌株N-2接种于LB培养基中,在28 ℃、160 r/min条件下培养至OD600nm值为1.0,收集70 mL培养液在12000 r/min离心2 min,弃上清液,用初始培养基重悬至70 mL后作为种子液备用。
1.2.6.1 不同pH对氨氮去除率的影响 将种子液以5%接种量接种于氨氮浓度为100 mg/L的初始培养基中,pH设置为5.0、6.0、7.0、8.0和9.0这5个梯度,28 ℃、160 r/min振荡培养10 h,考察pH对菌株N-2氨氮去除率的影响。
1.2.6.2 不同温度对氨氮去除率的影响 将种子液以5%接种量接种于氨氮浓度为100 mg/L的初始培养基中,温度设置为28、30、34、37和40 ℃这5个梯度,28 ℃、160 r/min振荡培养10 h,考察温度对菌株N-2氨氮去除率的影响。
1.2.6.3 不同碳氮比对氨氮去除率的影响 将种子液以5%接种量接种于氨氮浓度为100 mg/L的初始培养基中,将初始培养基的C/N设置为5、10、15、20和25这5个梯度,28 ℃、160 r/min振荡培养10 h,考察培养基C/N对菌株N-2氨氮去除率的影响。
1.2.6.4 不同转速对氨氮去除率的影响 将种子液以5%接种量接种于氨氮浓度为100 mg/L的初始培养基中,摇床转速设置为160、180、220、260和300 r/min 5个梯度,28 ℃振荡培养10 h,考察转速对菌株N-2氨氮去除率的影响。
1.2.6.5 不同装液量对氨氮去除率的影响 将种子液以5%接种量接种于氨氮浓度为100 mg/L的初始培养基中,摇瓶装液量设置为25、50、75、100和125 mL/250 mL5个梯度,28 ℃、160 r/min振荡培养10 h,考察装液量对菌株N-2氨氮去除率的影响。
1.2.7 正交试验优化N-2菌株氨氮去除率 在培养条件单因素试验结果的基础上,选择对菌株N-2氨氮去除率影响相对较大的温度、碳氮比、装液量,另外增加一列空列共4个因素,设置3个水平,进行正交试验(表1)。以培养10 h菌株对初始氨氮浓度100 mg/L模拟废水的氨氮去除率为参考指标,发酵试验设计3次重复,取3次试验的平均值作为发酵培养条件优化的试验结果。
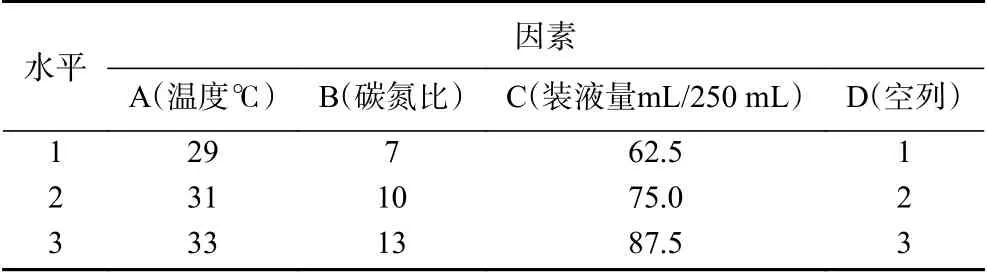
表1 正交试验因素与水平Table 1 The factors and levels of orthogonal experiment
1.3 数据处理
各数据均为三组的平均值,用平均值±标准差表示。利用Minitab18软件设计正交试验并进行正交试验结果分析,利用SPSS 22.0以及Excel对试验数据处理分析并进行图表制作。
2 结果与分析
2.1 除氨氮菌株的筛选与鉴定
2.1.1 除氨氮菌株的筛选 通过初步筛选培养,获得6株生长情况良好、菌落较大、可利用NH4Cl为唯一氮源的单菌株,分别命名为N-1、N-2、N-3、N-4、N-5和N-6。按照1.2.3中的方法测定6株菌的生长曲线及20 h氨氮去除率。由表2可得,与其他四株菌相比,N-2、N-3菌株氨氮去除率相对较高,可达82.90%、81.36%,具有较好的氨氮去除能力;由图1可得,在稳定期OD600nm大体一致的情况下,与N-3相比,N-2菌株指数期较短,能更快进入稳定期,生长繁殖相对较快,故将繁殖速度快且氨氮去除率高的菌株N-2保存于-80 ℃超低温冰箱中备用。
2.1.2 N-2菌株除氨氮特性 由图2可知,2~8 h时菌株N-2处于生长指数期,OD600nm快速增长,生长繁殖速度最快,同时,模拟废水中氨氮含量也在快速下降;8 h之后菌株达到稳定期,OD600nm与模拟废水中的氨氮含量均趋于稳定,结果表明菌株生长状况与氨氮去除情况同步;另外由图2可以发现在整个氨氮去除过程中硝酸盐氮与亚硝酸盐氮未见明显积累,说明氨氮并没有转化为硝酸氮和亚硝酸氮,菌株N-2是由细菌的同化作用将氨氮转化为自身所需营养物质。同时N-2菌株具有较快的氨氮去除性能,在10 h对初始氨氮浓度50 mg/L的氨氮模拟废水可达到最大氨氮去除效果,此时氨氮剩余量为9.4 mg/L,利用式(1)算得氨氮去除率为81.2%,远优于刘亚樵等[23]培养5 d时氨氮去除率78%的去除效果。
2.1.3 N-2菌株的鉴定 在LB固体培养基上菌株N-2的菌落形态为乳白色半透明状、质地软且菌落表面湿润、形状为扁圆形、边缘不规则;通过革兰氏染色表明菌株N-2是革兰氏阳性菌,在光学显微镜下呈短杆状,单个随机分布(图3)。将测定的N-2菌株16S rRNA基因序列GenBank accession number MT084039在NCBI数据库中进行序列相似性比对,选取BLAST中相似度最高的10株细菌序列,利用MEGA 5.05计算细菌序列相似度,并利用邻接法(neighbor-joining method)构建细菌系统发育树,如图4所示。菌株N-2与球形赖氨酸芽孢杆菌(Lysinibacillus sphaericusNR 042073.1)亲缘关系最近。

表2 6株菌培养20 h时氨氮去除率Table 2 Degradation rate of ammonia nitrogen of six strains cultured for 20 h
2.2 N-2菌株对氨氮浓度耐受性分析
按照1.2.5方法通过调节水样中铵离子浓度来测定N-2菌株对不同氨氮浓度的耐受能力和去除能力,分析结果如表3所示。结果可见,当氨氮浓度为50 mg/L时,培养10 h后,氨氮去除率可达82.1%;氨氮浓度为100 mg/L时,培养10 h氨氮去除率为68.2%;当氨氮浓度高达500 mg/L时,仍有54.6%的氨氮去除率;当氨氮浓度大于1000 mg/L,菌株N-2生长繁殖受到一定程度的抑制,OD600nm值不再随着氨氮浓度的增高而增高,且此时氨氮去除率较低,氨氮去除效果不明显;当氨氮浓度达到8000 mg/L时,菌株繁殖量下降。结果表明,菌株N-2具有极高的氨氮耐受性,当氨氮浓度为6000 mg/L时,菌株仍具有一定的生长繁殖能力;在氨氮去除能力方面,当模拟废水氨氮浓度为1000 mg/L时,菌株仍具有36.5%的氨氮去除效果。为了发掘菌株N-2除氨氮的潜力,并考虑到培养基中其他成分对于菌株繁殖的供给能力,将培养条件优化实验的培养基氨氮浓度设置为100 mg/L。此时,在初始培养条件下菌株N-2对氨氮的去除率为68.2%。

图1 6株菌生长曲线对比图Fig.1 Comparison of growth curves of six strains
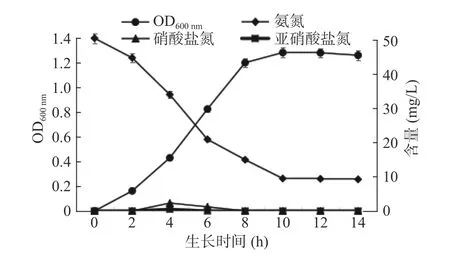
图2 N-2菌株的生长量、氨氮、硝酸盐氮、亚硝酸盐氮变化情况Fig.2 N-2 strain growth, ammonia nitrogen, nitrate nitrogen,nitrite nitrogen changes
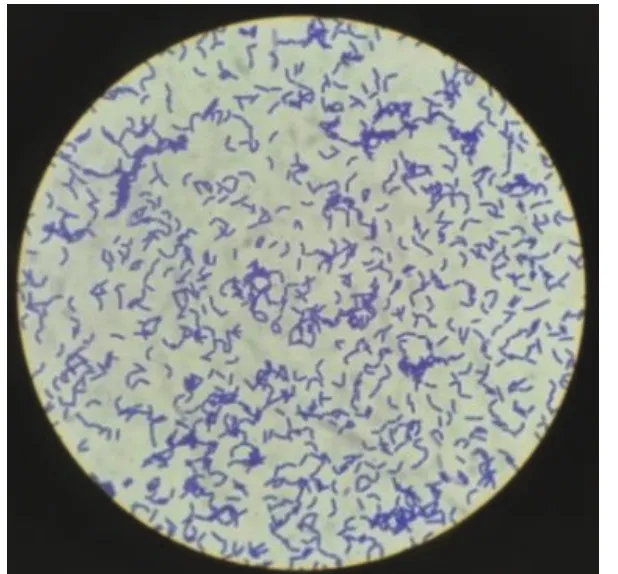
图3 光学显微镜下菌株N-2革兰氏染色图Fig.3 Gram stain photo of N-2 under light microscope
2.3 不同培养条件对氨氮去除率的影响
2.3.1 不同pH对N-2菌株氨氮去除率的影响 微生物各项生命活动都与酶反应息息相关,pH直接影响各种酶活力,在最适pH条件下,才可能发挥最佳酶活。如图5A所示,当培养基pH为5时,菌体生长繁殖受到明显抑制,氨氮去除率几乎为0;当pH大于6时,氨氮去除能力不断提高,pH为8时,氨氮去除率最大,达到77.0%。实验结束时,测定初始pH为6.0、7.0、8.0和9.0四组发酵液的终止pH,均为7.8左右。结果表明,N-2菌株最适pH为8.0左右,说明N-2菌株适合在微碱性环境下生长代谢。
2.3.2 不同温度对N-2菌株氨氮去除率的影响 发酵温度主要影响细胞酶活力,温度过高或过低都会降低酶活;发酵温度适宜,菌株才会最大限度利用培养基中营养物质。如图5B所示,当N-2菌株在培养温度为28~30 ℃时,生长量逐渐增多,氨氮去除率不断增大;当N-2菌株在培养温度为30~40 ℃时,生长量呈下降趋势,氨氮去除率不断降低。结果表明,最适温度为30 ℃,此时对氨氮的去除能力达到最大值82.0%。

图4 菌株N-2基于16S rRNA基因序列的系统发育树Fig.4 Phylogenetics tree based on 16S rRNA gene sequence of strain N-2
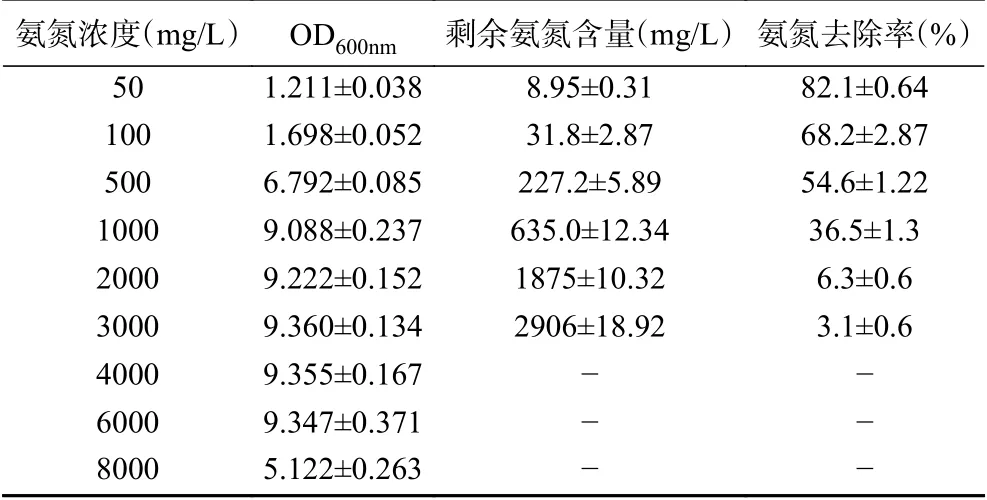
表3 菌株N-2在不同氨氮条件下的生长和去除性能Table 3 The growth and removal situation of strain N-2 under different concentrations of ammonia nitrogen
2.3.3 不同碳氮比对N-2菌株氨氮去除率的影响 碳氮比(C/N)是指培养基配制时,碳元素与氮元素物质的量比值。在微生物发酵培养中,C/N会直接影响微生物生长和发酵产量。如图5C所示,当N-2菌株在C/N为5~10时,生长量逐渐增多,氨氮去除率不断增大;当N-2菌株在C/N为10~25时,生长量呈下降趋势,氨氮去除率不断降低。结果表明,C/N为10时更适于N-2菌株的生长繁殖,此时氨氮去除率最大达到81.0%。
2.3.4 不同转速对N-2菌株氨氮去除率的影响 N-2菌为异养好氧型芽孢杆菌,培养过程需要保证氧气的供给。摇床转速与溶氧量呈正相关。如图5D所示,通过调整摇瓶培养转速,观察溶氧对N-2除氨氮的影响。当转速由160 r/min提高到180 r/min时,随着溶氧量增高,菌体生长量增高,氨氮去除率有所提高,由67.6%提高到73.5%;但当转速进一步提高后,随着溶氧量的急剧升高,细菌会产生大量的代谢产物,影响菌体生长,氨氮去除率降低。结果表明,最适转速为180 r/min,此时对氨氮的去除能力也达到最大值73.5%。
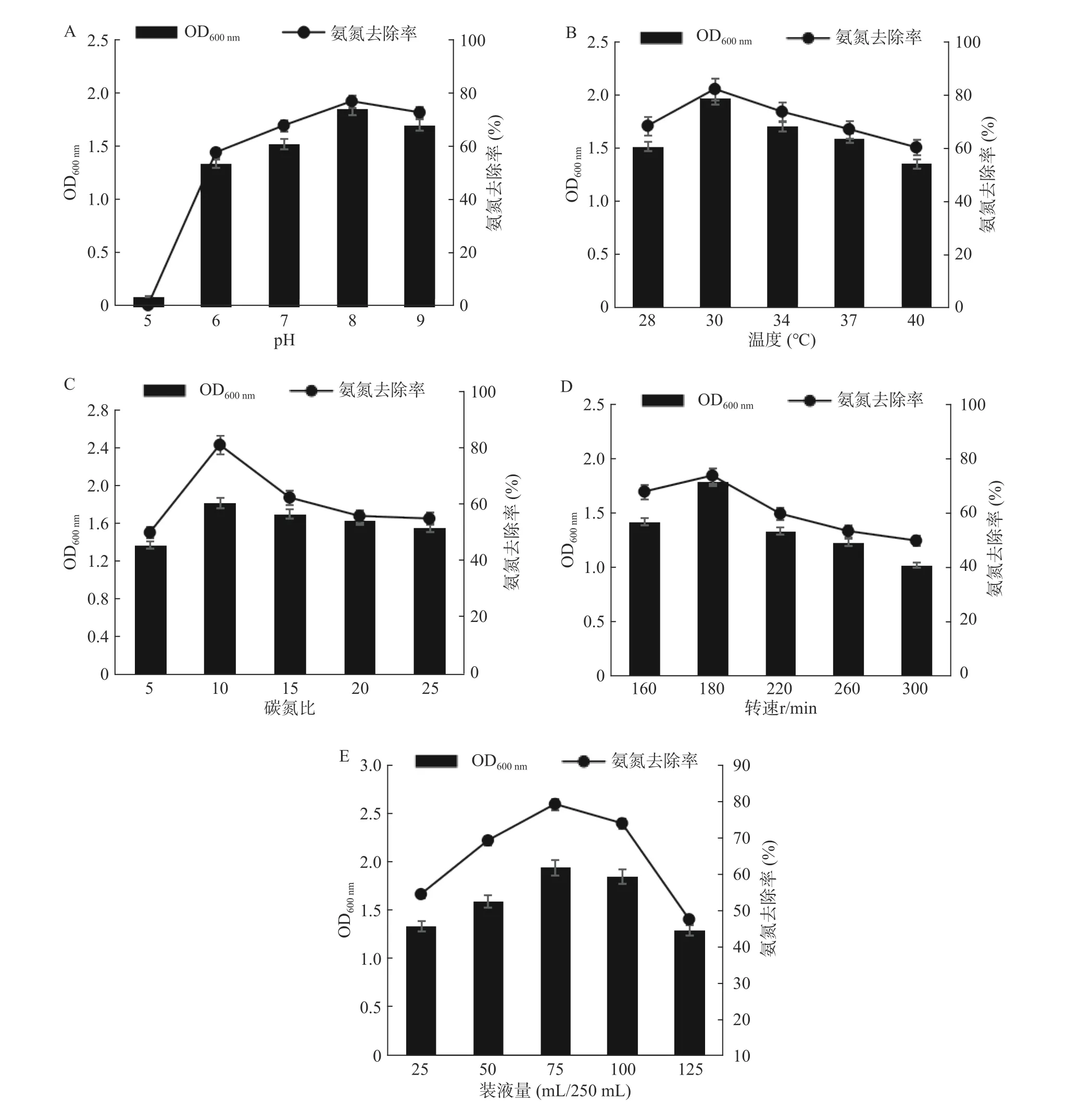
图5 不同pH(A)、温度(B)、碳氮比(C)、转速(D)、装液量(E)对N-2菌株发酵量及氨氮去除率的影响Fig.5 The effects of different pH (A), temperature (B), carbon-to-nitrogen ratio (C), rotation speed (D), and liquid volume (E) on the fermentation amount and ammonia nitrogen removal rate of N-2 strain
2.3.5 不同装液量对N-2菌株氨氮去除率的影响 提高摇瓶装液量在为细菌生长繁殖提供更多营养物质和资源的同时,也影响了溶氧量,因此适宜的装液量有利于更好的发挥菌株性能。如图5E所示,当N-2菌株在装液量为25~75 mL/250 mL时,菌体生长量逐渐增多,氨氮去除率也在不断增加;当装液量为75~125 mL/250 mL时,菌体生长量呈下降趋势,氨氮去除率不断降低。结果表明,在最适装液量75 mL/250 mL时,营养物质与溶氧量达到很好的平衡,菌体量最多,因此N-2氨氮去除能力达到最大值79.2%。
2.4 培养条件的正交试验结果
由上述单因素实验结果可知,在其他培养条件相同的情况下,分别进行pH为8、转速180 r/min、装液量75 mL/250 mL、培养基C/N 10以及培养温度30 ℃的单因素优化调整后,菌株N-2对氨氮的去除率依次为77.0%、73.5%、79.2%、81.0%和82.0%。其中装液量、培养基C/N和培养温度对菌株N-2氨氮去除率影响较大,因此,对这三个因素做进一步优化处理。根据正交表L9(34),设计一个四因素三水平的正交试验。
在正交试验中,各优化条件极差的大小反映了各个条件对菌株N-2除氨氮能力影响的主次,极差越大,影响越主要。由表4中的极差R可看出,初始温度、碳氮比和装液量这3个条件对除氨氮菌株发酵影响的主次因素依次为:C(装液量)>B(碳氮比)>A(温度);由表4中各因子的k值来看,最优组合为A2B2C1,即温度31 ℃,碳氮比10,装液量62.5 mL/250 mL。由表5可得,在α=0.05的水平上,碳氮比与装液量对菌株N-2去除氨氮有显著性影响(P<0.05),温度影响不显著(P>0.05)。
鉴于其最优组合A2B2C1不在正交试验设计表中,故对其最优组合进行试验验证,试验重复3次。结果表明,在最优条件下培养,对氨氮浓度为100 mg/L的模拟废水10 h时氨氮去除率为91.90%(图6A),高于其他实验组,结果可靠。因此,菌株N-2的最佳氨氮去除条件为接种量5%,培养基C/N 10,pH8.0,装液量为62.5 mL/250 mL,温度31 ℃,转速180 r/min。
为有效验证N-2菌株在低、中、高不同氨氮浓度废水中的最佳氨氮去除效能,以正交优化最优氨氮去除条件为基础,分别在氨氮浓度为50、100、500 mg/L的模拟废水中培养10 h后取样测定菌株氨氮去除率,结果见图6。结果表明在此最优培养条件下,菌株N-2对水体中氨氮的去除能力有了大幅度提高。初始氨氮浓度为100 mg/L时,由68.2%提高为91.0%(图6A),增幅为33.4%;初始氨氮浓度为50 mg/L时,由81.2%提高为97.7%(图6B),增幅为20.3%;初始氨氮浓度为500 mg/L时,由54.6%提高为71.7%(图6C),增幅为30.2%。

表4 正交试验结果Table 4 Results of orthogonal test
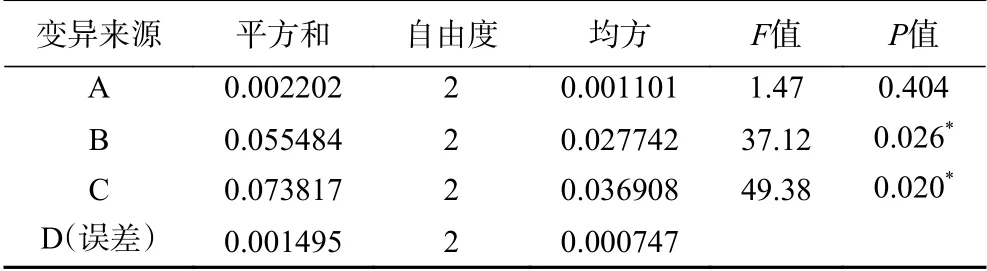
表5 正交设计方差分析Table 5 Orthogonal design variance analysis
3 结论与讨论
目前废水中氨氮的生物法去除多以利用菌株的硝化与反硝化作用为基础,生物硝化反硝化[24]法中无论是自养型还是异养型的硝化细菌都生长缓慢且有效菌体浓度低,并且对温度、pH和有机物浓度等外界因素敏感,直接影响硝化作用效果[25],菌株代谢产生的亚硝酸盐和N2O仍会污染环境,需二次处理。在氨氮废水处理方面,虽已有很多其他除氨氮菌被研究发现,但多由于氨氮耐受能力差或培养成本高而不适用于工业废水的处理。
为找到更适用于高浓度氨氮工业废水污染治理的菌种资源,本研究从受发酵工业污水污染严重的土壤中,通过初筛、复筛等一系列实验手段获得一株高浓度氨氮耐受的除氨氮球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)N-2。通过菌株N-2氨氮浓度耐受力测定结果表明,菌株N-2具有极强的氨氮耐受力和去除能力,在氨氮初始浓度达到500 mg/L时,该菌氨氮去除率为71.7%,明显高于张冠根等[19]21.90%的去除效果;在氨氮浓度为6000 mg/L时菌株N-2仍能大量繁殖,8000 mg/L时稍显抑制,该浓度已远高于通常情况下1000 mg/L左右氨氮浓度的工业废水,菌株N-2表现出了潜在的处理高浓度氨氮工业废水的产业化应用价值;在菌株N-2的整个发酵过程中并未发现硝酸盐氮和亚硝酸盐氮的积累,因此推测其是利用细菌的同化作用将氨氮转化为自身所需的营养物质;菌株N-2较其他已报道的可去除氨氮的芽孢杆菌[26-27]去除更加快速,为更好地发挥菌株性能,以菌株氨氮去除率为指标,通过单因素、正交试验对N-2菌株氨氮去除条件进行优化,优化后在C/N为10,温度为31 ℃,pH8.0,转速180 r/min和装液量62.5 mL/250 mL的培养条件下培养10 h,该菌对100 mg/L氨氮的最大去除率为91.0%,对50 mg/L的氨氮最大去除率可达97.7%,对500 mg/L的氨氮最大去除率可达71.7%。
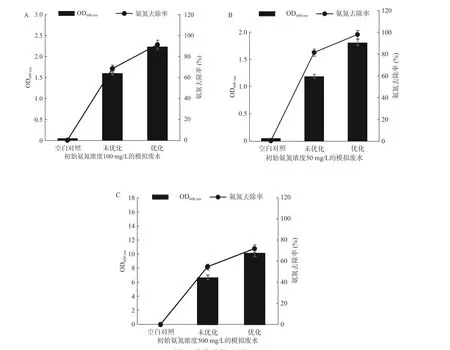
图6 优化效果对比图Fig.6 Comparison chart of optimization effect
综上所述,菌株N-2在模拟高浓度氨氮的废水处理中表现优异,具有潜在的处理高浓度氨氮工业废水的能力,是不可多得的优秀菌种资源。但菌株N-2吸收氨氮的机理及细胞内氨氮的转化途径仍需进一步研究,培养成本仍可进一步降低,针对具体的高浓度氨氮工业废水水质需研发最适宜的菌剂剂型及接种方式,距离实际应用仍具有较大差距。
