基于低场核磁的紫薯片真空冷冻干燥过程中水分变化
2021-06-17孙江丽朱洪梅
孙江丽,李 瑞,朱洪梅
(山西师范大学食品科学学院,山西临汾 041004)
紫薯果肉呈紫色至黑紫色,它除了具有普通红薯含有的营养物质外,还富含有大量的花青素[1],可被用做提取天然花青素的原料。紫薯花青素还具有多种保健功能,能够防癌[2]、抗氧化[3]、降低血压[4]、抑制胆固醇生成[5]等作用。目前,市场上的紫薯加工产品种类繁多,开发出来的产品有紫薯脆片、紫薯粉、紫薯饼、紫薯清酒等[6-7]。
干燥是紫薯的重要加工方式。真空低温油炸的产品色泽金黄、质地优良,但会对营养物质造成破坏[8]。常压冷冻干燥速率低[9],产品品质不稳定,经常出现组织塌陷、变色、加快有效成分降解等现象[10]。真空冷冻干燥技术对保持冻干材料外观形状有着很好的作用,还能使食品色、香、味和营养成分完好的保留下来,脱水彻底,干制品重量轻、体积小、复水快、食用方便[11],克服真空低温油炸和常压冷冻干燥加工工艺带来的缺陷,本研究利用真空冷冻干燥技术加工紫薯片。
在干燥过程中,物质内部水分变化及其迁移规律是现代科学研究的难点和热点,低场核磁的引用使得水分变化迁移研究变得容易,低场核磁共振(LFNMR)技术是一种快速无损、无需侵入的检测技术[12],它已经被广泛应用于各个领域[13-14]。低场核磁信号强度与氢质子含量成正比,可以通过检测样品中的氢质子检测对应水分含量,氢质子先吸收射频能量,随后释放能量,对于性质不同的样品,能量释放的快慢是不相同的,通过检测出的信号差别就可以寻找规律[15-16]。本实验采用低场核磁共振技术分析真空冻干燥过程中紫薯片的水分变化,以期为紫薯脆片的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜紫薯 采购于临汾万佳福五一路超市,挑选个体完整,直径大小均匀一致,无虫害、无腐烂、无机械损伤的紫薯作为实验原料。
SCIENTZ-10N型冷冻干燥机 宁波新芝生物科技股份有限公司;XB 220A型电子天平 上海天平仪器技术有限公司;NMI20-040V-型I低场核磁仪
上海纽迈电子科技有限公司;LEICA EZ4D型体视显微镜 北京中显恒业仪器仪表有限公司;CR-10型色差计 柯尼卡美能达公司。
1.2 实验方法
1.2.1 样品制备与处理 将紫薯清洗干净,沿圆形横截面切为5 mm的厚度,用于低场核磁共振测定的薄片再切为1 cm宽的条状,在-37 ℃条件下进行干燥,真空度设置为100 Pa,根据预试验结果,真空冷冻干燥时间分别设定为0、1.5、3.0、4.5、6.0、7.5和9.0 h,每个处理样品设置十个重复。
1.2.2 低场核磁共振检测 将处理好的七组样品进行核磁共振扫描(NMR)分析。把条状样品以垂直于试管底面的方向放置,选用低场核磁NMR专用试管直径为10 mm,然后将装有待测样品的试管置于永磁场中心位置的射频线圈,机器的温度稳定在32 ℃左右时,利用FID矫正分析软件的初始参数,先确定中心频率(SF)和90 °脉宽,再进行单次采样[17]。用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列进行扫描。参数设置:RE=1,NECH=5000,NS=64,SW=100 kHz,RFD=0.05 ms,RGI=20 db,PRG=2,DRGI=3。经过10 000次迭代拟合,采集到T2弛豫信息。
低场核磁共振成像(MRI)需要先预扫描标样,再成像确定层数,将样品置于磁场中心并保证每个样品放在同一位置和方向,最后扫描样品进行成像,将MRI得到的黑白图片,通过调节黑白色和不同灰度处理为伪彩图[18],以便更清晰地观察不同部位的水分含量。参数设置:FP=80 mm,TR=300 ms,TE=18.125,S=6,W=2 mm,NS=16。
1.2.3 体视显微镜观察 将冷冻干燥处理过的六组样品和新鲜紫薯片在冻结的状态下,沿横断面切成薄片,放在样品台上,使用连续变倍体视显微镜(莱卡EZ4D)放大倍数分别为16、20、25、30和35倍,按照从低到高的顺序观察其内部水分移动的情况和微孔结构,在清晰的倍数20倍下拍照。
1.2.4 含水量测定 真空冷冻干燥的紫薯片,含水量的测定参照GB 5009.3-2016《食品安全国家标准食品中水分的测定》[19]。每个样品组放置三个相同的紫薯片,分别对0、1.5、3.0、4.5、6.0、7.5和9.0 h干燥时间的样品称重,含水量的计算公式为:

式中:Xt表示t时刻物料的含水量,g/g;mt表示t时刻物料的重量,g;mg表示物料完全干燥后的重量,g。
1.2.5 色差测定 利用CR-10型色差计测定不同冷冻干燥时间条件下的紫薯片色差,每组放置三个样品。L*代表明暗度(黑白色),阈值为0~100,0表示黑色,100表示白色;a*代表红绿色,b*代表黄蓝色,阈值都为-128~+127,-a*表示接近绿色,+a*表示接近红色,-b*表示接近蓝色,+b*表示接近黄色;ΔE为两点之间颜色的变化值[20]。色差的计算公式为:
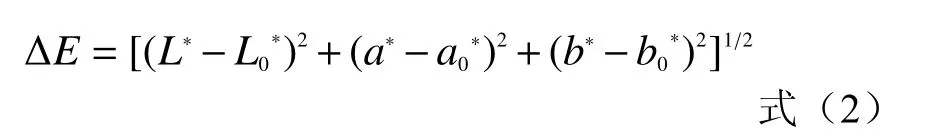
式中:L0*、a0*、b0*表示新鲜紫薯片的测定值;L*、a*、b*表示冻干处理过的紫薯片测定值。
1.3 数据统计
数据采用Office Excel 2019进行处理,运用SPSS 20对数据进行多重比较,使用Origin 8.0和Adobe Photoshop CS6进行作图。
2 结果与分析
2.1 不同冷冻干燥时间条件下NMR分析水分存在形式变化
真空冷冻干燥的紫薯片有三种形态的水分,其与物料结合的紧密程度不一样,横向驰豫时间T2越短,说明水分的自由度越小且与物料结合得越紧密,其在干燥过程中越难被脱除,反之则越容易[21]。结合水的横向驰豫时间最短,半结合水次之,自由水最长。根据T2把水分分为:T21(0.01~0.5 ms)为结合水,T22(0.5~5 ms)为半结合水,T23(5~1000 ms)为自由水,且分别由T2反演谱曲线上的3~5个波峰表示,根据不同弛豫时间信号幅值变化来反映样品真空冷冻干燥过程中水分变化的情况[22]。不同形态水分含量由不同峰面积表示,因为低场核磁共振信号量代表物料中的氢质子的数量,所以曲线上各个峰覆盖的信号量间接表示对应的三种状态水分的相对含量,总信号量表示总水分的相对含量。
在图1中,紫薯片干燥过程中0~3 h,水分变化较大,水分的组成形式也发生变化,自由水减少较多,随着干燥进行,T23峰显著变小,T21峰也向T22转移,整个T2反演图谱逐渐向T22峰移去。
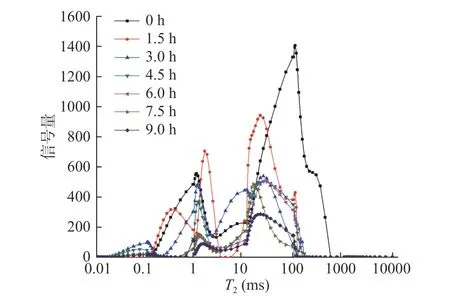
图1 真空冷冻干燥过程中紫薯片横向驰豫时间T2反演谱Fig.1 Inversion spectra of lateral relaxation time of purple sweet potato slices during vacuum freeze drying
从图1和图2得出,在整个真空冷冻干燥的过程中,紫薯片中三种形态的水分均被脱除了一部分,自由水占主体,约是总含水量的2/3,因而最容易被脱去,且在干燥开始的前1.5 h内自由水变化很大,干燥除去的主要是自由水,结合水也减少了一部分,而半结合水却呈增长的趋势,可能由于在干燥过程中自由水水分持续减少,部分结合水向半结合水转化[23]使半结合水增多。1.5~3.0 h,结合水和自由水有一定量的减少且失水速度较1.5 h前有所减缓,半结合水仍继续增加并达到最大值。干燥至4.5 h时,结合水和自由水均有少量减少,半结合水也开始下降且为三种形态的水分中减少速度最快的,是因为已失去大量自由水,紫薯片内部结合水向半结合水转化速率也减慢,干燥过程中,半结合水量升华速率大于转化率,半结合水也开始下降,在马铃薯切片干燥过程中半结合水量也呈先增大后减小的变化趋势[24]。结合水在4.5~6.0 h时基本保持不变,直到9.0 h,红薯片微波干燥360 s后T2图谱结合水量也很少[25];因为其含量很少,并与物料结合紧密,很难被干燥脱除,并且减少了微量的自由水;而半结合水减少了一大部分。7.5 h时,减少了少量的半结合水,自由水失水速度又开始加快,因为半结合水与结合水含量基本降至最低,且与物料结合紧密很难再被脱除,而自由水与物料结合疏松,因此,自由水脱除较多。在干燥最后的产品中,自由水含量最多,半结合水含量次之,结合水含量最少,因为整个紫薯片干燥过程中,结合形态水分向半结合水转化且与物料结合较为紧密,导致干燥最后,半结合水比结合水含量多。
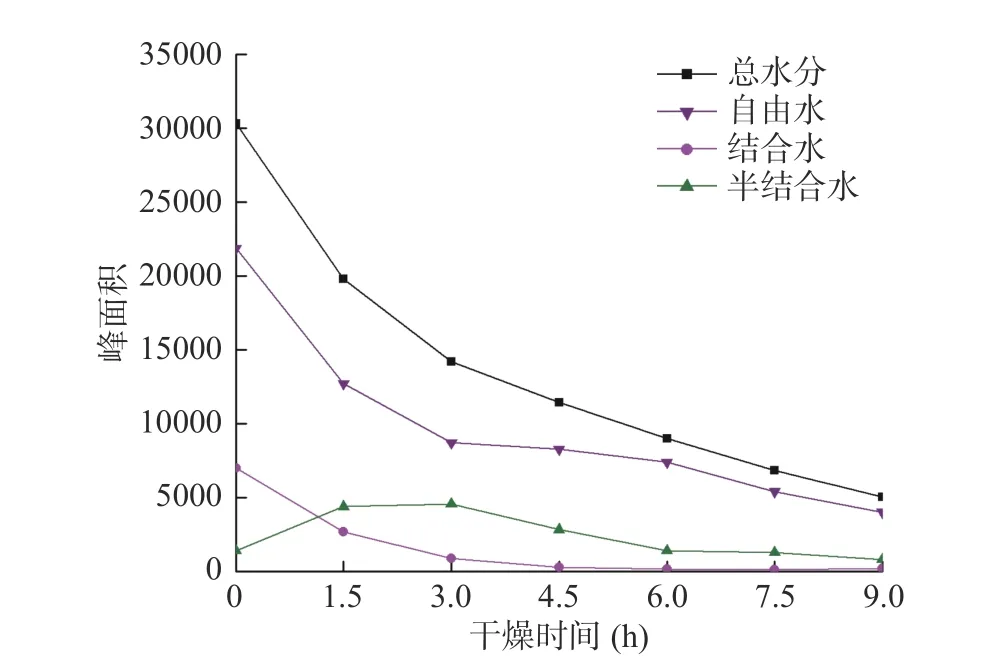
图2 真空冷冻干燥过程中紫薯片不同形态水峰面积变化曲线Fig.2 The change curve of different shapes water peak area of purple sweet potato slices during vacuum freeze drying
2.2 不同冷冻干燥时间条件下MRI分析水分移动情况
低场核磁共振成像(MRI)得到的伪彩图可以进一步直观地观察真空冷冻干燥紫薯片内部水分变化的情况,在紫薯片脱水过程中,不同颜色表示各区域相对含水量高低情况[26],图像清晰度表现为含水量的多少,图像亮度表现为氢质子活跃度。
从七个时间梯度的MRI伪彩图3可以观察到,紫薯片各个区域中水分信号强弱显著不同,与对照相比,干燥1.5 h的样品,水分含量减少较大,紫薯片图像绿色减弱明显,水分主要移动至甘薯表皮,表皮水分含量明显提高,表皮部分呈红色。而3.0 h时,甘薯片轮廓虽很清晰地呈现,但图片的背景蓝色与0 h相比亮度变差,图像亮度表现为氢质子活跃度[23],说明紫甘薯片总体水分减少明显,紫甘薯表皮水分含量仍是整个甘薯片水分含量最高的部位,说明水分干燥过程不仅涉及水分存在形式变化,而且还有水分迁移过程,紫甘薯片干燥时水分很容易迁移至紫甘薯周皮,这与甘薯块根结构有关,植物韧皮部中含有大量纤维成分[27],纤维与水分的结合较为紧密,该实验结果与NMR分析结果一致,半结合水含量在该时间段达到最多。甘薯干燥4.5 h后,伪彩图片紫甘薯周边形状越来越模糊,各部位水分含量均有下降,此时,自由水大量减少,结合水含量基本降至最低,半结合水开始被脱除。在6.0 h时,水分进一步减少,整个图片的清晰度有所降低且亮度也逐渐变差;图片亮度越差的区域说明氢质子的活跃度越低[28],图像亮度低但可以大致分辨出紫薯片的形状,随着干燥的进行,半结合水量进一步被脱除。7.5 h时,紫薯片轮廓周围已经有部分消失,消失部分与图片混为一体,而紫薯表皮红色部分又变得很清晰,该时间段自由水又减少了一部分,半结合水基本不变,使绿色部分进一步模糊,红色部分突出。干燥9.0 h时,图片模糊紫薯片的形状难以分辨,只留下边缘的一小部分模糊的绿色区域和周皮部位的一点红色,这时NMR分析不同形态水分降至最低。干燥的天花粉MRI图,同样以蓝色作为背景,随着水分的扩散,图片亮度、清晰度逐渐下降且代表不同形态水分的颜色也在消失[26]。

图3 真空冷冻干燥过程中紫薯片MRI图Fig.3 MRI images of purple sweet potato slices during vacuum freeze drying
2.3 不同冷冻干燥时间条件下紫薯片微观结构分析
真空冷冻干燥把含有水分的物料,预先冻成固体,然后在真空条件下使其直接升华为气体,而物质本身留在冻结时的冰架子中,因而干燥前后保持了原来的形态结构[29]。

图4 真空冷冻干燥过程中紫薯片微观结构图Fig.4 Microstructure images of purple sweet potato slices during vacuum freeze drying
使用连续变倍体视显微镜分别对七个时间梯度的冻干紫薯片横截面进行了观察。如图4为20倍显微镜下紫薯片的显微结构,可以看到新鲜的紫薯片含水量很大,整体结构均匀一致,呈水渍状,随着冷冻干燥时间增加至3.0 h时,甘薯物料水分蒸发,甘薯片总体积变小,甘薯物料水分蒸发时水分先向表皮移动,甘薯内部干物质也随水分向表皮靠拢,真空冷冻干燥处理的胡萝卜片表面也存在升华前沿,而内部的水分仍呈冻结状态[30],因为水分减少体积变小,表皮致密,表皮结构比甘薯内部致密。4.5 h后,随干燥去除水分越多,紫甘薯片体积越小,甘薯组织向两侧表皮移动,因为期间水分升华了,干物质聚集表皮附近,这时水分含量越来越少,水分挥发时动力不能带动干物质移动,水分升华后干物质出现疏松多孔的结构且逐渐增加。干燥至7.5 h时,出现了较大的孔隙,由于紫薯片中不同形态水分分布不均匀,出现较大孔隙的区域自由水含量高且很容易被除去,随着冻干的进行,失去的自由水增多,从而形成较大的孔隙。9.0 h时,大范围组织已经被干燥完毕并布满许多大小不均一的孔径,此时三种形态水分含量降至最低,残留的结合水和半结合水与物料紧密结合很难被除去。同时,紫甘薯片的疏松多孔结构也赋予冷冻甘薯片良好的口感。
2.4 不同冷冻干燥时间条件下紫薯片含水量变化
由图5可知,随着冷冻干燥时间的增加,紫薯片含水量越来越少,重量逐渐变轻,干物质比重增大,与NMR、MRI和微观结构分析结果一致。T2反演谱中,总水分的峰面积渐渐变小,自由水、半结合水和结合水三种形态水经过不同形式的转化,在干燥最后,峰面积降至最低。在MRI的伪彩图3中,随着干燥的进行,由于氢质子活跃度和数量降低,各图片亮度越来越暗,清晰度下降,表明水分含量也在下降。在6.0 h后图片清晰度很差,水分含量分析显示紫薯片中水分含量接近0.2 g/g,继续干燥至9 h,水分含量降至0.1 g/g。从微观结构中观察到,冷冻干燥处理的紫薯片两侧的疏松多孔结构逐渐增多,水分不断从内部扩散到紫薯片表面,引起水分减少。微波真空冷冻干燥怀山药过程中的水分扩散变化趋势与本研究结果相似[17]。
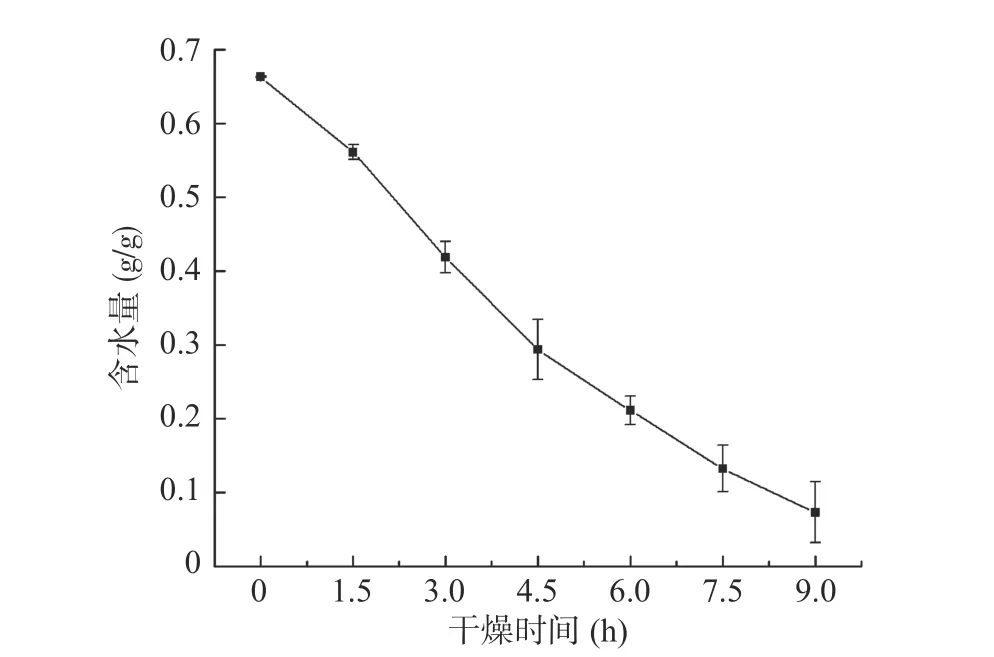
图5 真空冷冻干燥过程中紫薯片含水量曲线Fig.5 Curve of water content of purple sweet potato slices during vacuum freeze drying
2.5 不同冷冻干燥时间条件下紫薯片L*、a*、b*和ΔE值分析
图6中可知,相对于新鲜紫薯片鲜艳的色泽,干燥9 h时,L*值最大,表明干燥后颜色亮度有所差别,水分被脱除,紫薯片颜色变亮,而在干燥前7.5 h时,紫薯片亮度变化差异不显著,说明紫薯片在冷冻干燥后亮度显著增大,冻干可以提高甘薯片的亮度,邓资婧[31]对干燥紫薯全粉进行了色差测定,与本研究有相似结果。在真空冷冻干燥过程中,紫薯片红度值都比较高且七组样品红度变化差异不显著,说明冻干处理对紫甘薯片主要色泽红色影响不大。七组紫薯片均有低的黄度值,使样品呈现出淡黄色,样品干燥最后b*值与对照差异不大,进一步说明冻干过程对紫薯色片泽影响较小。三种色泽计算得到ΔE值,干燥9.0 h的紫薯片ΔE值与其他六组样品相比差异显著(P<0.05),因为冻干9.0 h的紫薯片红度值和黄度值基本无变化,而亮度明显增大,导致色差变化差异。
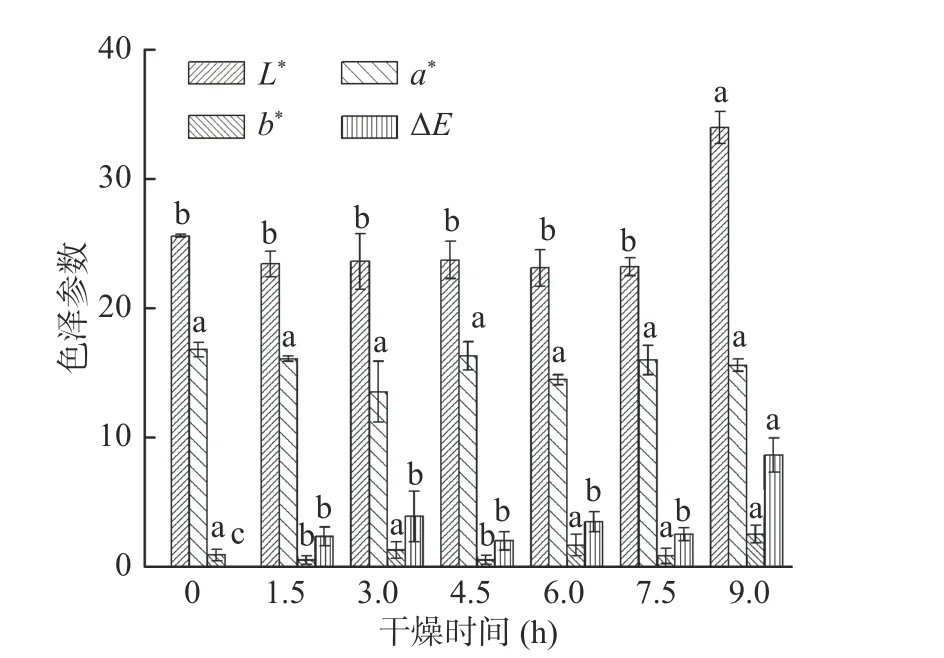
图6 真空冷冻干燥过程中紫薯片的L*、a*、b*和ΔE值Fig.6 Chromatic aberration (L *, a *, b*and ΔE) of purple sweet potato slices during vacuum freeze drying
3 结论
本研究对紫薯片冷冻干燥过程中水分形态和水分含量变化进行分析,NMR结果分析表明,紫薯片自由水约占总含水量的2/3,干燥过程的变化自由水为主,结合水与半结合水含量较低且与物料结合紧密,其变化较小,部分结合水会向半结合水转化,使T21峰向T22峰转移,从三种形态水分的峰面积变化可以得出不同形态水分之间的相互转化及其迁移规律。MRI得到的伪彩图反映了不同形态的水分在紫薯片中分布的位置,随着水分不断地被脱除,图片亮度和清晰度逐渐变差,紫薯片边缘部分含水量最高并显现出红色区域,能够直观地看出物料中各部位的水分含量变化和氢质子活跃度。在6.0 h后图片清晰度很差,水分含量仅为0.2 g/g,继续干燥至9.0 h,水分含量降至0.1 g/g。
体视显微镜从微观角度观察了紫薯片内部水分扩散的情况,失去水分的干物质中形成很多大小不同的孔状结构,真空冷冻干燥对维持物料原来的形状具有很好的作用,且随干燥时间延长,对物料的色泽影响较小,可以提高紫薯片亮度,对产品色泽进行改善,使物料具有更好的加工性能。本实验只从微观结构和色泽两方面来研究真空冷冻干燥效果,后续的实验还需对其营养组分、花青素、芳香物质等方面进行测定,来深入探究真空冷冻干燥紫薯片效果。
