DFG-STYK1/NOK对小鼠胚胎成纤维细胞系NIH3T3增殖以及细胞周期G1/S的影响
2021-06-17陈建苗
陈建苗
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原生物学系, 北京 100005)
受体酪氨酸激酶(receptor tyrosine kinases,RTKs)是一种对细胞增殖、分化、细胞周期、胚胎形成、血管生成和新陈代谢等细胞活动的进行具有重要意义的蛋白酶[1-2]。因此,RTKs表达异常会引起多种疾病和肿瘤[3-4]。RTKs胞外区与配体结合,激活RTKs胞内区的激酶活性,使含有Src同源区2(Src homology 2,SH2)和磷酸酪氨酸结合区(phosphotyrosine binding,PTB)结构域的蛋白与胞内区段结合被激活蛋白酶活性[1]。NOK(the novel oncog-ene with kinase-domain,NOK)是一种新型受体酪氨酸激酶。研究发现 NOK具有致癌作用[5]。对多种肿瘤的发生发展以及预后具有重要意义[6-8]。Asp-Phe-Gly(DFG)基序位于激酶活性中心活化环的起始部位,由天冬氨酸残基、苯丙氨酸残基和甘氨酸残基3个氨基酸残基组成,对调节激酶活性具有重要意义[9-11]。然而,研究发现,NOK激酶中没有此结构。于是,本研究拟通过同源配对定点加入DFG基序,以探究DFG-NOK对NIH3T3细胞增殖和细胞周期G1/S的影响。
1 材料与方法
1.1 材料
小鼠胚胎成纤维细胞系NIH3T3(中国医学科学院基础医学研究所细胞资源中心);新生牛血清(兰州民海生物工程有限公司);DMEM培养基(Gibco公司);Neofect 转染试剂(北京码因科技有限公司);MTT试剂(Sigma公司);CCK8试剂(MedChenExpress公司);Western blot相关试剂和PI染料(北京鼎国昌盛生物技术有限公司);PCR引物、pcDNA3.0-DFG-NOK的构建及测序(上海生工公司);感受态大肠杆菌(天根生化科技有限公司);限制性内切酶和定点突变试剂盒(TaKaRa公司);抗β-actin和NOK抗体(Proteintech公司);抗Akt、p-Akt、 Erk、p-Erk和cyclin D1抗体(北京中杉金桥生物技术有限公司);抗STAT1抗体(北京博奥森生物技术有限公司);抗p-STAT1抗体(Bioworld公司);抗STAT3和p-STAT3抗体(Cell Signaling公司);抗JAK3和p-JAK3抗体(Anbo公司)。
1.2 方法
1.2.1 细胞的培养与转染:将NIH3T3细胞置于含有10%新生牛血清DMEM的50 mm培养皿中,于37 ℃,5% CO2培养箱中培养,3 d传代1次。贴壁细胞达到90%汇合后,接种到30 mm培养皿中,24 h后换液。用Neofect高效转染试剂顺时转染NIH3T3细胞,分别转入pcDNA3.0、 pcDNA3.0-NOK和pcDNA3.0-DFG-NOK,转染6 h后换液,48 h后收细胞。
1.2.2 定点突变:突变使用定点突变试剂盒,按说明书操作。
1.2.3 质粒的构建:NOK激酶cDNA全长和HA(人流感病毒血凝素)标签蛋白融合,插入到pcDNA3.0载体的HindⅢ和XbaⅠ位点形成pcDNA-NOK质粒;DFG-NOK和FLAG标签蛋白融合,插入到pcDNA3.0载体的HindⅢ和NotⅠ位点形成pcDNA3.0-DFG-NOK质粒。pcDNA-DFG-NOK质粒的上游引物5′-ATAAGCTTATGGGCATGACACGGATG CT-3′,下游引物5′-ATGCGGCCGCTCACTTATCGT CGTCATCCTTGTAATCAAGCATGCTATAGTTGTAGA-3′。PCR反应扩增30个循环,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min。扩增产物经双酶切再亚克隆进pcDNA3.0载体,在感受态大肠杆菌中转化克隆,提取质粒并对扩增片段进行测序分析。
1.2.4 Western blot检测蛋白表达:收集细胞,裂解液冰上裂解30 min,12 000 r/min离心5 min收取蛋白,BCA工作液紫外分光光度计检测蛋白样品浓度,每孔蛋白上样量15 μg,100 ℃沸水浴5 min。12% SDS-聚丙烯酰胺凝胶分离胶电泳,转膜,5%脱脂牛奶37 ℃封闭1 h,一抗按比例用0.5%牛奶稀释后4 ℃孵育过夜,用1×TBST洗4次,每次5 min,37 ℃孵育二抗1 h,清洗,ECL发光液反应,暗室曝光。
1.2.5 CCK8法检测增殖:12孔板培养NIH3T3细胞,转染pcDNA3.0、 pcDNA3.0-NOK或pcDNA3.0-DFG-NOK,再将细胞铺置96孔板,培养48 h后,每孔加5 μL CCK8溶液,孵育1~2 h,酶标仪测定450 nm吸光度值;MTT法:12孔板培养NIH3T3细胞,转染pcDNA3.0、 pcDNA3.0-NOK或pcDNA3.0-DFG-NOK,再将细胞铺置96孔板,培养48 h后,每孔加10 μL MTT溶液,孵育4 h后弃上清,加入150 μL DMSO,在37 ℃摇床上振荡10 min,测定490 nm处吸光度(A)值。
1.2.6 Accuri C6流式检测细胞周期:收集2×106个细胞,1 000 r/min离心5 min,弃上清,加1 mL预冷的1×PBS重悬,1 000 r/min离心5 min,弃上清;加入0.3 mL预冷1×PBS,再逐滴加入3倍体积的4 ℃预冷的无水乙醇,轻轻振荡成单细胞悬液;-20 ℃固定1 h以上;4 000 r/min离心5 min去乙醇,PBS洗两遍,加100 μL 1×PBS重悬,加100 μL PI染色液避光染色10 min;流式细胞仪检测,保存为FCS文件格式,使用Modfit软件分析细胞周期分布。
1.2.7 同源比对:SWISS MODEL是一种同源建模服务器,根据NOK氨基酸序列同源构建蛋白三级结构,NOK的同源模板为成纤维细胞生长因子受体1(FGFR1),以FGFR1内DFG基序的位置,确定在NOK加入DFG基序的位置。
1.3 统计学分析

2 结果
2.1 DFG基序加入NOK的位置
根据其DFG基序位置确定NOK中DFG基序位置(图1)。将第269、270位G、L改为D、F,和第271位氨基酸组成DFG基序,对应于NOK cDNA第806、807、810位核苷酸G、A、A突变为A、C、T。
2.2 DFG-NOK对NIH3T3细胞增殖的影响
与瞬时转染pcDNA3.0组相比,瞬时转染pcDNA3.0-DFG-NOK的NIH3T3细胞组吸光度降低,增殖受到抑制(图2A,B)(P<0.05)。
2.3 DFG-NOK对NIH3T3细胞周期G1/S期的影响
与转染pcDNA3.0组相比,转染pcDNA3.0-DFG-NOK组,G1期所占比例升高,S期所占比例降低。DFG-NOK抑制细胞周期G1期进入S期(图3)(P<0.05)。
2.4 DFG-NOK对细胞信号通路和周期蛋白表达的影响
与转染pcDNA3.0组相比,转染pcDNA3.0-DFG-NOK组Erk、STAT1、STAT3和JAK3蛋白的磷酸化水平(图4A~C,E~H) 以及细胞周期蛋白cyclinD1表达水平均降低(图4D, I)。
3 讨论
NOK是一种新型受体酪氨酸激酶,包含422个氨基酸,镶嵌在细胞膜上,具有完整的胞内区、跨膜区和远小于其他受体酪氨酸激酶胞外区段的胞外区[5],它参与多种信号通路的激活,比如RAS-MAPK、PI3K-AKT和JAK-STAT等信号通路[12]。NOK在不同物种或组织器官中异常表达,人体内前列腺中的NOK表达量最高,小鼠体内小肠和结肠中表达量最高。293T和HeLa等细胞系中的NOK表达高于其他细胞系[5]。NOK在胶质瘤和鼻咽癌中激活PI3K-AKT信号通路[7-8]。此外,NOK对细胞周期也有重要作用,研究证明NOK可促进293T cyclin D1表达和细胞周期G1期进入S期[13]。
DFG分为两种构像DFG-in和DFG-on,存在于Src和P38等激酶中,对激酶活性起到重要作用[9-11]。比对NOK氨基酸序列发现其没有DFG基序。至今没有关于DFG基序和NOK激酶相关联的研究。基于以上科研背景,展开此项关于DFG-NOK的研究。
本研究选择NIH3T3细胞为研究对象,展开DFG-NOK对细胞信号通路、细胞周期及细胞增殖影响的研究。实验发现,NOK加入DFG基序后抑制增殖信号通路Erk、STAT3、JAK3的磷酸化和周期蛋白cyclin D1的表达;同时,也抑制NIH3T3细胞增殖和细胞周期由G1期进入S期。因此,推论NIH3T3细胞增殖的抑制可能是由于p-Erk、p-STAT3和p-JAK3表达下降引起的;细胞周期G1期进入S期阻滞可能是周期蛋白cyclin D1表达水平下降引起的,而G1期进入S期的抑制也引起细胞增殖的抑制。STAT1是细胞凋亡相关信号通路,对于结果中pcDNA3.0-DFG-NOK抑制p-STAT1表达原因还不清楚,需进一步对NIH3T3细胞进行凋亡检测。DFG-NOK中GLG突变为DFG,甘氨酸突变为天冬氨酸,非极性氨基酸变为酸性氨基酸,亮氨酸突变为苯丙氨酸,非极性氨基酸变为芳香族氨基酸,氨基酸性质的改变,致使各氨基酸残基之间的空间构象和相互作用力改变。
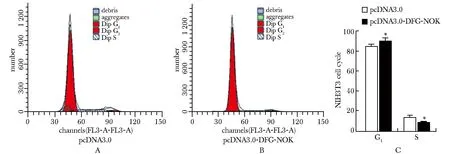
A.Accuri C6 result of NIH3T3 transiently transfected pcDNA3.0;B.Accuri C6 result of NIH3T3 transiently transfected pcDNA3.0-DFG-NOK;C.statistics analysis of the G1/S phase distribution; *P<0.05 compared with pcDNA3.0
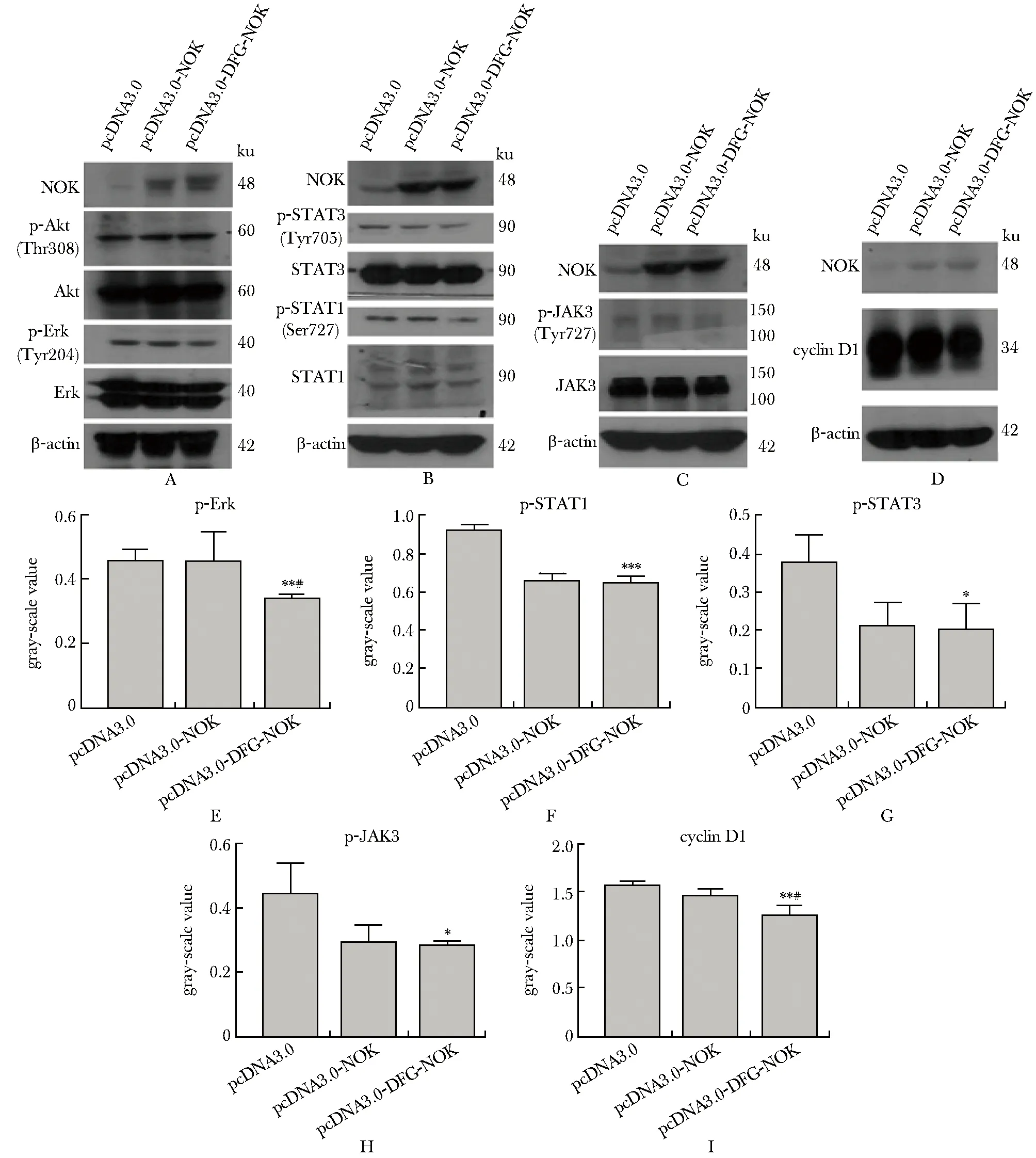
A.changes of Akt,p-Akt、Erk,p-Erk protein expression in responding to DFG-NOK over expression; B.changes of STAT1,p-STAT1,STAT3,p-STAT3 protein expression in responding to DFG-OK over expression;C.changes of JAK3,p-JAK3 protein expression in responding to DFG-NOK over expression;D.changes of cyclinD1 protein expression in responding to DFG-NOK over expression;E.gray-scale value of p-Erk in responding to DFG-NOK over expression;F.gray-scale value of p-STAT1 in responding to DFG-NOK over expression;G.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; H.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; I.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; *P<0.05,**P<0.01,***P<0.001 compared with pcDNA3.0 group; #P<0.05 compared with pcDNA3.0-NOK group
本工作虽然证实DFG-NOK抑制NIH3T3细胞增殖和细胞周期G1期进入S期。但对于DFG-NOK的结构和引起这些作用的机制还未明确,需做进一步研究。
