油茶籽仁中茶皂素的提取与分析
2021-06-16张洺榛廖小丽
◎ 张洺榛,廖小丽
(1.湖北江晓环保科技有限公司,湖北 武汉 430000;2.武汉海关技术中心,湖北 武汉 430000)
油茶作为21世纪重要的木本油料作物之一,近年来一直被作为研究热点为广大学者所热衷。油茶的主要利用部分为油茶果,油茶果主要由油茶外壳、油茶籽壳、油茶籽仁三大组分构成[1],其中,油茶籽仁除含有大量的不饱和脂肪酸外,蛋白质、糖类、茶皂素等也是其主要成分,同时油茶籽仁还含有植物甾醇、角鲨烯等微量活性成分。在这些组分当中,茶皂素又是其中的热点。茶皂素又被称为茶皂苷,熔点约224 ℃,平均分子式为C57H90O26,相对分子质量为1 200~2 800,是一种天然的糖苷化合物[2],同时也具备这一类物质的通性——易溶于乙醇和甲醇,但是难溶于无水甲醇和无水乙醇,不溶于石油醚、苯等有机试剂。由于其具备抗菌、抗病毒、降血脂等诸多优势,茶皂素被广泛地应用于医美、食品等领域[3]。
油茶是我国的特色植物,在国外的种植较为稀少,所以国外学者对于油茶及其相关物质的研究不多[4]。而国内学者提取茶皂素的方法主要分为水提法和醇提法两种,经有关学者试验得知,水提法提出来的茶皂素相对于醇提法来说杂质多一些,但是水提法相对成本低廉,所以这两种方法在实际的工业生产当中都有所应用[5]。本文采用80%热乙醇溶液(75 ℃)进行浸提,为了保证其得率,采用复提取的方法进行提取。
1 材料与方法
1.1 材料与试剂
样品采用湖南衡阳产地晒干带壳茶籽。茶皂素分析标准品(纯度≥98%,阿拉丁)。无水乙醇(AR)、硫酸(1.86 g·mL-1)、香草醛(AR)、石油醚(30~60 ℃,AR),试剂均为上海国药集团生产;纯水(满足实验室三级水及以上),实验室常用材料及耗材。
1.2 仪器与设备
E7221型紫外-可见分光度计及其配套器材;me2041型电子天平(感量为0.000 1 g);HH-S1型恒温水浴锅;101-4B型鼓风干燥机;HU10300/40B型超声清洗机;2500型粉碎机。
1.3 溶液配制
80%乙醇溶液(V/V):4份无水乙醇加1份纯水,充分混匀;1 mg·mL-1茶皂素标准溶液:准确称取100 mg样品,用80%乙醇溶液溶解并定容至100 mL;77%硫酸溶液(V/V):将77.00 mL硫酸(1.86 g·mL-1)用玻璃棒缓慢引流至盛有23.00 mL纯水的200 mL烧杯中;8%香草醛溶液(W/V):将4 g香草醛固体溶于50.00 mL的80%乙醇溶液中。
1.4 样品预处理
1.4.1 去壳处理
将200 g左右茶籽装在网袋中用木锤进行捶打,使油茶籽壳与油茶籽仁分离,然后挑选出茶籽仁。在这个过程中需要将所有茶籽分离,保证样品的均一性,同时在捶打过程中应当严格控制好力度,防止样品破碎导致出油率过高出现黏连等现象,引入过大的误差。
1.4.2 粉碎
将步骤1.4.1中分离的油茶籽仁放入粉碎机中粉碎,粉碎后过20目筛,样品过筛率要达到95%以上且不可以强行过筛,过筛完后将样品混匀,装袋备用。
1.4.3 含水率测定
通过重量法进行含水率测定,在烘干、干燥、恒重后的铝盒中加入步骤1.4.2中样品(10.0±0.1)g,盖上铝盒放入烘箱烘干至恒重,以上遵循国家标准《食品安全国家标准 食品中水分的测定》(GB 5009.3—2016)。该步骤是为了能够校正后面测定样品的实际质量,从而使结果误差有效降低。
1.4.4 索氏提取
以石油醚做提取剂用感量为0.000 1 g的电子天平称取步骤1.4.2中样品(1.00±0.01)g,按照索氏提取的操作规程用滤纸将样品包起来,折成适宜大小放入虹吸管进行索氏提取,时间为6 h。该步骤是为了充分将油清除,防止后面在显色时干扰实验结果。
1.4.5 干燥
将索氏提取完成后的滤纸包取出,放入鼓风干燥机中(70±2)℃恒温烘干30 min,将残留的石油醚蒸发耗尽。
1.4.6 乙醇提取
将干燥后的滤纸包放入100 mL的锥形瓶中,加入50 mL的80%乙醇溶液,封上封口膜,在75 ℃的条件下恒温水浴提取2 h,其间超声3~5次,到时间后将烧瓶中的残余液直接转移至250 mL容量瓶中,并用80%乙醇溶液清洗几遍,清洗滤液也转移至同一个250 mL容量瓶中。重复以上步骤进行乙醇复提取。
1.4.7 转移、定容
将两次提取液最终都放置在一起,并按照定容相关操作用80%乙醇溶液定容至刻度线。期间,定容至250 mL容量瓶约2/3处进行充分摇匀,定容结束后盖上玻璃塞进行上下摇匀,再将玻璃塞旋转180°后再度摇匀,确保溶液的均一性。
1.5 实验方法
1.5.1 上机前
用移液管准确吸取1 mL步骤1.5.7中定容后的溶液至玻璃试管中,加入0.5 mL的8%香草醛溶液,再加入5 mL的77%的浓硫酸溶液,充分混匀后60 ℃水浴15 min,紧接着冰水浴10 min。
1.5.2 上机测试
将步骤1.5.1中冰水浴后的样品用紫外-可见分光光度计在533 nm进行测试,记录下吸光度A。
2 结果与分析
2.1 提取次数确定
在本次实验中,提取率与提取次数的关系如表1所示。

表1 油茶中茶皂素提取率与提取次数的关系表
假设在第4次茶皂苷提取完全,在第1~3次的相对得率分别为76.56%、94.36%、97.32%,出于绿色化学理念和实验成本等多方面进行综合考量,提取2次是最佳实验方案。
2.2 标准曲线的制作与确定
选取6支玻璃试管,编号1、2、3、4、5和6,用移液管分别准确吸取0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL的1 mg·mL-1的茶皂素标准溶液,分别加入80%乙醇溶液0.8 mL、0.6 mL、0.4 mL、0.2 mL、0.0 mL;再分别加入0.5 mL的8%香草醛溶液,然后再加入5 mL的77%的浓硫酸溶液,充分混匀后60 ℃水浴15 min,紧接着冰水浴10 min。
最大吸收波长的选择:将2、4、6号管的溶液在400~780 nm,间隔1 nm区间进行光谱扫描,最终确定533 nm为最大吸收波长,即实验测定波长。
按照以上操作,以吸光度为纵坐标,以茶皂素浓度为横坐标,绘制标准曲线如图1所示,回归方程为y=0.796 7x-0.004 2,相关系数R2=0.999 6。
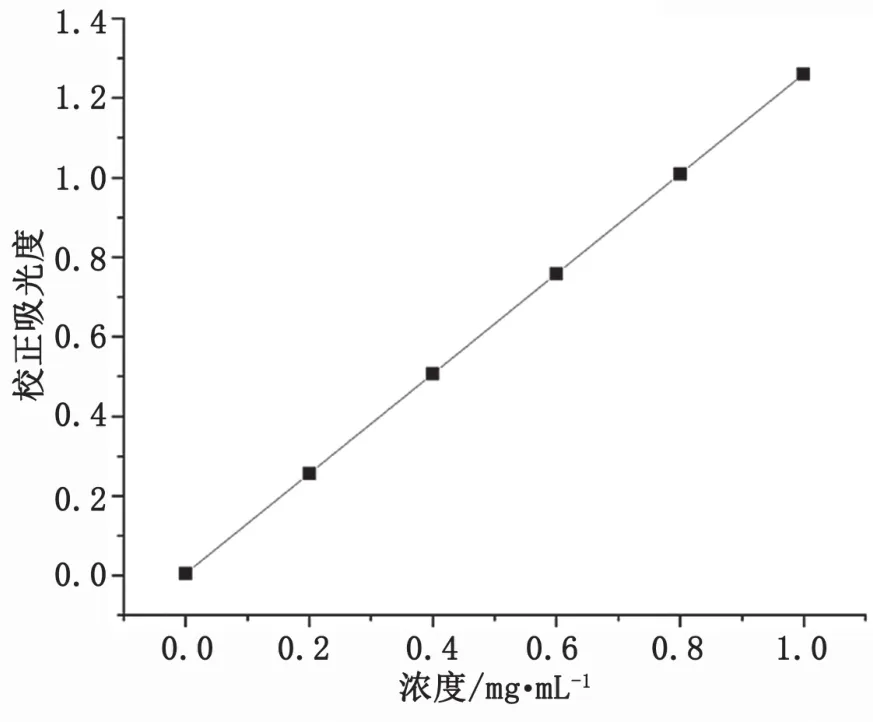
图1 茶皂素标准曲线图
2.3 油茶籽仁中茶皂素含量测定
测得样品浓度分别为16.05%、16.18%、16.14%,平均浓度为16.12%。经过测定,茶籽含水率为5.73%,则茶皂素的实际浓度为17.10%。
2.4 精密度试验
经过计算,相关数据相对平均偏差为0.33%,符合化学分析相关要求,即数据证明有效。
2.5 加标回收率
重新选择6根玻璃试管,分别加入0.0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL样品,再分别加入0.1 mL的1 mg·mL-1茶皂素标准溶液,用80%乙醇溶液补到1 mL,再加入0.5 mL的8%香草醛溶液,然后再加入5 mL的77%的浓硫酸溶液,充分混匀后60 ℃水浴15 min,紧接着冰水浴10 min。经测定,该方法的加标回收率为95.8%~101.3%如表2所示,符合化学分析相关要求,即数据证明有效。

表2 加标回收率测试原始数据表
3 结论
通过香草醛-浓硫酸法测定茶皂素含量,虽然在整个过程中会受到油脂的干扰以及反应时间的影响,但是相对于HPLC测定茶皂素来说,此方法更为便捷、消耗时间也更少,不需要进行过多的操作,为后续的类似实验处理提供了便捷途径。
本方法各项指标均符合化学分析的相关要求,但由于实验影响因素较多,所以导致部分细节方面有待商榷,在后续的实验中,应该更加注重一些细节性的问题,使油茶果中茶皂素的提取和测定更加精确。同时,由于茶皂素物质组成较为复杂,导致该实验不一定是最佳的测试条件,这也是茶皂素目前为止没有制定统一标准的原因之一。对于茶皂素测定的进一步规范化,还有待其他学者的进一步深入研学,从而找到一个公认的优良方法。
