人参皂苷CK对2型糖尿病大鼠肝损伤的保护机制
2021-06-16李光耀戴丛书崔昊震柳振宇林长青
闫 爽,李光耀,戴丛书,崔昊震,柳振宇,林长青
(延边大学医学院中医系,吉林延吉 133000)
糖尿病(Diabetesmellitus,DM)是由胰岛细胞受损导致的一类慢性代谢性疾病[1]。据统计,全球范围内糖尿病患病人数已超过5亿,且呈现逐年增长的趋势,死亡人数也在逐年递增,需要得到广泛重视。对于糖尿病患者,病情的加重会产生多种并发症,如脂质代谢失调[2],肾病[3],肝损伤[4],视网膜病变[5]等,其严重损害身体各个器官。糖尿病又分为1型糖尿病和2型糖尿病(T2DM),其中90%的糖尿病患者为T2DM,T2DM主要发病于肥胖人群,主要特征是胰岛素抵抗造成糖脂代谢紊乱[6-7]。脂代谢紊乱会直接引起其靶器官肝脏受到损伤,一般表现为肝肿大、脂肪肝、局部水肿等症状,严重影响着糖尿病患者的日常生活[8]。人参皂苷被视为在人参中发挥活性的主要成分,包括具有改善心肌损伤和炎症的人参皂苷Rg1[9],抑制癌细胞侵袭和转移作用的人参皂苷Rg5[10],改善阿尔兹海默症的人参皂苷Rh1[11]等。Rg1、Rg5、Rh1等的人参皂苷都是从人参当中能够直接提取出来的活性成分,而人参皂苷CK(Compound K)是天然二醇型人参皂苷在肠道内的代谢产物,是人参在体内发挥活性的实体,不能够从人参中直接提取出来。
目前对人参皂苷CK在抗肿瘤、抗炎、治疗糖尿病方面研究较多,研究认为人参皂苷CK能够显著抑制SW480细胞的增殖,作用机制可能是通过促进线粒体超氧化物升高,致使胞内ROS水平显著增加和MMP显著下降,进而导致CytC释放,上调Bax的表达,下调Bcl-2的表达,最终造成细胞凋亡[12]。此外,其还会通过调节炎症因子的水平和NF-κB信号通路来发挥抗炎作用[13]。对于改善2型糖尿病大鼠胰岛素抵抗作用,则认为是通过增强大鼠机体抗氧化能力,降低氧化应激损伤,增强葡萄糖转运能力从而改善胰岛素抵抗[14]。但目前对人参皂苷CK在治疗T2DM肝损伤作用方面的研究相对较少。
因此本试验通过建立T2DM大鼠模型,探讨人参皂苷CK对T2DM大鼠肝损伤的保护机制,为其在糖尿病肝损伤的预防和治疗上提供理论参考,为临床应用和保健品开发提供新的思路。
1 材料与方法
1.1 材料与仪器
雄性无特定病原体(SPF)级SD大鼠 50只,体重200±20 g,长春亿斯试验动物中心;高脂高糖饲料、普通饲料 上海帆泊生物技术有限公司;盐酸二甲双胍片 北京万辉双鹤药业有限责任公司;链脲佐菌素(STZ) 美国Sigma公司;人参皂苷CK 上海源叶生物科技有限公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、过氧化氢酶(CAT)试剂盒 江苏南京建城生物工程研究所;大鼠肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素IL-1β(IL-1β)、干扰素γ(IFN-γ)ELISA试剂盒 武汉博士德生物公司;Toll样受体4(TLR4)、髓样分化因子(Myd88)、细胞核因子(p65)、肌动蛋白(β-actin) 美国Abcam公司;大鼠核因子κB抑制蛋白α(p-IκB-α) 美国CST公司。
九安AG-605血糖仪及血糖试纸 天津九安医疗电子股份有限公司;JJ224BC分析天平 生工生物工程上海股份有限公司;Olympus IX73荧光倒置显微镜 奥林巴斯中国有限公司;Bio-Rad Biorad 165-8002电泳仪 美国伯乐公司;Bio Spectrum 510凝胶成像系统 美国UVP公司。
1.2 实验方法
1.2.1 动物分组及T2DM肝损伤动物模型的建立 T2DM肝损伤动物模型的建立方法参照安丽萍[14]的试验方法并稍作调整,取10只健康雄性SD大鼠作为空白对照组,给予常规饲料喂养,其余40只大鼠用高脂高糖饲料进行喂养6周,6周后对大鼠一次性腹腔注射STZ,剂量为30 mg·(kg·BW)-1,72 h后进行FBG测定,FBG水平高于16.7 mmol·L-1视为造模成功,一周后再次确定大鼠FBG水平是否高于16.7 mmol·L-1,将40只造模成功大鼠随机分为模型组、人参皂苷CK低剂量组、人参皂苷CK高剂量组、二甲双胍阳性对照组,每组10只。二甲双胍组给予二甲双胍0.2 g·kg-1灌胃,空白对照组和模型组灌胃相当体积的蒸馏水,人参皂苷CK高剂量组给药剂量为10.5 mg·kg-1,人参皂苷CK低剂量组给药剂量为5.25 mg·kg-1[15],共灌胃给药8周。试验过程中,每两周记录所有大鼠的FBG。灌胃8周后进行心脏取血,解剖,取肝脏组织。严格遵守《延边大学试验动物的保护和使用指南》中的要求,符合动物试验伦理要求。
1.2.2 T2DM大鼠OGTT的测定 在灌胃给药8周后,进行OGTT试验,以1 g/kg·BW灌胃葡萄糖,然后以0、30、60、90 min 为时间点分别测定大鼠血糖水平,并记录其数值。
1.2.3 血清指标检测 心脏取血,置于10 mL试管中,4000 r·min-1离心15 min,取出血清,装于EP管内,4 ℃冰箱中保存备用。TG、TC的测定:将血清取出放至室温,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,37 ℃孵育10 min,于510 nm测定各孔吸光值并记录。
HDL-C、LDL-C的测定:将血清取出放至室温,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,37 ℃孵育5 min,546 nm测定吸光值A1,再向反应体系中加入R2,混匀后,37 ℃孵育5 min,546 nm测定吸光值A2。
ALT、AST的测定:将血清取出放至室温,依次按试剂盒说明书步骤进行操作,所有反应液加完后,摇匀,室温放置15 min,于510 nm测定各孔吸光值。所测得的吸光值均安说明书计算公式进行计算。
1.2.4 肝脏组织相关指标检测 解剖后肝脏组织在冰上剪碎,用生理盐水洗去血水,置于试管中,按照m(组织重量)∶m(生理盐水)=1∶9的比例制备组织匀浆,保存备用。SOD,MDA,GSH,CAT,TNF-α,IL-6,IFN-γ和IL-1β检测参照试剂盒说明书,使用酶标仪测定吸光度。
1.2.5 肝脏组织病理观察 将肝脏组织用乙醇、二甲苯脱水后按常规方法用石蜡包埋,制成蜡块。蜡块经切片机切成2 μm的薄片,捞片,置于60 ℃烘箱中15 min烘干,采用HE染色法进行染色。
1.2.6 Western Blot检测相关蛋白的表达 用Western Blot法来测定TLR/Myd88/NF-κB信号通路中的相关蛋白。将肝脏组织和蛋白裂解液于研磨器中进行研磨,提取肝脏组织中的蛋白,用BCA试剂盒检测蛋白浓度,按30 μg,20 μL进行上样,电泳后100 V转膜1 h,再将PVDF膜在5%的TBST脱脂奶中封闭1 h,用TBST将封闭液洗净,防止封闭过度影响与一抗的结合。一抗按说明书比例进行稀释,PVDF膜洗净后孵育一抗,4 ℃过夜,TBST洗膜,室温下二抗孵育1 h,使用凝胶成像系统进行拍照,并用Image J软件进行分析。
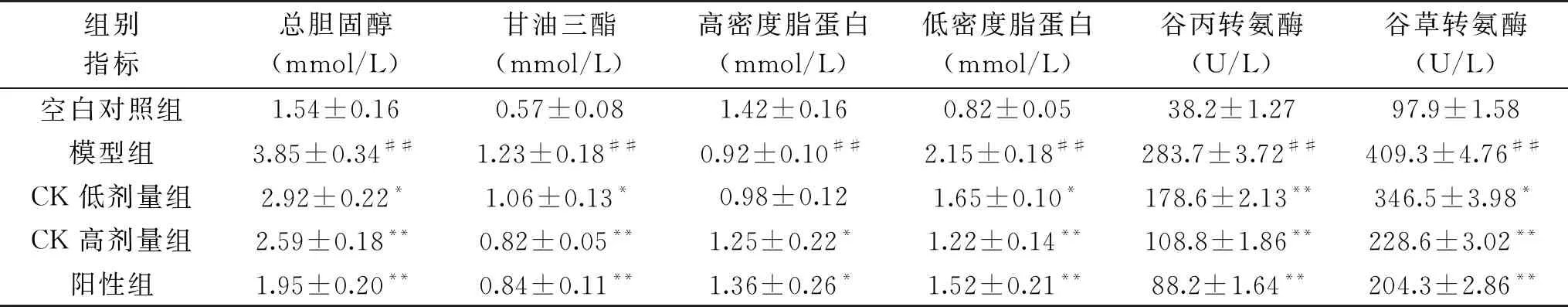
表1 人参皂苷CK对T2DM大鼠血清生化指标的影响Table 1 Effects of ginsenoside CK on serum biochemical indexes in T2DM rats
1.3 数据处理
实验结果重复三次,数据用平均值±标准偏差(平均值±SD)表示。使用t检验和单方差分析(ANOVA)进行组间比较,P<0.05表示具有显著性差异。使用IBM SPSS 20.0统计分析软件处理试验数据。
2 结果与分析
2.1 糖尿病大鼠基础指标
空腹血糖值能够较直观地反应T2DM大鼠的患病情况,图1为试验期间所测得大鼠的FBG变化情况,由图1中可知,在灌胃0周时,与空白对照组相比,模型组FBG均显著升高(P<0.05),且均超过16.7 mmol·L-1,证明T2DM大鼠造模成功。随着灌胃时间的延长,在灌胃8周时,与模型组相比,人参皂苷CK低、高剂量组、阳性组均能够使大鼠FBG均显著降低(P<0.05),使血糖值达到15 mmol·L-1以下,且人参皂苷CK高剂量组效果最好,显示出较好的降血糖水平。
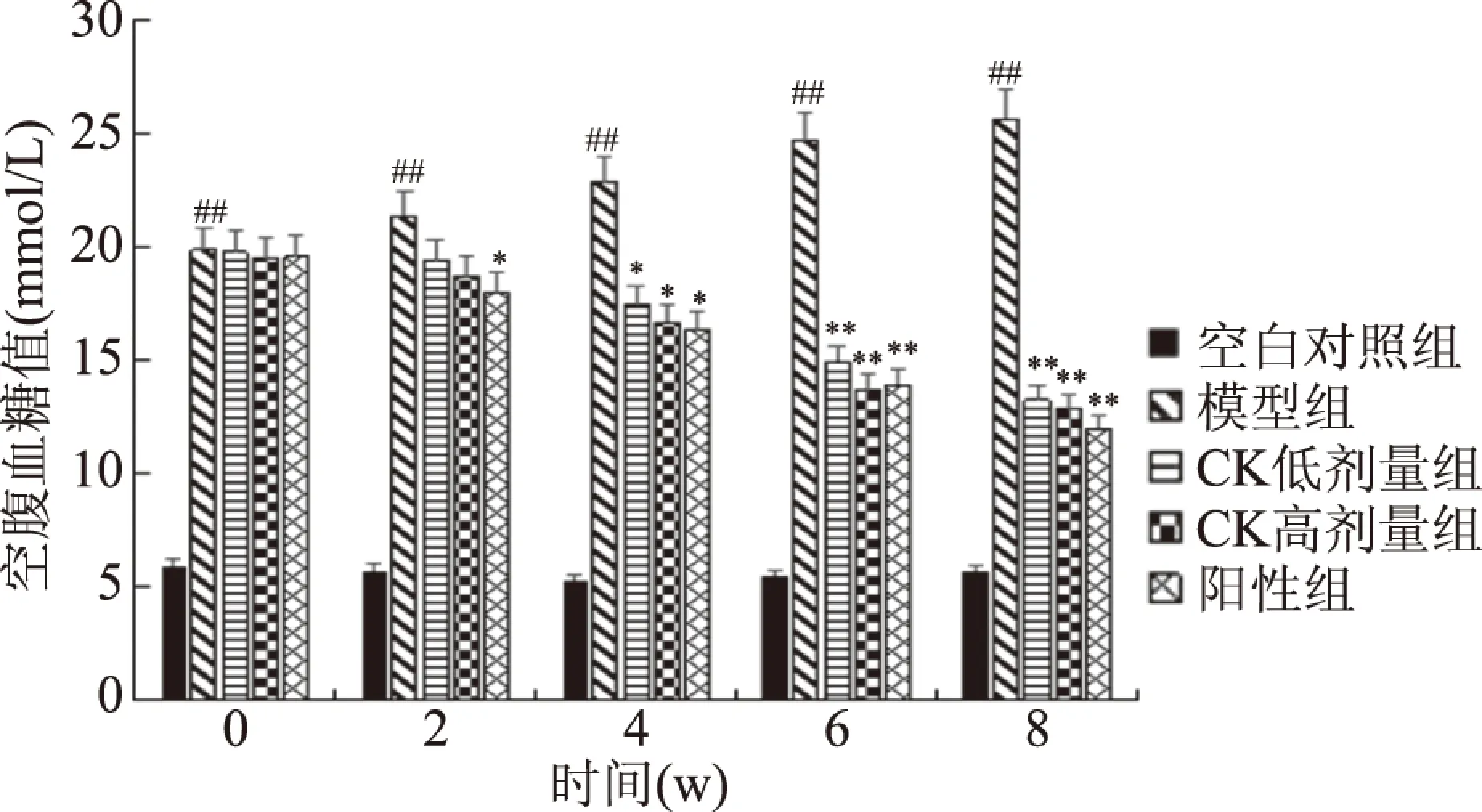
图1 大鼠空腹血糖值变化情况Fig.1 Changes of fasting blood glucose in rat注:#表示与空白对照组相比,模型组数据差异显著, P<0.05,##表示差异极显著,P<0.01; *表示与模型组相比差异显著,P<0.05, **表示差异极显著,P<0.01;图2~图3,图5、表1~表2同。
糖耐量能够反应出机体对体内血糖浓度的调节能力,是对大鼠进行葡萄糖灌胃,并在不同时段对其血糖值进行测定,分析其葡萄糖耐受能力。图2为大鼠糖耐量试验结果,结果显示,与空白对照组相比,模型组大鼠的血糖水平在0、30、60和90 min时显著增加(P<0.05),与模型组相比,经人参皂苷CK高、低剂量组处理的大鼠血糖水平在30、60和90 min时显著降低(P<0.05),且人参皂苷CK高剂量组效果更好。CK高剂量组与阳性对照组显示出相似的水平。
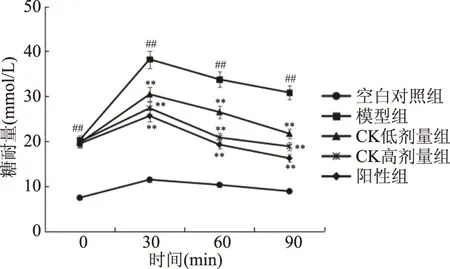
图2 大鼠糖耐量试验结果Fig.2 Results of rat glucose tolerance test
2.2 血清生化指标变化
表1为血清生化指标变化情况,由表1中数据可以看出,与空白对照组相比,T2DM大鼠中TC、TG、LDL-C水平显著升高(P<0.05),HDL-C水平显著降低(P<0.05),经CK低、高剂量组治疗后可有效恢复TC、TG、LDL-C、HDL-C水平,人参皂苷CK高剂量组与阳性对照组作用效果相当。与空白对照组相比,T2DM大鼠中ALT,AST水平均显著增加(P<0.05),经CK低、高剂量组治疗后可有效恢复该水平。
2.3 肝组织匀浆生化指标变化
SOD、GSH、CAT、MDA是氧化应激的相关指标,其数值的高低能够反映出氧化应激的水平,如表2所示,糖尿病大鼠的SOD、GSH、CAT的水平显著低于空白对照组(P<0.05),经人参皂苷CK治疗后可有效恢复其水平,而糖尿病大鼠的MDA水平显著高于空白对照组(P<0.05),经人参皂苷CK治疗后可降低其水平。在这些指标中显示人参皂苷CK高剂量组与阳性药物组有相似的治疗效果。
2.4 人参皂苷CK对T2DM大鼠肝组织炎性细胞因子的影响
细胞因子在大鼠免疫调节过程中具有重要作用,TNF-α又称肿瘤坏死因子,是炎性反应过程中的重要介质。IL-6是巨噬细胞的标志性细胞因子,能够促进T淋巴细胞和淋巴细胞的增殖分化,在炎症反应以及免疫方面有着重要作用。IFN-γ是来自淋巴细胞培养上清中存在的一种干扰素,主要参与机体的免疫调节。IL-1β是白细胞介素1的一种亚型,同样在炎性反应过程中发挥重要的作用[16]。图3为人参皂苷CK对T2DM大鼠肝组织炎性细胞因子的影响图,与空白对照组相比,模型组大鼠的促炎细胞因子的产生均有显著增加(P<0.05);而与模型组相比,经人参皂苷CK治疗后能够显著的降低肝组织炎性细胞因子的产生(P<0.05),且与阳性组的治疗水平相近。
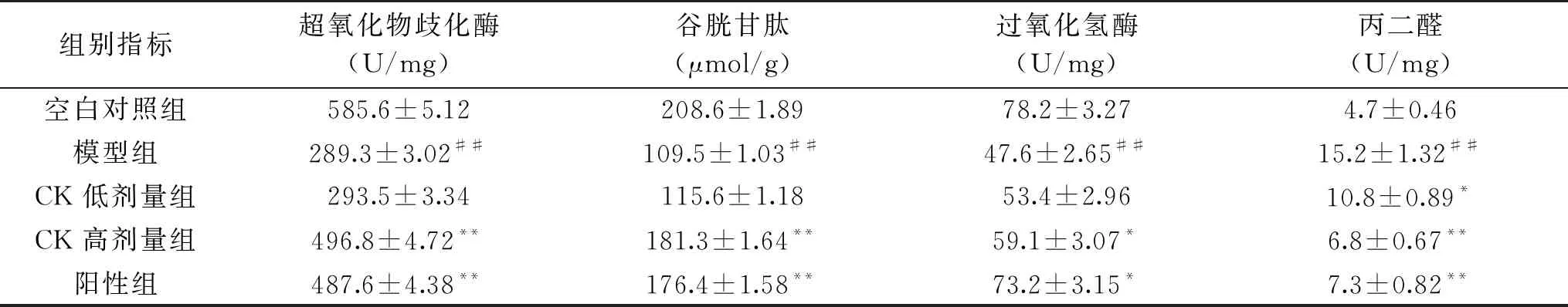
表2 人参皂苷CK对肝组织生化指标的影响Table 2 Effects of ginsenoside CK on biochemical indexes of liver tissue
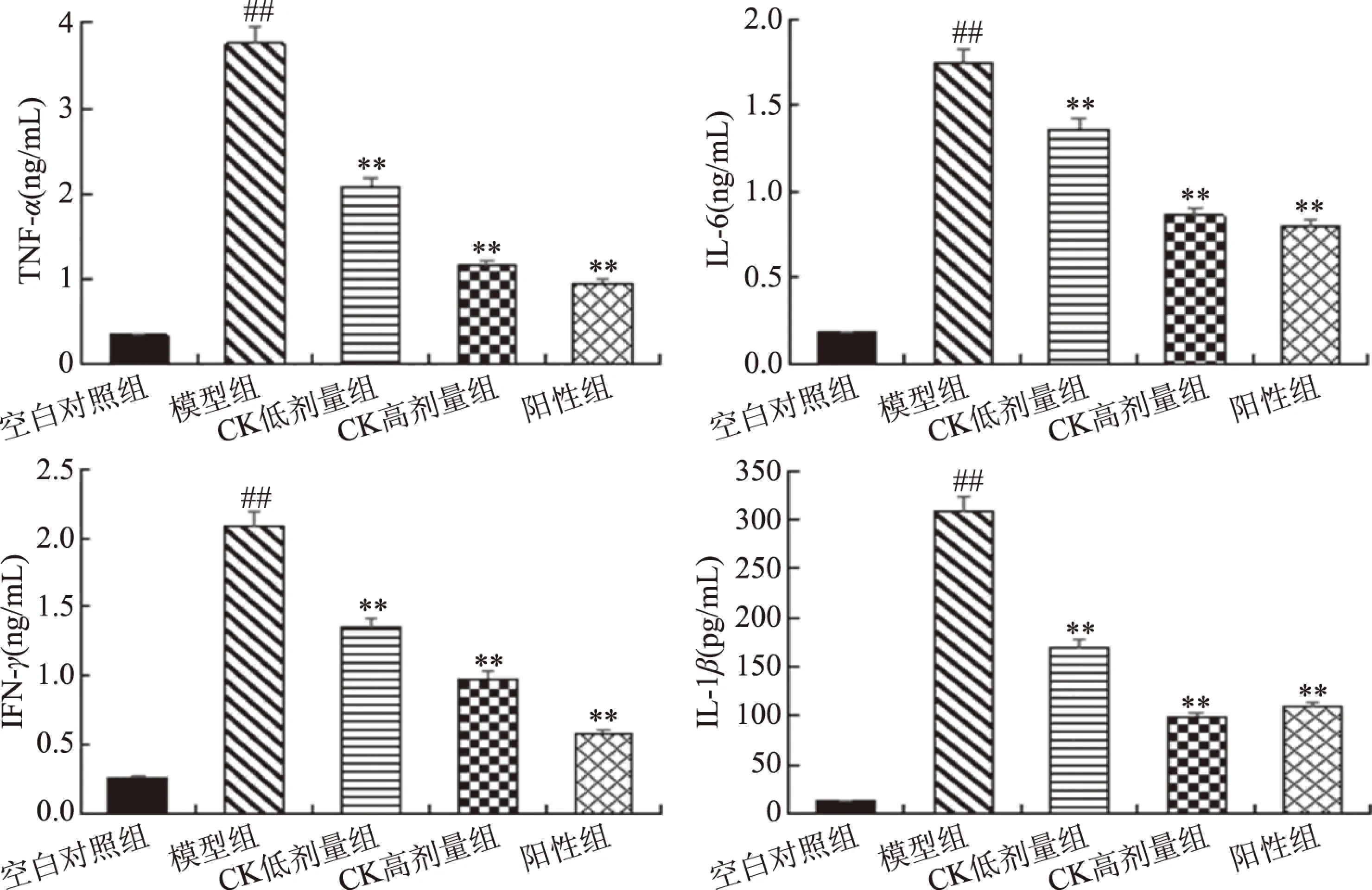
图3 人参皂苷CK对T2DM大鼠肝组织炎性细胞因子的影响Fig.3 Effect of ginsenoside CK on inflammatory cytokines in liver tissue of T2DM rats注:(A)TNF-α含量;(B)IL-6含量;(C)IFN-γ含量;(D)IL-1β含量。
2.5 肝脏组织病理形态变化
图4中显示了肝组织情况,从图4中能够看出,正常大鼠肝脏组织结构清晰完整,肝索及肝窦结构明显;模型组大鼠肝脏组织肝索界限不清晰,肝窦出现异常,肝细胞质有一定程度的空泡结构,组织结构紊乱、排列不规则。经人参皂苷CK治疗后,肝组织水肿情况减弱,肝索排列规则,肝窦基本恢复正常,并与阳性组的治疗水平相近。
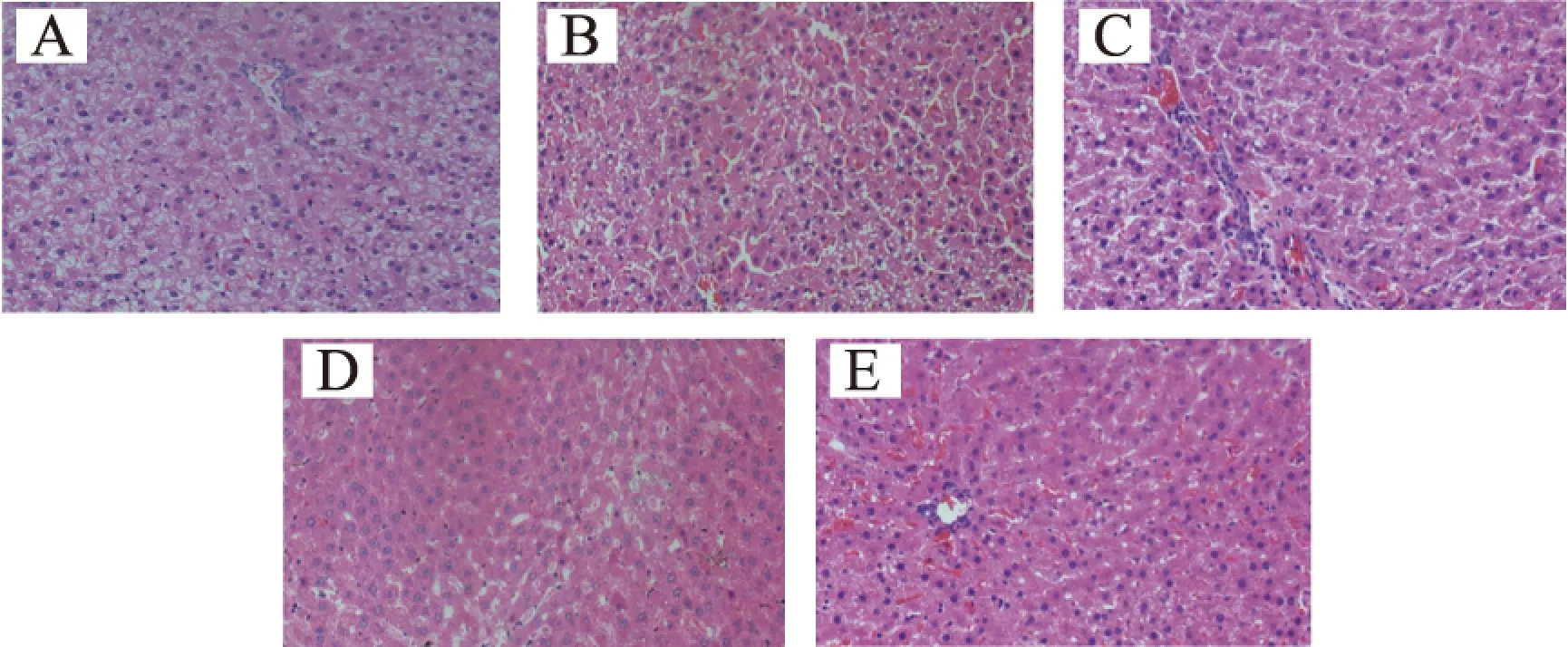
图4 人参皂苷CK对T2DM大鼠肝脏组织的影响Fig.4 Effect of ginsenoside CK on the liver tissue of T2DM rats注:A:正常对照组;B:模型组;C:人参皂苷CK低剂量组; D:人参皂苷CK高剂量组;E:阳性组。
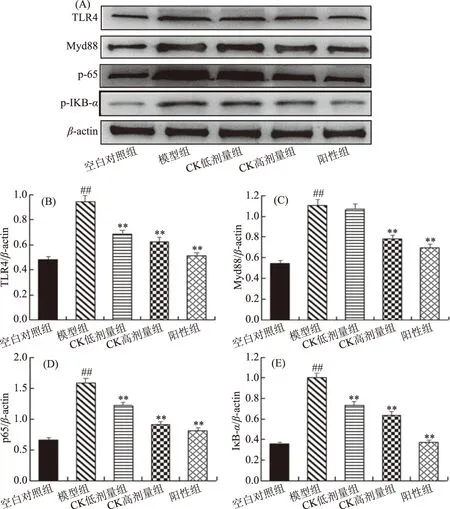
图5 人参皂苷CK对T2DM大鼠TLR4、Myd88、p-IκB-α蛋白表达的影响Fig.5 Effects of ginsenoside CK on the expression of TLR4,Myd88,P65 and p-IκB-α。注:(A)为蛋白条带;(B)、(C)、(D)、(E)分别为TLR4、Myd88、p65、p-IKB-α的量化结果;#表示与空白对照组相比,模型组 数据差异显著,P<0.05,##表示差异极显著,P<0.01;*表示模型组相比差异显著,P<0.05,**表示差异极显著,P<0.01。
2.6 肝组织中相关蛋白的表达情况
TLR4、Myd88、p-IKB-α是NF-κB信号通路中的关键蛋白,图5为肝组织中相关蛋白的表达情况,由图5可知,与空白对照组相比,T2DM组大鼠TLR4、Myd88、p-65、p-IKB-α的表达量均显著升高(P<0.05),与模型组比较,人参皂苷CK低、高剂量组能够显著降低其表达水平(P<0.05),且高剂量组显示与阳性组相似的治疗效果。
3 讨论与结论
肝组织损伤是糖尿病并发症的一种,损伤后会影响肝糖原、肌糖原对葡萄糖的转化,从而影响糖尿病患者的血糖[17]。有研究指出[18],人参皂苷CK对T2DM大鼠有降糖作用,能够抑制肝脏过度的糖异生,并能够有效抑制其内质网应激反应,从而防治酒精性肝损伤[19]。过多的脂肪积累会导致代谢紊乱,在大多数情况下会导致T2DM以及肝损伤的发生[20]。在试验中,T2DM大鼠的FBG显著增加(P<0.05),经人参皂苷CK治疗后,大鼠的FBG有下降趋势,且在糖耐量试验中显示经人参皂苷CK治疗后能够显著提高大鼠糖耐量能力(P<0.05),并与阳性对照组有相似的治疗效果。与正常对照组相比,T2DM大鼠血清的TC、TG、LDL-C浓度显著增加(P<0.05),而HDL-C浓度显著降低(P<0.05),表明T2DM大鼠出现了脂代谢异常,脂肪分解增加,产生了大量的游离脂肪酸(FFA),组织吸收脂肪酸的能力降低,FFA大量释放到血液和肝脏中,导致TC、TG、LDL-C的含量增多。临床上常将AST和ALT联合检测,并以AST/ALT的比值来诊断患者肝组织病变情况,试验中T2DM大鼠的AST、ALT值显示经人参皂苷CK治疗后,能够降低AST/ALT比值,有效恢复肝损伤病变的情况。当机体内氧自由基含量增多时,会使机体产生氧化应激反应,过多的氧自由基与脂质发生过氧化反应生成MDA,CAT与SOD在机体中具有较强的抗氧化能力,可抑制氧自由基的生成,从而降低氧自由基对细胞造成的伤害,并且可以降低MDA的生成量[21]。在唐俊等[22]指出,经人参皂苷Rg3治疗后,可有效提高SOD、GSH的水平,降低MDA水平,这与本试验的研究结果一致。TNF-α、IL-6、IFN-γ、IL-1β四种细胞因子在调节免疫细胞以及炎症反应中起着重要的作用。有研究显示,对2型糖尿病患者治疗后,体内TNF-α以及IL-6炎性细胞因子的水平有所降低[23]。在本试验中,显示经人参皂苷CK治疗后能够显著的降低肝组织炎性细胞因子的产生。
推测人参皂苷CK对T2DM大鼠肝损伤的保护可能是通过抑制炎症和氧化应激反应,从而受到NF-κB途径的调节。现有的研究表明,调节氧化应激通路中的相关分子可以改善胰岛细胞的功能,进而促进葡萄糖的代谢和利用,减少对肝组织的损伤,并可通过NF-κB信号转导途径实现糖尿病相关疾病的调控[24-25]。TLR4、Myd88、p65、p-IκB-α是NF-κB信号通路中的关键蛋白。单佳铃等[26]分析了藏族药对慢性酒精性肝损伤的治疗效果和可能机制,认为对慢性酒精性肝损伤的保护机制可能与TLR/Myd88/NF-κB信号通路有关。另有研究认为[27],对T2DM小鼠炎性因子的调节作用可能是通过调节TLR4/Myd88/NF-κB途径中IκB的磷酸化水平来实现,通过降低T2DM小鼠肝脏中IκB的磷酸化水平,可有效提高机体对葡萄糖的摄取能力,抑制炎性因子,改善肝损伤情况。在本研究中,试验结果显示肝损伤在T2DM大鼠中的发生与NF-κB信号通路中的重要分子TLR4、Myd88、p65、p-IκB-α的表达上调有关,经人参皂苷CK治疗后能够有效地降低这些蛋白的表达水平,改善了T2DM大鼠肝损伤的症状,减轻糖尿病对肝脏的伤害。由此可见,人参皂苷CK对T2DM大鼠肝损伤的保护作用可通过降低炎症和氧化应激反应来实现并受TLR/Myd88/p65/NF-κB信号通路调节。这与Paudel等[28]的研究相一致,即减少炎症的发生和氧化应激反应可以改善糖尿病肝损伤症状。
由此推测,人参皂苷CK对T2DM大鼠肝损伤的保护作用可通过降低炎症和氧化应激反应来实现,并受TLR/Myd88/NF-κB通路的调节。然而,人参皂苷CK对糖尿病肝损伤调节的其他机制有待进一步研究。
