预制调理低嘌呤大菱鲆鱼片的制备及品质研究
2021-06-16李婷婷宋敏杰赵贵琴励建荣
孙 宏,李婷婷,宋敏杰,赵贵琴,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁锦州 121013; 2.大连民族大学生命科学学院,辽宁大连 116600)
大菱鲆,英文Turbot音译而成,即欧洲比目鱼,在中国称之为“多宝鱼”,主要分布在大西洋东侧欧洲沿岸等地,被国际认为是高价值的食用鱼类[1]。我国现有渤海、黄海、东海和南海四大海区渔场,辽宁省作为我国大菱鲆养殖第一大省,养殖年产量达到2.2 万吨,占全国大菱鲆养殖面积的一半左右[2]。
大菱鲆含有丰富的高营养成分,如蛋白质、矿物质、维生素、Ω-3脂肪酸和DNA[3],符合消费者对深海水产品营养的需求。每天食用200 g的大菱鲆鱼,就可以满足一个成年人一天所需蛋白质含量的一半以上[4]。人体血尿酸正常含量为200~410 umol/L[5],Kaneko根据嘌呤含量的多少将食物分为极低、低、中度、高和极高嘌呤食物五个等级,极低组:<50 mg/100 g,低组:50~100 mg/100 g,中度组:100~200 mg/100 g,高组:200~300 mg/100 g,极高组:>300 mg/100 g[6]。其中极低嘌呤食物包括谷类、蔬菜、鸡蛋以及乳制品,低嘌呤食物包括菌菇和部分加工肉,中等嘌呤含量的食物包括部分肉制品及大部分水产品,而大菱鲆中所含嘌呤含量高达111.94 mg/100 g[7]。对于嘌呤脱除的食物主要集中在啤酒[8-9]及豆制品[10-11]中,而对于畜禽水产品中嘌呤的脱除主要是通过简单地加工[12-13]进行。吕兵兵[14]对带鱼分别进行水煮、清蒸和油炸加工处理,实验表明,水煮处理可以有效脱除嘌呤。任丽琨[15]通过对大菱鲆进行香辛调味料(大蒜粉、生姜粉、花椒粉、桂皮茴香)溶液浸泡处理,研究表明,这五种调味料均可有效脱除嘌呤,且大蒜粉、花椒粉、生姜粉浸泡处理的鱼肉嘌呤脱除效果最佳,并对大菱鲆进行大蒜素浸泡-水煮处理,研究表明,大菱鲆鱼片经大蒜素浸泡,清水水煮处理,嘌呤脱除率高达70%。因此通过浸泡-水煮处理,脱除嘌呤,开发独具特色的功能性调理水产品,可以提高产品受众范围,能够有效促进水产品产业朝着健康的方向发展。
鉴于目前对于水产品中嘌呤检测的方法没有明确的统一的标准,常用的方法包括色谱、电泳以及离子交换法。其中高效液相色谱因其高效、高速、高灵敏度的特点,使用最为广泛。因此本文基于高效液相色谱法,通过外源添加花椒粉浸泡鱼片并结合水煮处理的方法,对处理前后的样品嘌呤含量进行了检测,以制备低嘌呤调理鱼片。
1 材料与方法
1.1 材料与仪器
鲜活大菱鲆(Scophthalmusmaximus) 辽宁省锦州市林西市场,每条净重750~1000 g。花椒粉(Zanthoxylumbungeanum) 中国吉林省杞参食品有限公司;腺嘌呤(Adenine)、鸟嘌呤(Guanine)、次黄嘌呤(Hypoxanthine)、黄嘌呤(Xanthine)、四丁基氢氧化氨(10%于纯水中)、三氟乙酸(Trifluoroacetic acid,TFA)、冰乙酸(Glacial acetic acid) 均为色谱纯,纯度≥99.0%,上海阿拉丁生化科技股份有限公司;超纯水(Milli-Q Ultra-pure water) 美国Millipore公司;甲酸(Formic acid,FAC) 分析纯,天津市福晨化学试剂有限公司。
SK6210HP型超声清洗器 上海科导超声仪器有限公司;JYL-C012型绞肉机 九阳股份有限公司;DK-BD型电热恒温水槽 上海恒一科技有限公司;MS105DU型电子分析天平 瑞士梅特勒-托利多有限公司;LC-2030型岛津高效液相色谱仪 日本岛津;Biofuge Stratos型真空旋转蒸发仪 郑州世纪双科实验仪器有限公司。
1.2 嘌呤含量的测定
1.2.1 标准曲线的绘制 参考宋敏杰等[16]的方法稍作调整,分别称取0.0120 g腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤定容至10 mL,配置成浓度为1200 mg/L的标准储备液(1 mol/L的NaOH助溶)备用。随后用超纯水将四种嘌呤标准样品稀释配制成300、200、100、50、5、0.5、0.1 mg/L的标准液。所有待测样品过0.22 μm滤膜,在选定的色谱条件下进行嘌呤含量测定,得到峰面积。以峰面积为纵坐标(Y)、样品质量浓度为横坐标(X)做线性回归方程。
1.2.2 色谱条件 色谱柱Agilent ZORBAX Eclipse C18Plus(4.6 mm×250 mm,5 μm);流速0.6 mL/min;柱温25 ℃;进样量6.0 μL;检测波长254 nm。将冰乙酸、四丁基氢氧化铵、超纯水按体积比1.5∶1.5∶997混合作为流动相a,再与甲醇(流动相b)按95∶5混合作为最终流动相。
1.2.3 样品处理和测定 采用Qu等[17]测定嘌呤的方法,稍作修改。称取0.20 g样品置于50 mL离心管中。加入三氟乙酸及甲酸各10 mL,混合后90 ℃水浴加热12 min,然后置于80 ℃下旋转蒸发至干,残余物用流动相A复溶,取复溶后的液体过0.22 μm滤器后上机检测。
1.2.4 方法学考察 在此进一步通过方法学验证的方式探究其在本实验中的可行性。方法精密度:利用已确定的色谱方法对同一混标连续进样6次,进样量为6 μL,计算相对标准偏差(RSD),确定高效液相色谱方法的精密度(RSD)。重复性验证:取四种嘌呤的单一储备液,各自连续进样测定6次,计算四种嘌呤物质各自的相对标准偏差(RSD),确定仪器精密度。
1.3 预制调理低嘌呤大菱鲆鱼片的制备
1.3.1 工艺流程 在传统调理鱼片加工工艺[16]的基础上,增加嘌呤脱除工艺,制得预制低嘌呤调理鱼片。低嘌呤大菱鲆调理鱼片加工工艺流程:鱼→取背部鱼肉→脱除嘌呤→调味→包装→储藏。
1.3.2 操作要点
1.3.2.1 鱼片的前处理 将鲜活的大菱鲆运回实验室用碎冰猝死,去除内脏,沿椎骨剖开取背部鱼片,用水冲洗干净,沥水,取鱼背部肌肉,并切成体积大小为6 cm×3 cm×2 cm规格的鱼片[18]。
1.3.2.2 嘌呤脱除与加工 通过在添加有一定量的花椒粉溶液中浸泡一定时间后取出鱼肉,移至沸水中水煮一定时间,对鱼肉中的嘌呤含量进行脱除。
1.3.2.3 调味、包装、储藏 加入食盐2.5%,蔗糖1.5%,葱汁1.5%,蒜汁1.5%,香菜汁1.5%,料酒4.0%,制得调味液[19]。均匀的涂抹在加工过的鱼片上,真空包装[20],4 ℃冷藏贮藏。
1.3.3 花椒粉溶液浸泡对大菱鲆嘌呤含量影响 预实验结果表明,浸泡温度对嘌呤的影响较小,因此后续实验均在25 ℃条件下进行。
1.3.3.1 浸泡时间的选择 将20.00 g的样品(背部鱼肉)于2%的花椒粉水溶液中分别浸泡0、15、30、45、60 min,测定嘌呤含量。
1.3.3.2 花椒粉添加量的选择 将20.00 g的样品(背部鱼肉)于0、1.0%、1.5%、2.0%、2.5%、3.0%的花椒粉水溶液中浸泡20 min,测定嘌呤含量。清水浸泡为对照。
1.3.4 花椒粉水溶液水煮对大菱鲆嘌呤含量影响
1.3.4.1 生熟肉转化系数的确定 经水煮加工的水产品,组织中的汁液易流出,从而质量减小,以致于影响嘌呤含量的准确性,引起误差[21-22],为此,采用王新宴等[21]的方法计算生熟肉转化系数,减少误差。将20.00 g普通鱼肉在清水中煮0、2、4、6、8、10、12、14 min。称量各个时间点熟肉质量,计算生熟肉转换系数(F)[24],计算公式如下:
F=熟肉质量/生肉质量
熟肉中嘌呤含量=样品中嘌呤含量×转换系数
1.3.4.2 水煮时间对大菱鲆嘌呤含量影响 将2%的花椒粉加入到200 mL水中至沸腾,取20.00 g未浸泡鱼肉置于沸水中继续加热,并于0、2、4、6、8、10、12、14 min时对大菱鲆进行感官评分并测定嘌呤含量。
以清水为对照组,在200 mL水沸腾时,取20.00 g未浸泡鱼肉置于沸水中继续加热,并于0、2、4、6、8、10、12、14 min时测定嘌呤含量[25]。
1.3.4.3 感官评定 对鱼块进行浸泡、水煮处理之后,借用五名经过专业训练的感官评价员,采用5人评价法,对锡箔纸包裹着的熟鱼片从肌肉组织弹性、色泽、气味的变化、滋味口感得浓郁程度进行感官评价,感官评价表如表1所示。

表1 水煮时间对大菱鲆感官的影响Table 4 Effect of boiling time on the sensory sense of turbot
1.3.5 浸泡-水煮处理对嘌呤含量的影响 将20.00 g鱼肉在2%的花椒粉溶液中浸泡45 min后,置于清水中煮8 min,测其嘌呤含量。
1.3.6 嘌呤脱除率的计算
嘌呤脱除率(%)=(a-b)/a
式中:a:未经处理样品中嘌呤含量,g;b:花椒粉浸泡并清水水煮处理后样品嘌呤含量,g。
1.4 数据处理
所有实验都重复三次,结果表示为平均值±标准偏差,数据处理使用软件Excel 2007和SPSS 17.0,绘图采用Origin 8.0。
2 结果与分析
2.1 嘌呤含量的测定
2.1.1 标准曲线 由表2可知,该方法在0.1~300 mg/L的范围内线性关系良好,决定系数(R2)均大于0.999。符合实验要求。

表2 嘌呤标准曲线Table 2 Standard curves of purine
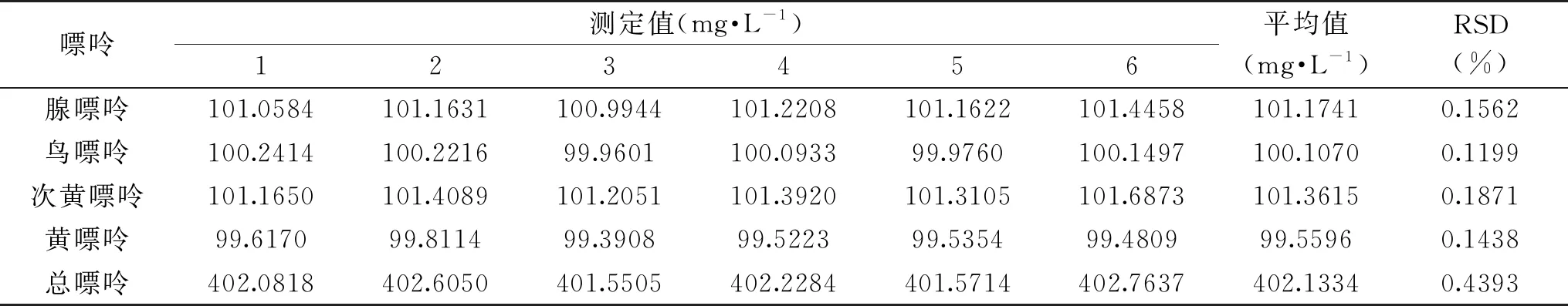
表3 精密度实验结果Table 3 The precision results
2.1.2 方法学验证 由于检测仪器的型号、厂家等客观因素能够对嘌呤检测的准确性造成一定的影响,因此进一步通过方法学验证的方式对所采用的实验方法进行验证,以确保实验结果的准确性。对同一混标连续进样测定6次,结果如表3所示,四种嘌呤物质测得相对标准偏差(RSD)在0.1199%~0.4393%,表明仪器精密度良好。
重复性实验结果显示(表4),四种嘌呤的峰面积的RSD分别为4.2983%、4.3827%、2.1970%、4.3859%,该方法重复性良好(RSD<5%),适用于嘌呤检测。
2.2 嘌呤的脱除
2.2.1 花椒粉溶液浸泡对大菱鲆嘌呤含量影响
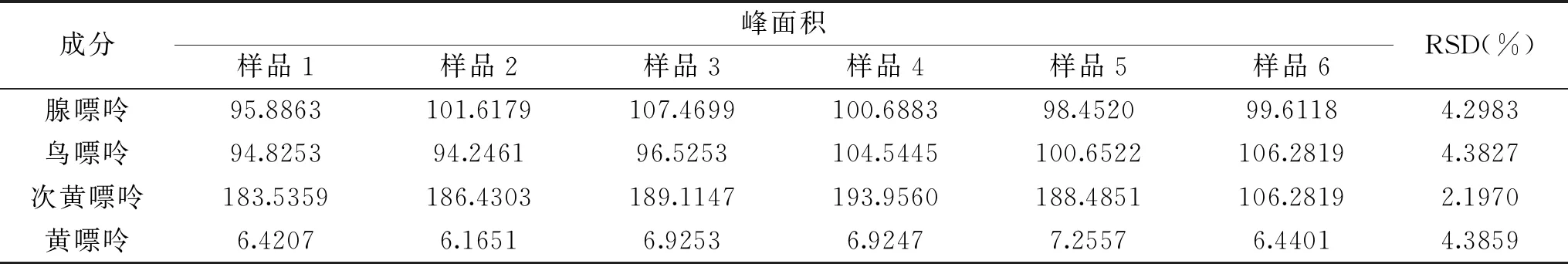
表4 重复性实验Table 4 Repeatability test
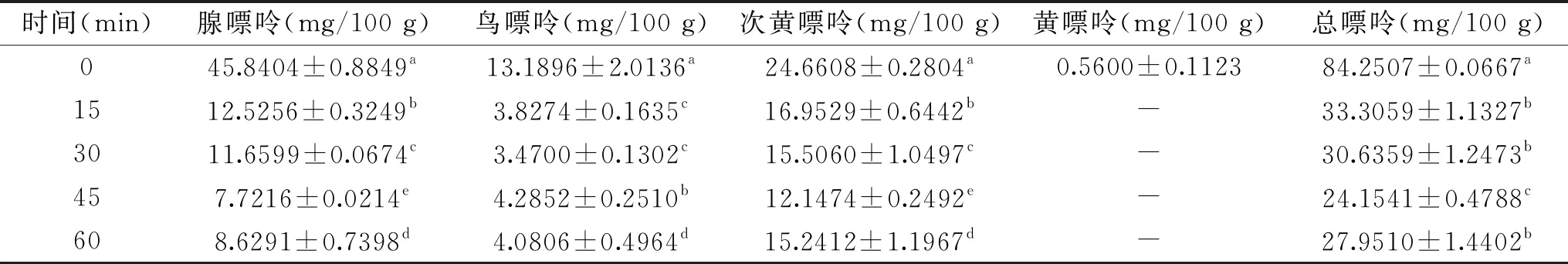
表5 浸泡时间对各嘌呤含量的影响Table 5 Effect of soaking time on the content of each purine
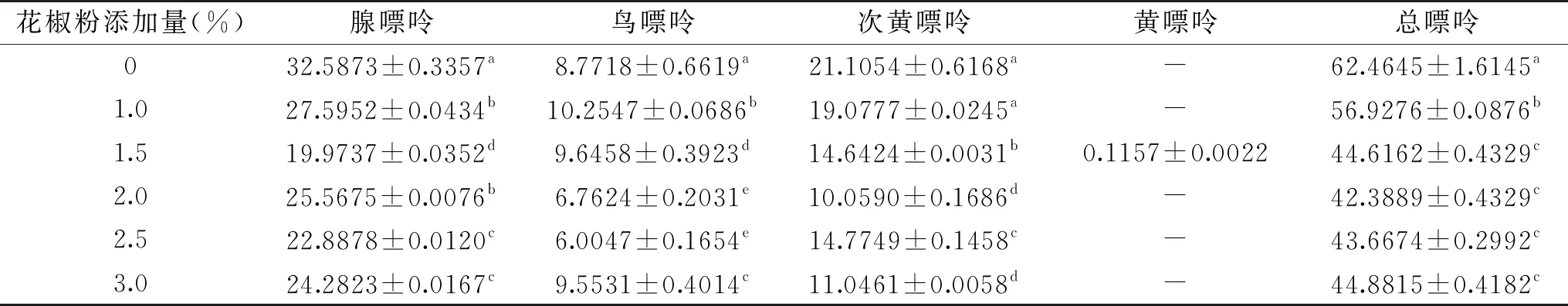
表6 花椒粉添加量对各嘌呤含量的影响(mg/100 g)Table 6 Effect of Pepper powder addition on the content of each purine(mg/100 g)
2.2.1.1 浸泡时间的确定 表5为不同浸泡时间对大菱鲆嘌呤含量的影响,大菱鲆经花椒粉水溶液浸泡60 min时,嘌呤含量总体呈下降趋势。在0~15 min内,三种嘌呤均迅速减少,腺嘌呤、次黄嘌呤、鸟嘌呤分别减少33.3148、7.7079、9.3622 mg/100 g。15 min以后,嘌呤减少速度逐渐缓慢,最后趋于稳定,结果与任丽琨[15]一致。且在15 min时嘌呤总含量减少了50.9448 mg/100 g,嘌呤脱除率达到60.47%,45 min时嘌呤含量最低,因此选择45 min为最佳浸泡时间。新鲜的大菱鲆中未检测到黄嘌呤,可能是因为背部鱼肉中黄嘌呤含量本来就少,且黄嘌呤易溶于水[26]。
2.2.1.2 花椒粉添加量的确定 表6为不同花椒粉添加量对大菱鲆嘌呤含量的影响,随着花椒粉添加量的增加,嘌呤含量总体呈现先下降后缓慢升高的趋势,腺嘌呤、次黄嘌呤均是如此,黄嘌呤因其含量较低仍然无法检出,其中腺嘌呤和次黄嘌呤变化最为显著,在花椒粉添加量达到2.0% 时,嘌呤总含量达到最低为42.3889 mg/100 g,嘌呤脱除率达到32.14%,推测可能与花椒粉中的某些活性成分有关[27]。之后嘌呤总含量呈现缓慢上升趋势,进行显著性分析,表明1.5%、2.0%、2.5%、3.0%之间的嘌呤含量差异不显著。因此实验最终选择2.0%的花椒粉为最佳添加量。
2.2.2 水煮时间对大菱鲆嘌呤含量影响
2.2.2.1 生熟肉转化系数结果 鱼肉在0、2、4、6、8、10、12、14 min时的转化系数分别为 1.000、0.939、0.857、0.802、0.771、0.746、0.730、0.707。随着水煮时间的增长,汁液流出,肌肉组织断裂损失,所以质量越来越小。
2.2.2.2 水煮时间对大菱鲆感官得分的影响 图1为水煮过程中大菱鲆的感官得分,随着水煮时间的增加,大菱鲆鱼腥味逐渐减弱,特有的香气变得越来越浓郁,生肉感逐渐消失,口感逐渐变得细腻,因此风味、口感得分越来越高,而肉质由于加热致使肌肉纤维收缩,使得鱼肉越来越没有弹性,且逐渐变得不完整[28],外观得分越来越低。

图1 水煮过程中大菱鲆感官得分Fig.1 Sensory scores of the cooked turbot with boiling
2.2.2.3 水煮时间对大菱鲆嘌呤含量影响 图2为水煮时间对嘌呤含量的影响,随着水煮时间的延长,嘌呤含量均呈现下降趋势,推测可能是由于随着水煮时间的增加,流动水渗入到鱼肉组织内部对嘌呤进行了稀释。有研究表明,随着温度的增加,鱼肉中肌纤维收缩,肌束空隙扩大,不易流动水向自由水转变,使肌肉组织中的自由水含量增大[29],从而引起嘌呤溶出。

图2 水煮时间对嘌呤含量影响Fig.2 Effects of cooking time on the content of purine
与空白组相比,实验组嘌呤总含量仅减少6.94%,即单纯花椒粉水溶液水煮对其嘌呤含量的影响不大,说明在嘌呤脱除过程中各工序存在协同作用。推测可能是因为在水煮加工过程中嘌呤的变化主要由热萃取作用引起。且次黄嘌呤相对较容易溶于汤中,腺嘌呤次之,鸟嘌呤最难[30]。
结合图1水煮过程中大菱鲆感官得分以及图2水煮时间对嘌呤含量的影响,最终选择水煮加工的最佳时间为8 min。
2.2.3 浸泡-水煮处理对嘌呤含量的影响 图3为浸泡-水煮对嘌呤含量的影响,与新鲜大菱鲆相比,利用清水对大菱鲆进行浸泡并且加热煮沸处理,能够使嘌呤含量减少58.07%;而以花椒粉对大菱鲆进行浸泡加热处理,与新鲜大菱鲆相比嘌呤总含量减少了79.50%,与清水浸泡-清水水煮过的空白组相比嘌呤含量降低了21.43%,推测可能是因为鱼肉中含较多的次黄嘌呤,而花椒粉中的有效成分可促进黄嘌呤氧化酶的活性,进而使次黄嘌呤转化为黄嘌呤,黄嘌呤易溶于热水[31],从而脱除嘌呤。由此可知,通过花椒粉浸泡-清水水煮的方式加工处理可以显著降低大菱鲆中的嘌呤含量。进而制得本文中预制低嘌呤鱼片。
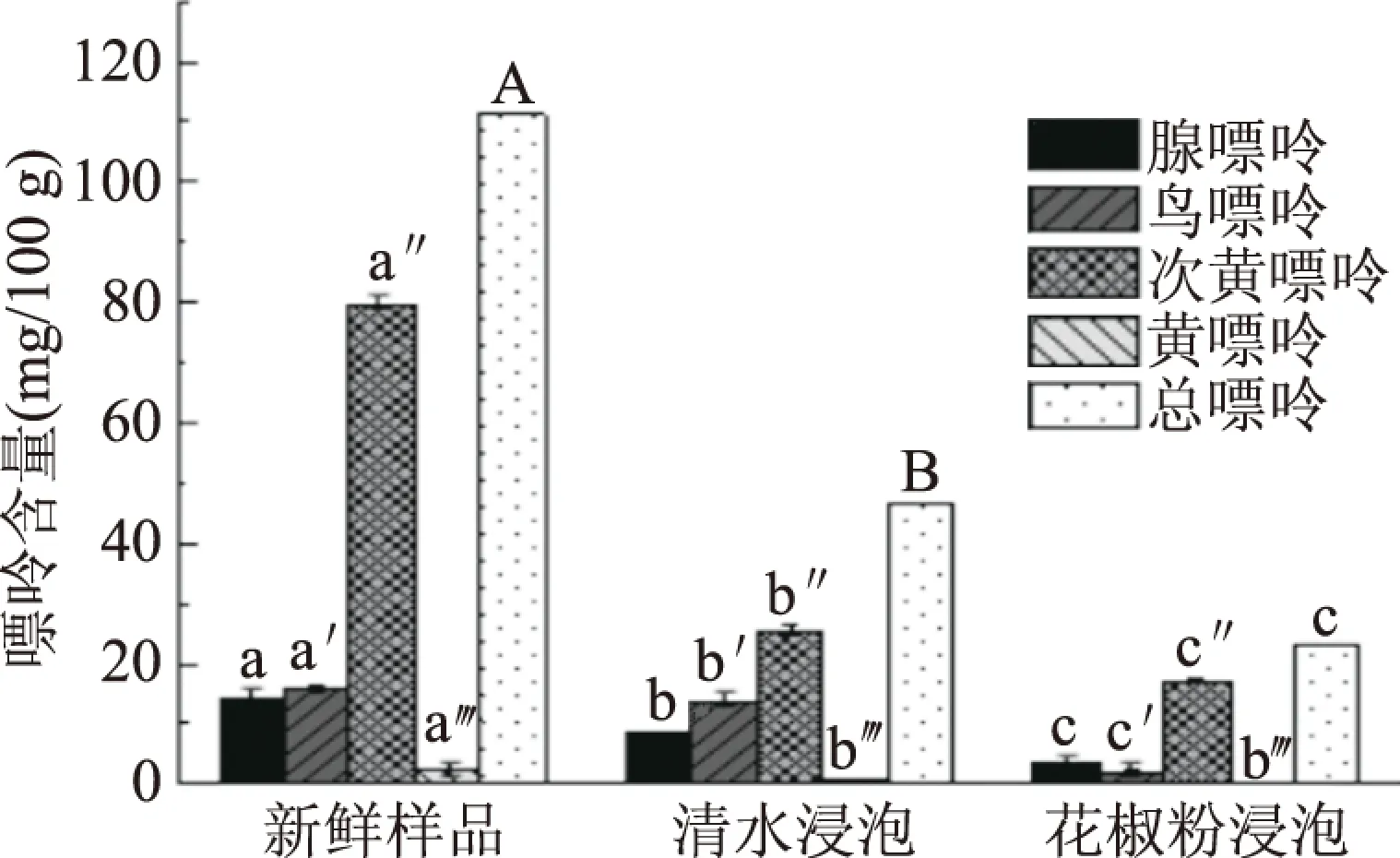
图3 浸泡-水煮对嘌呤含量的影响Fig.3 Effect of soaking-boiled on the content of purine注:不同小写字母代表同一指标 不同组之间差异显著(P<0.05)。
3 结论
本实验以高效液相色谱法为检测方法,通过用天然香辛料花椒粉溶液浸泡-清水水煮鱼片的方式,脱除鱼片中的嘌呤,结果显示通过用2%的花椒粉浸泡鱼片45 min,再用清水煮沸8 min,可得到低嘌呤调理鱼片。与清水浸泡-清水水煮过的空白组相比嘌呤含量降低了21.43%,基于此,花椒粉浸泡结合清水水煮的加工方式可有效脱除嘌呤,实验所研制的鱼片,提高了感官品质,拓宽了产品受众范围,进一步促进水产品产业健康发展。由于花椒粉成分复杂,花椒粉对嘌呤的脱除机理鲜有报道,起到主要作用的成分还有待进一步研究。后续可以尝试通过虚拟筛选、分子对接等现代化手段探究花椒粉中嘌呤相关的活性成分以及作用方式。
