番茄及灰霉菌转化酶和糖转运蛋白基因在发病期的表达研究
2021-06-15张越亭赵虎刘永华
张越亭 赵虎 刘永华

摘要 研究番茄叶片接种灰霉菌后番茄和病菌各自的转化酶和糖转运蛋白基因表达水平的变化规律,以阐明番茄和病菌各自的转化酶和糖转运蛋白在发病中的可能作用。通过系统测定接种后0、12、36和60 h番茄和灰霉菌的转化酶和糖转运蛋白基因的表达,结果发现,在接种后叶片逐渐发病,60 h时出现明显病斑。番茄叶片的CWIN基因LIN6表达水平在接种后12和60 h显著高于对照叶片,CWIN抑制蛋白基因INVINH1表达水平在接种后12 h也显著高于對照;番茄的2个STP基因SlSTP2和SlSTP1的表达水平分别在接种后12和60 h显著高于对照叶片;此外,番茄的3个Clade Ⅲ SWEET基因SlSWEET10c、SlSWEET11a和SlSWEET11c在接种后12 h即显著高于对照叶片。灰霉菌胞外转化酶基因Bc1g10247的表达水平在接种叶片后大幅上升,此外BcHXT1、BcHXT6、BcHXT13这3个己糖转运蛋白的表达水平在接种后也呈大幅上升趋势。总之,番茄CWIN和STP基因表达水平的上升并不能有效诱导抗病反应并阻止灰霉菌吸收叶片中的糖分。相反,番茄Clade III SWEET表达的上升可能会导致蔗糖被大量转运至细胞外空间,而灰霉菌胞外转化酶和己糖转运蛋白表达量的上升则可将细胞外蔗糖分解为己糖并吸收利用,最终导致灰霉病的发生。
关键词 灰霉病;番茄;蔗糖转化酶;糖分转运蛋白;基因表达
中图分类号 S436.412.1+3文献标识码 A
文章编号 0517-6611(2021)10-0101-07
doi:10.3969/j.issn.0517-6611.2021.10.027
开放科学(资源服务)标识码(OSID):
Expression of Invertase and Sugar Transporter Genes in Both Tomato and Botrytis cinerea during the Development of Grey Mold
ZHANG Yue-ting,ZHAO Hu,LIU Yong-hua (College of Horticulture,Hainan University,Haikou,Hainan 570228)
Abstract The dynamic changes in the expression levels of invertase and sugar transporter genes in both tomato and pathogens during the development of grey mold on tomato leaves caused by Botrytis cinerea were studied to clarify the possible roles of invertase and sugar transporter of tomato and pathogens in the pathogenesis.The expression of invertase and sugar transporter genes of tomato and Botrytis cinerea at 0,12,36,and 60 h after inoculation were systematically measured.It was found that the leaves were gradually infected and showed obvious disease lesions at 60 h after inoculation.The expression level of CWIN gene LIN6 in tomato leaves was significantly higher than that of control leaves at 12 and 60 h after inoculation,and the expression level of CWIN inhibitory protein gene INVINH1 was also significantly higher than that of control at 12 h after inoculation;the expression levels of two STP genes SlSTP2 and SlSTP1 in tomato were significantly higher than those of control leaves at 12 and 60 h after inoculation,respectively.In addition,the three Clade III SWEET genes SlSWEET10c,SlSWEET11a and SlSWEET11c of tomato were also significantly higher than those of control leaves at 12 h after inoculation.The expression level of the extracellular invertase gene Bc1g10247 of Botrytis cinerea rose sharply after inoculating to tomato leaves.Additionally,the expression levels of three hexose transporters including BcHXT1,BcHXT6 and BcHXT13 also showed a significant increase after inoculation.In short,the induced expression of tomato CWIN and STP genes cannot effectively enhance defense responses and prevent gray mold from absorbing sugar in tomato leaves.On the contrary,the increased expression of Clade III SWEET in tomato leaves may cause a large amount of sucrose to be exported to the extracellular space of tomato leaves,which is subsequently hydrolyzed into hexose (glucose and fructose) and absorbed into the fungal cells by the induced extracellular invertase and hexose transporter in Botrytis cinerea,eventually leading to the incidence of grey mold.
Key words Botrytis cinerea;Tomato;Sucrose invertase;Sugar transporter;Gene expression
番茄(Solanum lycopersicum)原产于南美洲,属于喜温、喜光性一年生或多年生茄科草本植物[1]。番茄是重要的果菜类蔬菜,2018年全世界番茄产量高达1.82亿t,其中我国番茄產量为0.62亿t(FAO)。番茄灰霉病是由灰葡萄孢菌(Botrytis cinerea)引起的一种世界性重要病害[2]。它主要危害番茄的果实,也会对花、茎、叶等部位产生危害,造成番茄减产,严重时甚至绝收[3]。
在植物对病菌的防卫方应中,蔗糖分解代谢发挥着重要作用[4-5],一方面,蔗糖分解代谢可以为植物防卫反应提供碳骨架和能量。如细胞壁加厚、植物抗毒素(Phytoalexin)的合成以及抗病相关蛋白的积累等防卫反应都需要大量的糖分供应[6]。另一方面,蔗糖分解产生的己糖(葡萄糖和果糖)也可以为病菌的生长提供能量和碳骨架[7]。在植物体内有2种分解蔗糖的酶,分别是蔗糖合成酶(sucrose synthase,Sus)和蔗糖转化酶(sucrose invertase,INV)。Sus可以将蔗糖分解为UDP-葡萄糖和果糖(该反应可逆),是叶片光合作用产物蔗糖进入各种代谢途径所必需的关键酶之一[8]。INV可以将蔗糖水解为葡萄糖和果糖(该反应不可逆),在植物生长发育中发挥着许多不同的功能,其中包括调节植物对病原菌的响应[5]。在植物中,根据亚细胞定位的不同可以将INV分为三类:细胞壁转化酶(cell wall invertase,CWIN)、液泡转化酶(vacuolar invertase,VIN)和细胞质转化酶(cytoplasmic invertase,CIN)[9]。
目前有关蔗糖分解酶在植物抗病中的研究主要集中于CWIN。植物在受到病菌侵染的过程中其CWIN活性呈上升趋势[10-11]。研究表明CWIN在植物抗病方面发挥着积极作用。如表达细胞壁转化酶的转基因烟草对马铃薯Y病毒(potato virus Y)的抗性增加[12]。超表达CWIN基因的水稻可以增强对细菌性病菌Xanthomonas oryzae pv.oryzae和真菌性病菌Magnaporthe oryzae的抗性[13]。相反,抑制CWIN表达会降低植物的抗病性。如通过RNA干扰技术抑制烟草中CWIN的表达导致植株对卵菌病原菌Phytophthora nicotianae的抗性降低[10]。利用化学试剂Acarbose专一性抑制CWIN的活性导致拟南芥对细菌病菌Pseudomonas syringae pv.Tomato DC3000(Pst DC3000)的抗性下降[11]。然而,研究表明CWIN在一些植物的抗病中发挥着负面作用。如沉默番茄CWIN基因LIN8的表达增强了番茄对细菌性病菌Xanthomonas campestris pv.vesicatoria(Xcv)的抗性[14]。同样,通过超表达CWIN抑制因子的方法降低CWIN的活性导致拟南芥对真菌病菌Plasmodiophora brassicae的抗性增加[15]。表明CWIN在植物抗病性中的作用可能受到植物和病菌种类的影响。
CWIN在质外体空间将蔗糖分解为葡萄糖和果糖后,植物为了阻止病原菌对糖分的吸收上述己糖往往会上调糖转运蛋白STP(Sugar TransPorter)的表达。STP主要位于植物细胞膜上,负责将细胞外空间的己糖吸收进入植物细胞,从而抑制病原菌的生长和繁殖[16-17]。如在拟南芥受到病菌侵染时,超表达AtSTP13可以增强其单糖摄取活性,与细菌竞争胞外糖,导致细菌无法得到能量来源,增强植物的抗病性[18]。相应地,病原菌为了从植物获得足够的糖分用于自身的生长发育也进化出了不同的对抗策略:一方面,病原菌诱导植物中糖转运蛋白SWEET(Sugars Will Eventually be Exported Transporter)的表达,SWEET可将植物细胞内的糖分(蔗糖、葡萄糖和果糖)转运至细胞外部供病原菌吸收利用[19]。如白叶枯病菌(Xanthomonas oryzae pv.oryzae)侵染水稻植株后分泌特定的转录激活(transcription Activator-Like,TAL)效应因子,该效应因子与OsSWEET11基因的启动子特异原件结合,诱导OsSWEET11基因表达上调,导致更多糖分转运至水稻细胞外部,病菌获得糖分,从而植株感病[20-22]。另一方面,大部分病原菌包括灰霉菌主要利用己糖(主要是葡萄糖)作为碳源,因此病原菌自身还表达蔗糖转化酶和己糖转运蛋白,可分解并吸收利用来自于植物的蔗糖[23]。如灰酶菌糖转运蛋白FRT1对果糖具有很高的特异性[24],而转运蛋白家族BcHXTs对己糖有很高的特异性[25]。此外,灰霉菌也向细胞外分泌转化酶(如Bc1g10247和Bc1g16010)[26]。在灰霉菌侵染拟南芥时,该病菌的Bc1g10247基因表达增强[27]。目前大多数研究仅关注植物细胞壁转化酶和糖转运蛋白对植物抗病性的影响,很少研究病菌蔗糖转化酶和糖转运蛋白对植物抗病性的影响,特别是尚未见有关番茄CWIN、STP和SWEET以及灰霉菌转化酶和己糖转运蛋白在番茄-灰霉菌互作过程中具体作用的研究。
笔者研究灰霉菌侵染番茄叶片过程中番茄叶片中CWIN、STP和SWEET相关基因表达水平的动态变化,同时也对灰霉病菌主要转化酶基因和己糖转运蛋白基因的表达变化进行研究,以期从番茄和灰霉菌两方面初步阐明糖代谢和转运调控灰霉病发病的可能机制,为后续高抗灰霉病番茄品种的选育提供理论指导。
1 材料与方法
1.1 材料 试验所用的番茄(Lycopersicon esculentum)品种为新疆农业科学院园艺研究所育成的“新番2号”。挑选番茄种子并消毒,23 ℃恒温催芽6 d。待种子发芽后,将已发芽的种子播种到穴盘内。待子叶长出后,开始浇施稀释后的日本园式营养液。栽培约20 d后,将4叶1心的番茄苗定植到海南大学实验基地大田中进行露地栽培,并施用一定量的复合肥(N∶P∶K=15∶15∶15)作为基肥。待番茄生长约30 d后,选取从植株顶端往下数第3~4叶位置的大小、形状均匀一致且较为平整的叶片进行灰霉菌离体接种。
1.2 方法
1.2.1 灰霉菌的培养和接种。灰霉菌(Botrytis cinerea)在V8培养基上,温度为23 ℃的黑暗条件下进行倒置培养,约14 d后灰霉菌产生大量分生孢子,可用于接种试验。番茄叶片离体接种灰霉菌的方法参照Lian等[28]并作一些调整。用SMB液体培养基先制备灰霉菌的孢子悬浮液,并调整孢子终浓度为2×104/mL。用蒸馏水将番茄叶片的表面清洗干净,并用吸水纸吸干叶面的水,在直径12 cm的塑料培养皿中倒入70 mL 0.8%的琼脂,琼脂冷却凝固后将叶片的叶柄轻轻地嵌入琼脂中并保持叶片上面平整。在每片叶子的主脉两侧各接种1滴孢子悬浮液,每滴5 μL,封口膜密封后,在23 ℃黑暗下培养。对照叶片则接种不含孢子的SMB液体培养基。分别于接种后0、12、36和60 h进行观察并取样,取样时以接种部位为中心取样,称取0.15 g样品,液氮速冻后在-80 ℃保存,用于后续相关指标的测定。每个处理均包含4个生物学重复。
1.2.2 灰霉菌生物量定量。
灰霉菌生物量测定方法参考Gachon等[29],使用Tiangen植物DNA提取试剂盒DP305分别提取番茄叶片和灰霉菌的DNA,并用NanoDrop测定浓度和纯度。使用诺唯赞ChamQ Universal SYBR qPCR Master Mix试剂盒,在德国耶拿qTOWER3G上进行qRT-PCR。具体反应条件:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。实时定量PCR的反应体系为10 μL,包括1.0 μL DNA,5.0 μL SYBR Green I Master mix,10 μmol/L的正反向引物各0.2 μL,3.6 μL ddH2O。使用番茄叶片DNA和灰霉菌DNA梯度稀释液绘制标准曲线,用于对每个样品中番茄和灰霉菌的DNA含量进行定量测定。
使用Tiangen试剂盒DP305提取接种灰霉菌后的番茄叶片总DNA。使用诺唯赞ChamQ Universal SYBR qPCR Master Mix试剂盒,在德国耶拿qTOWER3G上进行qRT-PCR。具体反应条件:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。实时定量PCR反应体系为10 μL,包括1.0 μL DNA,5.0 μL SYBR Green I Master mix,10 μmol/L的正反向引物各0.2 μL,3.6 μL ddH2O。根据标准曲线,计算出每个样品中IGS和ACTIN的DNA量,用IGS/ACTIN表示灰霉菌的生物量,灰霉菌IGS引物參考Suarez等[30],用SPSS 19.0软件分析数据。
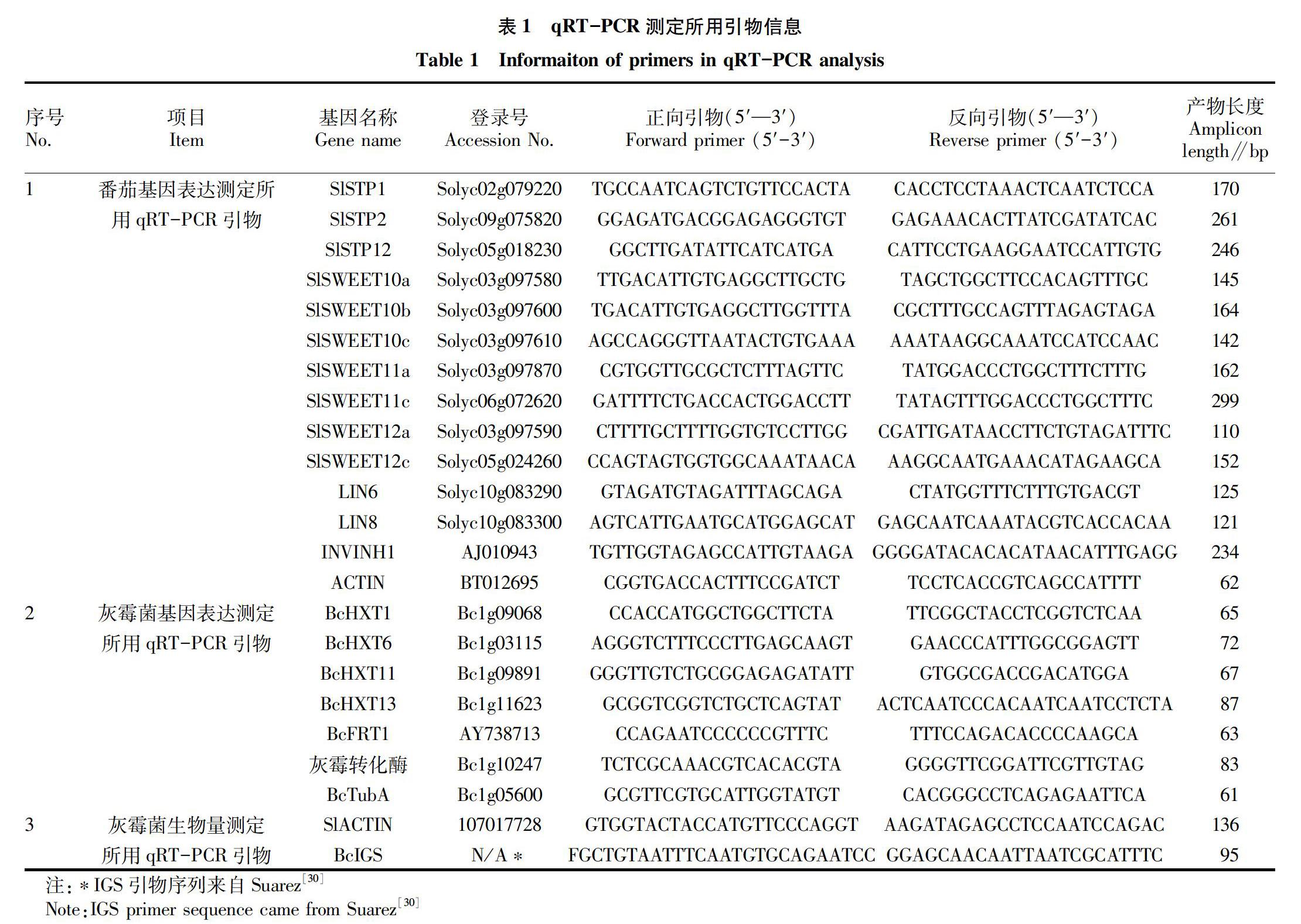
1.2.3 引物设计。番茄的基因序列均从http://www.sgn.cornell.edu网站获取,灰霉菌的基因均从https://www.broadinstitute.org网站获取。使用Primer 5设计qRT-PCR引物,使用NCBI网站的Primer Blast 进行引物特异性筛选,具体引物信息见表1。
1.2.4 植物和灰霉菌总RNA的提取。根据生工UNIQ-10 柱式Trizol 总RNA 抽提试剂盒的步骤提取植物和灰霉菌的总RNA,使用诺唯赞HiScript Ⅲ 1st Strand cDNA Synthesis Kit逆转录试剂盒按说明书将总RNA逆转录为cDNA,用于番茄和灰霉菌的转化酶和糖转运蛋白基因表达的分析。
1.2.5 植物和灰霉菌的基因表达。
使用诺唯赞ChamQ Universal SYBR qPCR Master Mix试剂盒,在德国耶拿qTOWER3G上进行。具体反应条件:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。实时定量PCR的反应体系为10 μL,包括1.0 μL cDNA,5.0 μL SYBR Green I Master mix,10 μmol/L的正反向引物各0.2 μL,3.6 μL ddH2O。选择用番茄ACTIN和灰霉菌BcTubA作为内参基因,以上述cDNA为模板,对番茄和灰霉菌的蔗糖转化酶和糖转运蛋白相关基因的表达进行检测。以0 h 的W样品对照,采用2-△△CT法对qRT-PCR结果进行计算。
1.3 数据处理 利用 Excel 2010软件对试验数据进行作图,使用SPSS 19.0软件对数据t-test分析。
2 结果与分析
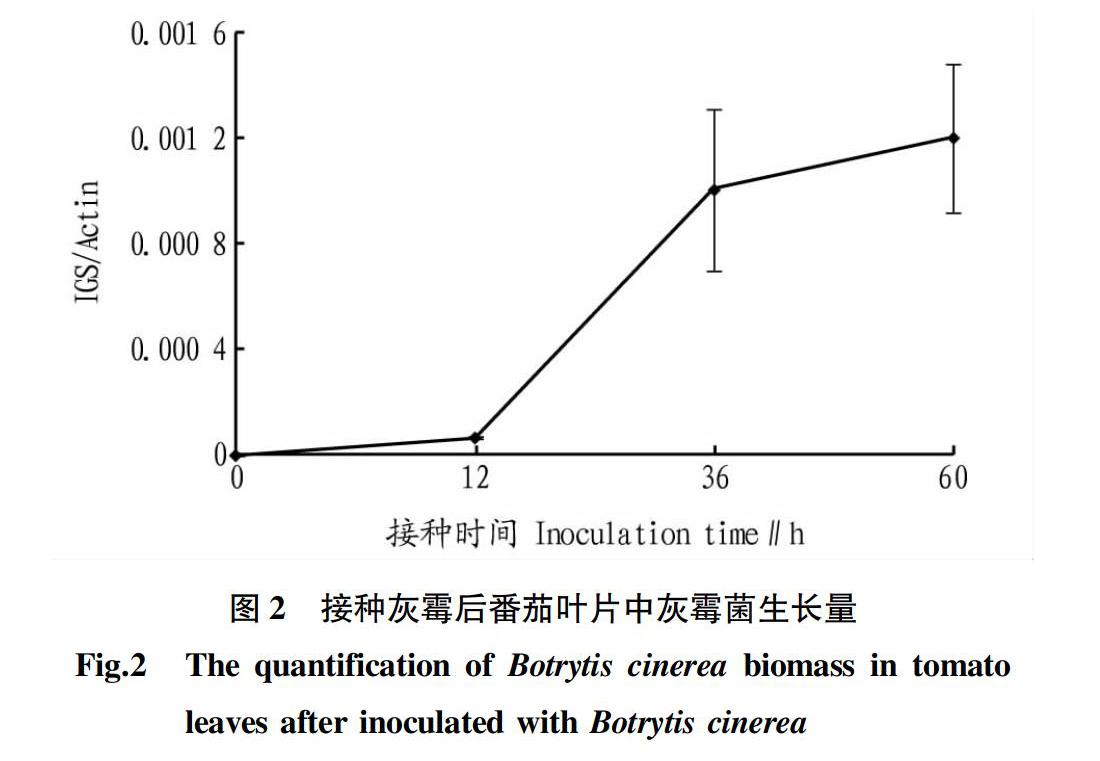
2.1 接种后番茄叶片发病情况和灰霉菌生长情况 对接种后0、12、36、60 h的番茄叶片进行观察,发现在接种后0~12 h观察不到病斑,接种后36 h在番茄叶片表面开始出现较小的病斑,而在接种后60 h则可观察到明显的病斑(图1)。根据Gachon等[29]的方法,通过提取接种后番茄叶片的总DNA,利用qRT-PCR技术分别对灰霉菌IGS基因和番茄ACTIN基因进行qRT-PCR测定,利用IGS/ACTIN来反映接种后叶片中灰霉菌的生长量,该比值越大表明番茄叶片中灰霉菌的生长量越高。测定结果发现,接种12 h后番茄叶片中的灰霉菌生长量出现小幅上升,而36和60 h灰霉菌的生长量呈大幅增加的趋势(图2)。表明随着番茄叶片病斑面积的增大,叶片中灰霉菌的生长量也逐渐增加。
2.2 接种灰霉菌后番茄叶片中CWIN及其抑制蛋白基因的表达分析
番茄基因组中共有4个编码CWIN的基因,分别为LIN5、LIN6、LIN7、LIN8,其中在番茄叶片表达CWIN只有LIN6和LIN8,且LIN8的表达量显著高于LIN6[31]。接种灰霉菌后,番茄叶片中主要的CWIN基因LIN8的表达量呈先上升后下降的趋势,且在接种后36 h达到峰值(图3)。未接种灰霉菌的对照叶片中LIN8的表达量也呈相似的变化趋势,且在4个时期内未接种灰霉菌的对照叶片和接种灰霉菌的叶片之间均无显著差异。接种叶片和对照叶片中的LIN6表达水平均呈先上升后下降再上升的趋势;特别值得注意的是,与对照叶片相比,接种番茄叶片的LIN6表达水平在接种后12和60 h显著升高,其表达水平分别为对照叶片的3和13倍。
植物中CWIN的活性不仅受到自身基因表达水平的影响,还受到CWIN抑制蛋白表达水平的调控,该抑制蛋白通过与CWIN蛋白结合的方式来抑制CWIN的活性[32]。对番茄叶片中CWIN抑制蛋白基因INVINH1表达水平的测定表明,接种叶片的INVINH1表达水平在接种后快速上升,而对照叶片中该基因的表达水平上升速度相对较慢,这导致在接种早期(12 h)接种叶片中的INVINH1表达水平显著高于对照叶片(图3);然而在接种后36和60 h接种叶片和对照叶片在INVINH1表达水平上均无显著差异。
2.3 接种灰霉菌后番茄叶片中糖转运蛋白STP和SWEET基因的表达分析
番茄基因组中共有18个STP基因家族成员,分别为SlSTP1-18,其中仅有SlSTP1、SlSTP2和SlSTP12这3个家族成员在叶片中表达,且表达量依次为SlSTP12>SlSTP1>SlSTP2[33]。qRT-PCR测定结果表明,接种叶片中的SlSTP1表达量在接种后12和36 h与对照叶片无显著差异,但在接种后60 h则显著高于对照叶片,比对照高2倍左右(图4);接种叶片中的SlSTP2表达量在接种后12 h显著高于对照叶片,较对照高4倍以上,但在接种后36和60 h与对照无显著差异;和上述2个基因不同,接种叶片中的SlSTP12表达量在接种后12和60 h不但没有高于对照叶片,反而显著低于对照叶片,而在接种后36 h与对照叶片无显著差异。上述结果表明灰霉菌接种会对STP相关基因的表达水平产生显著影响,且不同STP成员对灰霉菌接种的响应存在显著差异。
植物的SWEET基因分为4类,其中专一性运输蔗糖的CladeⅢ SWEET和植物之间的抗病性关系最为密切[19]。番茄中有29个SWEET家族成员,其中属于CladeⅢ的有13個,而在叶片中表达量较高的CladeⅢ基因有7个,分别为SlSWEET10a、SlSWEET10b、SlSWEET10c、SlSWEET11a、SlSWEET11c、SlSWEET12a、SlSWEET12c[33]。qRT-PCR测定结果表明,上述7个SWEET基因的表达对灰霉菌接种的反应大致可以分为两类,一类是接种灰霉菌后其表达量和对照叶片相比无显著差异,包括SlSWEET10a、SlSWEET10b、SlSWEET12a、SlSWEET12c(图5);另一类是接种灰霉菌后其表达量和对照相比显著升高,其中SlSWEET10c在接种后12 h相比对照分别上调了78%,SlSWEET11a在12和60 h相比对照分别上调了225%和267%;SlSWEET11c 在12和36 h相比对照分别上调了97%和126%;上述结果表明灰霉菌接种可能只是对部分SWEET基因的表达产生上调的影响,而这些SWEET可能在番茄抵御灰霉病侵染中发挥着重要作用。
2.4 接种番茄叶片后灰霉菌转化酶和己糖转运蛋白基因的表达分析
除测定番茄叶片中细胞壁转化酶和糖转运蛋白基因的表达外,还测定了接种后灰霉菌自身转化酶和己糖转运蛋白基因的表达变化。结果表明,灰霉菌可向细胞外分泌转化酶,灰霉菌基因组中一个编码胞外转化酶的基因为Bc1g10247,其在灰霉病致病性中发挥着重要作用[27]。对Bc1g10247表达量的测定表明,接种番茄叶片后灰霉菌Bc1g10247表达量呈快速上升趋势(图6)。此外,灰霉菌基因组中有17个编码己糖转运蛋白的基因,其中BcHXT1、BcHXT6、BcHXT11、BcHXT13这4个己糖转运蛋白胨基因的表达丰度较高[27]。测定结果表明BcHXT1、BcHXT6、BcHXT13的表达水平在接种番茄叶片后均呈上升趋势,特别是BcHXT1在接种后36 h即出现明显的上升,表明这3个己糖转运蛋白基因可能在灰霉菌获取糖分的过程中发挥着重要作用。BcHXT11的表达水平在接种番茄后呈下降趋势。此外,灰霉菌中编码果糖转运蛋白的基因BcFRT1的表达水平在接种番茄叶片后也呈下降趋势(图6)。
3 讨论
病原菌成功侵入植物细胞之前及其随后在植物组织中的整个发育过程都需要从植物质外体空间吸收糖分(主要是葡萄糖)来维持其生长发育[34-35]。因此,无论是植物还是病菌的蔗糖分解酶和糖转运蛋白均会对植物-病菌的互作产生重要影响,从而影响病害的发生。然而,目前绝大部分有关糖代谢在植物抗病中的作用研究仅集中于研究植物蔗糖分解酶和糖分转运蛋白,很少同时对病原菌的蔗糖分解酶和糖转运蛋白进行研究,该研究则同时研究番茄和灰霉菌的蔗糖转化酶和糖转运蛋白相关基因的表达。
研究表明,番茄叶片的CWIN活性在接种灰霉菌后12、24和48 h均显著高于对照叶片[36],但尚不清楚是哪个CWIN基因的表达在其中发挥主要作用,也不清楚CWIN抑制蛋白的表达水平发生了何种变化。该研究对番茄CWIN基因LIN6和LIN8表达水平的测定表明,在番茄叶片中表达丰度最高的LIN8的表达水平在接种叶片和对照叶片之间无显著差异,而LIN6的表达水平在接种后12和60 h叶片中的表达水平显著高于对照叶片(图3)。同时,接种叶片中的CWIN抑制蛋白基因INVINH1表达水平在接种后12 h显著高于对照叶片(图3)。上述结果表明,接种灰霉菌后番茄叶片中CWIN活性的升高主要是LIN6表达水平上升所导致的,而CWIN抑制蛋白基因INVINH1表达水平的升高并不能显著抑制接种后番茄叶片CWIN活性的上升。
接种后番茄叶片CWIN活性的增加可通过将更多蔗糖分解为己糖(葡萄糖和果糖)从而导致质外体空间中己糖/蔗糖比值的升高[36]。一方面,升高的己糖/蔗糖比值可诱导番茄的抗病反应[16-17];但另一方面,增加的质外体空间己糖也可为病菌生长发育提供更多的能量和碳骨架,从而促进病害的发生[7]。植物的糖分转运蛋白STP可将质外体空间的糖分吸收进入植物细胞从而可阻止病菌从叶片获取糖分。对番茄叶片中表达的3个STP基因SlSTP1、SlSTP2和SlSTP12表达水平的测定表明,SlSTP1的表达量在接种后60 h显著高于对照叶片,而SlSTP2表达量在接种后12 h显著高于对照叶片。鉴于上述2个STP蛋白均位于植物细胞质膜上[37],推测其表达量的上升可通过将糖分吸收进入叶片细胞从而抑制番茄灰霉病的发生。然而,伴随着STP表达水平的变化,糖分转运蛋白SWEET的表达水平也发生了较大的变化。由于SWEET可将植物细胞内的糖分(蔗糖、葡萄糖和果糖)转运至细胞外部供病原菌吸收利用,因此会促进病菌对糖分的吸收利用[19]。对在番茄叶片中表达量较高的7个CladeIII SWEET基因表达水平进行测定,结果表明有3个SWEET基因的表达水平受到灰霉病菌的强烈诱导,分别是SlSWEET10c、SlSWEET11a和SlSWEET11c。上述结果表明,灰霉菌可能通过诱导番茄SWEET基因的表达来抵消STP表达增加的作用,从而能获取足够的糖分来成功侵染番茄。
除測定番茄叶片中细胞壁转化酶和糖转运蛋白基因的表达外,还测定了接种后灰霉菌自身转化酶和己糖转运蛋白基因的表达变化。研究发现,接种番茄叶片后,灰霉菌胞外转化酶基因Bc1g10247的表达水平呈持续增加的趋势;此外,3个己糖转运蛋白BcHXT1、BcHXT6、BcHXT13的表达水平在接种番茄叶片也大幅上升。上述结果表明,接种番茄叶片后胞外转化酶和己糖转运蛋白基因表达水平的上升,将有利于灰霉菌将番茄叶片质外体空间的蔗糖分解为己糖并吸收利用,从而有助于灰霉菌的成功侵染。
接种灰霉菌后,番茄叶片SWEET相关基因的表达水平受到灰霉菌的诱导而增加,糖分(主要是蔗糖)被SWEET转运至质外体空间。同时,灰霉菌的胞外转化酶和己糖转运蛋白相关基因的表达量上升,从而可将番茄质外体空间的蔗糖分解为己糖并吸收利用。虽然番茄叶片STP相关基因的表达量在接种灰霉菌后也大幅增加,但这并不能有效阻止灰霉菌对己糖的吸收利用,最终灰霉菌成功侵染番茄叶片。
参考文献
[1]
程智慧.蔬菜栽培学各论[M].北京:科学出版社,2010:6.
[2] 陈利军,郭世保,田雪亮,等.产香真菌GS-1菌株鉴定及其挥发性物质对番茄灰霉病的生防效果[J].植物保护学报,2016,43(4):608-613.
[3] 李保聚,朱国仁,赵奎华,等.番茄灰霉病在果实上的侵染部位及防治新技术[J].植物病理学报,1999,29(1):63-67.
[4] KOCH K.Sucrose metabolism:Regulatory mechanisms and pivotal roles in sugar sensing and plant development[J].Current opinion in plant biology,2004,7(3):235-246.
[5] RUAN Y L.Sucrose metabolism:Gateway to diverse carbon use and sugar signaling[J].Annual review of plant biology,2014,65(1):33-67.
[6] BERGER S,SINHA A K,ROITSCH T.Plant physiology meets phytopathology:Plant primary metabolism and plant-pathogen interactions[J].Journal of experimental botany,2007,58(15/16):4019-4026.
[7] RICO A,PRESTON G M.Pseudomonas syringae pv.tomato DC3000 uses constitutive-and apoplast-induced nutrient assimilation pathways to catabolize nutrients that are abundant in the tomato apoplast[J].Molecular plant-microbe interactions,2008,21(2):269-282.
[8] 李丽娜,孔建强.植物蔗糖合酶的结构、功能及应用[J].中国生物化学与分子生物学报,2015,31(9):904-913.
[9] STURM A.Invertases:Primary structures,functions,and roles in plant development and sucrose partitioning[J].Plant physiology,1999,121(1):1-8.
[10] ESSMANN J,BONES P,WEIS E,et al.Leaf carbohydrate metabolism during defense[J].Plant signaling and behavior,2008,3(10):885-887.
[11] BONFIG K B,GABLER A,SIMON U K,et al.Post-translational derepression of invertase activity in source leaves via down-regulation of invertase inhibitor expression is part of the plant defense response[J].Molecular plant,2010,3(6):1037-1048.
[12] HERBERS K,MEUWLY P,FROMMER W B,et al.Systemic acquired resistance mediated by the ectopic expression of invertase:Possible hexose sensing in the secretory pathway[J].Plant cell,1996,8(5):793-803.
[13] SUN L,YANG D L,KONG Y,et al.Sugar homeostasis mediated by cell wall invertase GRAIN INCOMPLETE FILLING 1 (GIF1) plays a role in pre-existing and induced defence in rice[J].Molecular plant pathology,2014,15(2):161-173.
[14] KOCAL N,SONNEWALD U,SONNEWALD S.Cell wall-bound invertase limits sucrose export and is involved in symptom development and inhibition of photosynthesis during compatible interaction between tomato and Xanthomonas campestris pv vesicatoria[J].Plant physiology,2008,148(3):1523-1536.
[15] SIEMENS J,GONZLEZ M C,WOLF S,et al.Extracellular invertase is involved in the regulation of clubroot disease in Arabidopsis thaliana[J].Molecular plant pathology,2011,12(3):247-262.
[16] DOIDY J,GRACE E,KHN C,et al.Sugar transporters in plants and in their interactions with fungi[J].Trends in plant science,2012,17(7):413-422.
[17] POMMERRENIG B,MDSAM C,KISCHKA D,et al.Treat and trick:Common regulation and manipulation of sugar transporters during sink establishment by the plant and the pathogen[J].Journal of experimental botany,2020,71(14):3930-3940.
[18] LEMONNIER P,GAILLARD C,VEILLET F,et al.Expression of Arabidopsis sugar transport protein STP13 differentially affects glucose transport activity and basal resistance to Botrytis cinerea[J].Plant molecular biology,2014,85(4/5):473-484.
[19] CHEN L Q,HOU B H,LALONDE S,et al.Sugar transporters for intercellular exchange and nutrition of pathogens[J].Nature,2010,468(7323):527-532.
[20] CHU Z H,FU B Y,YANG H,et al.Targeting,xa13,a recessive gene for bacterial blight resistance in rice[J].Theoretical and applied genetics,2006,112(3):455-461.
[21] YUAN M,CHU Z H,LI X H,et al.Pathogen-induced expressional loss of function is the key factor in race-specific bacterial resistance conferred by a recessive R gene xa13 in rice[J].Plant and cell physiology,2009,50(5):947-955.
[22] YANG B,SUGIO A,WHITE F F.Os8N3 is a host disease-susceptibility gene for bacterial blight of rice[J].Proceedings of the national academy of sciences,2006,103 (27):10503-10508.
[23] WILSON A M,WILKEN P M,VAN DER NEST M A,et al.Homothallism:An umbrella term for describing diverse sexual behaviours[J].IMA Fungus,2015,6(1):207-214.
[24] DOEHLEMANN G,MOLITOR F,HAHN M.Molecular and functional characterization of a fructose specific transporter from the gray mold fungus Botrytis cinerea[J].Fungal genetics and biology,2005,42(7):601-610.
[25] DULERMO T,RASCLE C,CHINNICI G,et al.Dynamic carbon transfer during pathogenesis of sunflower by the necrotrophic fungus Botrytis cinerea:From plant hexoses to mannitol[J].New phytologist,2009,183(4):1149-1162.
[26] PARRENT J L,JAMES T Y,VASAITIS R,et al.Friend or foe? Evolutionary history of glycoside hydrolase family 32 genes encoding for sucrolytic activity in fungi and its implications for plant-fungal symbioses[J].BMC Evolutionary Biology,2009,9:1-16.
[27] VEILLET F,GAILLARD C,COUTOS-THVENOT P,et al.Targeting the AtCWIN1 gene to explore the role of invertases in sucrose transport in roots and during Botrytis cinerea infection[J].Frontiers in plant science,2016,7:1-20.
[28] LIAN J J,HAN H Y,ZHAO J H,et al.In-vitro and in-planta Botrytis cinerea inoculation assays for tomato[J].The plant cell,2018,8(8):e2810.
[29] GACHON C,SAINDRENAN P.Real-time PCR monitoring of fungal development in Arabidopsis thaliana infected by Alternaria brassicicola and Botrytis cinerea[J].Plant physiology and biochemistry,2004,42(5):367-371.
[30] SUAREZ M B,WALSH K,BOONHAM N,et al.Development of real-time PCR (TaqMan) assays for the detection and quantification of Botrytis cinerea in planta[J].Plant physiology and biochemistry,2005,43(9):890-899.
[31] FRIDMAN E,ZAMIR D.Functional divergence of a syntenic invertase gene family in tomato,potato,and Arabidopsis[J].Plant physiology,2003,131(2):603-609.
[32] JIN Y,NI D A,RUAN Y L.Posttranslational elevation of cell wall invertase activity by silencing its inhibitor in tomato delays leaf senescence and increases seed weight and fruit hexose level[J].Plant cell,2009,21(7):2072-2089.
[33] FENG C Y,HAN J X,HAN X X,et al.Genome-wide identification,phylogeny,and expression analysis of the SWEET gene family in tomato[J].Gene,2015,573(2):261-272.
[34] NEHLS U,GHRINGER F,WITTULSKY S,et al.Fungal carbohydrate support in the ectomycorrhizal symbiosis:A review[J].Plant biology,2010,12(2):292-301.
[35] FERNANDEZ J,MARROQUIN-GUZMAN M,WILSON R A.Mechanisms of nutrient acquisition and utilization during fungal infections of leaves[J].Annual review of phytopathology,2014,52:155-174.
[36]
彭家麗,赵虎,李智佳,等.灰霉病对番茄叶片蔗糖转化酶活性和可溶性糖含量的影响[J].安徽农业科学,2020,48(11):156-160,163.
[37] REUSCHER S,AKIYAMA M,YASUDA T,et al.The sugar transporter inventory of tomato:Genome-wide identification and expression analysis[J].Plant and cell physiology,2014,55(6):1123-1141.
