两株猪链球菌血清9型菌株的生物特性分析
2021-06-15王召贺陈波徐高原张华伟郝根喜潘建刚周明光
王召贺 陈波 徐高原 张华伟 郝根喜 潘建刚 周明光


摘要 为了解猪链球菌血清9型菌株KQ-1株、KQ-2株的生物特性,对其进行了菌种鉴定、生長曲线绘制、毒力因子鉴定和小鼠致病性试验。首先采用革兰氏染色、PCR鉴定的方法对2株菌进行菌种鉴定,然后利用猪链球菌的主要毒力基因mrp、epf、sly、gadph、orf2、fbps、89k的引物对2株菌的毒力基因进行鉴定;将2株菌在TSB培养基(含10%新生牛血清)中进行培养,绘制其生长曲线,初步了解这2株菌的生长特性;选取45只健康的昆明鼠注射2株菌的菌液,进行致病性试验,了解其致病性。结果显示,KQ-1株、KQ-2株革兰氏染色呈阳性,PCR鉴定结果为猪链球菌血清9型;2株菌均在37 ℃培养6 h时菌液密度达到最高值。对2株菌毒力基因的鉴定结果如下:KQ-1株的基因型为mrp+/epf-/sly+/gadph+/orf2-/fbps-/89k-,KQ-2株的基因型为mrp-/epf-/sly-/gadph+/orf2+/ fbps-/ 89k-;对2株菌的小鼠致病性试验表明,2株菌均为强毒株。
关键词 猪链球菌;血清9型;毒力基因;致病性试验
中图分类号 S855.1+1文献标识码 A
文章编号 0517-6611(2021)10-0092-06
doi:10.3969/j.issn.0517-6611.2021.10.025
开放科学(资源服务)标识码(OSID):
Biological Characteristics Analysis of Two Streptococcus suis Serotype 9 Strains
WANG Zhao-he,CHEN Bo,XU Gao-yuan et al (Wuhan Keqian Biology Co.,Ltd.,Wuhan,Hubei430000)
Abstract In order to understand the biological characteristics of Streptococcus suis serotype 9 strains(KQ-1 and KQ-2),the identification of strains and their virulence genes,drawing of growth curves,mouses pathogenicity test were conducted.Those two strains were identified by Gram staining and PCR,then the primers of the main virulence genes (mrp,epf,sly,gadph,orf2,fbps,89k) of S.suis were used to identify the virulence genes of the two strains.The two strains were cultured in TSB medium (containing 10% newborn calf serum),and their growth curves were drawn to get a preliminary understanding of the growth characteristics of the two strains.45 healthy Kunming rats were injected with two strains of bacteria for the pathogenicity test to understand their pathogenicity.The results showed that the Gram staining results of KQ-1 strain and KQ-2 strain were positive,they were identified as S.suis serotype 9 strains by PCR identification.The bacterial liquid density of the two strains both reached the peak at 6 h when cultured at 37 ℃.The results of virulence factors of the two strains showed that the genotype of KQ-1 strain was mrp+/epf-/sly+/gadph+/orf2-/fbps-/89k-,while that of KQ-2 strain was mrp-/epf-/sly-/gadph+/ orf2+/fbps-/89k-.The results of pathogenicity test on mice showed that the two strains were highly virulent.
Key words Streptococcus suis;Serotype 9;Virulence genes;Pathogenicity test
猪链球菌(Streptococcus suis)是一种革兰氏阳性菌,能引起感染猪只的脑膜炎、关节炎、败血症等症状,属于人畜共患病原体[1]。1998和2005年,在江苏南通和四川资阳等地发生猪链球菌感染暴发事件,并引发工作人员感染,造成了重大的经济损失和人员伤亡[2-3]。根据荚膜多糖抗原性的不同,猪链球菌可分为35个血清型,即血清1~34型和1/2型。在世界范围内以血清2型最为流行,其次是血清9型、3型等,血清2型也是目前研究最多的血清型,而关于其他血清型的研究较少[4]。目前我国虽然没有血清9型的暴发事件发生,但经常从病猪体内分离出血清9型菌株,且近年来血清9型有扩大流行趋势[5-7],需要引起相关研究人员和养殖业从业人员的注意。
武汉科前生物股份有限公司从送检的病料中分离出2株病原菌,经鉴定为猪链球菌血清9型。笔者通過革兰氏染色、PCR鉴定的方式验证菌种和血清型,并进行其毒力基因的鉴定、生长曲线的绘制和小鼠致病性试验,进一步了解了2株菌的生长特性和致病特性,以期为后期开发针对性的疫苗、制定防治策略奠定基础。
1 材料与方法
1.1 菌种 试验菌种由武汉科前生物股份有限公司从送检的病料中分离,并鉴定、保存,分别命名为KQ-1株、KQ-2株。
1.2 主要试剂 TSA(Tryptic Soy Agar)、TSB(Tryptic Soy Broth)培养基购自DB Biotech生物科技有限公司;新生牛血清购自内蒙古金源康生物工程有限公司;革兰氏染液购自南京建成科技有限公司;引物合成由擎科生物技术有限公司完成;PrimeSTAR Max DNA Polymerase购自TaKaRa公司。
1.3 试验动物 SPF级昆明小鼠45只,4~6周龄,购自华中农业大学实验动物中心。
1.4 革兰氏染色 将冻干保存的菌种取一小块固体于TSA平板(含10%新生牛血清)上,待其溶解后,用经酒精灯火焰烧过的接种环沾取菌液,在平板上划线,将平板倒置,37 ℃恒温培养箱培养过夜。挑取针尖大小、表面光滑、灰白色、半透明的疑似单菌落,继续在TSA平板(含10%新生牛血清)上划线、传代。重复1次,挑取疑似单菌落,进行革兰氏染色,染色步骤按照操作说明书完成。
1.5 菌种鉴定 按照参考文献[8]设计猪链球菌血清9型的荚膜多糖合成基因cps9H引物,引物序列如下:P1为GGCTACATATAATGGAAGCCC,P2为CCGAAGTATCTGGGCTACT-G。预计扩增片段大小为389 bp。引物由擎科生物技术有限公司合成。
用经酒精灯火焰烧过的接种环从TSA平板(含10%新生牛血清)上挑取疑似单菌落,在50 μL的PBS缓冲液中搅动,使菌体从接种环上洗脱至PBS缓冲液中。水浴煮沸10 min,置于冰上2 min,12 000 r/min离心5 min,取上清液作为PCR的模板。PCR体系如下:模板0.5 μL,引物P1、P2各0.5 μL,2×PrimeSTAR MAX 5 μL,用ddH2O补足10 μL。PCR程序如下:95 ℃预变性5 min;95 ℃变性15 s,56 ℃退火30 s,72 ℃延伸15 s,30个循环;72 ℃延伸10 min;4 ℃下保存。将PCR产物进行1%琼脂糖凝胶电泳检测,120 V电泳20 min,在凝胶成像系统下观察有无条带。
1.6 毒力基因鉴定
按照参考文献[9-10],选择猪链球菌的主要毒力因子溶菌酶释放蛋白(mrp)、胞外蛋白因子(epf)、溶血素(sly)、纤连蛋白/血纤蛋白原结合蛋白(fbps)、甘油醛-3-磷酸脱氢酶(gadph)、毒力相关因子(orf2)、89k毒力岛作为鉴定基因,合成相应引物,引物序列见表1。以KQ-1、KQ-2株的基因组DNA作为模板,用合成的相应引物进行PCR扩增,鉴定菌株的基因型。
1.7 生长曲线的绘制
在无菌操作台中挑取TSA平板(含10%新生牛血清)上经过传代、纯化的单菌落,接种于50 mL TSB培养基(含10%新生牛血清)中,37 ℃ 180 r/min培养5~8 h,作为种子液。将种子液按2%的比例接入100 mL TSB培养基(含10%新生牛血清)中,37 ℃ 180 r/min培养,每隔2 h取出1 mL菌液,用PBS(pH 7.2,0.15 mol/L)以10倍的梯度倍比稀释106倍,取100 μL菌液均匀涂在TSA平板(含10%新生牛血清)上,涂3个平板,约12 h后统计菌落数,以3个平板的平均值为准,计算菌液浓度。重复3次,取平均值,绘制生长曲线。
1.8 小鼠攻毒试验 分别挑取2个菌株在TSA平板(含10%新生牛血清)上经过传代、纯化的单菌落,接种于50 mL TSB培养基(含10%新生牛血清)中,37 ℃ 180 r/min培养5~8h,作为种子液。将种子液按2%的比例接入100 mL TSB培养基(含10%新生牛血清)中,37 ℃ 180 r/min培养8 h,按“1.7”中菌液计数的方法计算细菌密度。收获菌液,4 ℃下放置12 h,5 000 r/min离心,弃去上清液,以原培养基0.1倍体积的PBS溶液重悬菌体。将45只昆明小鼠分为9组,每组5只,每个菌株的菌液分4个浓度梯度20×108、10×108、5×108、1×108 CFU/只,以腹腔注射的方式对小鼠进行攻毒,每只小鼠注射0.2 mL,对照组5只小鼠注射0.2 mL的PBS溶液。连续观察7 d,记录每组死亡数,死亡小鼠立即进行解剖,对各脏器进行分菌、PCR菌种鉴定。将死亡小鼠解剖后,取心血、脑、肝、肺、脾等组织于TSA平板(10%新生牛血清)上划线、分离细菌,用无菌接种环沾取少量腹水,按照同样的方式于平板上划线、分离细菌。37 ℃培养过夜,挑取单菌落,按“1.5”中的方法,以从各器官及腹水中分离出的单菌落的基因组DNA为模板,用猪链球菌血清9型的特异性引物进行PCR菌种鉴定。
2 结果与分析
2.1 革兰氏染色 2株菌均能在TSA平板(含10%新生牛血清)上生长良好,菌落呈灰白色,光滑整齐,呈针尖大小,在灯光下可见荧光。经革兰氏染色后,菌体在显微镜下呈紫色,短杆状或棒状,多由3个以上菌体连结成链状(图1、2),表明这2株菌均为革兰氏阳性菌。
2.2 菌种鉴定
如图3所示,以cps9H引物对2株菌的基因组DNA进行PCR扩增,2株菌均能扩增出389 bp大小的片段,阴性对照无条带,表明2株菌均为猪链球菌血清9型。
2.3 毒力基因鉴定
以KQ-1、KQ-2株的基因组DNA为模板,用mrp、epf、sly、gadph、orf2、fbps、89k基因的引物进行PCR扩增后,经琼脂糖凝胶电泳,于凝胶成像系统下得到凝胶图像。如图4所示,KQ-1株的基因组DNA由mrp、sly、gadph基因的引物扩增后,分别在316、1 099、571 bp处有条带出现,其余引物的泳道内无条带;KQ-2株的基因组DNA由gadph、orf2基因的引物扩增后,分别在825和571 bp处有条带出现,其余引物的泳道内无条带;阴性对照组无条带出现。这表明KQ-1株的基因型为mrp+/epf-/sly+/gadph+/orf2-/fbps-/89k-,KQ-2株的基因型为mrp-/epf-/sly-/gadph+/orf2+/fbps-/89k-,基因型的不同提示了2株菌的毒力和感染宿主后引起的症状可能有所不同。
2.4 生长曲线的绘制
将2株猪链球菌血清9型的种子液按2%的比例接种到TSB培养基(含10%新生牛血清)中,每2 h计数1次,重复3次,用平均值绘制出生长曲线。从图5、6可以看出,2株菌在37 ℃下培养2 h即进入对数期,培养6 h 进入稳定期,活菌数达到峰值,KQ-1株的活菌数达到8.7×108 CFU/mL,KQ-2株的活菌数达到8.1×108 CFU/mL,12 h后活菌数明显下降,进入衰亡期。
2.5 小鼠致病性试验
KQ-1菌株、KQ-2菌株分别以20×108、10×108、5×108、1×108 CFU/只的菌液浓度对昆明小鼠进行攻毒试验。攻毒后7 d,每组小鼠的存活情况见表2。参考Wei等[11]的方法对2株猪链球菌血清9型菌株的毒力进行判定,攻毒剂量为5×108 CFU/只的试验组出现50%(含)以上的菌株为强毒(HV);攻毒剂量为30×108 CFU/只的试验组
出现50%(含)以上死亡,攻毒剂量5×108 CFU/只的试验组50%(不含)以上不死亡的为中等毒力(MV);攻毒剂量30×108 CFU/只的试验组50%(不含)以上不死亡的为低毒(LV)。该试验中KQ-1株攻毒小鼠5×108 CFU/只的试验组有80%死亡,KQ-2株攻毒小鼠1×108 CFU/只的试验组有60%死亡,均可判定为强毒株。攻毒数小时后,KQ-1菌株20×108 CFU/只的试验组有1只小鼠急性死亡;至攻毒后第3天,攻毒剂量20×108 CFU/只的试验组与攻毒剂量10×108 CFU/只的试验组小鼠已全部死亡,攻毒剂量5×108 CFU/只的试验组有4只小鼠死亡,攻毒剂量1×108 CFU/只的试验组无小鼠死亡,至攻毒后7 d内不再有小鼠死亡。攻毒剂量1×108 CFU/只的试验组无小鼠死亡,但有2只小鼠出现神经症状,头部倾斜(图7A),将出现神经症状的小鼠以颈椎脱臼的方式处死,经剖检发现小鼠脑部有水肿、出血现象(图7B)。
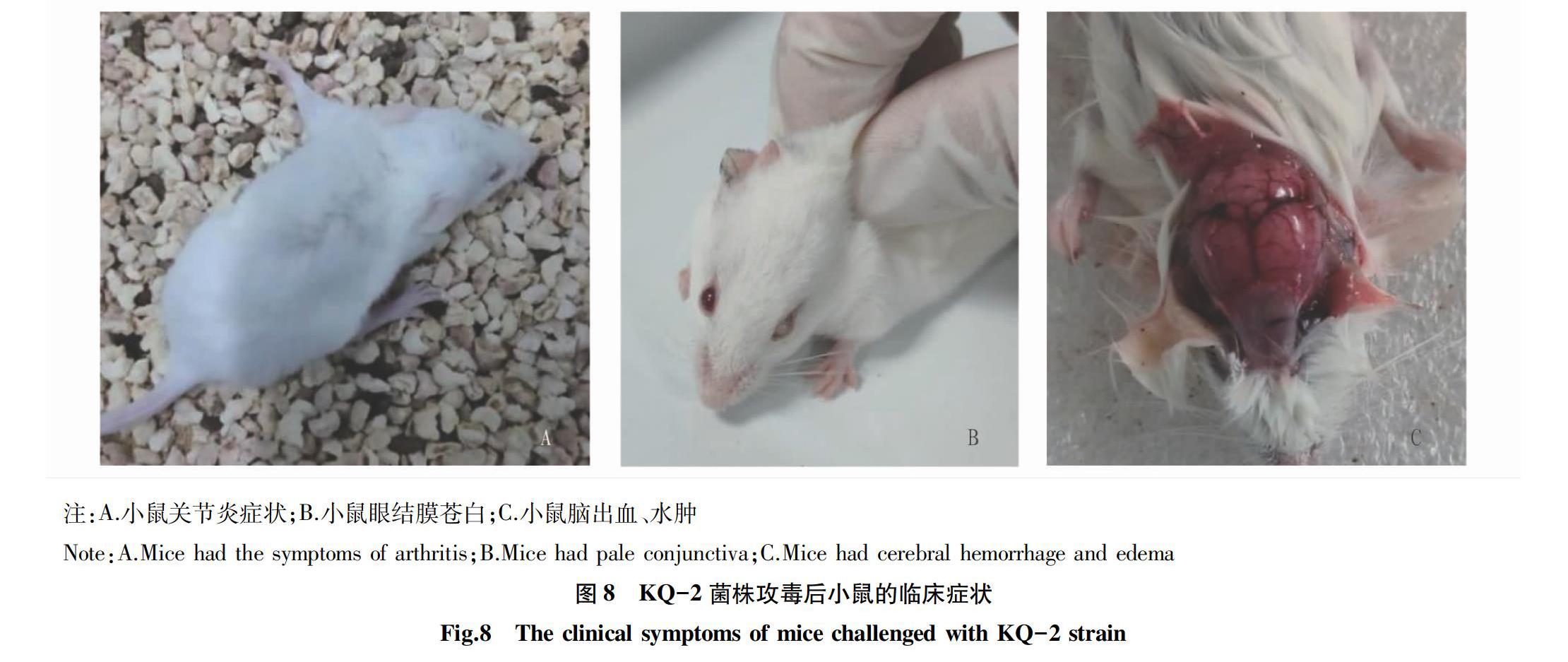
KQ-2菌株20×108 CFU/只试验组在攻毒后第1天有1只小鼠死亡;从攻毒后第1天至第5天陆续有小鼠死亡,至攻毒后7 d,20×108 CFU/只试验组死亡4只,10×108 CFU/只试验组死亡4只,5×108 CFU/只试验组有3只死亡,1×108 CFU/只试验组有3只死亡。10×108CFU/只试验组有2只小鼠出现明显的关节炎症状,无法行走(图8A),另有1只小鼠出现十分少见的眼结膜苍白现象;5×108 CFU/只试验组有1只出现关节炎症状,与10×108 CFU/只试验组出现关节炎的小鼠症状相似,另有1只小鼠出现稍轻的眼结膜苍白现象(图8B);1×108 CFU/只试验组有1只小鼠出现稍轻的眼结膜苍白现象。剖检后发现,KQ-1株攻毒的小鼠虽然死亡速度较KQ-2更快,但KQ-2株攻毒的小鼠脑水肿更明显,脑部呈果冻样,并伴有明显出血(图8C)。
在无菌工作台上,从死亡小鼠挑取一小部分的器官接种到TSA平板(含10%新生牛血清)上,37 ℃恒温培养过夜,待长出菌落(图9、10),按“1.5”中的方法进行PCR鉴定,以ddH2O为阴性对照。从2菌株攻毒死亡小鼠体内各器官和腹水接种平板后长出的菌落均可扩增出389 bp大小的条带,表明分离出的菌落均为猪链球菌血清9型(图11)。
3 讨论
猪链球菌是一种人畜共患病原菌,对我国养殖业危害严重,对猪链球菌的研究有助于人们进一步了解这种病原菌,掌握其发病特性,有针对性地研发治疗猪链球菌病的药物和预防猪链球菌病的疫苗,更好地制订防治策略和方法。目前世界上猪链球菌流行最多的是血清2型,致病力也最强,而在欧洲、大洋洲一些地区最流行的是血清9型[12],其致病力较血清2型稍弱,近几年血清9型在我国有扩大流行趋势。目前国内对血清9型的研究很少,市场上也没有针对血清9型的疫苗问世,需要加强对血清9型流行病学的关注,对其进行更深入的研究,并研制有针对性的疫苗,防止出现血清9型的大范围流行。
该研究对武汉科前生物股份有限公司分离、鉴定、保存的2株猪链球菌血清9型进行了菌种鉴定、毒力基因鉴定、生长曲线绘制、毒力试验等研究,对其菌种特性和致病力有了初步的了解。通过对2个菌株的革兰氏染色和菌种的PCR鉴定,可以确定2菌株均为猪链球菌血清9型。从生长曲线可看出,2菌株在TSB培養基(含10%新生牛血清)中培养时,均在6~10 h达到菌体含量最高值,提示可在这一时间收集菌液,得到最大含量的抗原。
对2菌株毒力基因的鉴定结果显示,KQ-1株的基因型为mrp+/epf-/sly+/gadph+/orf2-/fbps-/89k-,KQ-2株的基因型为mrp-/epf-/sly-/gadph+/ orf2+/fbps-/89k-。溶菌酶释放蛋白(mrp)又称为M蛋白,被普遍认为与猪链球菌的吸附能力有关。曾巧英等[13]研究发现,mrp+的菌株对HEp-2细胞的最大黏附菌数显著高于mrp-株,认为其是主要的黏附素。胞外因子(epf)只在培养上清中发现,表明其是一种分泌蛋白。mrp和epf被认为是猪链球菌2种重要的毒力因子,与猪链球菌的致病性有密切关系,Vecht等[14]对108株分离的猪链球菌的mrp、epf基因的研究发现,从病猪体内分离出的菌株80%都是mrp+/epf+表型,而健康猪体内分离出的菌株86%都是mrp-/epf-表型。但需要指出的是这2种毒力因子对株链球菌的致病性并非必需,所以不能简单地以这2种毒力因子作为致病性的标志[15]。毒力因子的鉴定结果表明,KQ-1株为mrp+/epf-表型,KQ-1株为mrp-/epf-表型。小鼠致病性试验结果显示,KQ-1株比KQ-2株具有更高的致病性,在注射20×108 CFU含量的菌液后几个小时即可引起小鼠的急性死亡,这可能是mrp赋予了KQ-1株对细胞更强的吸附能力,可以更容易突破血脑屏障,引发小鼠的脑膜炎,使小鼠死亡。
溶血素(sly)也稱猪溶素,最早是由Jacobs等[16]进行了纯化、鉴定和相关研究。溶血素对包括上皮细胞、巨噬细胞在内的多种细胞均有细胞毒性[17-18],但其机制和在疾病中的作用尚不清楚。这表明溶血素与猪链球菌的毒力可能有紧密关系,然而在敲除溶血素基因的试验中,只有小鼠模型中发现了毒力下降的情况[19],而对猪的攻毒模型研究中敲除溶血素基因对毒力几乎没有影响[20]。该研究中的小鼠致病性试验结果显示,
2菌株均为强毒株,KQ-1株具有sly基因,KQ-2株不具有sly基因,KQ-2株没有小鼠全部死亡的小组,出现小鼠死亡的时间也较KQ-1株滞后,可能与sly基因有一定关系。
甘油醛-3-磷酸脱氢酶(gadph)多现于细菌胞浆中,是糖分解途径中的一种酶,其作用是将GAP磷酸化,生成1,3-二磷酸甘油酯。gadph在猪链球菌的有毒株和无毒株中均有发现,与白蛋白有结合活性,发挥一定的黏附作用。在小鼠模型中,随着gadph表达量的增加,猪链球菌的毒力也随之增加[21]。李丽等[22]从广东某猪场中分离出的1株猪链球菌血清9型,发现其也具有gadph基因,通过对比发现其gadph基因与GenBank中国内外分离株的同源性为98.7%~99.6%,序列十分保守。该研究中的2株猪链球菌血清9型都具有gadph基因,说明该基因可能在猪链球菌血清9型中普遍存在。gadph蛋白与细菌的黏附作用有关,其机制仍需进一步研究。
orf2基因来自于Smith等[23]发现的一段毒力相关序列,这段序列通过计算机分析后,发现其含有4个开放阅读框,其中orf1、orf3和orf4都与其他已知基因有部分相似性,orf2与其他已知基因均无相似性,由此被认为是一种新的毒力因子。李干武等[24]对31株猪源链球菌的检测中发现,orf2基因存在于约87.5%的猪链球菌血清2型中,其他猪源链球菌中有约39.1%具有orf2基因,在A、B、C、D等群中均有出现,表明orf2基因在猪源链球菌中普遍存在。
通过对2株猪链球菌血清9型的7种毒力基因的检测可以看出,2菌株有4种毒力基因表型是相同的,其他3种毒力基因表型不同,这表明同一血清型的猪链球菌其基因型仍有可能存在很大差异。它们在小鼠上所引起的症状不同,可能与其毒力因子的差异有关。该研究的小鼠致病性试验中,2株猪链球菌均为强毒株,KQ-1株攻毒小鼠主要表现为急性死亡和神经症状,初步判定为脑膜炎型;KQ-2株攻毒小鼠则主要表现出关节炎症状,初步判定为关节炎型,这些症状与菌株的毒力因子的联系需要更深入的研究。它们对猪的致病性需要通过进一步的试验进行验证,下一步需要摸索出适合的攻毒模型,为疫苗的研制、制定防疫策略奠定基础。
参考文献
[1]
HILL J E,GOTTSCHALK M,BROUSSEAU R,et al.Biochemical analysis,cpn60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34,isolated from pigs,are Streptococcus orisratti[J].Veterinary microbiology,2005,107(1/2):63-69.
[2] 胡晓抒,朱凤才,汪华,等.人-猪链球菌感染性综合征研究[J].中华预防医学杂志,2000,34(3):150-152.
[3] ZHU Y F,TAN Z M,ZHU L Y,et al.Streptococcus suis serotype 2 caused streptococcal toxic shock syndrome(STSS) in a patient[J].Journal of Nanjing Medical University,2008,22(5):313-316.
[4] SEGURA M.Streptococcus suis vaccines:Candidate antigens and progress[J].Expert review of vaccines,2015,14(12):1587-1608.
[5] 石大丽,葛晨玲,朱远致,等.广西部分地区猪链球菌血清型及其毒力因子流行性调查分析[J].中国畜牧兽医,2019,46(4):1116-1126.
[6] 刘琪,王娟,周如月,等.广东地区健康猪群和发病猪群猪链球菌流行病学调查分析[J].中国畜牧兽医,2017,44(6):1825-1831.
[7] 王淑杰,雷连成,徐敏,等.东北地区猪群链球菌分离鉴定及流行病学调查分析[J].中国兽医学报,2009,29(7):877-881.
[8]SMITH H E,VEENBERGEN V,VAN DER VELDE J,et al.The cps genes of Streptococcus suis serotypes 1,2,and 9:Development of rapid serotype-specific PCR assays[J].Journal of clinical microbiology,1999,37(10):3146-3152.
[9] 方勤美,黄绍谦,俞伏松,等.猪链球菌2型福建分离株的主要毒力基因分析[J].中国人兽共患病学报,2010,26(1):65-68.
[10] 鞠爱萍,王长军,郑峰,等.江苏省中部地区猪链球菌主要致病性血清型分子流行病学调查[J].中华流行病学杂志,2008,29(2):151-154.
[11] WEI Z G,LI R,ZHANG A D,et al.Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007[J].Veterinary microbiology,2009,137(1/2):196-201.
[12] WISSELINK H J,SMITH H E,STOCKHOFE-ZURWIEDEN N,et al.Distribution of capsular types and production of muramidase-released protein (MRP) and extracellular factor (EF) of Streptococcus suis strains isolated from diseased pigs in seven European countries[J].Veterinary microbiology,2000,74(3):237-248.
[13] 曾巧英,陆承平.猪链球菌2型溶菌酶释放蛋白的黏附作用[J].南京农业大学学报,2002,25(4):67-71.
[14] VECHT U,WISSELINK H J,JELLEMA M L,et al.Identification of two proteins associated with virulence of Streptococcus suis type 2[J].Infection and immunity,1991,59(9):3156-3162.
[15] SMITH H E,VECHT U,WISSELINK H J,et al.Mutants of Streptococcus suis types 1 and 2 impaired in expression of muramidase-released protein and extracellular protein induce disease in newborn germfree pigs[J].Infection and immunity,1996,64(10):4409-4412.
[16] JACOBS A A,LOEFFEN P L,VAN DEN BERG A J,et al.Identification,purification,and characterization of a thiol-activated hemolysin (suilysin) of Streptococcus suis[J].Infection and immunity,1994,62(5):1742-1748.
[17] NORTON P M,ROLPH C,WARD P N,et al.Epithelial invasion and cell lysis by virulent strains of Streptococcus suis is enhanced by the presence of suilysin[J].FEMS Immunology and Medical Microbiology,1999,26(1):25-35.
[18] SEGURA M,GOTTSCHALK M.Streptococcus suis interactions with the murine macrophage cell line J774:Adhesion and cytotoxicity[J].Infection and immunity,2002,70(8):4312-4322.
[19] ALLEN A G,BOLITHO S,LINDSAY H,et al.Generation and characterization of a defined mutant of Streptococcus suis lacking suilysin[J].Infection and immunity,2001,69(4):2732-2735.
[20] LUN S C,PEREZ-CASAL J,CONNOR W,et al.Role of suilysin in pathogenesis of Streptococcus suis capsular serotype 2[J].Microbial pathogenesis,2003,34(1):27-37.
[21]
QUESSY S,BUSQUE P,HIGGINS R,et al.Description of an albumin binding activity for Streptococcus suis serotype 2[J].FEMS Microbiology Letters,1997,147(2):245-250.
[22] 李麗,黄良宗,谢博,等.9型猪链球菌广东株的分离鉴定和基因序列分析[J].中国畜牧兽医,2018,45(4):1016-1026.
[23] SMITH H E,BUIJS H,WISSELINK H J,et al.Selection of virulence-associated determinants of Streptococcus suis serotype 2 by in vivo complementation[J].Infection and immunity,2001,69(3):1961-1966.
[24] 李干武,姚火春,陆承平.在猪链球菌2型江苏分离株中发现新的orf2毒力相关基因[J].农业生物技术学报,2003,11(3):295-298.
