E.coli Nissle 1917(EcN)curli菌毛和鞭毛对其生物被膜形成的影响
2021-06-15龚冰雪周贤轩
龚冰雪 周贤轩

摘要 E.coli Nissle 1917 是被广泛认可的益生菌,可以通过形成生物被膜定殖在肠道中抑制沙门氏菌等病原菌的生长。通过λ-Red同源重组系统构建curli菌毛合成基因(csgA)和鞭毛调控基因(hnsA)突变菌株,探究curli菌毛和鞭毛对EcN生物被膜形成的影响。结果表明,curli菌毛对EcN运动能力以及生物膜形成没有影响;EcNΔhnsA菌株的运动能力下降,生物被膜含量升高,说明鞭毛通过促进EcN运动,抑制细菌的附着,从而抑制生物膜的形成。
关键词 E.coli Nissle 1917(EcN);curli菌毛;鞭毛;生物被膜;形成;影响
中图分类号 Q939.9 文献标识码 A 文章编号 0517-6611(2021)10-0008-04
doi:10.3969/j.issn.0517-6611.2021.10.003
开放科学(资源服务)标识码(OSID):
Effects of Curli and Histone-like Nucleoid Structuring Protein on Biofilm Formation of E.coli Nissle 1917 (EcN)
GONG Bing-xue,ZHOU Xian-xuan
(School of Food Science and Engineering, Hefei University of Technology, Hefei,Anhui 230009)
Abstract E.coli Nissle 1917 is a widely recognized probiotics, which can inhibit the growth of Salmonella and other pathogenic bacteria in the intestinal tract by forming biofilm colonization. The mutants of curli fimbriae synthesis gene (csgA) and flagellum regulatory gene (hnsA) were constructed by λ-Red homologous recombination system, and the effects of curli fimbriae and flagellum on the biofilm formation of EcN were investigated. The results showed that curli fimbriae had no effect on the ability of motility and biofilm formation of EcN. While the ability of motility of EcNΔhnsA strain decreased and biofilm formation increased, indicating that flagellum inhibited the formation of biofilm by promoting the motility ability and inhibiting the attachment of EcN.
Key words E.coli Nissle 1917(EcN);Curli fimbriae;Flagellum;Biofilm;Formation;Effect
生物被膜是嵌入在生物或非生物表面上的自生三維结构基质中的微生物细胞集合[1],其生长发育一般由初始黏附、固定、成熟和分散4个阶段组成[2]。细菌生物被膜的形成在病原微生物持续性感染中起着非常重要的作用,是许多临床疾病慢性反复感染的根源[3]。
大肠杆菌Nissle 1917(EcN)是被普遍认为的肠道益生菌,可以通过形成生物膜在肠道中定殖,与病原菌竞争肠道附着空间,以此来抑制肠道致病菌繁殖[4-5]。因此EcN通常被用于预防与治疗传染性腹泻和炎性肠疾病等。
curli菌毛是由革兰氏阴性菌产生、位于细胞表面的蛋白质聚集体。在大肠杆菌和肠道沙门氏菌的生物被膜中,curli是细胞外基质的主要蛋白质组分。在生物膜内,curli纤维形成一个相互交织的网状结构,支持细胞外基质并包裹住单个细胞。研究表明,curli菌毛通过促进细菌黏附来促进生物被膜的形成[6-7]。类组蛋白类核结构蛋白(H-NS)是大肠杆菌中高度保守的蛋白[8]。研究表明,H-NS通过结合在鞭毛主操纵子flhDC启动子上影响其表达,hns突变会导致编码鞭毛蛋白的结构基因fliC和编码鞭毛sigma因子基因fliA的表达水平降低,导致细菌运动能力丧失[9-10],从而影响其生物被膜的形成[11]。
然而,curli菌毛和鞭毛对EcN生物膜形成的影响尚不清楚。笔者通过λ-Red同源重组系统构建curli 菌毛合成基因(csgA)和鞭毛调控基因(hnsA)突变菌株,探究curli菌毛和鞭毛对EcN生物被膜形成的影响。
1 材料与方法
1.1 试验材料
大肠杆菌菌株Nissle 1917、BW25142,质粒pKD3、pKD46、pCP20,均由合肥工业大学微生物与酶工程实验室保存。Primer Star DNA聚合酶、DNA分子量标准、乙酸、结晶紫,均购于生工生物工程(上海)股份有限公司;引物由通用生物系统(安徽)有限公司合成;大肠杆菌培养所用的培养基为LB和M9C(6.8 g/L Na2HPO4、3.0 g/L KH2PO4、0.5 g/L NaCl、1.0 g/L NH4Cl、0.4%葡萄糖、0.4%酪蛋白氨基酸、2 mmol/L MgSO4、0.1 mmol/L CaCl2);培养所需的抗生素为氨苄青霉素(Ap,100 μg/mL)和氯霉素(Cm,15 μg/mL)。
1.2 试验方法
1.2.1 EcN中的基因敲除。
采用λ-Red同源重组系统对EcN进行基因敲除[12]。首先以质粒pKD3为模板,用两端带有目的基因上下游的39 bp同源臂的引物对PCR扩增FRT-Cm-FRT片段,将得到的PCR产物进行纯化,电击转化入EcN/pKD46电击感受态细胞中,涂于Cm抗性平板,37 ℃培养。挑选隔夜生长的单克隆菌落作為模板,加入相应检验引物进行菌落PCR检测。
1.2.2 抗性的去除。
菌落PCR鉴定结果为阳性的菌株可利用辅助质粒pCP20将抗性片段去除,pCP20电转至阳性菌落,涂布于Ap抗性平板,30 ℃培养过夜,挑取单克隆于LB培养基(Ap,100 μg/mL),30 ℃培养。蘸取菌液划线于LB平板,42 ℃培养使温敏性质粒pCP20丢失。将单菌落分别依次划线于Ap抗性平板、Cm抗性平板、LB平板,37 ℃培养。对Ap平板和Cm平板上都不生长、LB平板上生长的菌落进行PCR检验。
1.2.3 生长曲线的测定。
用M9C培养基将隔夜培养的菌液稀释至OD600为0.03,于37 ℃振荡培养,每隔1 h取样测OD600,直至细菌生长至稳定期。
1.2.4 生物被膜的形成。
用M9C培养基将隔夜培养的菌液稀释至OD600为0.05,加入聚苯乙烯96微孔板,每孔200 μL,于37 ℃恒温培养箱中静置培养24 h,吸出菌液,置于50 ℃培养箱中烘干20 min。每孔加入250 μL 0.1%结晶紫染色液染色15 min。吸去染色液,去离子水洗涤3次以去除未结合的结晶紫,置于50 ℃培养箱中烘干20 min。每孔加入200 μL 30%乙酸溶液,洗净孔壁及孔底,吸出脱色液,测OD570。
1.2.5 泳动试验。
用M9C培养基将隔夜培养的菌液稀释至OD600为0.1,取2 μL滴于0.3%琼脂糖半固体培养基上,37 ℃恒温培养24 h,保持空气湿润。拍照记录并测量泳动圈的直径。
2 结果与分析
2.1 EcN中csgA及hnsA的敲除
以pKD3为模板扩增FRT-Cm-FRT片段,电泳结果如图1所示,泳道1、2是带有csgA基因同源臂的FRT-Cm-FRT片段,泳道3、4是带有hnsA基因同源臂的FRT-Cm-FRT片段。条带大小约为1 kb,符合预期大小。将纯化后的DNA片段电转至EcN/pKD46中,在pKD46表达的λ噬菌体重组酶的作用下其同源臂序列可与基因组上的同源序列发生同源重组。将转化的菌液涂在相对应的抗性平板上,隔夜培养后挑取单克隆进行菌落PCR检测。
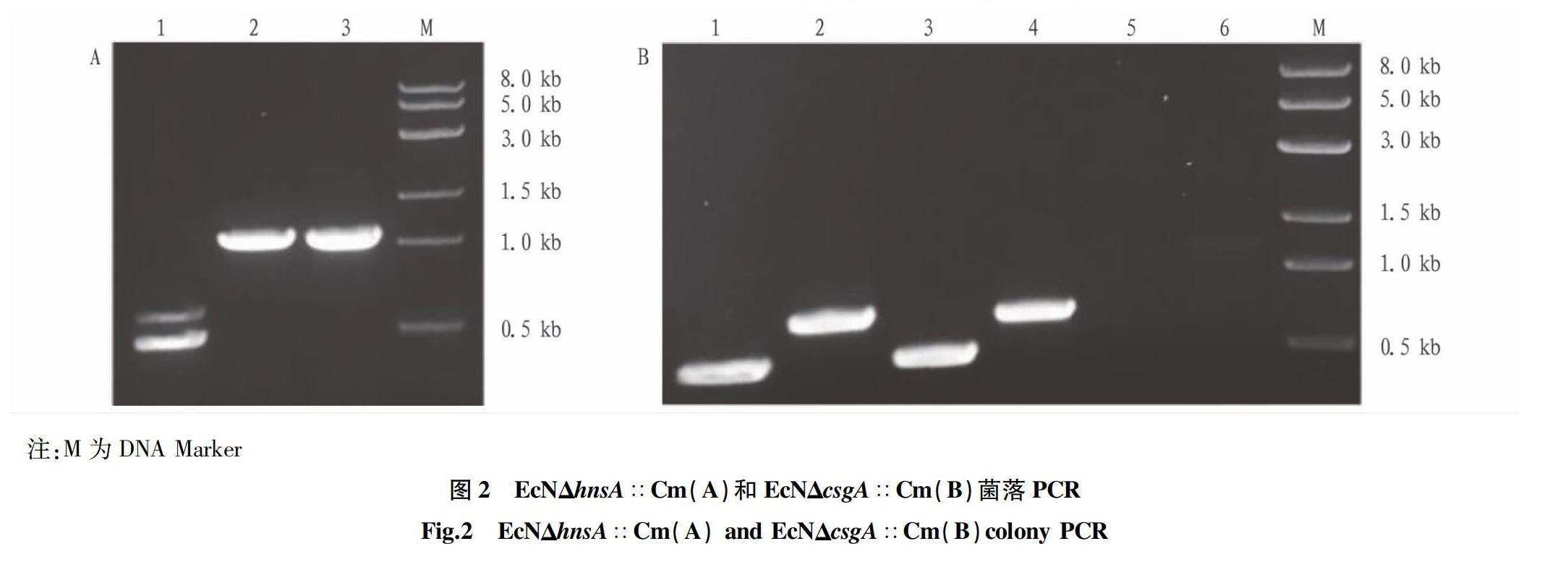
hnsA的敲除结果如图2A,选取2个单克隆和阴性对照
EcN/pKD46,同一个模板分别加入2对检验引物,泳道1、2为①号菌,泳道3、4为②号菌,泳道5、6为阴性对照EcN/pKD46,阳性克隆的预期条带大小为0.49和0.71 kb,①号菌与②号菌均为阳性克隆EcNΔhnsA∷Cm。
csgA的敲除结果如图2B,泳道1、2为随机挑选的2个单克隆,加入4条检验引物进行菌落PCR鉴定,泳道3为阴性对照EcN/pKD46,阳性克隆目的片段大小应为0.47和0.61 kb,由图可知泳道1电泳结果符合预期,该单克隆为阳性克隆EcNΔcsgA∷Cm。
2.2 抗性的去除
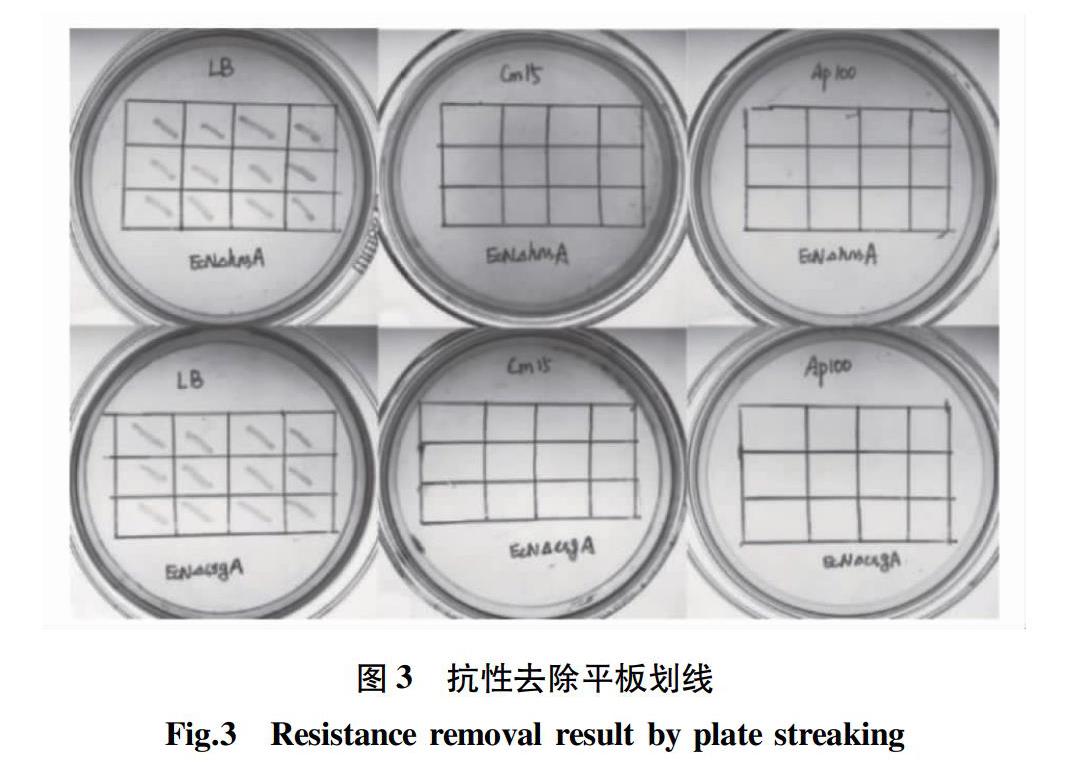
将EcNΔcsgA∷Cm/pCP20和EcNΔhnsA∷Cm/pCP20划线于LB板42 ℃培养过夜。挑取单克隆,依次划线LB板、Cm(15 μg/mL)板和Ap(100 μg/mL)板,在37 ℃培养,结果如图3所示,所有的单克隆均在LB平板上能够生长,抗性平板上不生长,说明菌株的氯霉素抗性片段去除成功,且质粒pCP20也已丢失。
为保证细菌的抗性去除成功,通过菌落PCR的方法再次检验,各随机挑取2个单克隆作为模板,加入相应引物进行菌落PCR检测。成功去除抗性的菌株条带大小分别为0.75 kb(csgA)、0.87 kb(hnsA)。如图4,条带与预期相符,说明菌株的抗性片段被成功去除。
2.3 EcN野生型及突变株生长曲线
基因敲除成功后,对突变株EcN△csgA、EcN△hnsA与野生型EcN的生长情况进行测定,进而来评估该基因是否影响细菌的生长。该研究选用M9C培养基来测定生长曲线,如图5A所示,csgA的敲除导致细菌在前4 h内生长较野生型慢,4 h后的生长情况则基本一致,但hnsA的敲除导致细菌生长明显缓慢,且24 h后细
菌浓度较低。根据生长曲线,计算各菌株的倍增时间,结果如图5B,野生型、EcN△csgA、EcN△hnsA的倍增时间分别为36、57、115 min。以上结果说明csgA对细菌的生长略有影响,
hnsA基因的缺失严重影响了EcN的生长,H-NS蛋白对EcN的生长起着较重要的作用。
2.4 EcN及其突变株的运动能力检测
细菌在半固体培养基上生长形成的泳动圈可用于反映细菌的运动能力,EcN及其突变株的泳动圈如图6,csgA突变株与EcN的泳动圈大小基本一致,直径约为2 cm;而hnsA突变株的泳动圈明显小于EcN和EcNΔcsgA,直径只有0.5 cm左右。表明csgA的缺失并未影响细菌的运动能力,而hnsA的缺失会导致细菌的运动能力受到极大限制。
2.5 EcN及其突变株生物被膜定量分析
结晶紫染色法被广泛应用于细菌生物被膜的半定量测定。EcN及其突变株在96孔板中用M9C培养基培养24 h,生物被膜的形成情况如图7所示。从图7可以看出,EcN野生型菌株与EcNΔcsgA菌株形成的生物被膜的量基本一致,而EcNΔhnsA菌株的生物被膜的形成量明显高于野生型,说明curli对EcN生物被膜形成没有明显影响,而H-NS蛋白对EcN生物被膜的形成有抑制作用。
3 討论与结论
EcN是广泛认可的益生菌,可通过形成生物膜在肠道中定殖,抑制肠道致病菌繁殖。因此,研究影响EcN生物被膜的形成将有助于研究宿主对病原体的抵抗力,是减缓生物被膜形成的治疗学发展的重要理论基础,为生物被膜预防和制定控制新策略提供思路。
该研究探究了curli菌毛和鞭毛对EcN生物被膜形成的影响。通过λ-Red同源重组系统构建curli菌毛合成基因(csgA)和鞭毛调控基因(hnsA)突变菌株,并对野生型、EcNΔhnsA、EcNΔcsgA的生长情况进行了监测,结果显示,csgA的敲除导致细菌的生长速度较野生型略慢,hnsA的敲除则严重影响了EcN的生长,这可能是由于hnsA编码的类组蛋白类核结构蛋白(H-NS)是全局调控因子,与DNA结合调控转录许多基因的表达,因而影响了细菌的生长能力。
细菌运动能力的降低会导致其黏附能力的增强,有利于生物被膜的初始黏附,由此可促进生物被膜的形成。泳动试验结果显示,csgA突变株与EcN运动能力基本相同,说明curli菌毛不影响细菌的运动能力。csgA突变株与EcN和生物被膜的形成量基本一致,说明csgA的缺失对细菌生物被膜的形成没有影响,可能是由于EcN除curli外具有的另外2种菌毛(type1和F1C菌毛)弥补了curli菌毛缺失对生物被膜的影响。
研究表明,H-NS可调控细菌鞭毛基因的表达。hnsA突变株的运动能力明显弱于野生型,说明H-NS对鞭毛是正调控作用,hnsA的缺失抑制了鞭毛的合成,使EcN的运动能力降低。且96孔板试验显示,hnsA的缺失导致细菌生物被膜形成明显增多,说明hnsA突变株的运动能力降低,导致其黏附能力的增强,以此促进了生物被膜的形成。
参考文献
[1] SUN F J,QU F,LING Y,et al.Biofilm-associated infections:Antibiotic resistance and novel therapeutic strategies[J].Future microbiology,2013,8(7):877-886.
[2] VOGELEER P,TREMBLAY Y D N,MAFU A A,et al.Life on the outside:Role of biofilms in environmental persistence of Shiga-toxin producing Escherichia coli[J].Frontiers in microbiology,2014,5:1-12.
[3] STEWART P S.Theoretical aspects of antibiotic diffusion into microbial biofilms[J].Antimicrobial agents and chemotherapy,1996,40(11):2517-2522.
[4] YAN H H,BAO F F,ZHAO L P,et al.Cyclic AMP(cAMP)receptor protein-cAMP complex regulates heparosan production in Escherichia coli strain nissle 1917[J].Applied and environmental microbiology,2015,81(22):7687-7696.
[5] DERIU E,LIU J Z,PEZESHKI M,et al.Probiotic bacteria reduce Salmonella typhimurium intestinal colonization by competing for iron[J].Cell host & microbe,2013,14(1):26-37.
[6] SHARMA V K,BEARSON B L.Hha controls Escherichia coli O157:H7 biofilm formation by differential regulation of global transcriptional regulators FlhDC and CsgD[J].Applied and environmental microbiology,2013,79(7):2384-2396.
[7] SALDAA Z,XICOHTENCATL-CORTES J,AVELINO F,et al.Synergistic role of curli and cellulose in cell adherence and biofilm formation of attaching and effacing Escherichia coli and identification of Fis as a negative regulator of curli[J].Environmental microbiology,2009,11(4):992-1006.
[8] SINGH K,MILSTEIN J N,NAVARRE W W.Xenogeneic silencing and its impact on bacterial genomes[J].Annual review of microbiology,2016,70(1):199-213.
[9] SOUTOURINA O,KOLB A,KRIN E,et al.Multiple control of flagellum biosynthesis in Escherichia coli:Role of H-NS protein and the cyclic AMP-catabolite activator protein complex in transcription of the flhDC master operon[J].Journal of bacteriology,1999,181(24):7500-7508.
[10] BERTIN P,TERAO E,LEE E H,et al.The H-NS protein is involved in the biogenesis of flagella in Escherichia coli[J].Journal of bacteriology,1994,176(17):5537-5540.
[11] ZHANG L,WENG Y,WU Y,et al.H-NS is an activator of exopolysaccharide biosynthesis genes transcription in Vibrio parahaemolyticus[J].Microbial pathogenesis,2018,116:164-167.
[12] DATSENKO K A,WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the national academy of sciences of the United States of America,2000,97(12):6640-6645.
