白藜芦醇磷脂复合物固体脂质纳米粒的制备及其体内药动学研究
2021-06-15娟钟莹尚曙玉贾
杨 娟钟 莹尚曙玉贾 安
(黄河科技学院医学院,河南 郑州450006)
白藜芦醇是一种天然多酚类蒽醌萜化合物,主要存在于决明子、葡萄、虎杖、松树等果实或植物中,具有保护心血管、抗风湿、调血脂等作用[1⁃2],可通过诱导癌细胞分化和凋亡、抑制癌细胞增殖、抑制环氧化酶等机制对宫颈癌、卵巢癌、子宫内膜癌等妇科肿瘤具有较好的疗效[3]。但该成分在水中的溶解度低(仅为28.3 μg/mL)[4],稳定性差[5],大大限制了药物体内吸收,口服后绝对生物利用度也仅为5%[6],故开发相关新型口服制剂具有较高的研究价值。
课题组前期曾采用磷脂复合物技术对白藜芦醇进行基本性质研究[4],但并未进行体内评价,所得产品是一种半固体、疏水性、分散性差的物质[7⁃8],不仅难以进行制剂学研究,也使药物溶出度或生物利用度的提高程度有限[9⁃10]。近年来,将纳米制剂技术应用到磷脂复合物制备中的研究越来越多[11⁃15],可有效解决后者固有缺陷,故本实验将白藜芦醇磷脂复合物制成固体脂质纳米粒,对其粒径、Zeta 电位、溶出度、稳定性等指标进行评价,并考察其体内药动学,以期为该制剂进一步开发利用提供依据。
1 材料
1.1 仪器 Agilent 1260 InfinityⅡ型高效液相色谱仪,配置G7115A 检测器(美国Agilent 公司);BSA224S 型电子天平,配置防风罩(德国Sartorius公司);P180H 型超声仪(德国Elma 公司);DW⁃40/60 W 型超低温冰箱(浙江和利制冷设备有限公司);78⁃1 型磁力搅拌器(济南欧莱博科学仪器有限公司);XW⁃80A 型漩涡混合器(上海医科大学仪器厂);Nano⁃S90li 粒度分析仪(英国Malvern 公司);YOYN⁃DCY⁃24Y 型氮气吹扫仪(上海乔跃电子科技有限公司)。
1.2 试剂与药物 白藜芦醇原料药(批号19122⁃3,纯度98.0%,台州市博纳化工有限公司);白藜芦醇对照品(批号 111535⁃201808,纯度98.7%,中国食品药品检定研究院)。卵磷脂(批号190515,磷脂酰胆碱质量分数90%,上海太伟药业有限公司);泊洛沙姆188(批号GN28622DT,德国BASF公司);单硬脂酸甘油酯(批号150813,国药集团化学试剂有限公司)。四氢呋喃为色谱纯(批号T818769⁃4 L,上海麦克林生化科技有限公司)。
1.3 动物 SPF 级SD 大鼠,体质量250~300 g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016⁃0001,在课题组实验室饲养1周。
2 方法与结果
2.1 白藜芦醇含量测定
2.1.1 色谱条件 参考文献[16] 报道。Hypersil C18色谱柱(4.6 mm×250 mm,5 μm);药动学实验加预柱(4 mm×4 mm,5 μm);流动相水(含0.1%磷酸)⁃乙腈(70 ∶ 30);体积流量1.0 mL/min;检测波长305 nm;进样量20 μL。含量测定过程中注意避光,白藜芦醇色谱峰理论塔板数不低于9 500,对称因子为1.04。
2.1.2 供试品溶液制备 取白藜芦醇磷脂复合物固体脂质纳米粒混悬液1 mL,置于10 mL 量瓶中,加入5 mL 乙腈超声处理2 min,静置至室温后流动相定容至刻度,-4 ℃下10 000 r/min 离心10 min,取5 mL 上清液至10 mL 量瓶中,流动相定容至刻度,即得。
2.1.3 线性关系考察 称取白藜芦醇对照品30 mg,置于100 mL 量瓶中,甲醇超声溶解后定容至300 μg/mL,流动相依次稀释至60、30,15、5、0.5、0.25 μg/mL,在“2.1.1”项色谱条件下进样测定。以白藜芦醇质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=18.254 7X+1.967 1(r=0.999 8),在0.25~60 μg/mL范围内线性关系良好。
2.1.4 方法学考察 取供试品溶液,于0、2、4、8、12、24 h 在“2.1.1”项色谱条件下进样测定,测得白藜芦醇峰面积RSD 为0.72%,表明溶液在24 h 稳定性良好。取同一份白藜芦醇磷脂复合物固体脂质纳米粒混悬液,在“2.1.1”项色谱条件下进样测定6 次,测得白藜芦醇含量RSD 为1.35%,表明该方法重复性良好。取同一份供试品溶液,在“2.1.1”项色谱条件下进样测定6 次,测得白藜芦醇峰面积RSD 为0.36%,表明仪器精密度良好。取“2.1.3”项下300 μg/mL 对照品溶液8 mL,置于10 mL 量瓶中,乙腈定容至刻度,得到240 μg/mL 溶液,取9 份白藜芦醇磷脂复合物固体脂质纳米粒混悬液1 mL,分别置于10 mL量瓶 中,加入上述溶液0.8、1.0、1.2 mL,按“2.1.2”项下方法制备供试品溶液,在“2.1.1”项色谱条件下各进样测定6 次,测得白藜芦醇平均加样回收率分别为99.36%、100.63%、100.14%,RSD 分别为0.67%、1.02%、0.84%。
2.2 白藜芦醇磷脂复合物及其固体脂质纳米粒制备
2.2.1 磷脂复合物 根据文献[4] 报道的方法制备,并略作调整。称取白藜芦醇0.3 g、卵磷脂1.0 g,置于圆底烧瓶中(比例1 ∶1),加入150 mL四氢呋喃后立即密封,置于45 ℃水浴中,恒温条件下磁力搅拌3 h,得澄清溶液,同温下减压旋转蒸发除去溶剂,得浅黄色半固体状态物质。由于白藜芦醇不溶于二氯甲烷,而磷脂复合物易溶于后者,故将半固体状态物质置于20 mL 该溶剂中,0.45 μm 微孔滤膜过滤除去未形成磷脂复合物的白藜芦醇,45 ℃下减压旋转蒸发除去溶剂,即得(浅黄色半固体状态)。
2.2.2 固体脂质纳米粒 课题组前期以包封率为指标,在固定磷脂复合物用量75 mg 的前提下对脂质材料种类(硬脂酸、单硬脂酸甘油酯、三萮酸甘油酯)、用量(350、400、450、500 mg)、表面活性剂体积分数(0.5%、1%、1.5%)进行考察,最终确定最优制备工艺为称取单硬脂酸甘油酯450 mg、白藜芦醇磷脂复合物75 mg,置于圆底烧瓶中,加入20 mL 无水乙醇,加热至65 ℃后搅拌溶解,作为有机相;配制含1%泊洛沙姆188 的溶液60 mL,加热至65 ℃,作为水相,将有机相在磁力搅拌条件下滴入水相,滴毕后继续搅拌30 min,减压旋蒸挥尽无水乙醇,得到初乳,设置超声波细胞粉碎仪功率为300 W(每工作2 s 后停止2 s),将初乳置于冰水混合物中,在超声波细胞粉碎仪中超声处理5 min,再立即置于-10 ℃冰箱中固化5 min,0.45 μm 微孔滤膜过滤,补加蒸馏水至60 mL,即得。
2.3 包封率、载药量测定 取1 mL 混悬液至超滤离心管中,在-4 ℃下10 000 r/min 离心45 min,取续滤液,测定白藜芦醇含量(m游离),取1 mL混悬液,加入5 mL 乙腈超声处理2 min,静置至室温后定容至刻度,在-4 ℃下10 000 r/min 离心10 min,取5 mL 上清液,置于10 mL 量瓶中,流动相定容至刻度,测定白藜芦醇总含量(m总),按照文献[14] 报道的方法测定包封率、载药量,测得3 批白藜芦醇磷脂复合物固体脂质纳米粒两者平均值分别为84.07%、2.62%。
2.4 粒径、Zeta 电位测定 取3 批白藜芦醇磷脂复合物固体脂质纳米粒混悬液,蒸馏水稀释50 倍后各取3.5 mL,置于比色皿中,测定粒径、Zeta 电位,结果见图1~2。由此可知,3 批样品平均粒径为218.6 nm,PDI 为0.034,Zeta 电位为-15.6 mV。
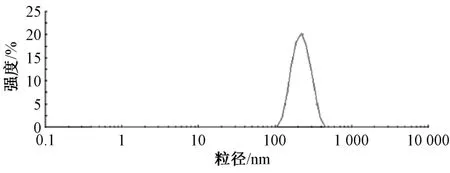
图1 白藜芦醇磷脂复合物固体脂质纳米粒粒径分布Fig.1 Particle size distribution of solid lipid nanoparticles of resveratrol phospholipids complex
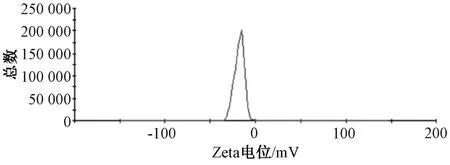
图2 白藜芦醇磷脂复合物固体脂质纳米粒Zeta 电位Fig.2 Zeta potential of solid lipid nanoparticles of res⁃veratrol phospholipids complex
2.5 冻干粉制备 取白藜芦醇磷脂复合物固体脂质纳米粒混悬液适量,置于西林瓶中,分别加入2%、3.5%、5% 冻干保护剂(葡萄糖、蔗糖、甘露醇)适量,混匀,封口膜封口,将西林瓶垂直置于-60 ℃冰箱预冻1 d 后取出,封口膜扎孔,放入-40 ℃冻干机中抽真空,冷冻干燥2 d,即得,其外观、色泽、粒径见表1。由此可知,甘露醇用量为3.5%、5%时各指标均较佳,考虑到成本,最终选择3.5%甘露醇作为冻干保护剂。
表1 冻干保护剂对冻干粉外观、色泽、粒径的影响()Tab.1 Effects of lyoprotectant on the appearance,colour and particle size of lyophilized powder()

表1 冻干保护剂对冻干粉外观、色泽、粒径的影响()Tab.1 Effects of lyoprotectant on the appearance,colour and particle size of lyophilized powder()
2.6 稳定性试验 取白藜芦醇磷脂复合物及其固体脂质纳米粒冻干粉适量,置于5 mL 蒸馏水中,使白藜芦醇含量均为0.5 mg/mL,超声处理2 min后,于0、1、2、3、6、8、12、24、36、48 h 取混悬液适量,振荡混匀后过0.45 μm 微孔滤膜,取续滤液,在“2.1.1”项色谱条件下进样测定,计算白藜芦醇含量,结果见图3。由此可知,随着时间延长,白藜芦醇含量逐渐降低,表明磷脂复合物在水相中稳定性较差;制成固体脂质纳米粒后,白藜芦醇含量下降速度大大降低,表明该剂型对包裹于其中的磷脂复合物起到了明显的保护作用[17]。
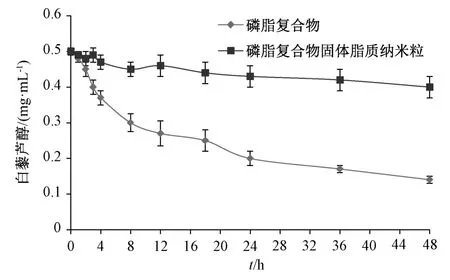
图3 白藜芦醇体外稳定性曲线Fig.3 In vitro stability curves for resveratrol
2.7 体外释药研究 白藜芦醇在1%SDS 溶液中的溶解度为66.31 μg/mL,可满足10 mg 该成分在900 mL 该溶液中的漏槽条件,故以其为释放介质。取白藜芦醇原料药、磷脂复合物及其固体脂质纳米粒冻干粉适量,白藜芦醇含量均为10 mg,加入3 mL 1%SDS 溶液制备混悬液,转移至透析袋(截留分子量14 000 Da)中,固定于搅拌桨叶上,并对溶出仪作避光保护。配制900 mL 1%SDS 溶液,设置溶出仪转速及温度分别为75 r/min、37 ℃,于0、0.25、0.5、1、1.5、2、3、4、6、8、12、24、36、48 h 各取样3 mL,同时补加空白溶出介质3 mL,5 000 r/min 离心10 min,取上清液,在“2.1.1”项色谱条件下进样测定,结果见图4。由此可知,原料药在48 h 内累积溶出度为27.93%;制成磷脂复合物后虽有提高,但仍不足45%,并且透析袋中仍有磷脂复合物存在,而将其进一步制成固体脂质纳米粒后达到76.18%,差异有统计学意义(P<0.01)。
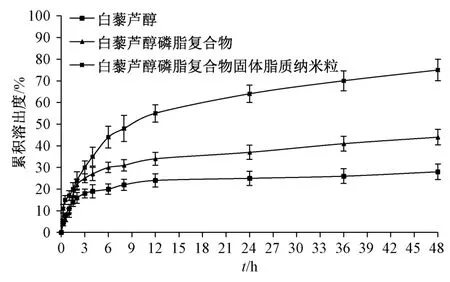
图4 白藜芦醇体外释药曲线Fig.4 In vitro drug release curves for resveratrol
2.8 体内药动学研究
2.8.1 分组、给药与采血 取白藜芦醇及其磷脂复合物、固体脂质纳米粒冻干粉适量,加入0.5%CMC⁃Na 溶液,制成2 mg/mL 混悬液。18 只大鼠随机分为3 组,每组6 只,分别灌胃给予相应混悬液,剂量均为20 mg/kg,然后迅速乙醚麻醉,于0.25、0.5、1、1.5、2、3、4、6、8、10、12 h 眼内眦静脉采血各约0.3 mL,置于肝素浸润的EP 管中,涡旋30 s,-4 ℃下2 500 r/min 离心3 min,取上层浅色含药血浆,密封并冷冻保存。
2.8.2 血样前处理 精密量取“2.8.1”项下血浆样品100 μL,置于1.5 mLEP 管中,加入300 μL乙腈,涡旋5 min 以沉淀蛋白及血浆内源性物质,在-4 ℃下10 000 r/min 离心20 min,分取上清液,氮气缓慢吹干,加入100 μL 乙腈复溶,4 ℃下10 000 r/min 离心8 min,取上清液进样分析。
2.8.3 线性关系考察 健康大鼠麻醉后心脏取血,制备空白血浆,备用。精密称取白藜芦醇对照品10 mg,置于100 mL 容量瓶中,乙腈溶解并定容至刻度,依次稀释至2 000、1 000、500、250、100、50 ng/mL,各精密量取100 μL 至EP 管中,氮吹仪上氮气缓慢吹干,加入100 μL 空白血浆,涡旋10 min 后混 匀,得到2 000、1 000、500、250、100、50 ng/mL 血浆对照品溶液,在“2.1.1”项色谱条件下进样测定。以峰面积为纵坐标(Y),白藜芦醇质量浓度为横坐标(X)进行回归,得方程为Y=1.602 8X+5.114 9(r=0.992 4),在50~2 000 ng/mL 范围内线性关系良好。
2.8.4 方法学考察 取空白血浆、血浆对照品、血浆样品溶液,在“2.1.1”项色谱条件下进样测定,结果见图5,可知血浆内源性物质不干扰测定,表明该方法专属性良好。取血浆样品,按“2.8.2”项下方法处理,于0、2、4、8、12、24 h在“2.1.1”项色谱条件下进样测定,测得白藜芦醇峰面积RSD 为1.63%,表明溶液在24 h 内稳定性良好。取50、500、2 000 ng/mL 血浆对照品溶液,在“2.1.1”项色谱条件下各进样测定6次,测得白藜芦醇峰面积RSD 分别为9.82%、6.07%、4.11%,表明仪器精密度良好。制备100、500、1 000 ng/mL对照品溶液,各精密量取100 μL,氮气吹干,加入100 μL 空白血浆,涡旋混匀,按“2.8.2”项下方法处理,在“2.1.1”项色谱条件下进样测定,测得白藜芦醇平均加样回收率分别为90.13%、94.69%、92.07%,RSD 分别1.26%、0.77%、1.90%,符合2020 年版《中国药典》 规定的生物样品分析要求。另外,该方法定量限、检测限分别为4、1 ng/mL。
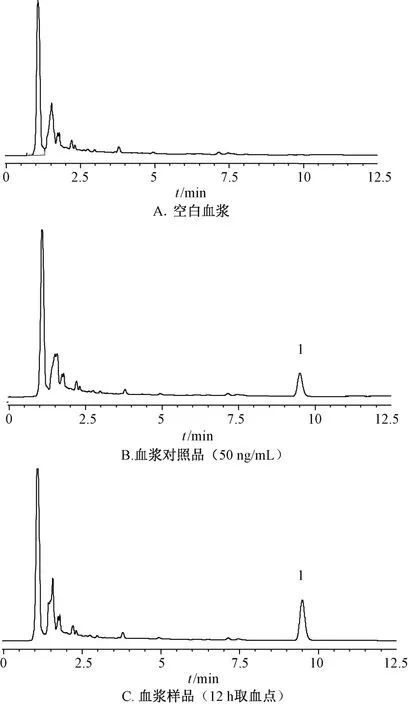
图5 白藜芦醇HPLC 色谱图Fig.5 HPLC chromatograms of resveratrol
2.8.5 结果分析 图6、表2 显示,白藜芦醇磷脂复合物tmax无明显变化(P>0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.05,P<0.01),相对生物利用度与原料药相比增加至1.55 倍;将其进一步制成固体脂质纳米粒后,tmax延长(P<0.01),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度与原料药相比增加至3.00 倍。
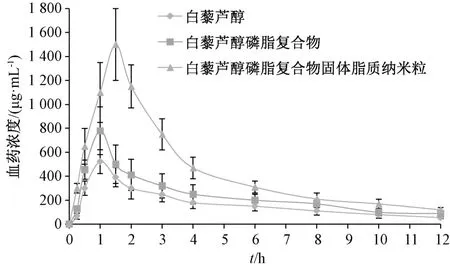
图6 白藜芦醇血药浓度⁃时间曲线Fig.6 Plasma concentration⁃time curves for resveratrol
表2 白藜芦醇主要药动学参数(, n=6)Tab.2 Main pharmacokinetic parameters for resveratrol(, n=6)
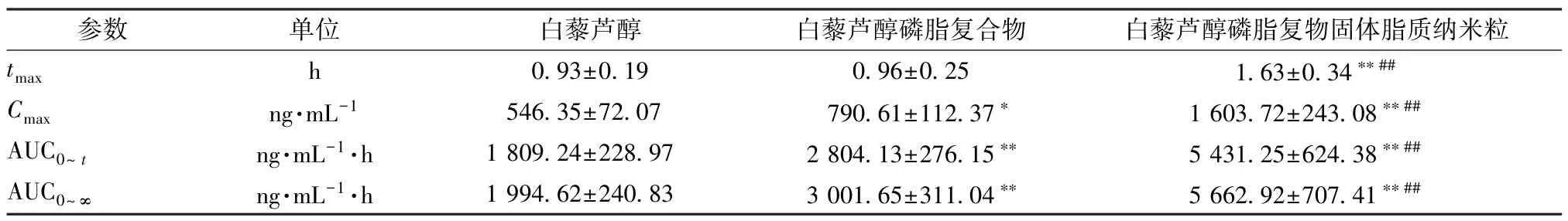
表2 白藜芦醇主要药动学参数(, n=6)Tab.2 Main pharmacokinetic parameters for resveratrol(, n=6)
注:与白藜芦醇比较,**P<0.01;与白藜芦醇磷脂复合物比较,##P<0.01。
3 讨论
磷脂在处方中可作为复合物、固体脂质纳米粒的载体及表面活性剂等,近几年在制剂领域受到颇多关注。本实验制备的白藜芦醇磷脂复合物固体脂质纳米粒与文献[18⁃19] 报道的白藜芦醇纳米制剂相比,包封率更高。体外稳定性试验结果显示,磷脂复合物在水中不稳定,白藜芦醇含量下降程度较明显,可能与前者物理稳定性不高、后者遇光容易降解[17]等因素有关。但在体外溶出试验中,磷脂复合物累积溶出度呈上升趋势,这是因为它是漏槽条件下进行测定,从中析出的原料药可能重新溶于溶出介质中,并作了避光处理,可降低光照对白藜芦醇含量的影响[17]。
药动学研究结果显示,磷脂复合物可将白藜芦醇的口服吸收生物利用度提高至1.55 倍,而白藜芦醇磷脂复合物固体脂质纳米粒Cmax、AUC0~t、AUC0~∞与磷脂复合物相比显著升高,生物利用度进一步增至3.00 倍,其原因一方面是由于固体脂质纳米粒可提高磷脂复合物的稳定性,降低药物与磷脂之间的解离,改善复合物分散性,促进药物溶出;另一方面,它发挥了纳米制剂特殊的吸收机制[20⁃21],有助于促进药物高效吸收。今后,将对白藜芦醇磷脂复合物固体脂质纳米粒的体内药效学作进一步评价[22],从而更好地开发利用该制剂。
