青蒿素类化合物抗肿瘤作用激活机制的研究进展
2021-06-11王钰婷罗贤强罗开丽万少翔
廖 媛,王钰婷,罗贤强,罗开丽,万少翔,卿 晨
昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500
青蒿素来源于菊科植物黄花蒿Artemisia annuaL.,是一种含有过氧桥的倍半萜内酯类化合物,极大地改善了疟疾的治疗效果[1]。多年来,人们对青蒿素类化合物的研究并没有止步于抗疟作用,其在抗肿瘤、抗寄生虫病(除疟疾外)、抗病毒及抗炎等方面也具有药理活性[2]。青蒿素为无色针状结晶,味苦,可溶于有机溶剂,在对其结构进行修饰后得到了抗疟活性更好的双氢青蒿素,为了改善双氢青蒿素分子中化学性质不稳定的半缩醛结构,经进一步的结构修饰得到了蒿甲醚、蒿乙醚、青蒿琥酯等溶解性更好的化合物[3]。青蒿素类化合物的共性是其分子中均存在一个过氧桥结构,研究表明,过氧桥是青蒿素发挥药理活性的必需结构,失去过氧桥结构后其药理活性显著降低[4]。自青蒿素被发现以来,研究人员就努力探索青蒿素的抗疟作用机制,希望更合理地应用青蒿素类化合物,减少疟原虫对青蒿素耐药性的发生,并为青蒿素的多种药理学作用研究提供依据。
在抗肿瘤研究方面,2003年,美国国家癌症研究所以包括白血病、黑色素瘤、非小细胞肺癌、结肠癌、卵巢癌、中枢神经系统肿瘤、前列腺癌和乳腺癌在内的55 株肿瘤细胞株为模型,对青蒿素类化合物青蒿琥酯的细胞毒活性进行了筛选,发现其对各类肿瘤细胞都有一定的抑制作用,尤其对白血病和结直肠癌细胞株的抑制活性更高[5]。这一结果也是近20年来青蒿素类化合物抗肿瘤研究的重要基础。
从已有研究结果看,青蒿素对正常人组织细胞的体外抑制作用较小,因而认为其安全性较好[6-7]。在抗肿瘤实验中,也发现若将青蒿素与有效的激活剂联用,被激活后的青蒿素效果会比单独给药(无激活剂)时更好[2,8]。由于肿瘤细胞复杂的内环境,使得影响青蒿素激活的因素和青蒿素的作用靶点未有结论。在抗疟机制中,疟原虫消化红细胞释放出大量亚铁离子(Fe2+)和血红素,这类还原物质使青蒿素过氧桥断裂,生成碳自由基;并通过抑制疟色素形成,使蛋白质烷基化等方式杀死疟原虫[9]。肿瘤细胞是一类生长失控的快速增殖细胞,其细胞内的血红素及Fe2+是其生长增殖所必需的。研究显示,肿瘤细胞内血红素及Fe2+的含量普遍较正常细胞高,可能成为青蒿素类化合物发挥抗肿瘤作用的生物学基础[10-11]。多年来,对青蒿素发挥疗效的生物学基础及激活机制的探索从未止步,希望发现青蒿素类化合物的特点和优势,为发挥其多方面的临床作用、拓展其应用提供科学依据。本文对近年来有关肿瘤细胞中青蒿素及其类似物激活因素的研究进展进行综述,为深入研究其抗肿瘤作用提供依据。
1 Fe2+对青蒿素类化合物的激活作用
1995年,Lai 等[10]用双氢青蒿素联合转铁蛋白作用于人急性淋巴母细胞白血病MOLT-4 细胞株,发现其能有效抑制MOLT-4 细胞的增殖,而且两者的联用对正常人淋巴细胞的影响较小;之后在乳腺癌细胞和正常乳腺细胞中的实验也得到了相似的结果[6]。转铁蛋白的功能是结合外周血中的铁离子(Fe3+),将Fe3+通过细胞内吞作用进入细胞,随即在细胞内还原物质作用下,Fe3+还原成为Fe2+,继而参与DNA 合成等细胞活动[12]。对青蒿素类化合物在Fe2+依赖下发挥抗肿瘤作用机制的研究也发现,在白血病、宫颈癌等细胞中存在的Fe2+确实与青蒿素的激活相关,并发现了Fe2+催化的过氧桥是通过发生芬顿反应生成活性氧(reactive oxygen species,ROS),从而发挥破坏肿瘤细胞的作用[13-14]。此后根据肿瘤细胞表面转铁蛋白的高表达及肿瘤细胞的高铁环境,陆续开展青蒿素激活机制的研究,并认为转铁蛋白、氧化铁纳米材料等可作为青蒿素的载体,实现针对肿瘤细胞的靶向给药,并在一定程度上提高了青蒿素的抗肿瘤效果[15]。这些研究结果支持游离铁激活青蒿素发挥抗肿瘤作用的推测。Efferth 等[16]用甘氨酸硫酸亚铁联合青蒿素作用于人急性淋巴细胞白血病T 淋巴CCRF-CEM 细胞株和人星形胶质细胞瘤U373 细胞株,两者的生长都受到了明显的抑制,认为此效果是由于Fe2+介导了青蒿素的激活。但也强调,即使没有外源性Fe3+的供应,青蒿素、青蒿琥酯也仍然具有活性,但由于细胞生物学基础的不同,其抗肿瘤作用也存在很大差异。几年后,该团队扩大实验对象,用36 株肿瘤细胞研究了Fe2+与青蒿琥酯发挥细胞毒活性的关系,这些细胞株包括结直肠癌、胃癌、乳腺癌、黑色素瘤、头颈部肿瘤等,结果发现,青蒿琥酯单用和联用对大部分肿瘤细胞均有抑制作用,但其中的11 株肿瘤细胞在联用甘氨酸硫酸亚铁时的半数抑制浓度并没有比单用青蒿琥酯低,提示Fe2+对青蒿素的激活并不是普遍发生在肿瘤细胞中[17]。
关于Fe2+激活青蒿素类化合物,其在抗肿瘤方面的研究晚于在抗疟作用中的研究,实际的情况及得到的结果也更为复杂。因此,目前Fe2+激活青蒿素类化合物发挥抗肿瘤作用的假说尚不能确定。
2 血红素对青蒿素类化合物的激活作用
近年来,研究较多的另一类青蒿素类化合物的激活因素是血红素。血红素是含有Fe2+的卟啉类化合物,广泛参与细胞代谢,也是许多蛋白如血红蛋白、肌红蛋白、细胞色素P450、过氧化物酶及细胞色素C 等的辅基,细胞色素中的血红素还参与线粒体电子传递链/线粒体呼吸链(mitochondrial electron transport chain,ETC)的电子传递[18]。血红素还是具有潜在杀伤作用的一类生物因子,过多游离的血红素会形成ROS,通过氧化应激反应损伤细胞膜、破坏组织细胞[19]。红细胞内期的疟原虫吞食血红蛋白以满足其对大量氨基酸的需求,消化血红蛋白后产生的血红素在食物泡中的浓度可达到 0.4 mol/L[1]。如此多的血红素势必会损伤疟原虫体内的膜结构,于是疟原虫就将血红素打包成疟原素,减小游离血红素浓度,达到存活的目的[1]。研究表明,即使是从形成疟原素过程中漏出的少量游离血红素也可有效地激活青蒿素[20]。正常人体的外周血和正常细胞内的血红素浓度都受到严格的调节和控制,维持在0.2~0.6 μmol/L 的较低水平。研究显示,肿瘤细胞中的血红素含量要高于正常细胞,这有利于肿瘤细胞的生长增殖[21-22]。
20 世纪90年代,Yang 等[23]在研究青蒿素发挥抗疟作用中的激活因素时发现,青蒿素可与细胞色素C、血红蛋白结合,在体外可使蛋白烷基化,而不与不含血红素的珠蛋白反应,表明青蒿素在血红素的作用下产生自由基,并获得烷基化蛋白质的能力。此后的研究证明,在抗肿瘤中血红素是激活青蒿素的主要及重要因子[11]。在体外,Zhang 等[24]采用血红素、氯化血红素、血红蛋白和亚铁氰化物分别与青蒿素在特定的情况下进行反应,结果显示,血红素能在更短的时间内与青蒿素发生反应,并且表示血红素也可能是激活青蒿素发挥抗肿瘤作用的主要因素。
根据血红素的生物合成途径,以线粒体中甘氨酸和琥珀酰辅酶 A 在 5-氨基乙酰丙酸合成酶(aminolevulinic acid synthase,ALAS)作用下合成5-氨基乙酰丙酸(aminolevulinic acid,ALA)为起始,经由一系列生物合成反应,最终生成血红素(图1)[11]。琥珀酰丙酮(succinyl acetone,SA)是研究血红素合成途径常用的阻断剂,它通过抑制ALA 缩合成原卟啉使后续步骤无法进行,导致血红素合成失败[25]。研究发现,肿瘤细胞的快速增殖不仅与血红素的含量增加有关,其细胞内的甘氨酸和ALAS 同样比正常细胞内的水平要高[11,26]。基于以上原理,Gerhard课题组[27]将双氢青蒿素分别与ALA、原卟啉Ⅺ、转铁蛋白联用增加其对MOLT-4 细胞的细胞毒作用,并用SA 阻止其细胞毒性,结果表明,ALA 这个由限速酶合成且为血红素合成途径的上游分子,在与双氢青蒿素联用后的效果最好,而SA 与双氢青蒿素联合应用后,则大部分逆转了双氢青蒿素的细胞毒性。之后,该研究组在此基础上进一步证实双氢青蒿素联合ALA能在MOLT-4细胞中产生大量ROS,因而发挥更强的细胞毒活性作用[28]。Wang 等[11]研究发现,将青蒿琥酯与ALA 联用,在体内外均能抑制结直肠癌HCT-116 细胞株及其移植瘤的生长,通过比较HCT-116 细胞和正常结肠上皮CDC841 细胞株内的血红素含量发现,ALA 通过促进肿瘤细胞血红素的合成,增强青蒿琥酯对HCT-116 细胞的细胞毒性。青蒿素二聚体是2 分子青蒿素母核通过不同连接子连接起来的一类化合物,其中含有2 个过氧桥结构[29]。Stockwin 等[30]在研究青蒿素二聚体(NSC724910 和NSC735847)对人早幼粒白血病HL-60 细胞株和前列腺癌PC-3 细胞株的细胞毒活性中也发现血红素的调控对激活二聚体十分重要,钴卟啉能增强血红素加氧酶(heme oxygenase,HO)活性,使其加快对血红素的代谢,从而抑制青蒿素二聚体的活性;锌卟啉抑制HO,则增强了青蒿素二聚体的毒性。另外,有研究通过干扰ALAS 等血红素合成途径的酶来研究血红素对青蒿素的激活作用,也得到了相似的结果[31]。肿瘤细胞中血红素对青蒿素的激活效率比铁更高,但目前研究采用的肿瘤细胞株模型总体还较少,要确认血红素是青蒿素激活因素的假说还有很多工作要做。
3 线粒体对青蒿素类化合物的激活作用
虽然血红素激活青蒿素后表现出了较好的抗肿瘤效果,但加入肿瘤细胞的血红素剂量却需要认真推敲,因为血红素是细胞内多种重要蛋白的辅基,可多方面参与细胞生物学功能的调节,其含量的异常与多种疾病相关。Kalainayakan 等[32]的研究指出,直接增加线粒体内的血红素会促使肺癌复发。在肿瘤细胞中,线粒体作为青蒿素的激活因素也是一大研究热点。酿酒酵母是研究线粒体的经典模式生物之一,2005年,Li 等[33]从该模型中发现青蒿素可以使线粒体膜电位去极化,干扰ETC 后,青蒿素的作用效果下降。之后他们对给药2 h 后伯氏疟原虫感染小鼠的红细胞进行了分离,从中检测到疟原虫线粒体的去极化,加入还原型烟酰胺腺嘌呤二核苷酸磷酸脱氢酶抑制剂(抑制ETC)后与青蒿素联用减弱了青蒿素的抗疟疾效果[34]。这是提出血红素、Fe2+是青蒿素激活因素观点后的又一新发现。为继续深入研究,Sun 等[35]培养了一种酵母血红素合成途径中的合成酶HEM2基因敲除酵母株,分别在发酵和非发酵培养基上培育,酵母在非发酵培养基上需要线粒体的呼吸作用,发酵培养基中则不需要线粒体进行呼吸作用。在发酵培养基上,只有血红素高低表现出对青蒿素敏感性的变化,但在非发酵培养基上0.1 μmol/L 青蒿素可抑制HEM2基因敲除酵母的生长,正常酵母则需要在5 μmol/L 时才能出现相同抑制效果,因此认为线粒体激活较少的青蒿素,就能达到一定的抑制作用,而血红素会让青蒿素迅速消耗,使依赖线粒体(可能是ETC)激活的部分随之减少。实验中,虽然HEM2基因敲除的酵母血红素合成途径被阻断,但检测到其在有无青蒿素时的呼吸活性并无变化,说明ETC 及其中的血红素没有受到青蒿素的影响[35]。以上结果提示,在某些生物(酵母和疟原虫)中,增加血红素的合成并不一定能增强青蒿素的活性,线粒体也可能激活青蒿素并介导更灵敏的杀伤方式。Mercer 等[36]以缺乏功能性ETC 的人宫颈癌HeLa ρ0 细胞株和正常HeLa 细胞株为模型,发现虽然大剂量的青蒿琥酯对HeLa ρ0细胞株仍有细胞毒活性,但正常的HeLa 细胞对青蒿琥酯更敏感,而HeLa ρ0 细胞株和正常HeLa 细胞株中的碳自由基含量大致相同,说明ETC 是介导青蒿琥酯发挥作用的部分原因。但ETC 是否是青蒿素类化合物的激活因素还有待进一步探讨。
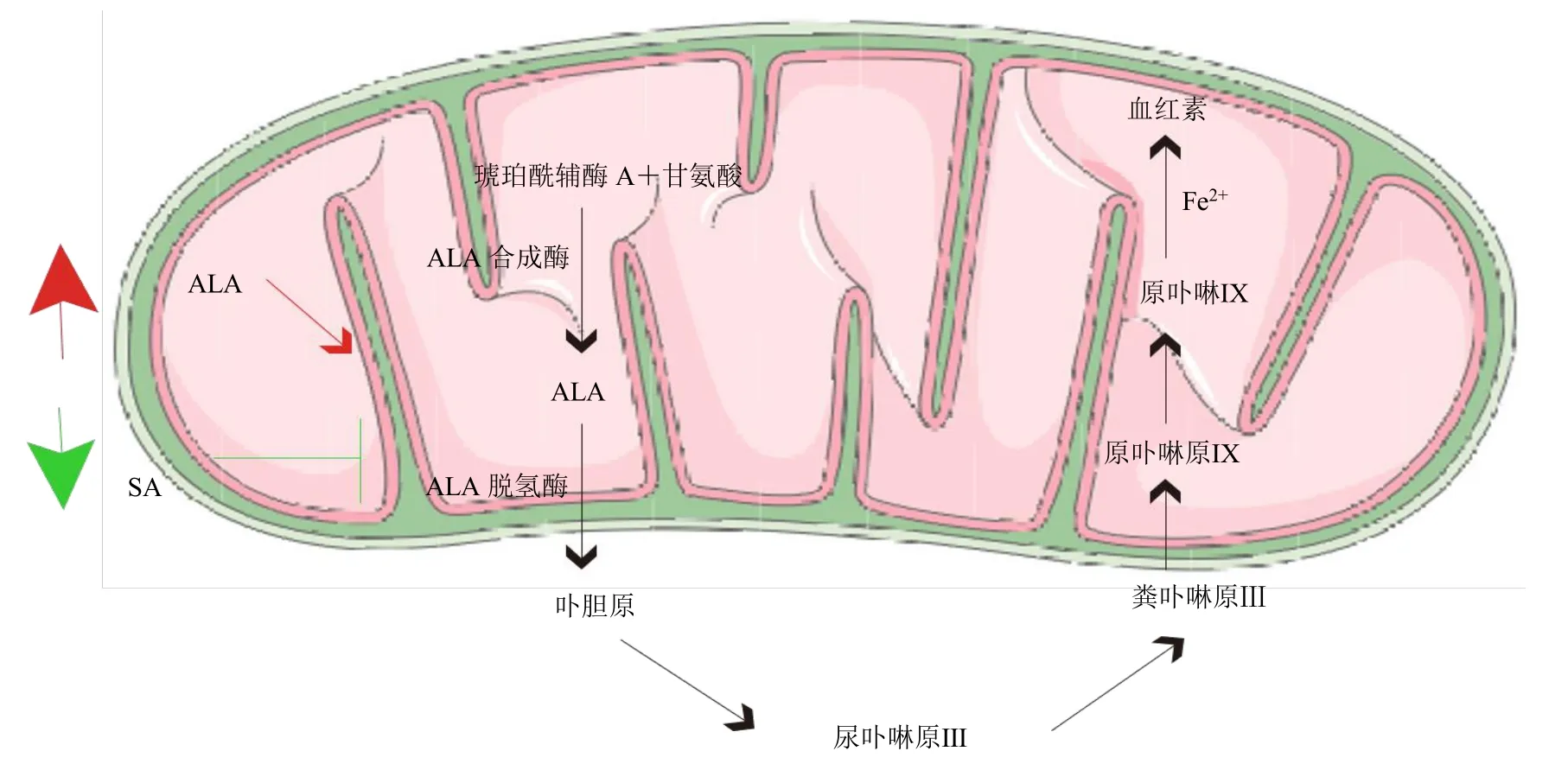
图1 外源性调节因素对肿瘤细胞内血红素合成途径的影响Fig.1 Effects of exogenous modulators on heme biosynthetic pathway in tumor cells
在许多研究中发现,青蒿素类化合物在单用或联合抗肿瘤药物时可以破坏肿瘤细胞的线粒体,显著降低线粒体膜电位[37-38]。线粒体膜电位的损伤可以激活肿瘤细胞的内源性凋亡途径,导致细胞死亡[39]。还有部分文献报道,青蒿素类化合物增加肿瘤细胞的ROS 不一定能引起细胞凋亡,它们甚至不会改变细胞ROS 的含量,这可能由于细胞的生理环境不同造成[38,40]。因此,线粒体介导的细胞凋亡可能是青蒿素类化合物抑制肿瘤细胞增殖的一种稳定方式。通过将青蒿素靶向输送到线粒体(血红素的合成部位),结果发现在线粒体聚集的青蒿素有更强的抗肿瘤作用[41]。Sun 等[42]还提出靶向线粒体后,青蒿素在增强抗肿瘤作用的同时会减弱其抗酵母及抗疟疾的能力。以上结果表明线粒体很可能与血红素是通过不同的途径增强了青蒿素的作用,线粒体可以使青蒿素发挥更强的抗肿瘤作用,并且是青蒿素直接的,但不是唯一的靶点,ETC 与青蒿素的敏感性紧密相关。
4 结语
铁、血红素、线粒体都是细胞内不可分割的组成部分,后者更是包含了前者。许多实验设计将三者的作用割裂开来,欲探索单一因素对青蒿素类化合物的激活机制,但都难以获得全面的解释(图2)。血红素已被证明是青蒿素重要的激活因素和靶蛋白,在不同生物体内都可在一定程度上激活青蒿素,因此被认为是介导青蒿素细胞毒活性的基础[27,35]。研究还证实肿瘤细胞内是一个高铁环境,游离的铁来源于其细胞膜表面高表达的转铁蛋白,但肿瘤细胞线粒体中的铁却低于正常细胞,进一步降低了铁对青蒿素激活的可能性[43]。Efferth 等[5]研究显示,肿瘤细胞甚至同一组织来源的肿瘤细胞其转铁蛋白表达量都存在差异,且外源性的Fe2+不能激活所有细胞株中的青蒿素,仅可以提高某些肿瘤细胞中青蒿素的活性。后来的研究解释,如果外源性铁的加入没有参与血红素的合成,则不会增强青蒿素诱导肿瘤细胞凋亡的作用[27,36,44]。也有研究表明不能否认非血红素铁对青蒿素的激活作用,Stocks 等[45]的研究证明了这部分铁可以稳定青蒿素与靶蛋白的加成物。外源性铁的加入对青蒿素类化合物在不同肿瘤细胞中加成效果不同,而铁螯合剂与青蒿素类化合物联用时,却能在大多数肿瘤细胞中逆转青蒿素的抗肿瘤作用。因为铁螯合剂不仅减少了游离铁和血红素中铁的部分,还可抑制ETC 的活性,从多方面阻断青蒿素的激活[34]。ETC 由复合物I~Ⅳ、电子载体泛醌组成,电子从复合物I或Ⅱ进入泛醌,经过 复合物Ⅲ和Ⅳ,转移到分子氧而产生水,是细胞内ROS 产生的场所[46]。血红素参与ETC 复合物Ⅱ~Ⅳ的组成,对电子传递、线粒体呼吸起着关键作用[32]。目前还没有证实ETC 是青蒿素发挥抗肿瘤作用的激活因子,但已有文献表明,功能性的ETC 一方面为青蒿素的激活提供还原动力,另一方面还可促进产生更多的ROS 以达到共同杀伤细胞的效果[35-36]。

图2 青蒿素类化合物抗肿瘤作用的激活机制Fig.2 Activation mechanism of artemisinin and its derivatives in anti-tumor effects
青蒿素的抗肿瘤作用机制在学术界一直没有统一的认识。普遍认为过氧桥基团是青蒿素的药效基团,没有过氧桥的化合物既不能与血红素结合,也不能发挥较强的抑制肿瘤细胞生长的作用[23]。但也有研究显示没有过氧桥的新型青蒿素衍生物也有一定的抗肿瘤活性,青蒿素二聚体更好的抗肿瘤活性也不能仅通过2 个过氧桥来解释[30,47]。在抗疟疾的研究中发现,大部分青蒿素类化合物必须由某种因素激活才能产生氧自由基,进而重排为更具活性的碳自由基,发挥抗疟作用[45]。大部分研究也证明青蒿素产生的ROS 是引起细胞死亡的主要原因,但是Lu 等[38]的研究表明双氢青蒿素诱导HL-60 细胞线粒体损伤和细胞凋亡是通过激活丝裂原活化蛋白激酶信号通路,而与ROS 无关,因为细胞内ROS 的含量没有变化,并认为双氢青蒿素在不同细胞内不一定都能产生ROS,可能与细胞的不同生物学背景有关[48]。
目前,针对青蒿素类化合物复杂的激活机制研究结果大多数来源于疟原虫或酵母模型,但是,肿瘤细胞是一个比疟原虫更复杂的生物学环境,单从线粒体及其功能来看,不同物种间就存在差异,这可能是很难对青蒿素的激活机制下定论的原因。由于青蒿素类化合物用于抗肿瘤方面的剂量大于抗疟的剂量,因此发现安全的小分子化合物,以低剂量的形式高效地激活血红素合成途径或增敏青蒿素对线粒体的抑制作用,可能是今后的一个研究方向,旨在使青蒿素这个抗疟药发挥抗肿瘤作用切实可行。
利益冲突所有作者均声明不存在利益冲突
