高良姜素通过PTEN/AKT信号通路抑制乳腺癌发展并增加曲妥珠单抗抗肿瘤活性
2021-06-07赵艳姣
赵艳姣,范 浩,廉 斌
1宁夏医科大学总医院肿瘤医院肿瘤内三科,银川 750004;2首都医科大学附属北京中医医院乳腺科,北京 100010
乳腺癌(BC)是导致女性癌症相关死亡的首要原因。化学疗法是当前乳腺癌的主要治疗策略之一[1]。曲妥珠单抗是一种重组DNA 衍生的人源化单克隆抗体,通过靶向Her-2(人表皮生长因子2)阻断乳腺癌癌细胞的生长,同时刺激机体免疫细胞杀伤癌细胞,但是,许多乳腺癌患者对初始靶向疗法没有反应,或者在随后的治疗中发生获得性耐药和交叉耐药,导致临床患者预后较差,死亡率较高[2,3]。因此,迫切需要开发用于乳腺癌的新疗法,或者有效的增效剂或辅助药物联合治疗以提高治愈率。
随着中医药研究的快速发展,传统中药的抗癌以及增敏作用被广泛研究,并逐步成为临床癌症肿瘤的有效辅助手段[4]。高良姜素(galangin)为传统中药高良姜的活性成分,研究发现高良姜素具有一定抗肿瘤活性,可以保护机体免受致癌因素的损伤,同时抑制肿瘤侵袭和迁移。最近的研究表明,高良姜素可通过PI3K/Akt通路的激活,防止caspase级联反应导致的细胞死亡,从而抑制肝癌细胞增殖,侵袭以及迁移,并诱导癌细胞凋亡[5,6],还通过作用于MDM2/p53间接调节细胞增殖和凋亡,最终抑制肿瘤细胞的恶性增殖[7,8]。但是它是否可以抑制乳腺癌进展以及其具体机制尚未可知。因此,我们的研究目的是应用高良姜素治疗乳腺癌,并在细胞核分子层面进一步阐明其分子机制,从而为临床乳腺癌的治疗提供策略。
1 材料和方法
1.1 细胞培养及试剂
正常乳腺细胞Hs 578Bst以及人乳腺癌细胞系MCF-7和SKBR3均购自睿凯干细胞生物科技有限公司(中国)。MCF-7和SKBR3细胞系使用添加10%胎牛血清(南通伊仕生物技术股份有限公司,中国)和1%青霉素/链霉素(维润赛润生物试剂有限公司,中国)的RPMI 1640(Invitrogen,美国)培养,将细胞放在37 ℃和5%CO2的恒温恒湿培养箱中培养。将乳腺癌细胞用高良姜素(格鲁斯特,中国)以终浓度20 μM处理48 h。
高良姜素(博拓生物科技股份有限公司,中国);曲妥珠单抗(辉瑞,美国);Akt抑制剂HY-10358(博奥森生物技术有限公司,中国);GAPDH、Bcl-2蛋白一抗(B细胞淋巴瘤2)、Caspase-9一抗、Akt一抗和p-AKT(懋康生物科技有限公司,中国);p-MDM2一抗、Caspase-3一抗、Alexa Fluor 488偶联的兔抗小鼠二抗(利翰生物科技有限公司,中国)。
1.2 异种移植肿瘤模型建立
Balb/cnu/nu裸鼠(上海信帆生物科技有限公司,中国),饲养于动物实验中心SPF级动物实验室,自由饮食饮水。将乳腺癌细胞(1×107个细胞)悬浮在100 μL无血清培养基中,并皮下注射到4~6周龄的雄性Balb/cnu /nu裸鼠的左侧腹中,饲养两周,当肿瘤直径达到3 mm×4 mm时,将接种肿瘤细胞的小鼠随机分为四个治疗组,每组包含十只小鼠,MCF对照组和SKBR3对照组使用PBS作为对照;MCF-BP组和SKBR3-BP组每天腹腔注射200 mg/kg BP。建立SKBR3肿瘤移植模型,随机分组,对照组(control,Con):生理盐水;高良姜素组(galangin,Gal):给予高良姜素(0.75 mg/kg);曲妥珠单抗组(trastuzumab,Tra):给予曲妥珠单抗(10 mg/kg);联合用药组(Gal+Tra)(0.75 mg/kg高良姜素+10 mg/kg曲妥珠单抗),每天尾静脉给药一次,每3天计算一次小鼠的肿瘤体积:V = 2LS/2,在治疗后约4周,颈椎脱臼法处死小鼠,切除肿瘤,称重后固定在10%福尔马林中,并进行石蜡包埋进行以下分析。
1.3 免疫荧光染色
用条件培养基诱导后,将细胞固定在4%多聚甲醛中并使用含0.1%Triton X-100的PBS浸润,5%BSA封闭后将细胞与p-MDM2一抗(1∶1 000)和Caspase-3一抗(1∶1 000),室温孵育30 min,然后用Alexa Fluor 488偶联的兔抗小鼠(1∶200)或山羊抗兔IgG抗体(1∶200)标记。在荧光显微镜下观察细胞。
1.4 免疫组织化学测定
处死小鼠分离异种移植肿瘤,将新鲜肿瘤组织在福尔马林中固定48 h,然后使用石蜡包埋制作常规石蜡切片,用切片机将其切成2 mm切片后固定在载玻片上,将切片与Ki67(1:1 000),p-MDM2(1∶1 000)和Caspase3(1∶1 000)抗体一起孵育,在含5%胎牛血清的PBS中4 ℃孵育过夜。然后根据制造商的说明,通过染色试剂盒在室温下用稀释的链霉亲和素过氧化物酶HRP偶联物孵育切片,然后使用苏木精复染5 min,安装并在相差显微镜下进行分析。
1.5 TUNEL法检测细胞凋亡
TUNE根据制造商的方案,使用荧光素原位细胞死亡检测试剂盒,通过TUNEL进行样品的凋亡分析并通过苏木精复染,在荧光显微镜下计数观察并记录TUNEL阳性细胞的数目。
1.6 细胞迁移和侵袭
将Transwell小室置于6孔板中,将2 mL细胞培养液加入到小室下方的6孔板中,BP或PBS处理48 h后将2×104个(200 μL)乳腺癌细胞加入小室内,37 °C孵育48 h后,按照试剂商说明书使用结晶紫/甲醇染色30 min,使用倒置显微镜观察并记录迁移细胞数;将 Matrigel基质胶与RPMI1640 培养基(1∶5)混匀后,取100 μL加至小室底部,将Transwell小室放入6孔板中,室温孵育过夜,后续操作与侵袭实验类似,使用倒置显微镜观察并记录侵袭细胞数量。
1.7 流式细胞仪分析细胞周期
剪切肝脏组织,通过II型胶原酶消化后1 000 rpm,离心5 min获得肝细胞,悬浮在RPMI 1640培养基中,将细胞悬浮液以1 000 rpm离心5 min以去除细胞碎片和杂质,收获肝单核细胞(MNC),并重悬于70%percoll分层液中,从中间相中收集MNC,并在Hank缓冲液中洗涤两次,用含有5%胎牛血清的培养液稀释细胞悬液至1×106/mL接种于6孔板,分别添加PBS或高良姜素,37 ℃孵育24 h,胰酶消化后1 000 rpm,离心5 min,弃上清液,根据使用说明书,使用R&D试剂盒,在装有单细胞悬液的流式细胞仪试管中加入抗CD4 FITC和抗CD8 FITC抗体,使用CytomicsTMFC 500 MCL进行分析后通过流式细胞仪进行细胞检测,上述实验重复3次。
1.8 蛋白质印迹分析
将细胞分为对照组(control,Con)、Akt抑制剂组(AktI)、高良姜素组(galangin,Gal)、高良姜素+AKT抑制剂组(Gal+AktI),分别添加DMAO、SB431542、高良姜素、高良姜素+SB431542,与细胞共同孵育24 h后,胰酶消化获取细胞,根据制造商的说明,使用T-PER组织蛋白提取试剂盒提取细胞蛋白,通过BCA蛋白质测定试剂盒测定蛋白质浓度,并将每孔等量的蛋白质上样至10%十二烷基硫酸钠聚丙烯酰胺凝胶上。随后,将蛋白质转移到聚偏二氟乙烯膜上,在含0.05%Tween-20(TBS-T),补充有5%脱脂乳的Tris缓冲盐水中,室温下振荡封闭2 h,然后用TBS-T洗涤3次。将在TBST中稀释特异性GAPDH(1∶1 000)、Bcl-2蛋白(1∶1 000)、caspase-9(1∶1 000)、Akt(1∶1 000)、p-AKT(1∶1 000)FAS(1∶100)、PTEN(1∶100)、P53C(1∶100)、P53N(1∶100)以及P21(1∶100)一抗,与该膜在4 °C下孵育过夜。随后,将膜用TBS-T洗涤三次,然后与过氧化物酶偶联的小鼠二抗(1∶500)在室温下孵育1 h,使用增强的化学发光蛋白质印迹检测试剂盒检测免疫活性蛋白。使用GE Healthcare ECL Western blotting分析系统检测并分析Western蛋白印迹带。
1.9 实时定量PCR分析
按照制造商的方案,使用Trizol试剂从小鼠肾脏中分离出的总RNA,使用SuperScript第一链合成试剂盒(RT-PCR)逆转录cDNA(1 μg)。表1为用于实时PCR的引物。在GenBank中检查所有引物序列,以避免意外的序列同源性。由亨代劳生物科技有限公司(美国)进行引物序列的设计和合成,引物序列见表1。使用SYBRGreen PCR预混液在BioRad iCycler iQ检测系统中进行反应。以GAPDH为内部对照,使用2-Delta Delta C(T)方法对基因进行标准化和并计算倍数变化。

表1 PCR引物及序列Table 1 PCR primers and sequences
1.10 统计分析
数据表示为平均值±SEM。使用Graph Pad PRISM(6.0版;Graph Pad Software,美国),通过单向方差分析与Dunn最小显着性差异检验比较处理过的细胞,组织和相应的对照。P<0.05时,组间差异显着的具有统计学意义。
2 结果
2.1 高良姜素抑制乳腺癌细胞的侵袭和迁移、抑制肿瘤生长
与对照组相比,使用高良姜素治疗后,乳腺癌细胞MCF-7和SKBR3的细胞迁移和侵袭能力显著下降(图1A~C),MCF-7(图1E)和SKBR3(图1F)肿瘤异种移植模型小鼠的肿瘤尺寸显着减小。
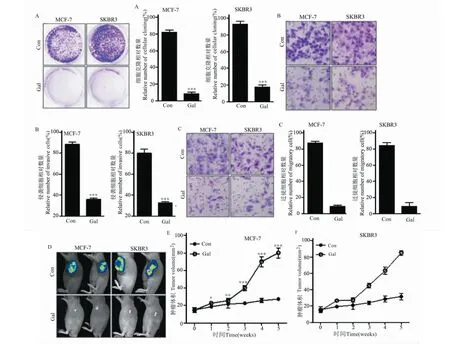
图1 高良姜素在体外抑制乳腺癌细胞系的增殖、侵袭和迁移,并在体内减小肿瘤的大小Fig.1 Galangin inhibits the proliferation,invasion and migration of breast cancer cell lines in vitro,and reduces tumor size in vivo注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:乳腺癌细胞系的集落形成;B:迁移中的MCF-7和SKBR3细胞的代表性图像,柱形图显示细胞计数的统计数据;C:具有侵袭性的MCF-7和SKBR3细胞的代表性图像,柱形图显示细胞计数的统计数据;D:异种移植裸鼠模型肿瘤的代表性图像;E:异种移植裸鼠模型的肿瘤体积。Note:Compared with the control group, *P<0.05;**P <0.01;***P <0.001.A:Colony formation of breast cancer cell lines;B:Representative images of migrating MCF-7 and SKBR3 cells.The column graph shows the statistics of the cell count;C:Representative images of aggressive MCF-7 and SKBR3 cells,with column graph showing statistics of cell counts;D:Representative images of xenograft nude mouse model tumors;E-F:Tumor volume of xenograft nude mouse model.
2.2 高良姜素增强曲妥珠单抗体内外抗肿瘤作用
不同浓度的高良姜素或曲妥珠单抗处理细胞24 h后,细胞活力明显抑制,且呈现剂量依赖性(图2A、D),与高良姜素或曲妥珠单抗单独处理相比,联合用药明显抑制细胞活力,(图2B、C、E、F)。流式细胞仪分析表明,与低剂量的高良姜素或曲妥珠单抗处理组相比,高良姜素和曲妥珠单抗联合用药显著诱导MCF-7和SKBR3细胞的凋亡(图2G、H),证实高良姜素可显著增强曲妥珠单抗的体外抗癌活性。

图2 高良姜素增强曲妥珠单抗的体外抗肿瘤活性Fig.2 Galangin enhances the anti-tumor activity of trastuzumab in vitro注:*P <0.05。A:高良姜素和曲妥珠单抗对人乳腺癌细胞MCF细胞的活性抑制曲线;B:高良姜素、曲妥珠单抗以及联合用药对人乳腺癌细胞MCF细胞的活性抑制曲线;C:曲妥珠单抗治疗或联合用药对MCF细胞的活性抑制;D:高良姜素和曲妥珠单抗对人SKBR3细胞的活性抑制曲线;E:高良姜素、曲妥珠单抗以及联合用药对人乳腺癌细胞SKBR3细胞的活性抑制曲线;F:曲妥珠单抗治疗或联合用药对乳腺癌细胞SKBR3的活性抑制;G:单独用曲妥珠单抗或联合用药24 h后的乳腺癌细胞MCF7细胞凋亡和定量;H:单独用曲妥珠单抗或联合用药24 h后的SKBR3细胞凋亡和定量。Note: *P <0.05.A:Inhibition curve of galangin and trastuzumab on human breast cancer cell MCF cells;B:Inhibition curve of galangin,trastuzumab and their combination on human breast cancer cell MCF cell activity;C:Trastuzumab treatment or combination medication inhibits the activity of MCF cells;D:Activity inhibition curve of galangin and trastuzumab on human SKBR3 cells;E:The activity inhibition curve of galangin,trastuzumab and the combination on human breast cancer cell SKBR3 cells;F:Trastuzumab treatment or combination therapy inhibits the activity of breast cancer cell SKBR3;G:The apoptosis and quantification of breast cancer cell MCF7 cells 24 hours after trastuzumab alone or combination therapy;H:Apoptosis and quantification of SKBR3 cells 24 hours after using trastuzumab alone or in combination.
BC异种移植裸鼠模型结果显示,与低剂量高良姜素(0.75 mg/kg)或曲妥珠单抗(10 mg/kg)治疗组相比,低剂量高良姜素(0.75 mg/kg)和曲妥珠单抗(10 mg/kg)联合用药处理显著抑制肿瘤的发展,且与高剂量曲妥珠单抗(30 mg/kg,图3A)抑制作用相当。此外,与高剂量曲妥珠单抗(30 mg/kg)治疗相比,高良姜素与曲妥珠单抗联合用药可显著诱导肿瘤细胞凋亡(图3B),减少ki67阳性细胞数量(图3C),增加癌组织中TUNEL阳性的数量(图3D),证实高良姜素可显著增强曲妥珠单抗的体内抗乳腺癌活性。
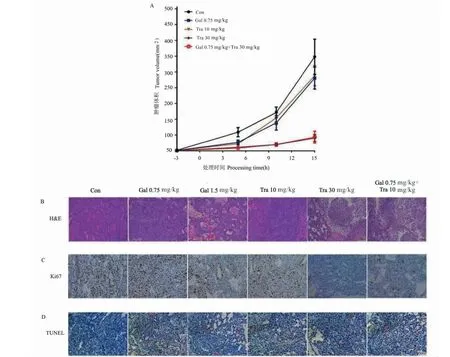
图3 高良姜素增强曲妥珠单抗的体内抗肿瘤活性Fig.3 Galangin enhances the anti-tumor activity of trastuzumab in vivo注:*P <0.05。A:SKBR3原位移植小鼠模型肝肿瘤的生长曲线;B:高良姜素和曲妥珠单抗治疗后原位肝肿瘤的代表性苏木精和曙红(H&E)染色图像;C、D:在高良姜素和曲妥珠单抗治疗的肿瘤中,增殖标志物ki67和凋亡标志物TUNEL;比例尺:50 μm。Note:*P <0.05.A:The growth curve of liver tumor in SKBR3 orthotopic transplantation mouse model;B:Representative hematoxylin and eosin (H&E) stained image of orthotopic liver tumor after galangin and trastuzumab treatment;C,D:Representative immunohistochemical staining of proliferation marker ki67 and apoptosis marker TUNEL;Scale bar:50 μm.
2.3 磷酸化的AKT在乳腺癌细胞系中高表达
与正常乳腺细胞和正常癌旁组织样品相比,乳腺癌细胞系中AKT磷酸化显着增加,AKT基因表达水平明显提高(图4A和4B),且乳腺肿瘤组织中AKT的表达与小鼠存活率呈负相关(图4E)。

图4 磷酸化的AKT在乳腺癌细胞系中高表达Fig.4 Phosphorylated AKT is highly expressed in breast cancer cell lines注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:正常乳腺细胞和乳腺癌细胞系中的p-AKT蛋白表达;B:正常乳腺细胞和乳腺癌细胞系中AKT mRNA的表达;C:正常癌旁组织和肿瘤组织切片的抗AKT IHC染色;D:AKT阳性细胞的百分比;E:通过AKT表达与异种移植裸鼠模型的总体存活率。Note:Compared with the control group, *P<0.05;**P <0.01;***P <0.001.A:Expression of p-AKT protein in normal breast cells and breast cancer cell lines;B:AKT mRNA expression in normal breast cells and breast cancer cell lines.;C:Anti-AKT IHC staining of normal adjacent tissues and tumor tissue sections;D:Percentage of AKT positive cells;E:The overall survival rate of nude mice model by AKT expression and xenotransplantation.
2.4 高良姜素抑制AKT活性,下调p-MDM2表达
与对照组相比,使用高良姜素治疗后,乳腺癌细胞MCF-7(图5A)和SKBR3(图5B)中AKT表达水平显著下调,MDM2的激活明显抑制(图5A),p-MDM2蛋白表达以及MDM2 mRNA水平显著降低(图6B~D);与AktI组相比,乳腺癌细胞MCF-7和SKBR3中AKT表达水平,MDM2的激活,p-MDM2蛋白表达以及MDM2 mRNA水平无显著差异(图6B~D);

图5 高良姜素通过抑制AKT活性抑制乳腺癌细胞的生长和迁移Fig.5 Galangin inhibits the growth and migration of breast cancer cells by inhibiting AKT activity注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:MCF-7细胞中AKT的表达;B:KBR3细胞中的AKT表达;C:MCF-7和SKBR3细胞中AKT的代表性图像,条形图显示细胞计数的统计数据;D:MCF-7和SKBR3细胞的集落形成。Note:Compared with the Control group, *P<0.05;**P <0.01;***P <0.001.A:AKT expression in MCF-7 cells;B:AKT expression in KBR3 cells;C:Representative images of AKT in MCF-7 and SKBR3 cells,bar graphs showing statistics of cell counts;D:Colony formation of MCF-7 and SKBR3 cells.

图6 高良姜素通过p-Mdm2调节抑制乳腺癌的生长Fig.6 Galangin inhibits the growth of breast cancer through p-Mdm2 regulation注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:MCF-7和SKBR3细胞的p-Mdm2免疫荧光染色分析(红色),细胞核(蓝色);B:异种移植肿瘤的p-Mdm2抗体IHC染色;C:乳腺癌细胞系中p-Mdm2的表达;D:p-Mdm2的相对蛋白质水平;E:乳腺癌细胞系中p-Mdm2 mRNA表达水平。Note:Compared with the Control group, *P<0.05;**P <0.01;***P <0.001.A:p-Mdm2 immunofluorescence staining analysis of MCF-7 and SKBR3 cells (red),nucleus (blue);B:p-Mdm2 antibody IHC staining of xenograft tumors;C:p-Mdm2 in breast cancer cell lines expression;D:Relative protein level of p-Mdm2;E:The expression level of p-Mdm2 mRNA in breast cancer cell lines.
2.5 高良姜素抑制细胞增殖
与对照组相比,高良姜素处理后MCF-7和SKBR3细胞质和细胞核中p53的活性明显上调,p53下游信号蛋白P21,FAS和PTEN水平明显增加(图7A和B)。细胞周期分析表明(图7C-E),与对照组相比,使用高良姜素处理后,MCF-7和SKBR3细胞中G0/G1期的细胞明显上调,S期细胞明显降低。

图7 高良姜素通过抑制乳腺癌细胞增殖Fig.7 Galangin inhibits breast cancer cell proliferation注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:乳腺癌细胞系中增殖相关的信号p-P53、P53、P21、FAS和PTEN的表达;B:p-P53、P53、P21、FAS和PTEN的相对蛋白水平;C:高良姜素处理后诱导MCF-7和SKBR3细胞G2/M细胞周期停滞;D:MCF-7中细胞周期百分比;E:SKBR3中细胞周期百分比。Note:Compared with the control group, *P<0.05;**P <0.01;***P <0.001.A:The expression of proliferation-related signals p-P53,P53,P21,FAS and PTEN in breast cancer cell lines;B:Relative protein levels of p-P53,P53,P21,FAS and PTEN;C:Galangin treatment induces G2/M cell cycle arrest in MCF-7 and SKBR3 cells;D:Cell cycle percentage in MCF-7;E:Cell cycle percentage in SKBR3.
2.6 高良姜素促进细胞凋亡
与对照组相比,高良姜素处理后MCF-7和SKBR3细胞凋亡明显增加(图8A),抗凋亡因子c-FLIP和Bcl-2显著下调,凋亡因子Caspase-9和Caspase-3明显上调(图8B)。免疫荧光分析表明,高良姜素处理组MCF-7(图8C)和SKBR3(图8D)细胞中Caspase-3明显激活。
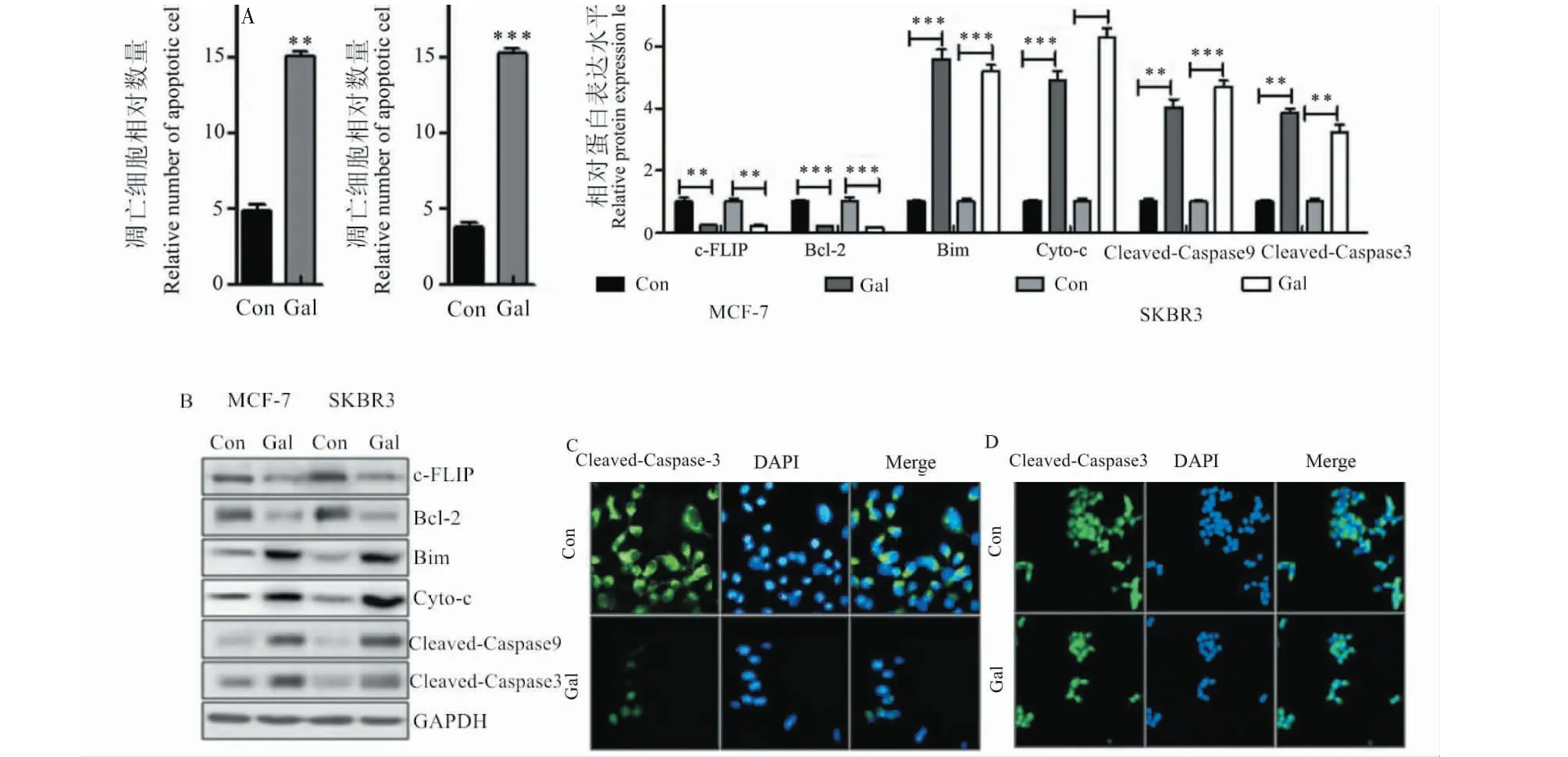
图8 高良姜素通过促进细胞凋亡改善乳腺癌的进展Fig.8 Galangin improves breast cancer progression by promoting apoptosis注:与对照组组相比,*P<0.05;**P <0.01;***P <0.001。A:通过流式细胞仪分析进行膜联蛋白V-FITC/PI确定MCF-7和SKBR3细胞的凋亡;B:乳腺癌细胞系中凋亡信号包括c-FLIP、Bcl-2、Bim、Cyto-c、Caspase-9和Caspase-3的表达;C:免疫荧光染色分析MCF-7细胞中 Caspase-3(绿色)表达,细胞核(蓝色);D:免疫荧光染色分析SKBR3细胞中,Caspase-3(绿色)表达,细胞核(蓝色)。Note:Compared with the Control group, *P<0.05;**P <0.01;***P <0.001.A:Annexin V-FITC/PI was analyzed by flow cytometry to determine the apoptosis of MCF-7 and SKBR3 cells;B:Apoptotic signals in breast cancer cell lines include c-FLIP,Bcl-2,and Bim,Cyto-c,Caspase-9 and Caspase-3 expression;C:Immunofluorescence staining analysis of Caspase-3 (green) expression in MCF-7 cells,nucleus (blue);D:Immunofluorescence staining analysis of SKBR3 cells,Caspase-3 (green) expression,and nucleus (blue).
3 讨论
乳腺癌是最常见的女性恶性肿瘤之一,近年来,传统中医药在乳腺癌临床治疗和基础研究上取得快速进展,逐渐成为乳腺癌患者术后的有效辅助疗法[9]。高良姜素由中药材高良姜提取而来,主要化学成分之一黄酮(flavonoids)是一类含15个碳原子的多元酚化合物,近年来研究表明高良姜素具有广泛的药理活性,包括抗病毒、抗癌、抗致畸、抗突变、抗菌及止痉作用等作用[10,11],可通过激活caspase-8/t-Bid线粒体途径诱导肝癌细胞的凋亡,发挥抗肝癌作用,并通过TGF-β受体/Smad信号通路诱导自噬。我们的研究结果提示高良姜素可能是乳腺癌治疗的一种新途径。
PI3K/Akt信号传导通路广泛参与各种细胞过程,例如细胞增殖,细胞分化以及细胞凋亡,在癌细胞增殖和细胞周期进程以及细胞侵袭,血管生成和转移过程中起着至关重要的作用,与乳腺癌的发生发展密切相关[12]。先前的研究报道PI3K/AKT信号级联可以通过Bcl-2家族成员或caspase家族蛋白介导细胞存活,并通过调节caspase活化,以及促凋亡和抗凋亡蛋白变化决定细胞命运[13,14]。我们的结果表明,高良姜素可以下调Bcl-2表达,增加Capsase-9的酶促活性,激活Caspase-3,导致Caspase级联反应被激活进而诱导凋亡。
PTEN(MMAC1)位于人类染色体10q23.3,编码403 bp的PTEN蛋白,其蛋白尾区内PDZ 结构域具有调控PIP3水平和PI3K的去磷酸化,抑制肿瘤细胞锚定生长等重要作用,由于在肿瘤发生过程中基因缺失或突变而在多种恶性肿瘤中,PTEN的表达受到抑制[15,16]。研究表明,在包括乳腺癌,卵巢癌,胃癌以及结肠癌在内的多种肿瘤类型中PTEN的失活都会导致 RTK/PI3K/Akt 信号的过度激活,从而驱动肿瘤的发生[17,18]。作为PIK3/AKT途径的抑制剂,PTEN可通过抑制AKT途径来抑制肿瘤细胞的生长和侵袭,我们的研究结果表明,在乳腺癌细胞或肿瘤组织样本中,AKT的表达高于对照组,与对照组相比,使用高良姜素处理后,AKT表达显著降低,同时高良姜素施用可以显著上调PTEN表达,进而调节AKT信号通路抑制乳腺癌细胞增殖,抑制肿瘤进展。
P53是一种抑癌基因,位于人染色体17p13,编码53kD的P53蛋白,通过与细胞核内性异性DNA部位结合,上调抑制细胞增殖相关基因的表达,同时抑制细胞增殖相关基因的启动子,进而阻断细胞周期[19],抑制细胞增殖发挥抑癌作用。研究表明抑癌基因p53与乳腺增生与乳腺癌发生发展密切相关,调节性细胞周期蛋白p53和p21的表达变化可促进乳腺癌细胞G2/M期阻滞,诱导细胞凋亡。MDM2是p53的天然结合伙伴和抑制剂,参与p53的自调节循环,可以作为泛素连接酶结合p53活化域诱导p53降解[20]。我们的结果表明,高良姜素可以通过上调p53和p21的表达调节乳腺癌细胞的细胞周期停滞,诱导细胞凋亡。
总之,我们的研究表明,高良姜素可以明显抑制MDM2和Bcl-2表达,并增强p53和Caspases活性,诱导PTEN表达导致AKT失活,进而抑制乳腺癌细胞的生长,侵袭和迁移,抑制体内肿瘤的生长,同时增加曲妥珠单抗抗癌活性,具有抑制乳腺癌发展以及曲妥珠单抗增效作用,因此,高良姜素可能成为乳腺癌的的潜在治疗药物,并未高良姜素用于临床辅助药物提供依据。

