p(Vm − b) = RT实际气体在一些热力学过程中的应用
2021-06-03金明善杨树斌李庆忠
金明善,杨树斌,李庆忠
烟台大学化学化工学院,山东 烟台 264005
理想气体在各个热力学过程中的应用是物理化学的重要基础知识,要求学生熟练掌握,但是理想气体作为一个常用系统,过于简单,学生学习后很容易形成误解,例如经常把等温过程热力学能不变的这种特殊性质当成一般性质滥用于其他气体,因此,在教学中先让学生牢固掌握理想气体的基本性质及其应用的基础上,了解实际气体在一些热力学过程中的应用是非常必要的。由于van der Waals方程的数学处理又过于复杂,因此作为过渡,介绍p(Vm− b) = RT实际气体的一般性质及其在部分热力学过程中的应用有很好的教学示范作用。
1 p(Vm − b) = RT实际气体的一般性质及其在两种常见热力学过程中的应用
1.1 热力学能
热力学能的热力学基本方程为dU = TdS − pdV,在等温条件下,等式两边对体积求导得,

将麦克斯韦关系式(∂S/∂V)T= (∂p/∂T)V代入,得
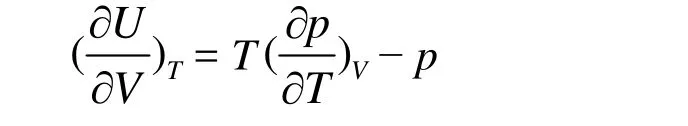
因为 p = RT/(Vm− b),所以(∂p/∂T)V= R/(Vm− b),代入得(∂U/∂V)V= RT/(Vm− b) − p = 0,即

这说明p(Vm− b) = RT,实际气体的热力学能仅仅是温度的函数,即该气体在等温过程中热力学能保持不变,ΔU = 0,该结果可以表达为以下三种形式:
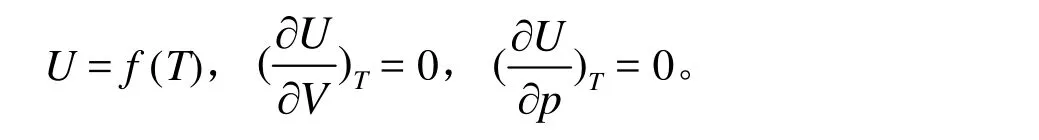
设 U = f (T,V),则其全微分关系式为 dU = CVdT + (∂U/∂V)TdV,因为(∂U/∂V)T= 0,得到
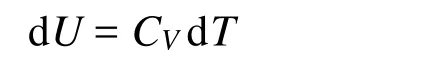
这个求热力学能的公式适用于该气体的任何过程,也就是该气体在非等温过程:绝热、等压、等容、任意过程中,热力学能的变化均可以用dU = CVdT求得,这一点相同于理想气体。
1.2 等压热容与等容热容之间的关系

p(Vm− b) = RT 可以表达为 pV = nRT + nbp,V = nRT/p + nb,(∂V/∂T)p= nR/p,(∂U/∂V)T= 0 代入上式,得Cp− CV= nR 或 Cp,m− CV,m= R
理想气体等压热容与等容热容之间的关系也具有上述表达式。
1.3 在等温过程中各种热力学量的计算
当p(Vm− b) = RT实际气体由始态(p1,V1),经过等温过程到达终态(p2,V2),因为该气体的热力学能仅仅是温度的函数,所以等温过程中ΔU = 0,Q = −W,因为热和体积功是过程量,所以在等温过程的三个不同途径,即绝热向真空膨胀、等温等外压、等温可逆过程的求法分别不同,而H、S、A、G是状态函数,ΔH、ΔS、ΔG、ΔA在上述始终态相同的三个不同途径,具有相同的值。具体计算如下表1所示。

表1 p(Vm − b) = RT实际气体在等温不同途径各种热力学量的计算
通过表中的总结可以看出,W、Q、ΔU、ΔS、ΔA用压力表示的表达式与理性气体相同,而ΔH和与焓相关的ΔG的表达式与理性气体不同。
[例1] (中国海洋大学2005年硕士研究生入学试题)某实际气体状态方程为pVm= RT + bp,式中b为大于0的常数,当该气体经绝热向自由膨胀后,气体的温度__________。
[解] 该气体经绝热向自由膨胀过程,Q = 0,W = 0,ΔU = 0,因为该气体的热力学能仅仅是温度的函数,所以温度不变。
[例2] (南京大学2004年硕士研究生入学试题)一直到1000pӨ,氮气仍服从下列状态方程式p(Vm−b) = RT,式中常数 b = 3.90 × 10−2dm3∙mol−1,在 500 K,1 mol N2(g)从 1000pӨ等温膨胀到 pӨ,计算ΔU、ΔH、ΔS、ΔG、ΔA。
[解] 前已证明p(Vm−b) =RT实际气体的热力学能仅仅温度的函数,在该等温过程中:ΔU= 0
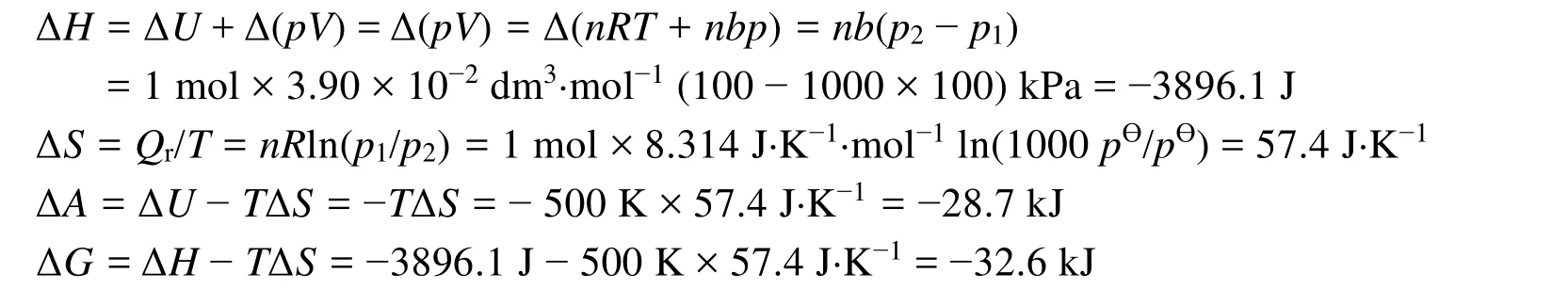
1.4 绝热可逆过程
绝热可逆过程Qr= 0,所以δW =dU,因为该气体任何过程dU = CVdT,所以

p(Vm− b) = RT,其中b是大于零的常数。
(1) 证明该气体的热力学能只是温度的函数;
(2) 推出该气体的绝热可逆过程方程:T2/T1= [(V1− nb)/(V2− nb)]R/CV,m
[解]
(1) 证明该气体的热力学能只是温度的函数,请参考前面的内容;
(2) 该气体的绝热可逆过程方程的推导,请参考前面的内容,其中温度和体积之间的关系为:
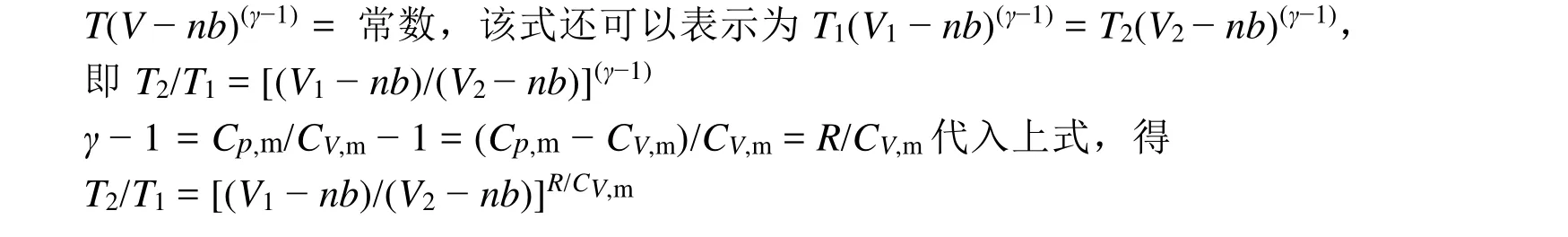
2 p(Vm − b) = RT实际气体在两个实验过程中的特点
2.1 Joule实验
焦耳实验中气体发生绝热向真空膨胀过程,因为Q = 0,W = 0,所以ΔU = 0,温度保持不变,所以

2.2 Joule-Thomson实验
等焓、绝热、压力减小是Joule-Thomson实验的三大基本特征,可以用Joule-Thomson系数μJ-T=(∂T/∂p)H衡量气体节流膨胀后制冷或制热的能力[4]。


因为在节流膨胀过程中压力减小p2< p1,所以T2> T1,即该气体节流膨胀后温度升高,这说明p(Vm−b) = RT实际气体无法通过节流膨胀进行液化。
[例4] (中国科学院大学2000年硕士研究生入学试题)已知1 mol氢气的物态方程
p(V − b) = RT,(b > 0),若该气体经一个绝热的自由膨胀过程由始态(T1,V1)到达终态体积V2。求:(1) 终态的温度T2;
(2) 过程的 ΔU、ΔH、ΔS;
(3) 计算说明该气体经过节流膨胀后,温度如何变化?
[解]
当物质的量为1 mol时,p(Vm− b) = RT实际气体物态方程为p(V − b) = RT,前面已证明该气体的热力学能仅仅是温度的函数和Joule-Thomson系数μJ-T= − nb/Cp< 0。
(1) 因为在绝热自由膨胀过程中Q = 0,W = 0,所以ΔU = 0,所以温度保持不变,T2= T1,即该气体绝热自由膨胀过程为等温过程。
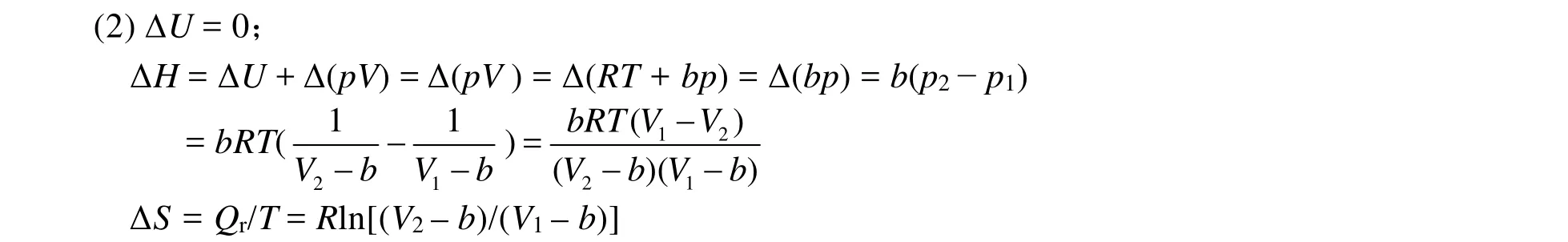
(3) μJ-T= (∂T/∂p)H= −(1/Cp)(∂H/∂p)T= −b/Cp< 0,因为节流膨胀过程 p2< p1,所以 T2> T1,说明该气体经过节流膨胀后,温度升高。
3 p(Vm − b) = RT实际气体的化学势及其应用
3.1 化学势等温式
根据物态方程pVm= RT + bp,Vm= RT/p + b,代入dμ = Vmdp中

美国化学家G. N. Lewis提出了逸度f的概念,对压力进行了修正之后,p(Vm− b) = RT实际气体的化学势表达式为
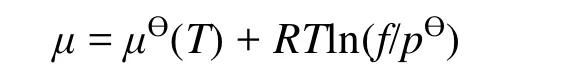
其中逸度 f=γp,γ为逸度系数。
3.2 逸度系数的求法

3.3 五个热力学函数
通过化学势的表达式 μ(T, p) = μ(T, p⊖) + RTln(p/pӨ) + b(p − pӨ),可以分别推导五个热力学函数的表达式:

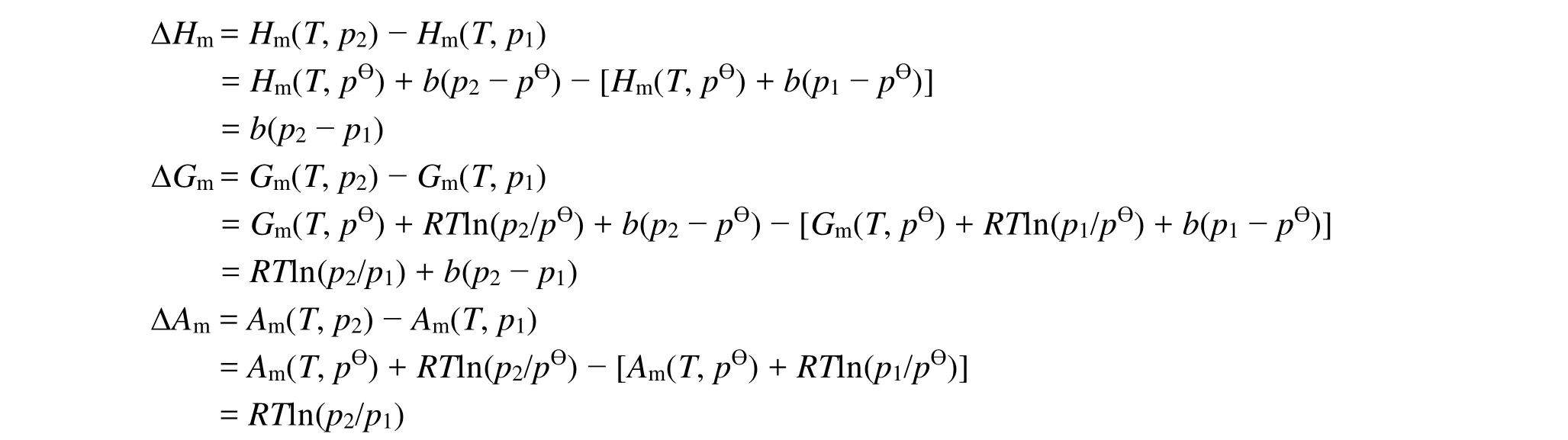
利用化学势导出的五个热力学函数的表达式来推导p(Vm− b) = RT实际气体在等温过程中五个热力学函数的变化,得出了与前面一致的结果。
[例5] 设气体B遵守下列物态方程pVm= RT + bp (b为大于零的常数)。
(1) 请导出其化学势、熵、焓的表达式;
(2) 导出在(T, p1) → (T, p2)过程的逸度比;
(3) 设B在pӨ为理想气体,求其在298 K,20pӨ的逸度[3]。

由以上内容可以总结,p(Vm− b) = RT实际气体的热力学能仅仅是温度的函数、等压热容与等容热容之差Cp− CV= nR,等温、绝热可逆等热力学过程中,用压力表示的一些热力学量的计算与理想气体具有相同的性质,通过做大量的习题可以更深入地掌握该气体和理想气体之间的联系和区别,进一步探索其他更复杂的实际气体的热力学性质。
