基于核转录因子κB信号通路探讨益气固表丸治疗慢性阻塞性肺疾病的疗效研究
2021-06-01罗建江张艳丽刘珊
罗建江,张艳丽,刘珊
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是临床常见的一种慢性呼吸系统疾病,以气道、肺实质和肺血管慢性炎症为主要特征,患病率较高,且病情易反复加重,严重影响患者的劳动能力和生活质量[1-2]。炎症是COPD的主要机制[3]。脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要成分,可黏附于支气管黏膜的上皮细胞,进而刺激中性粒细胞及单核细胞释放白介素(interleukin,IL)-1、IL-6、肿瘤坏死因 子 α(tumor necrosis factor alpha,TNF-α)等细胞因子,激活信号通路释放各种自由基、水解酶等,进而导致肺损伤,造成炎症级联反应[4-5]。既往研究发现,中药复方制剂——益气固表丸可有效降低COPD患者IL-6、TNF-α水平[6]。核因子激活的核转录因子κB(nuclear transcription factor κB,NF-κB)是IL-6和 TNF-α基因的调控信号途径,但LPS是如何通过NF-κB信号通路来诱导COPD尚不明确。基于此,本研究旨在探讨益气固表丸通过阻断LPS/NF-κB信号通路来抑制COPD的分子机制,以期为益气固表丸治疗COPD提供科学依据。
1 材料与方法
1.1 实验时间 2017年7月—2018年6月。
1.2 实验动物 本实验选取了8周龄的SPF级SD雄性大鼠48只,平均体质量(190±10)g,均于2017年7月购于新疆医科大学实验动物中心,动物质量合格证书:SCXK(新)2016-0002。饲养环境:模拟自然昼夜条件,室温20~25 ℃,相对湿度为50%~65%,环境安静,定时换窝。通过气管滴注弹性蛋白酶、LPS以建立COPD大鼠模型,并通过检查其炎性因子和肺功能进一步确定建模是否成功。按照随机数字表法将所有COPD大鼠分为空白对照组、模型组、益气固表丸高剂量组、益气固表丸低剂量组,每组12只。本研究经新疆医科大学伦理委员会审核批准。
1.3 试剂与仪器 试剂:益气固表丸(新疆制药厂生产,生产批号:20121212)购于新疆医科大学附属中医医院中心药房;LPS购于美国Sigma公司;IL-6、TNF-α均采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测,试剂盒购于上海联科生物医药有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物购于生工生物工程(上海)股份有限公司;DNA反转录试剂盒购于北京全式金生物技术有限公司;IκBα、p-IκBα抗体均购于北京博奥森生物技术有限公司。仪器:多功能酶标仪购于Bio-RadBio-Rad(伯乐生命医学产品)有限公司;实时荧光定量PCR仪购于Bio-Rad有限公司;化学发光成像仪系统(Chemiscope 3000)购于上海勤翔科学仪器有限公司。
1.4 模型制备及治疗 大鼠适应性喂养1周后,气道滴注弹性蛋白酶联合LPS以建立COPD大鼠模型[7],具体方法如下:大鼠均予以10%水合氯醛进行腹腔麻醉,而后模型组、益气固表丸高剂量组、益气固表丸低剂量组大鼠均于气道内给予猪胰弹性蛋白酶4.2 U,1周后再气道滴注LPS 100 μl,1次/10 d,持续给药10次。空白对照组大鼠仅于气道内喷相同剂量的0.9%氯化钠溶液。
确定建模成功后,益气固表丸高剂量组大鼠给予益气固表丸200丸+0.9%氯化钠溶液500 ml进行治疗;益气固表丸低剂量组大鼠给予益气固表丸100丸+0.9%氯化钠溶液500 ml进行治疗,大鼠均按照1.5 ml∶100 g的比例进行灌胃,2次/d,持续治疗14 d;空白对照组和模型组大鼠则给予相同剂量的0.9%氯化钠溶液,且采用相同的灌胃频率处理。
1.5 观察指标
1.5.1 肺组织病理变化情况 观察大鼠肺组织病理变化情况。建模后第2天,四组大鼠均予以10%水合氯醛进行腹腔麻醉,而后迅速开胸剥离肺组织,在垂直于支气管的左侧肺矢状面最大周径处取厚约5 mm的肺组织,用10%甲醛溶液固定,制作石蜡组织切片,用苏木精-伊红(HE)染色后在显微镜下观察四组大鼠肺组织病理变化情况。
1.5.2 血清TNF-α、IL-6水平 比较四组大鼠血清TNF-α、IL-6水平。抽取四组大鼠血液,4 000 r/min离心10 min(离心半径6 cm),取上清液,采用ELISA检测血清TNF-α、IL-6水平,具体操作严格按试剂盒说明书进行,具体操作步骤如下:(1)准备好所有需要的试剂及工作浓度标准品。(2)将不需要的板条拆卸下来,放回装有干燥剂的铝箔袋,重新封口。(3)加入300 μl洗液静置、浸泡30 s,弃掉洗液后,在吸水纸拍干微孔板;洗板完成后,立即使用微孔板,不要让微孔板干燥。(4)标准孔加入100 μl 2倍比稀释的标准品,空白孔加入100 μl标准品稀释液。(5)样本孔加入100 μl血清样本。(6)每孔加入50 μl稀释的检测抗体。保证步骤4、5、6连续加样,不间断。加样过程在15 min内完成。(7)使用封板膜封板。300 r/min振荡,室温孵育2 h。(8)弃掉液体,每孔加入300 μl洗液洗板,洗涤6次。每次洗板在吸水纸上拍干。(9)每孔加入100 μl稀释的辣根过氧化物酶标记的链霉亲和素。(10)使用新的封板膜封板。300 r/min振荡,室温孵育45 min。(11)重复步骤8。(12)每孔加入100 μl TMB底物显色试剂盒,避光,室温孵育5~30 min。(13)每孔加入100 μl终止液。(14)在30 min内,使用酶标仪进行双波长检测,测定450 nm最大吸收波长和570 nm参考波长下的OD值。校准后OD值为450 nm处OD值与570 nm处OD值的差。
1.5.3 RelA(p65)、NF-κB1(p53)基因相对表达量 比较四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量。麻醉处死大鼠后,快速采集肺组织,组织样本经液氮研磨后取100 mg置于离心管中,加入1 ml TRLZOL将组织吹打、混匀,室温放置15 min以上;而后加入200 μl的氯仿,颠倒混匀后室温放置2~5 min,再在4 ℃环境下以12 000 r/min的转速离心处理15 min(离心半径10 cm),而后取上清液置于一个新的离心管中,加入等体积的异丙醇混匀,并于-20 ℃环境下静置30 min以上,再在4 ℃环境下以12 000 r/min的转速离心处理15 min(离心半径10 cm),倒掉上清液;加入75%乙醇,使沉淀漂浮起来洗涤;再在4 ℃环境下以12 000 r/min的转速离心处理15 min(离心半径10 cm),倒掉上清液,吸尽液体,晾干;用无RNA、DNA酶的水溶解沉淀。进行1.8%琼脂糖凝胶电泳,150 V,10 min,电泳完毕后应用凝胶成像仪进行观察。剩余RNA置于-80 ℃环境下保存或直接反转录成cDNA,再进行实时荧光定量反转录-聚合酶链式反应(rRT-PCR),实时荧光定量PCR引物序列见表1,观察四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量。

表1 引物序列Table 1 Primer sequence
1.5.4 IκBα、p-IκBα蛋白相对表达量 采用Western blotting法检测四组大鼠IκBα、p-IκBα蛋白相对表达量。麻醉处死大鼠后,快速提取肺组织,匀浆,经液氮研磨后取约100 mg的肺组织加入到预冷的1.5 ml离心管中,然后加入400 μl RIPA裂解液(已加入蛋白酶抑制剂和广谱磷酸酶抑制剂)充分混匀,在4 ℃环境下放置60 min后,12 000 r/min离心15 min(离心半径10 cm),取上清液,提取白蛋白。用蛋白质定量法测定蛋白浓度。将已电泳后的聚丙烯酰胺凝胶用考马斯亮蓝染色60 min。蛋白样本中加入适量十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂loading buffer(含β-巯基乙醇),100 ℃沸水中加热5 min,使蛋白充分变性,12 000 r/min离心5 min(离心半径10 cm),取上清液备用。配制12%、15%分离胶与5%浓缩胶,依次进行制胶、加样、电泳、转膜、一抗抚育、二抗抚育、曝光,显影、定影。结果扫描后,经光密度分析系统计算灰度值。
1.6 统计学方法 应用SPSS 22.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 四组大鼠肺组织病理变化情况 HE染色结果显示,空白对照组大鼠肺组织大体结构基本正常;模型组大鼠肺组织肺泡壁增生、增厚,伴细胞增大、增多,间质炎症细胞浸润,部分肺泡萎缩或扩张,支气管上皮细胞部分增生及缺损,黏膜下大量慢性炎症细胞浸润,有较多出血、坏死区;与模型组相比,益气固表丸低剂量组大鼠肺组织改善并不明显,而益气固表丸高剂量组大鼠肺泡增生、增厚,支气管病变有所好转,见图1。
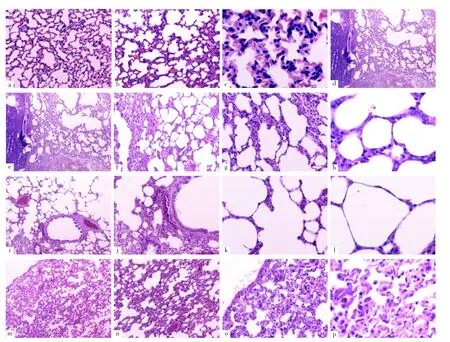
图1 四组大鼠肺组织病理变化情况Figure 1 Pathological changes of lung tissue in the four groups of rats
2.2 四组大鼠血清TNF-α、IL-6水平比较 四组大鼠血清TNF-α、IL-6水平比较,差异有统计学意义(P<0.05)。模型组、益气固表丸低剂量组大鼠血清TNF-α、IL-6水平及益气固表丸高剂量组血清TNF-α水平高于空白对照组,差异有统计学意义(P<0.05);益气固表丸高剂量组大鼠血清TNF-α、IL-6水平低于模型组及益气固表丸低剂量组,差异有统计学意义(P<0.05),见表2。
表2 四组大鼠血清TNF-α、IL-6水平比较(±s,pg/ml,n=12)Table 2 Comparison of serum levels of TNF-α,IL-6 in the four groups of rats
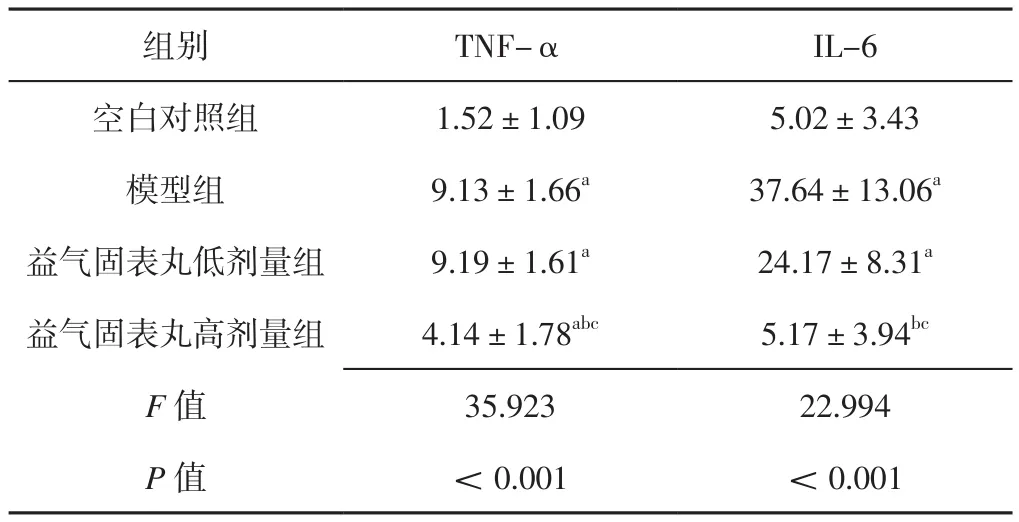
表2 四组大鼠血清TNF-α、IL-6水平比较(±s,pg/ml,n=12)Table 2 Comparison of serum levels of TNF-α,IL-6 in the four groups of rats
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与益气固表丸低剂量组比较,cP<0.05;TNF-α=肿瘤坏死因子α,IL-6=白介素6
组别 TNF-α IL-6空白对照组 1.52±1.09 5.02±3.43模型组 9.13±1.66a 37.64±13.06a益气固表丸低剂量组 9.19±1.61a 24.17±8.31a益气固表丸高剂量组 4.14±1.78abc 5.17±3.94bc F值 35.923 22.994 P值 <0.001 <0.001
2.3 四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量比较 四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量比较,差异有统计学意义(P<0.05)。模型组、益气固表丸低剂量组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量高于空白对照组,差异有统计学意义(P<0.05);益气固表丸高剂量组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量低于模型组,RelA(p65)基因相对表达量低于益气固表丸低剂量组,差异有统计学意义(P<0.05),见表3。
表3 四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量比较(±s,n=12)Table 3 Comparison of the gene relative expression of RelA(p65) and NF-κB1(p53) in the four groups of rats

表3 四组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量比较(±s,n=12)Table 3 Comparison of the gene relative expression of RelA(p65) and NF-κB1(p53) in the four groups of rats
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与益气固表丸低剂量组比较,cP<0.05
组别 RelA(p65) NF-κB1(p53)空白对照组 1.02±0.22 1.01±0.11模型组 1.66±0.14a 1.76±0.19a益气固表丸低剂量组 1.48±0.25a 1.59±0.31a益气固表丸高剂量组 1.21±0.21bc 1.19±0.16b F值 10.003 17.249 P值 <0.001 <0.001
2.4 四组大鼠IκBα、p-IκBα蛋白相对表达量比较四组大鼠IκBα蛋白相对表达量比较,差异无统计学意义(P>0.05)。四组大鼠p-IκBα蛋白相对表达量比较,差异有统计学意义(P<0.05)。模型组、益气固表丸低剂量组大鼠p-IκBα蛋白相对表达量高于空白对照组,差异有统计学意义(P<0.05);益气固表丸高剂量组大鼠p-IκBα蛋白相对表达量低于模型组及益气固表丸低剂量组,差异有统计学意义(P<0.05),见表4、图2。
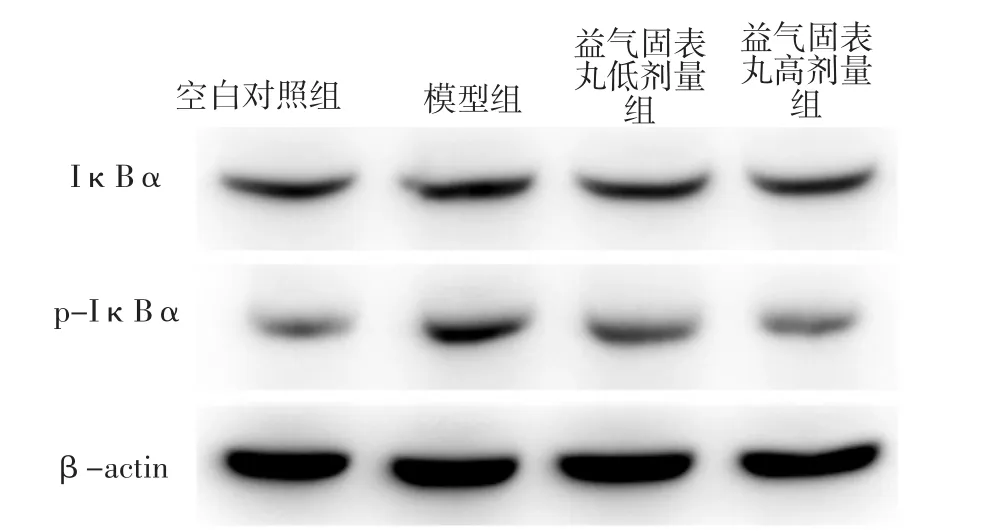
图2 Western blotting法检测IκBα、p-IκBα蛋白相对表达量的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图Figure 2 SDS-PAGE of relative expression of IκBα and p-IκBα protein detected by Western blotting
表4 四组大鼠IκBα、p-IκBα蛋白相对表达量比较(±s,n=12)Table 4 Comparison of the protein relative expression of IκBα and p-IκBα in the four groups of rats
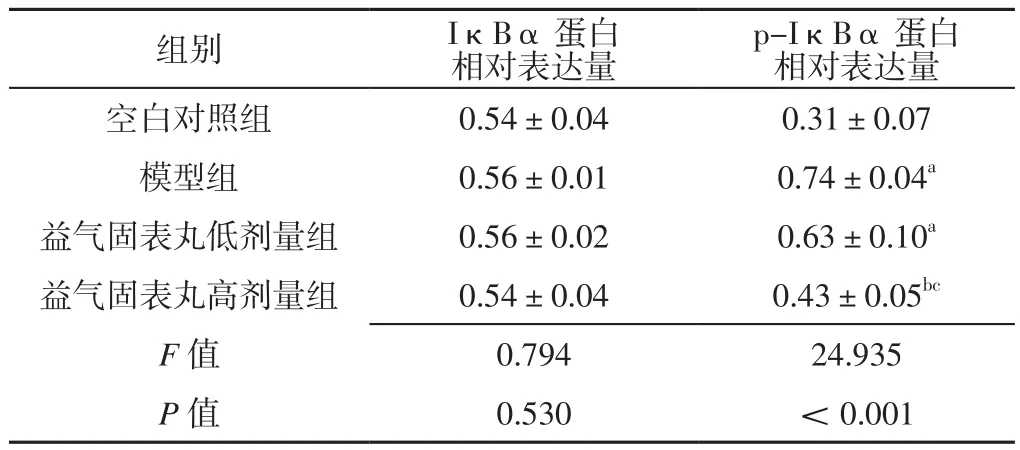
表4 四组大鼠IκBα、p-IκBα蛋白相对表达量比较(±s,n=12)Table 4 Comparison of the protein relative expression of IκBα and p-IκBα in the four groups of rats
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与益气固表丸低剂量组比较,cP<0.05
组别 IκBα蛋白相对表达量p-IκBα蛋白相对表达量空白对照组 0.54±0.04 0.31±0.07模型组 0.56±0.01 0.74±0.04a益气固表丸低剂量组 0.56±0.02 0.63±0.10a益气固表丸高剂量组 0.54±0.04 0.43±0.05bc F值 0.794 24.935 P值 0.530 <0.001
3 讨论
COPD气道慢性炎症发生的中心环节是炎症细胞局部趋化、激活以及大量相关炎性递质的释放[8],长期反复发作可导致患者肺损伤及肺功能恶化,最终引发呼吸衰竭甚至死亡。研究表明,西药虽可控制COPD患者现有症状、缓解急性加重症状,但均不能逆转肺损伤[9],目前传统中医药治疗COPD逐渐得到重视。
中医学理论认为,COPD属“肺胀”范畴。COPD是本虚标实,日久肺气亏虚,病及脾肾,故益气固表、健脾燥湿是其主要治疗原则。本院研制的复方制剂——益气固表丸是由茯苓、陈皮、(炒)白术、法半夏、浮小麦、薏苡仁、蜜枇杷叶、黄芩、防风、紫苏子、伊贝母、党参、蜜款冬花13味中药构成的丸剂,具有抗炎、抗氧化、调节机体免疫力的作用,能有效缓解COPD患者喘、咳、痰、胀等不适,减少患者急性加重,降低再住院率[10-11]。
COPD的主要致病菌是革兰阴性菌[12]。LPS是革兰阴性菌细胞壁的主要成分,具有广泛生理活性,可与巨噬细胞、单核细胞和树突状细胞膜上的CD14/TLR4/MD2复合物结合并通过MyD88/TAK1等激活NF-κB通路,促进细胞分泌促炎因子、一氧化氮(NO)等多种细胞因子,而弹性蛋白酶作用于气道弹性蛋白时可激活肺泡巨噬细胞,引起炎性因子表达增加[13]。本研究在建模过程中不仅对大鼠气管滴注弹性蛋白酶,还结合LPS反复刺激气道产生慢性炎症反应,从而成功建立COPD大鼠模型,结果显示,空白对照组大鼠肺组织大体结构基本正常;模型组大鼠肺组织肺泡壁增生、增厚,伴细胞增大、增多,间质较多慢性炎症细胞浸润,部分肺泡萎缩或扩张,支气管上皮细胞部分增生及缺损,黏膜下大量慢性炎症细胞浸润,较多出血、坏死区,表明COPD大鼠建模成功。另外,益气固表丸低剂量组较模型组肺组织病变差异不明显;益气固表丸高剂量组与模型组比较,肺泡增生、增厚及间质炎症细胞浸润程度均有所改善,肺泡萎缩及肺泡壁断裂、扩张程度均减轻,支气管病变有所好转,表明高剂量益气固表丸可有效减轻COPD大鼠肺组织损伤程度,改善炎症细胞浸润程度。本研究结果还显示,模型组、益气固表丸低剂量组大鼠血清TNF-α、IL-6水平及益气固表丸高剂量组血清TNF-α水平高于空白对照组;益气固表丸高剂量组大鼠血清TNF-α、IL-6水平低于模型组及益气固表丸低剂量组,表明益气固表丸高剂量治疗较低剂量可更有效地减轻COPD大鼠炎症反应。金晶等[14]研究表明,益气固表丸可抑制JKA/STAT通路及其下游炎症蛋白的活化与表达,改善COPD大鼠肺内炎症反应。另有研究表明,益气固表丸可改善肺脾气虚型COPD稳定期患者机体免疫功能[15],但其具体机制尚未明确。
NF-κB是人体重要的转录调节因子,是由多个多肽亚单位组成的蛋白家族[16]。RelA(p65)、IκB、p-IκB皆是NF-κB家族的重要成员。当无活化刺激信号时,RelA可与细胞质内的IκB结合形成复合物;支气管上皮细胞在LPS刺激下释放的炎性因子如IL-1、IL-6可激活NF-κB通路,IκB激酶复合物IKK可使IκB磷酸化,生成p-IκB,进而激活RelA/IκB复合物使其分离,游离的RelA进入细胞核内调节相关炎性因子表达[17]。本研究结果显示,模型组、益气固表丸低剂量组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量高于空白对照组;益气固表丸高剂量组大鼠RelA(p65)、NF-κB1(p53)基因相对表达量低于模型组,RelA(p65)基因相对表达量低于益气固表丸低剂量组;模型组、益气固表丸低剂量组大鼠p-IκBα蛋白相对表达量高于空白对照组;益气固表丸高剂量组大鼠p-IκBα蛋白相对表达量低于模型组及益气固表丸低剂量组,表明益气固表丸高剂量治疗可更有效地降低COPD大鼠RelA(p65)基因相对表达量及p-IκBα蛋白相对表达量,推测益气固表丸可通过抑制NF-κB信号通路中p-IκBα来阻断RelA(p65)进入细胞核激活基因的转录,减少炎性递质释放,从而减轻炎症反应。研究表明,COPD患者IL-1、IL-6与NF-κB基因相对表达量呈正相关,表明NF-κB与炎性因子可相互影响而加速局部炎症的发生发展[18-19],本研究结果与之一致。
综上所述,高剂量益气固表丸可通过调控COPD大鼠体内的NF-κB信号通路及其下游RelA(p65)基因相对表达量、p-IκBα蛋白相对表达量而降低炎性细胞水平,进而减轻气道炎症反应。
作者贡献:罗建江进行文章的构思与设计,研究的实施与可行性分析,结果分析与解释,撰写论文,进行论文的修订;刘珊进行数据收集、整理、分析;张艳丽负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
