微小RNA-107对气道平滑肌细胞增殖和迁移的影响研究
2021-06-01宇文婷罗雅妮黎满慧史菲熊轶
宇文婷,罗雅妮,黎满慧,史菲,熊轶
哮喘是发生在气道的慢性炎症性疾病,随着发病率和死亡率的增加,其成为了重点关注的疾病[1]。哮喘的特征包括气道变窄、可逆性气流阻塞、气道高反应性、气道炎症和气道重塑[2-3]。而气道平滑肌细胞(airway smooth muscle cells,ASMCs)增殖、迁移功能的异常会进一步导致气道重塑[4]。因此,研究ASMCs功能的影响因素并进行干预有助于缓解患者哮喘症状。哮喘的病因目前尚不完全清楚,但是已经有研究表明,遗传学在其中发挥着重要作用,非编码RNA调控是主要的表观遗传机制之一[5]。
微小RNA(microRNA,miRNA)是指由18~25个核苷酸组成的单链非编码RNA,可以与靶基因的3'非翻译区(3'-untranslated regions,3'-UTR)结合,抑制靶基因的转录后水平和翻译水平[6]。研究表明,异常表达的miRNA可能参与哮喘的发生发展[7]。已有文献报道,miRNA-107在膀胱癌和胃肠癌中呈低表达,且抑制miRNA-107的表达可以促进肿瘤细胞的增殖和迁移[8-9]。但是,miRNA-107对ASMCs功能的影响尚未见报道。本研究主要探讨miRNA-107对ASMCs增殖和迁移的影响,以期为将miRNA-107应用于哮喘的诊断和治疗奠定一定的理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 20只4~6周的SPF级雌性BABL/c小鼠均购自广东省实验动物中心,动物实验许可证号为SYXK(粤)2015-0106。小鼠饲养于SPF级环境中,自由进食、饮水,保持12 h昼夜节律。本研究经深圳北京大学香港科技大学医学中心动物实验伦理委员会批准通过。
1.1.2 实验试剂及仪器 DMEM-F12培养基、Opti-MEM无血清培养基、胎牛血清(fetal bovine serum,FBS)、胰酶、青/链霉素、羊抗兔488二抗(美国Invitrogen公司);Ⅰ型胶原酶(sigma公司);viafect转染试剂盒(美国Promega公司);荧光定量试剂盒、BrdU细胞增殖检测试剂盒(比色分析法)(美国Roche公司);兔源α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(美国Abcam公司);穿梭小室(美国Corning公司);激光扫描共聚焦显微镜(德国Carl Zeiss公司)。
1.2 实验方法
1.2.1 实验时间 本研究时间为2019年9月—2020年12月。
1.2.2 ASMCs的培养 将6~8周的小鼠脱颈处死后,在75%乙醇溶液中浸泡2~5 min;将肺和气管完整取出,研磨肺上皮,露出透明的支气管;将气管和支气管切成1 mm的小块,加入3 ml 2 mg/L的Ⅰ型胶原酶和2 ml 0.25%的胰酶混合消化25 min,用含20% FBS和1%青/链霉素的DMEM-F12培养基终止消化后以1 000 r/min离心5 min(离心半径17.8 cm),去除上清液,用5 ml含20% FBS和1%青/链霉素的DMEM-F12培养基重悬细胞并置于培养瓶中,在37 ℃、5% CO2培养箱中培养3 d,细胞贴壁后换液。
1.2.3 ASMCs的免疫荧光鉴定 将1×104个对数生长期的ASMCs铺到35 mm的培养皿中,24 h后吸掉培养基,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗2次,每次5 min;用4%多聚甲醛室温固定30 min;用PBS洗3次,每次5 min;加入免疫荧光封闭液,室温封闭1 h;加入用免疫荧光一抗稀释液稀释的兔源α-SMA抗体,4 ℃过夜;用免疫荧光清洗液洗3次,每次5 min;加入用免疫荧光二抗稀释液稀释的羊抗兔488二抗,室温孵育2 h;用PBS洗4次,每次10 min;加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI),室温孵育6 min,然后用双蒸水洗2次,每次5 min;加适量的抗荧光淬灭剂于载玻片,取出盖玻片倒置于载玻片上,风干后在激光扫描共聚焦显微镜下观察细胞形态。其中绿色荧光(α-SMA)标记ASMCs中的平滑肌肌动蛋白,蓝色荧光(DAPI)标记ASMCs的细胞核。
1.2.4 细胞转染与分组 运用viafect转染试剂盒转染细胞,具体操作如下:在6孔板的每孔中接种2×105个对数生长期的ASMCs,1 d后细胞融合度达到60%~70%。将细胞随机分为miRNA-107模拟物组(miRNA-107 mimic组)、模拟物对照组(mimic NC组)和miRNA-107抑制剂组(miRNA-107 inhibitor组)、抑制剂对照组(inhibitor NC组)。miRNA-107 mimic组和mimic NC组的细胞分别转染5 μl 20 μmol/L的 miRNA-107 mimic或 5 μl 20 μmol/L的 mimic NC+7.5 μl viafect+200 μl Opti-MEM 无 血 清 培 养 基;miRNA-107 inhibitor组和inhibitor NC组的细胞分别转染 10 μl 20 μmol/L 的 miRNA-107 inhibitor或 10 μl 20 μmol/L 的 inhibitor NC+15 μl viafect+200 μl Opti-MEM无血清培养基。加入2 ml含10% FBS的DMEM-F12培养基,置于细胞培养箱培养。
1.2.5 ASMCs中miRNA-107相对表达水平检测 采用荧光定量试剂盒检测各组ASMCs中miRNA-107相对表达水平。采用Trizol法提取转染48 h的ASMCs的RNA,采用反转录试剂盒将RNA反转录为cDNA,用无核酸酶水稀释10倍;将2.6 μl无核酸酶水、0.2 μl 10 μmol/L的特异引物F、0.2 μl 10 μmol//L的特异引物R、5 μl 2×核苷酸胶体染料(SYBR Green)、2 μl cDNA加入96孔板。进行PCR,反应条件为:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 1 min,共39个循环;溶解曲线:从65 ℃缓慢增加到95 ℃。以U6作为内参,采用2-ΔΔCt法计算miRNA-107相对表达水平。实验独立重复3次。
1.2.6 细胞增殖能力检测 运用BrdU细胞增殖检测试剂盒(比色分析法)检测各组细胞增殖能力。在96孔板的每孔中放入5 000个对数生长期的ASMCs,转染2 d后,每孔加入10 μl BrdU标记液和100 μl含10% FBS和1%青/链霉素的DMEM-F12培养基,孵育4 h;吸掉标记液,每孔加入200 μl固定液,室温孵育30 min;去掉固定液,每孔加入100 μl BrdU抗体,室温孵育1.5 h;去除抗体,每孔加入200~300 μl洗液,洗3次;去除洗液,每孔加入100 μl底物,室温孵育20 min,检测370/492 nm处的吸光度,其差值代表细胞增殖能力。实验独立重复3次。
1.2.7 细胞迁移能力检测 运用穿梭小室检测各组细胞迁移能力。在6孔板的每孔中接种2×105个对数生长期的ASMCs,转染2 d后用胰酶消化,用450 μl DMEM-F12培养基重悬细胞;每孔上室加入150 μl细胞悬液,下室加入700 μl含10% FBS和1%青/链霉素的DMEM-F12培养基,在培养箱中孵育1 d;用棉签将小室内面的细胞去除,用4%多聚甲醛固定迁移细胞,用0.5%结晶紫染色液染色,将穿梭小室倒置于普通光学显微镜下,计算5个随机视野的细胞数,其均值代表细胞迁移能力。实验独立重复3次。
1.3 观察指标 (1)观察ASMCs的鉴定结果。(2)分别比较miRNA-107 mimic组与mimic NC组、miRNA-107 inhibitor组与inhibitor NC组ASMCs中miRNA-107相对表达水平、细胞增殖能力和细胞迁移能力。
1.4 统计学方法 应用SPSS 20.0统计学软件进行数据分析。计量资料以(±s)表示,组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ASMCs的鉴定 ASMCs从组织块周围呈放射状萌出,7 d后逐渐长满培养瓶,呈谷峰状,见图1A。首次传代后,ASMCs呈梭形,多有突起,生长致密且平行排列,见图1B。培养2代后的ASMCs经免疫荧光鉴定后有绿色荧光,见图1C。经鉴定,99%以上的细胞均是ASMCs。

图1 小鼠原代ASMCs的形态及鉴定结果Figure 1 Morphology and identification results of primary ASMCs of mouse
2.2 miRNA-107 mimic组与mimic NC组ASMCs中miRNA-107相对表达水平、细胞增殖能力和细胞迁移能力比较 miRNA-107 mimic组ASMCs中miRNA-107相对表达水平高于mimic NC组,吸光度差值、迁移细胞数低于mimic NC组,差异有统计学意义(P<0.05),见表1、图2A~B。
表1 miRNA-107 mimic组与mimic NC组 ASMCs中 miRNA-107相对表达水平、吸光度差值和迁移细胞数比较(±s,n=3)Table 1 Comparison of miRNA-107 relative expression level in ASMCs,absorbance difference and number of migrating cells between miRNA-107 mimic group and mimic NC group
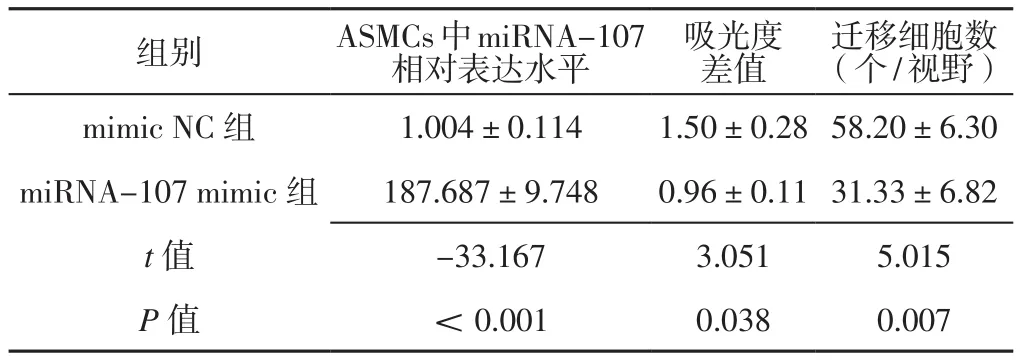
表1 miRNA-107 mimic组与mimic NC组 ASMCs中 miRNA-107相对表达水平、吸光度差值和迁移细胞数比较(±s,n=3)Table 1 Comparison of miRNA-107 relative expression level in ASMCs,absorbance difference and number of migrating cells between miRNA-107 mimic group and mimic NC group
注:ASMCs=气道平滑肌细胞,miRNA=微小RNA,mimic NC组=模拟物对照组,miRNA-107 mimic组=miRNA-107模拟物组
组别 ASMCs中miRNA-107相对表达水平吸光度差值迁移细胞数(个/视野)mimic NC 组 1.004±0.114 1.50±0.28 58.20±6.30 miRNA-107 mimic组 187.687±9.748 0.96±0.11 31.33±6.82 t值 -33.167 3.051 5.015 P值 <0.001 0.038 0.007
2.3 miRNA-107 inhibitor组与inhibitor NC组ASMCs中miRNA相对表达水平、细胞增殖能力和细胞迁移能力比较 miRNA-107 inhibitor组ASMCs中miRNA-107相对表达水平低于inhibitor NC组,吸光度差值、迁移细胞数高于inhibitor NC组,差异有统计学意义(P<0.05),见表2、图2C~D。

图2 各组细胞迁移能力检测结果(结晶紫染色,×10)Figure 2 Results of cell migration ability test in each group
表2 miRNA-107 inhibitor组与inhibitor NC组ASMCs中miRNA-107相对表达水平、吸光度差值和迁移细胞数比较(±s,n=3)Table 2 Comparison of miRNA-107 relative expression level in ASMCs,absorbance difference and number of migrating cells between miRNA-107 inhibitor group and inhibitor NC group

表2 miRNA-107 inhibitor组与inhibitor NC组ASMCs中miRNA-107相对表达水平、吸光度差值和迁移细胞数比较(±s,n=3)Table 2 Comparison of miRNA-107 relative expression level in ASMCs,absorbance difference and number of migrating cells between miRNA-107 inhibitor group and inhibitor NC group
注:inhibitor NC组=抑制剂对照组,miRNA-107 inhibitor组=miRNA-107抑制剂组
组别A S M C s中m i R N A-1 0 7相对表达水平吸光度差值迁移细胞数(个/视野)i n h i b i t o r N C 组 1.0 0 3±0.9 9 6 0.9 3±0.2 8 3 0.5 3±1.7 5 m i R N A-1 0 7 i n h i b i t o r组 0.1 3 0±0.0 4 0 1.7 0±0.3 7 4 6.9 3±7.2 9 t值 1 4.0 6 6 -2.9 0 2 -3.7 8 7 P值 <0.0 0 1 0.0 4 4 0.0 1 9
3 讨论
哮喘是一种以气道平滑肌功能异常为核心的疾病[10]。大量文献表明,ASMCs的异常增殖和迁移是气道重塑的重要因素[11-12]。已有研究表明,miRNA可能调节气道平滑肌的功能,导致气道重塑,从而引发哮喘症状[13]。为了研究miRNA-107在哮喘发展中的作用,本研究原代培养了小鼠的ASMCs,探究过表达或抑制miRNA-107对ASMCs增殖和迁移的影响。
本研究运用免疫荧光验证了培养的细胞是ASMCs,这为后续的实验奠定了基础。本研究结果显示,miRNA-107 mimic组ASMCs中miRNA-107相对表达水平高于mimic NC组,吸光度差值、迁移细胞数低 于 mimic NC组;miRNA-107 inhibitor组 ASMCs中miRNA-107相对表达水平低于inhibitor NC组,吸光度差值、迁移细胞数高于inhibitor NC组。提示过表达miRNA-107可以抑制ASMCs的增殖和迁移能力,而抑制miRNA-107的表达可以促进ASMCs的增殖和迁移能力,这与既往研究结果一致[14-15]。既往研究表明,miRNA-107可以通过靶向第10号染色体上磷酸酶和张力蛋白同源缺失基因(gene of phosphate and tension homology deleted on chromsometen,PTEN)或细胞分裂蛋白激酶6(cyclin-dependent kinase 6,CDK6)而抑制肿瘤细胞的增殖和迁移[16-17]。这提示miRNA-107可能通过调节下游靶基因的表达,影响与细胞增殖和迁移有关的信号通路,进而影响ASMCs的功能。
目前哮喘的治疗方法主要是针对气道阻塞和气道炎症,如支气管扩张剂、皮质类固醇、白介素受体拮抗剂和抗lgE治疗等[18],但这些方法的预后并不是很好。因此,探索新的治疗哮喘的靶标有着重要的临床意义。本研究结果为将来运用miRNA模拟物抑制哮喘的发生发展提供了一定理论依据,但本研究未探讨miRNA-107影响ASMCs功能的具体分子机制,仍需要进一步探究。
综上所述,miRNA-107可以抑制ASMCs的增殖和迁移。抑制miRNA-107的表达可以促进ASMCs的增殖和迁移,这可能是哮喘患者发生气道重塑的机制之一。因此,miRNA-107有望作为抑制气道重塑的一个靶点,为哮喘的治疗提供新的方法。但本研究未针对miRNA-107的下游蛋白及分子机制进行研究,还需要进一步研究以使miRNA-107的作用机制更加完善,为miRNA-107的临床应用奠定基础。
作者贡献:宇文婷进行实验设计与实施、资料收集与整理,撰写文章并对文章负责;罗雅妮、黎满慧协助进行实验实施;史菲进行论文、英文的修订并提供基金支持;熊轶负责文章的质量控制和审校,对文章整体负责、监督管理。
本文无利益冲突。
